Introducción
A nivel internacional, México ocupa el octavo lugar en producción mundial de chile seco, con 119 958 toneladas anuales y una superficie cosechada de 68 860 ha (SIAP, 2017). Guanajuato es el estado que contribuye con 60% de la producción de chile ancho del país, el cual destina alrededor de 5 700 ha para la producción de chile, de las cuales alrededor de 4 000 ha son de chile ancho (Cortez et al., 2011).
La producción de plántulas en almácigos es una práctica muy común entre los productores, se realiza con la finalidad de proteger las plántulas del frío y disponer de ellas una vez concluida la temporada de heladas, por lo que se hace necesario el uso de tecnologías e invernaderos para la producción de plántulas de calidad, lo cual genera un costo para los agricultores (Reveles et al., 2012). La plántula debe cumplir con los siguientes atributos de calidad: buena sanidad, sistema radicular bien desarrollado, color verde oscuro en el follaje y apariencia vigorosa (Jasso y Martínez, 2003). Con respecto a las especies hortícolas, la prueba de vigor se realiza en su fase inicial en comparación con otros cultivos de interés económico.
El indicador más empleado en semillas de hortalizas para evaluar el vigor es el primer conteo en la prueba de germinación (Barros y Minami, 2000). El concepto de germinación es definido como la emergencia y desarrollo de estructuras esenciales provenientes del embrión, las cuales manifiestan la capacidad de la semilla para producir una planta normal bajo condiciones favorables (Moreno, 1996). El proceso de germinación inicia con la imbibición y termina con la emergencia. La imbibición es una fase de absorción de agua por parte de la semilla y la emergencia se refiere al proceso mediante el cual el eje embrionario o radícula crece y traspasa las estructuras que lo rodean (Azcón y Talón, 2008). Una vez que la radícula comienza a elongarse fuera de la testa el proceso de germinación ha concluido (Carranza et al., 2016).
Existe en el mercado productos comerciales recomendados para promover el desarrollo de las plantas, el promotor I utilizado en esta investigación, contiene fitohormonas de los tres principales grupos: giberelinas (ácido giberélico, 20 ppm), auxinas (ácido indol acético, 63 ppm), citoquininas (zeatina, 210 ppm), así como también: carbohidratos (glucosa y fructosa, 0.7%), vitaminas (niacina 0.0006% e inositol 0.43%), nitrógeno (1%), fósforo (0.5%), potasio (4.5%), manganeso (0.12%), hierro (0.49%) y zinc (0.37%), además de sugerirse como sinérgico de la actividad de auxinas y citoquininas, con efectos en el aumento de biomasa aérea y radicular; en hortalizas de fruto se recomienda de 1 a 2 L ha-1 (Arysta, 2015a).
El promotor II posee extractos de origen vegetal, es empleado como fitorregulador hormonal en cuya composición contiene tres fitohormonas: citoquininas (zeatina, 94 ppm), giberelinas (36 ppm), auxinas (36 ppm); otros compuestos que incluye son: magnesio (2.53 g L-1), azufre (6 g L-1), boro (3.3 g L-1), hierro (5.39 g L-1), manganeso (1.32 g L-1), zinc (4.07 g L-1), dentro de sus funciones se encuentra el de estimular diversos procesos metabólicos y fisiológicos de las plantas, tales como: la división y diferenciación celular, translocación de sustancias, síntesis de clorofila y diferenciación de yemas, entre otros, la dosis recomendada para chile es de 450 a 500 mL ha-1 (Arysta, 2015b).
Con respecto al KNO3, una de sus funciones principales es que favorece la reparación metabólica de tejidos y el incremento de la respiración; por lo tanto, mejora la tasa de crecimiento y la germinación (Shim et al., 2008). Este último y el contenido de los dos primeros productos se han empleado en el acondicionamiento a las semillas, con la finalidad de revigorizar, acelerar y uniformar la germinación de las semillas del género Capsicum (Garruña et al., 2014). Por lo anterior el objetivo del presente estudio fue evaluar la calidad fisiológica de semillas de chile ancho imbibidas en diferentes soluciones de reguladores de crecimiento.
Materiales y métodos
Tratamientos
Se emplearon tres productos: KNO₃≥ 99.6% (2, 4 y 6% p/v), promotor I (0.5, 1 y 1% v/v), promotor II (1, 2 y 3% v/v) y como testigo agua destilada para imbibición de las semillas. Todos los productos se diluyeron en agua destilada.
Localización
Los ensayos se llevaron a cabo en el Laboratorio de Fisiología de Semillas del Centro de Capacitación y Desarrollo en Tecnología de Semillas (CCDTS), de la Universidad Autónoma Agraria Antonio Narro (UAAAN), que se localiza entre las coordenadas geográficas 25° 22’ de latitud norte y 101° 02’ longitud oeste y a una altitud de 1 742 m.
El experimento se realizó en dos etapas
Etapa I. Curvas de imbibición
Para determinar la curva de imbibición, se tomó el peso de 120 semillas, en una balanza analítica marca Ohaus con precisición de 310 g x 0.001 g, enseguida se sumergieron en 20 mL de agua destilada para los testigos y 20 ml en solución de cada tratamiento, para ello se utilizaron vasos de precipitado de 40 mL. Durante las primeras 12 h, cada 2 h, se escurrieron las semillas en coladores de plástico, se secaron con toallas de papel absorbente y se pesaron nuevamente; esta actividad se repitió cada 12 h hasta finalizar el proceso a las 48 h (0, 2, 4, 6, 8, 10, 12, 24, 36, 48 h). El volumen imbibido (mL) de los tratamientos por las semillas, se determinó con la diferencia de peso entre el peso inicial y el peso final, se calculó la imbibición de las unidades de peso, transformándolas a unidades de volumen (con base en que 1 g de peso aumentado = 1mL imbibido).
Etapa II. Ensayos de germinación entre papel
Transcurridas las 48 h, las semillas se sembraron entre papel anchor humedecido con agua destilada, 4 repeticiones por tratamiento de 25 semillas cada una, se enrollaron en forma de taco y se colocaron en posición vertical en bolsas de plástico dentro de una cámara bioclimática Thermo Cientific (Precision) a una temperatura controlada de 25 ±2 °C y fotoperiodo de 16 h luz/8 h de oscuridad (ISTA, 2016). La germinación se evaluó a los 21 días al cuantificar porcentaje de: plántulas normales (PN), plántulas anormales (PA) y semillas sin germinar (SSG), además de las longitudes de plúmula (LP) y radícula (LR), que se midieron con una plantilla de papel milimétrico y se determinó la media por repetición de cada tratamiento.
El porcentaje de plántulas normales (PN) se consideró como el total de aquellas cuyas estructuras esenciales se encontraban bien desarrolladas bajo condiciones favorables de agua, luz y temperatura (Moreno, 1996), se contabilizaron y se dividieron entre el total de semillas sembradas entre papel, de igual forma se obtuvo el porcentaje de plántulas anormales (PA) y semillas sin germinar (SSG).
Para el estudio de las variables se utilizó el paquete estadístico Statistical Analysis System (SAS) versión 9.0 (SAS Institute, 2002), con los datos se realizó un análisis de varianza (Andeva). Los valores medios, se sometieron a la Prueba de Tukey p≤ 0.05.
Resultados y discusión
Etapa I. Curvas de imbibición
Para la primera fase del proceso de germinación, se observó entre las semillas, que la mayor velocidad de imbibición ocurrió durante las primeras 2 h (Figura 1a y 1b), al elevar hasta 46% su peso seco inicial; después de las 2 h, el incremento en peso fue más lento a medida que transcurrió el tiempo.
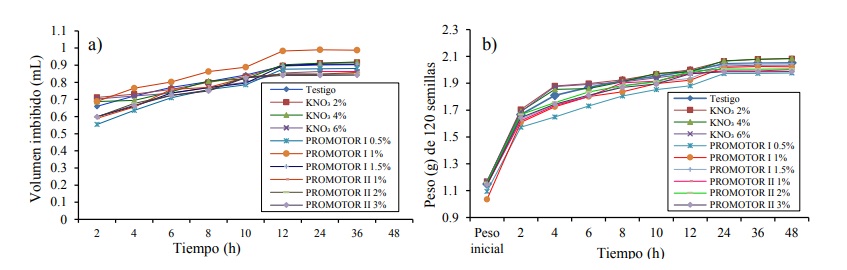
Figura 1 a) volumen imbibido (mL) de 120 semillas de chile ancho durante 48 h, en nueve tratamientos; b) peso imbibido (g) de 120 semillas de chile ancho durante 48 h, en nueve tratamientos.
Al llegar las 24 h se alcanzó la segunda fase del proceso de germinación, al registrar un incremento de 78% con respecto a su peso seco (Figura 1b). En esta segunda etapa de la germinación, se observó un comportamiento constante en la hidratación de las semillas, no hubo emergencia de radícula en ninguno de los tratamientos evaluados, es decir no se llegó a la fase III.
Esto se atribuye a que las capacidades hídricas de la semilla y de la solución entran en equilibrio, por lo que se detienen los procesos metabólicos al dejar de ingresar líquido al interior de la semilla (Akers y Holley, 1986), lo que evita que no ocurra la emergencia de radícula. Sousa et al (2006), refirieron que durante el proceso de imbibición de semillas de Swietenia macrophylla, el aumento en el peso de la semilla fue mayor, con respecto al volumen, el cual fue discreto. En este experimento se observó el mismo comportamiento en las curvas de imbibición para las dos primeras fases del proceso de germinación; es decir, la primera de absorción rápida de humedad y la segunda fase estacionaria que se caracterizó al final, por la ausencia de absorción de solución de los tratamientos (Figuras 1a y 1b), sin llegar a la fase III.
El análisis de varianza no mostró diferencias significativas (p≤ 0.01), para el incremento en gramos de peso en las semillas y el volumen imbibido (mL) de solución entre los tratamientos (Cuadro 1); lo anterior, se debe a que los ritmos de absorción de solución en las semillas expuestas a los diferentes tratamientos fueron uniformes, lo cual indica que el tipo de solución acondicionadora de los tratamientos no influyó en la disposición de agua por la semilla.
Cuadro 1 Cuadrados medios para peso y volumen de solución imbibida por semillas de chile ancho.
| FV | GL | Peso imbibido (g) | GL | Volumen imbibido (mL) |
| Tratamientos | 9 | 0.015 NS | 9 | 0.0104 NS |
| Error | 90 | 0.02 | 80 | 0.017 |
| Total | 99 | 0.07 | 89 | |
| CV | 14.89% | 17.25% |
FV= fuentes de variación; GL= grados de libertad; CV= coeficiente de variación; NS= no significativo a p≤ 0.01.
Etapa II. Ensayos de germinación entre papel germinación
De acuerdo con el análisis de varianza, en todas las variables: porcentajes de plántulas normales (% PN), plántulas anormales (% PA), semillas sin germinar (% SSG), longitud de plúmula (LP) y longitud de radícula (LR) se obtuvieron diferencias significativas (p≤ 0.01) entre tratamientos (Cuadro 2).
Cuadro 2 Cuadrados medios para porcentaje de plántulas normales (PN), plántulas anormales (PA), semillas sin germinar (SSG) longitud de plúmula (LP) y longitud de radícula (LR).
| FV | GL | PN (%) | PA (%) | SSG (%) | GL | LP (cm) | LR (cm) |
| Tratamientos | 9 | 2705.07** | 1724.67** | 2291.96** | 9 | 8.13** | 107.98** |
| Error | 30 | 322.13 | 292.40 | 111.33 | 369 | 0.61 | 4.83 |
| Total | 39 | 378 | |||||
| CV | 47.73% | 43.29% | 46.08% | 29.38% | 20.42% |
**= significativo a p≤ 0.01; FV= fuentes de variación; GL= grados de libertad; CV= coeficiente de variación.
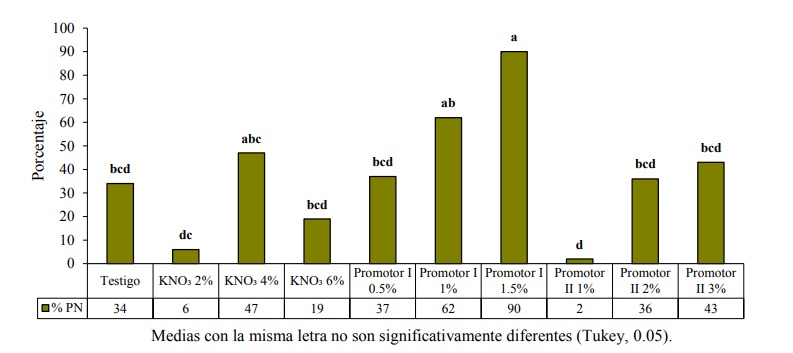
Es importante mencionar que debido al posible deterioro que presentaron las semillas, el porcentaje de plántulas normales tuvo respuestas variables que se confirma al observar el resultado del testigo (34%), con respecto a los tratamientos KNO₃ al 2 y 6% y al promotor II al 1%. El tratamiento con el promotor I al 1.5%, mostró mejor porcentaje de plántulas normales (Figura 2), con 90%, el cual expresó un incremento de 56% con respecto al testigo.
Este resultado se atribuye a las concentraciones de fitohormonas y microelementos, cuyo efecto positivo se expresa con el incremento del porcentaje de germinación, lo cual concuerda con el ácido giberélico que pudo haber estimulado en las semillas, la síntesis del almidón para su desdoblamiento en azúcares más simples como la glucosa, los cuales estuvieron disponibles como fuente de energía para las células del embrión durante el proceso de germinación; así mismo posiblemente la concentración de auxinas y citoquininas (zeatina) tuvieron efectos estimulantes sobre el crecimiento de tallos y raíces y en general en la formación de plántulas, ya que promueven el alargamiento celular.
Con el KNO₃ al 4% (47% de PN) se obtuvo un mayor número de plantas normales con respecto a las concentraciones de 2% (6 % de PN) y 6% (19% de PN), lo que coincide con lo reportado con Garruña et al. (2014) quienes evaluaron el efecto de una concentración cercana al 3%, sobre el acondicionamiento de semillas de chile habanero y obtuvieron un efecto positivo en la emergencia de plántulas (91% de PN) superando al testigo (72% de PN).
Las semillas imbibidas con KNO₃ al 2% obtuvieron el más alto porcentaje en plántulas anormales con 60% (Figura 3), este resultado pudo deberse a la concentración del tratamiento, además de que aún se desconocen los efectos del nitrato de potasio sobre el proceso de germinación en semillas de chile (Andrade y Laurentin, 2015). El tratamiento con mayor porcentaje en semillas sin germinar se obtuvo con el promotor II al 1% con 82% (Figura 3), este resultado puede atribuirse a la concentración, ya que en plántulas normales al 2 y 3% numéricamente superaron al testigo, este aumento concuerda con los resultados obtenidos por González et al. (2015) quienes con el mismo promotor a 1.6% y durante 24 h de inmersión de semilla de chile amashito (Capsicum annuum L. var. Glabriusculum), elevaron significativamente la germinación hasta 86%.
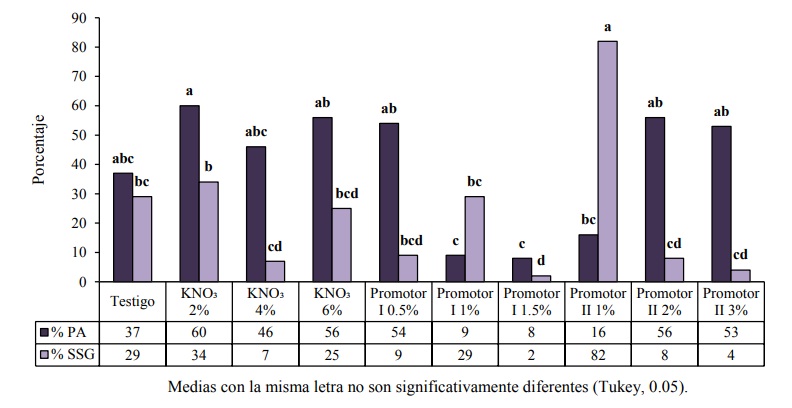
Figura 3 Comparación de medias en porcentaje de plántulas anormales (% PA) y semillas sin germinar (% SSG).
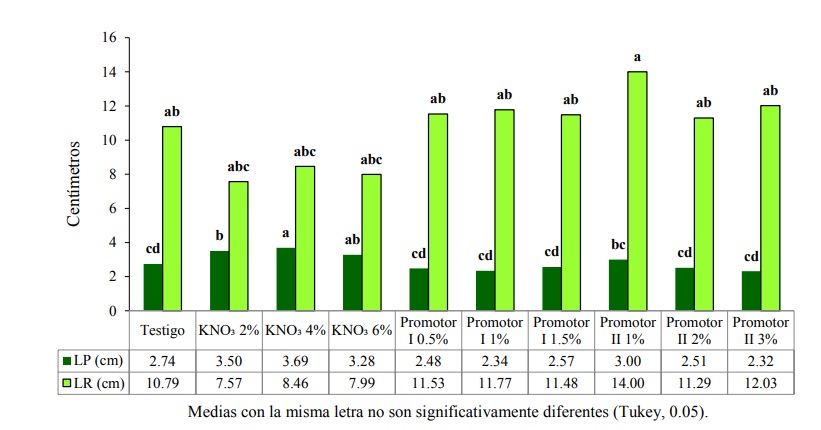
En relación a longitud de plúmula (LP), de acuerdo con Tukey, se obtuvieron diferencias significativas (p≤ 0.05), en la Figura 4 se observa que el tratamiento KNO₃ al 4% fue estadísticamente mejor con 3.69 cm, lo anterior coincide con lo expuesto por Shim et al. (2008), mencionan que este producto favorece la reparación metabólica de tejidos y el incremento de la respiración, por lo que mejora la tasa de crecimiento y germinación. Le siguieron los tratamientos: KNO₃ al 2% con 3.50 cm, KNO₃ al 6% con 3.28 cm, el promotor II al 1% con 3 cm, en comparación con el testigo que fue de 2.74 cm. Para la variable longitud de radícula (LR) en la Figura 4 se aprecia que el promotor II al 1% resultó estadísticamente mejor con 14 cm.
Aunque estadísticamente fueron iguales al testigo, numéricamente lo superaron, los tratamientos: Promotor II al 3% con 12.03 cm, Promotor I al 1% con 11.77 cm, al 0.5% con 11.53 cm, al 1.5% con 11.48 cm y el promotor II al 2% con 11.29 cm. Es importante señalar, aunque este último al 1%, resultó estadísticamente similar al testigo, este tratamiento obtuvo el menor porcentaje de plántulas normales (2%) (Figura 4).
Conclusiones
De acuerdo con los resultados la velocidad de imbibición de todos los tratamientos fue la misma en la semilla de chile de la variedad San Luis. Se concluye que el promotor I a una concentración de 1.5% (v/v) y 1% (v/v), tienen un efecto positivo en el incremento de la germinación en relación a plántulas normales (90% y 60%, respectivamente) de chile ancho, así como el buen desarrollo de la radícula, la cual es importante para el establecimiento de las plantas en campo.
En relación a la longitud de plúmula, el mejor tratamiento fue KNO₃ a 4%, el cual también fue uno de los tratamientos que superó al testigo en cuanto a porcentaje de plántulas normales.











 texto en
texto en