Introducción
El frijol de tipo negro, que incluye al negro brillante de raza Jalisco y al negro opaco de raza Mesoamericana, es el más producido en México. En el año 2015, la producción de frijol negro representó 37.9% de la producción nacional de frijol (FIRA, 2016). El frijol negro opaco se produce en 15 estados, principalmente en condiciones de humedad residual; Chiapas, Veracruz y Nayarit destacan por el volumen de producción (SIACON, 2015). En todos los estados productores de frijol negro opaco se han detectado infecciones simples y mixtas de BCMV y BCMNV (Flores-Esteves et al., 2003; Lepe-Soltero et al., 2012), mientras que en Chiapas y Nayarit además de estas dos especies se ha detectado al BGYMV (Garrido-Ramírez et al., 2000; Chiquito-Almanza et al., 2017), que junto con el virus del mosaico dorado del frijol (BGMV) son considerados una de las mayores limitantes para la producción de frijol, no solo en México, sino en toda América Latina (Beebe et al., 2011).
La alta incidencia de infección del embrión por BCMV y BCMNV, con porcentajes que pueden llegar hasta 80%, hace que la semilla sea el principal medio de diseminación (Morales y Castaño, 1987). Posteriormente, la transmisión secundaria es mediada por varias especies de áfidos, que transmiten al virus de manera no persistente dentro y fuera del cultivo, perpetuando al agente etiológico y dando lugar a un nuevo ciclo de la enfermedad (Morales y Castaño, 2008).
En los sistemas de producción de frijol de México, especialmente con los agricultores de pequeña escala y de subsistencia, es común que se siembren variedades tradicionales susceptibles a estos virus, y que el grano cosechado se use como semilla para el siguiente ciclo productivo, lo que permite la existencia permanente de una fuente de inóculo en todas las regiones donde se cultiva frijol.
El BCMV y el BCMNV producen las enfermedades conocidas como mosaico común y raíz negra del frijol. En variedades susceptibles, el BCMV puede ocasionar perdidas en el rendimiento entre 53% y 83% (Sastry, 2013b). Aunque la incorporación de resistencia dominante monogénica conferida por el gen I previene la infección sistémica crónica o mosaico común ocasionado por algunas cepas de BCMV, cuando estas variedades se infectan con BCMNV o alguna cepa inductora de necrosis de BCMV, se desarrolla una respuesta hipersensible conocida como necrosis apical o raíz negra (Drijfhout, 1978).
Es por ello que el cultivo simultáneo o escalonado de variedades infectadas con BCMNV, y de variedades que poseen solo resistencia monogénica dominante ha contribuido a crear brotes o pandemias de raíz negra en los campos sembrados con variedades resistentes al mosaico común (Morales y Castaño, 2008). La mejor estrategia para controlar al mosaico común y la raíz negra, es cultivar variedades resistentes que combinen la resistencia dominante conferida por el gen I con los genes recesivos bc1 2 , bc2 2 y bc-3, con el fin de eliminar la posibilidad de infección por cepas del BCMV o BCMNV (Morales y Castaño, 2008).
Por su parte, el BGYMV provoca la enfermedad conocida como mosaico dorado amarillo del frijol (Garrido-Ramírez et al., 2000). Los genotipos de frijol susceptibles, infectados en las primeras etapas de desarrollo generalmente muestran un amarillamiento sistémico intenso, y pueden tener pérdidas totales debido a la alta incidencia de aborto de flores y la deformación de las vainas (Morales y Niessen, 1988). En genotipos de frijol de la raza Mesoamericana es común que este virus cause deformación, enanismo y aborto de flores, particularmente en condiciones de alta temperatura (Morales y Niessen, 1988).
El BGYMV es transmitido de manera persistente por el insecto vector Bemisia tabaci (Genn.) con un periodo de latencia de 4 a 48 h (Morales y Anderson, 2001). La incidencia de la enfermedad y la magnitud de las pérdidas varían dependiendo de las poblaciones del vector, la susceptibilidad de la variedad, las prácticas culturales, y las condiciones ambientales, principalmente la precipitación, que afectan a las poblaciones de B. tabaci (Morales y Anderson, 2001). Desde inicios de los 90’s, en el Trópico de México se han reportado perdidas en el rendimiento atribuidas a BGYMV en genotipos susceptibles como ‘Negro Jamapa’ (87.6%) (Rodríguez y Yoshii, 1990), ‘Negro Tacaná’ (18%) y ‘Negro Husteco-81’ (40.5%) (López-Salinas et al., 1993).
Una de las principales fuentes de resistencia a BGYMV se encuentra en el frijol criollo Garrapato (G2402), que contiene al gen recesivo bgm-1 (Morales y Niessen, 1988). Este gen reduce el mosaico y el amarillamiento sistémico típicos de la enfermedad, y ha sido especialmente importante y efectivo en América Central (Beebe et al., 1995) demostrando que es un gen estable y valioso para generar variedades tolerantes al mosaico dorado amarillo (Blair et al., 2007).
El proceso de selección de variedades de frijol resistentes puede acelerarse mediante selección asistida por marcadores moleculares (SAMM). Actualmente se dispone de MM ligados a algunos genes de resistencia a BCMV y BCMNV, como los MM dominantes SW13, ligado al gen I (Melotto et al., 1996) y el SBD5 ligado al gen bcI 2 (Miklas et al., 2000a), o el MM co-dominate ENM ligado al gen bc-3 (Naderpour et al., 2010); mientras que para BGYMV se dispone del marcador co-dominante SR2, ligado al gene bgm-1 (Miklas et al., 2005).
El objetivo de este estudio fue identificar genotipos de frijol negro opaco Mesoamericano con genes de resistencia a BCMV, BCMNV y BGYMV mediante la inoculación con estos patógenos y la genotipificación con marcadores moleculares ligados a los genes de resistencia I, bc-3, bc1 2 y bgm-1. Los genotipos identificados se utilizarán como fuente de resistencia para desarrollar variedades con resistencia múltiple y con adaptación a las regiones de cultivo de este tipo de frijol.
Materiales y métodos
Genotipos de frijol
Se evaluaron 70 genotipos de frijol negro opaco de acervo Mesoamericano, que incluyeron 20 variedades comerciales, la mayoría desarrolladas por el Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP), y 50 líneas recombinantes (LR) avanzadas derivadas de las cruzas ‘Negro Papaloapan’/SEN-46, ‘Negro Citlali’/XRAV-187-3 y ‘Jamapa plus’/XRAV-187-3 (Cuadro 1).
Cuadro 1 Líneas recombinantes avanzadas y variedades de frijol de tipo negro opaco evaluadas.
| Líneas recombinantes | Líneas recombinantes | Variedades | |||||
| 1 | ‘Negro Papaloapan’/SEN-46-1-7 | 26 | ‘Negro Papaloapan’/SEN-46-7-1 | 51 | ‘Jamapa’ a | ||
| 2 | ‘Negro Papaloapan’/SEN-46-1-8 | 27 | ‘Negro Papaloapan’/SEN-46-7-6 | 52 | ‘Negro Veracruz’ a | ||
| 3 | ‘Negro Papaloapan’/SEN-46-1-10 | 28 | ‘Negro Papaloapan’/SEN-46-7-7 | 53 | ‘Negro Huasteco-81’ a | ||
| 4 | ‘Negro Papaloapan’/SEN-46-2-1 | 29 | ‘Negro Papaloapan’/SEN-46-7-8 | 54 | ‘Negro Cotaxlta-91’ a | ||
| 5 | ‘Negro Papaloapan’/SEN-46-2-2 | 30 | ‘Negro Papaloapan’/SEN-46-7-9 | 55 | ‘Negro INIFAP’ a | ||
| 6 | ‘Negro Papaloapan’/SEN-46-2-3 | 31 | ‘Negro Papaloapan’/SEN-46-7-10 | 56 | ‘Negro Tacana’ a | ||
| 7 | ‘Negro Papaloapan’/SEN-46-2-4 | 32 | ‘Negro Papaloapan’/SEN-46-7-11 | 57 | ‘Negro Tropical’ a | ||
| 8 | ‘Negro Papaloapan’/SEN-46-2-5 | 33 | ‘Negro Papaloapan’/SEN-46-7-12 | 58 | ‘Negro Medellín’ a | ||
| 9 | ‘Negro Papaloapan’/SEN-46-2-6 | 34 | ‘Negro Papaloapan’/SEN-46-7-13 | 59 | ‘Negro Papaloapan’ a | ||
| 10 | ‘Negro Papaloapan’/SEN-46-2-7 | 35 | ‘Negro Citlali’/XRAV-187-3-1-2 | 60 | ‘Negro Comapa’ a | ||
| 11 | ‘Negro Papaloapan’/SEN-46-2-11 | 36 | ‘Negro Citlali’/XRAV-187-3-1-5 | 61 | ‘Verdín’ a | ||
| 12 | ‘Negro Papaloapan’/SEN-46-3-2 | 37 | ‘Negro Citlali’/XRAV-187-3-1-6 | 62 | ‘Negro Grijalva’ a | ||
| 13 | ‘Negro Papaloapan’/SEN-46-3-5 | 38 | ‘Negro Citlali’/XRAV-187-3-1-8 | 63 | ‘T-39’ c | ||
| 14 | ‘Negro Papaloapan’/SEN-46-3-7 | 39 | ‘Negro Citlali’/XRAV-187-3-1-9 | 64 | ‘Negro 8025’ a | ||
| 15 | ‘Negro Papaloapan’/SEN-46-4-5 | 40 | ‘Negro Citlali’/XRAV-187-3-2-2 | 65 | ‘Negro Nayarit’ a | ||
| 16 | ‘Negro Papaloapan’/SEN-46-4-8 | 41 | ‘Negro Citlali’/XRAV-187-3-2-4 | 66 | DOR 448 b | ||
| 17 | ‘Negro Papaloapan’/SEN-46-4-9 | 42 | ‘Negro Citlali’/XRAV-187-3-2-5 | 67 | UCR 55 b | ||
| 18 | ‘Negro Papaloapan’/SEN-46-4-10 | 43 | ‘Negro Citlali’/XRAV-187-3-7-2 | 68 | ‘Jamapa Plus’ a | ||
| 19 | ‘Negro Papaloapan’/SEN-46-5-5 | 44 | ‘Negro Citlali’/XRAV-187-3-14-6 | 69 | Negro 17-99 a | ||
| 20 | ‘Negro Papaloapan’/SEN-46-6-1 | 45 | ‘Negro Citlali’/XRAV-187-3-14-7 | 70 | SCN-2 b | ||
| 21 | ‘Negro Papaloapan’/SEN-46-6-2 | 46 | ‘Negro Citlali’/XRAV-187-3-16-7 | ||||
| 22 | ‘Negro Papaloapan’/SEN-46-6-3 | 47 | ‘Jamapa Plus’/XRAV-187-3-1-2 | ||||
| 23 | ‘Negro Papaloapan’/SEN-46-6-4 | 48 | ‘Jamapa Plus’/XRAV-187-3-1-8 | ||||
| 24 | ‘Negro Papaloapan’/SEN-46-6-5 | 49 | ‘Jamapa Plus’/XRAV-187-3-4-1 | ||||
| 25 | ‘Negro Papaloapan’/SEN-46-6-6 | 50 | ‘Jamapa Plus’/XRAV-187-3-4-4 |
a= variedades generadas por el INIFAP; b= variedades generadas por el CIAT; c= variedad generadas por la Universidad de California, Davis, EE.UU.
Cepas virales
La fenotipificación de resistencia a BCMV y BCMNV se realizó con la cepa BCMNV NL-3, preservada en semillas de frijol de la variedad Michelite 62, y proporcionada por el Laboratorio de Interacciones Planta-Virus del Centro de Investigación y de Estudios Avanzados del Instituto Politécnico Nacional (CINVESTAV), en Irapuato, México; para fenotipificar la resistencia a BGYMV se usaron los componentes A y B (No. de accesión al GenBank AF173555 y AF173556) de la cepa BGYMV-MX, proporcionada por el Dr. Robert L. Gilbertson del Departamento de Patología de Plantas de la Universidad de California, Davis, EE.UU.
Fenotipificación de resistencia a BCMV, BCMNV y BGYMV
Todas las evaluaciones de resistencia se realizaron en condiciones confinadas de invernadero en las instalaciones del INIFAP. La fenotipificación de resistencia a BCMV y BCMNV se realizó en el Campo Experimental Bajío localizado a 20° 34’ 48.75’’ latitud norte 100° 49’ 16.490’’ longitud oeste, a una altitud de 1767 m, y la de BGYMV en el Campo Experimental Centro de Chiapas localizado a 16° 46’ 48’’ latitud norte 93° 24’ 21’’ longitud oeste, a una altitud de 800 m. Para fenotipificar la resistencia a BCMV y BCMNV se inocularon mecánicamente 12 plantas de cada genotipo.
El inoculo se obtuvo macerando 1 g del tejido foliar de la variedad Michelite 62 infectada con BCMNV NL-3 en buffer de fosfatos 0.01 M pH 7.5 (1:10 w/v); se humedeció una gasa de algodón estéril en la solución macerada, y se frotaron las hojas primarias bien extendidas en la etapa V2. La inoculación se realizó entre las 7:00 y 9:00 am. La incidencia de síntomas de mosaico común y raíz negra se determinó visualmente siete días después de la inoculación (DDI), de acuerdo a la gama de síntomas típicos desarrollados en frijol inoculado con BCMNV (Drijfhout, 1978). Aquellas plantas que no presentaron síntomas se re-inocularon con el mismo método en las dos hojas primarias y el primer trifolio, y se determinó la incidencia de síntomas 21 DDI. Los genotipos que no presentaron síntomas después de la re-inoculación se consideraron como resistentes.
Para fenotipificar la resistencia a BGYMV se agroinocularon 10 plantas de cada genotipo en la etapa V2 mediante punción con jeringa en el primer internudo (Hou et al., 1988). Como inoculo se utilizó una mezcla 1:1 de suspensiones celulares de los clones de BGYMV en agrobacterium pBGMXAbin (DNA-A) y pBGMXBbin (DNA-B) (Garrido-Ramírez et al., 2000), previamente cultivados en medio liquido LB + Kanamicina (90 mg L-1), en agitación por 48 h y analizados por PCR para verificar la permanencia de ambos componentes.
Los primeros síntomas de amarillamiento de nervaduras, mosaico dorado y distorsión de hojas se evaluaron 15 DDI. Las plantas que mostraron alguno de estos síntomas se conservaron hasta la etapa R8 (60 DDI) para registrar el desarrollo de los síntomas que incluyeron acortamiento de entrenudos, aborto de flores y deformación de vainas. La confirmación de la infección por BGYMV se realizó mediante PCR con los iniciadores degenerados PAL1v1978/PAR1c496 para el componente A y PBLv2040/PCRc2 para el componente B siguiendo el procedimiento descrito por Rojas et al. (1993).
Genotipificación con marcadores moleculares
Para genotipificar la resistencia a BCMV y BCMNV la extracción del ADN total se realizó con el método de extracción basado en CTAB (Abarshi et al., 2010), mientras que para BGYMV se utilizó el método de Dellaporta (Gilbertson et al., 1991). La genotipificación de resistencia a BCMV y BCMNV se realizó con el MM codominante de tipo CAPS ENM, ligado al gen bc-3, y MM de tipo SCAR SW13, ligado al gen I, y SBD5, ligado al gen bcI 2 , de acuerdo a Naderpour et al. (2010); Melotto et al. (1996); Miklas et al. (2000a), respectivamente. El tamaño de la amplificación esperado para el MM SW13 y SBD5 fue de 650 pb y 1400 pb, respectivamente.
La amplificación de un fragmento de 541 pb con el MM ENM se confirmó mediante electroforesis, y se realizó la restricción de 1 µL del producto de PCR en un volumen final de 10 μL con 1 U de la enzima Fau I en buffer 1x de acuerdo a las instrucciones del fabricante (New England Biolabs). Los homocigotos resistentes (eIF4E 2 /eIF4E 2 ) presentaron un fragmento de 418 pb y otro de 123 pb. Por su parte, la genotipificación de resistencia a BGYMV se realizó con el MM codominante SR2 ligado al gen bgm-1 de acuerdo a Miklas et al. (2005); los homocigotos resistentes (bgm-1/bgm-1) amplificaron un fragmento de 530 pb, y los susceptibles uno de 570 pb. Todos los productos de PCR se resolvieron por electroforesis en agarosa 1% y se visualizaron con biotina (GelRed™) bajo luz UV.
Para cada uno de genotipos se determinó el porcentaje de plantas con MM ligados a genes de resistencia I, bc-3 y bgm-1 dividiendo el número de plantas con MM entre el número de plantas genotipificadas y multiplicado por cien. Las plantas que no presentaron síntomas a la inoculación con BCMNV NL-3 y tuvieron ambos MM ligados a los genes I y bc-3 se consideraron resistentes a BCMNV y BCMV; mientras las que no presentaron síntomas a la inoculación con BGYMV-MX y tuvieron el MM ligado al gen bgm-1 se consideraron resistentes a BGYMV.
Resultados y discusión
Se fenotipificaron y genotipificaron 69 genotipos de frijol negro opaco, entre ellos 50 LR avanzadas obtenidas de las cruzas ‘Negro Papaloapan’/SEN-46 (34 LR), ‘Negro Citlali’/XRAV-187-3 (12 LR) y ‘Jamapa Plus’/XRAV-187-3 (4 LR) (Cuadro 1). Los progenitores ‘Negro Papaloapan’ y XRAV-187-3 poseen genes de resistencia a BCMV, BCMNV y BGYMV. ‘Negro Papaloapan’ derivó de la línea DOR-454 generada por el Centro Internacional de Agricultura Tropical (CIAT) (López-Salinas et al., 2007), esta línea se originó de la cruza (DOR-364 x G-18521) x (DOR-365 x LM-30630), posee resistencia cuantitativa a BGYMV (QTL mayor) (Miklas et al., 1996), el gen I de resistencia a BCMV y probablemente también los genes bc-3 y Ur-5, de resistencia a BCMNV y roya, respectivamente (Miklas et al., 2000b).
Por su parte, XRAV-187-3 es una línea derivada de la cruza PR0003-124/‛Raven’ (Beaver et al., 2014). PR0003-124 derivó de la cruza ‛DOR483/BelNeb RR-2//MUS83/DOR483’, que fue seleccionada en Puerto Rico por su resistencia a BGYMV, pudriciones de raíz y tolerancia a altas temperaturas; tiene el gen bgm-1 y el QTL SW12, ambos de resistencia a BGYMV, así como el gen I (Beaver et al., 2014), por su parte ‛Raven’ fue desarrollada y liberada por la Estación Experimental Agrícola de Michigan, tiene adaptación al trópico, los genes I y bc-3, así como el gen Ur-3 de resistencia a roya (Kelly et al., 1994).
Fenotipificación de resistencia a BCMV, BCMNV y BGYMV
A excepción del genotipo Negro 17-99, del cual no germinó ninguna semilla, se fenotipificó la resistencia a BCMV y BCMNV de 12 plantas de 50 genotipos, en los 19 genotipos restantes se evaluaron entre 8 y 11 plantas. Se inocularon 797 plantas correspondientes a 69 genotipos con la cepa BCMNV-NL-3 y siete días después, 631 plantas mostraron lesiones necróticas localizadas (LNL) en las hojas primarias inoculadas (Figura 1F), lo que indicó la presencia del gen I y la ausencia de algún gen recesivo bc (Drijfhout, 1978). Nueve días después de la re-inoculación algunas plantas desarrollaron LNL, y 21 DDI se observaron síntomas de mosaico común en 120 plantas (Figura 1I y 1J) y ningún síntoma en 46 plantas (Figura 1H). Las plantas que en la primera inoculación presentaron LNL desarrollaron raíz negra y murieron (Figura 1G).

Figura 1 Fenotipificación de resistencia a BCMV, BCMNV y BGYMV en los genotipos del ensayo. A, B, C, D y E: síntomas inducidos por la inoculación de BGYMV-MX. F, G, H, I, y J: síntomas inducidos por BCMNV NL-3. A) amarillamiento de nervaduras; B) mosaico dorado; C) enanismo en una planta susceptible (izquierda), en comparación con una planta resistente con el gen bgm-1 (derecha); D) acortamiento de entrenudos y aborto de flores y vainas; E) deformación de hojas; F) lesiones necróticas localizadas en los genotipos que poseen únicamente el gen I; G) raíz negra; H) plantas resistentes con la combinación genética I + bc-3; I) mosaico en nervaduras; y J) mosaico común.
Los síntomas de LNL generalmente se manifiestan de 6 a 10 DDI, mientras que los de mosaico común demoran entre 15 y 20 DDI (Drijfhout, 1978). El desarrollo de síntomas de mosaico común en las plantas inoculadas con BCMNV NL-3 indicó la ausencia del gen I, mientras que la ausencia de síntomas sugirió la presencia de algún gen recesivo como bc1 2 , bc2 2 , bc-3 solo o en combinación con el gen I (Drijfhout, 1978).
Para fenotipificar la resistencia a BGYMV se usaron entre dos y nueve plantas; con excepción del genotipo Negro 17-99, y la LR ‘Negro Citlali’/XRAV-187-3-1-8 en las que no hubo germinación. Las plantas inoculadas mostraron síntomas diversos que incluyeron la ausencia de síntomas (Figura 1C), amarillamiento de nervaduras (Figura 1A), mosaico dorado amarillo (Figura 1B), deformación de hojas (Figura 1E), acortamiento de nervaduras (Figura 1D) y en los casos en que las plantas infectadas se dejaron llegar hasta la etapa R8, se observó aborto de flores y deformación de vainas.
Mediante PCR se confirmó la presencia de BGYMV en las plantas que desarrollaron síntomas, mientras que en las plantas asintomáticas no se obtuvo amplificación, lo que confirmó la ausencia del virus. En trabajos de agroinoculación de frijol con la cepa BGYMV-MX, Garrido-Ramírez et al. (2000) observaron diferencias según el origen de los genotipos. Es probable que la variedad de síntomas expresados en las plantas inoculadas se debió a que las LR tienen en su pedigrí a DOR-454 y a PR0003-124, por lo que además del gen bgm-1 algunas podrían tener también al QTL de resistencia mayor (SW12), lo que explicaría la heterogeneidad en el desarrollo de síntomas.
Genotipificación con los marcadores moleculares ligados a los genes I, bc-3 y bc1 2
Con la intención de reducir el costo de detección de los MM ligados a los genes de resistencia a BCMV y BCMNV, se genotipificó una muestra compuesta por todas las plantas de cada genotipo. El patrón electroforético de los MM SW13, ENM y SR2 se muestra en la Figura 2. En todas las muestras compuestas se detectó al MM SW13 ligado al gen I. El MM SBD5 se detectó únicamente en la LR ‘Negro Papaloapan’/SEN-46-6-5, lo que sugirió que al menos una planta de esta LR poseía el gen bc1 2 , ya que 10 de las plantas desarrollaron raíz negra y dos necrosis en el tallo; estas últimas plantas se genotipificaron individualmente, y 45 DDI la única planta que tuvo la combinación de genes I + bc1 2 murió debido al desarrollo de raíz negra. La combinación de los genes I + bc1 2 confiere resistencia a BCMNV NL-3 entre 17 y 26 °C, pero se rompe a 30 °C (Drijfhout, 1978); también se ha observado el desarrollo de necrosis en venas 10 DDI con la cepa BCMNV NL-3, aunque no se indica a que temperatura (Bello et al., 2014). En este trabajo, la temperatura osciló entre los 30 y 36 °C en las horas más calurosas del día.
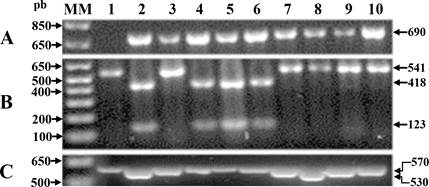
Figura 2 Figura representativa de la genotipificación con marcadores moleculares ligados a genes de resistencia a BCMV, BCMNV y BGYMV en líneas recombinantes de frijol negro opaco. Carriles 1 y 2: control negativo y positivo, respectivamente. Carriles 3 al 10: muestras problema; A) marcador molecular (MM) SW13. Un fragmento de 690 pb indica la presencia del MM ligado al gen I; B) MM ENM. La presencia de dos fragmentos (418 pb y 123 pb) después de la digestión con la enzima Fau I indica la presencia del MM ligado al gen bc-3 y C) Marcador molecular SR2; un fragmento de 530 pb indica la presencia del MM ligado al gen bgm-1.
En 55 de los genotipos no se detectó al MM codominante de tipo CAPS ENM, lo que indicó que ninguna de ellas tenía el gen bc-3; solo 10 de las LR y el genotipo elite SCN-2 mostraron el patrón típico de bandeo de un heterocigoto eIF4E 2 /eIF4E 3 y cuatro el de un homocigoto eIF4E 2 /eIF4E 2 indicando que algunas LR aún son heterogéneas en relación a la presencia de este gen.
Las plantas de cada genotipo que no desarrollaron síntomas de mosaico común o raíz negra después de la segunda inoculación se genotipificaron individualmente con MM ligados a los genes I, bc-3 y bc1 2 . En las LR ‘Negro Papaloapan’/SEN-46-4-9, ‘Negro Papaloapan’/SEN-46-7-6, ‘Negro Papaloapan’/SEN-46-7-7, ‘Negro Citlali’/XRAV-187-3-14-7, ‘Jamapa Plus’/XRAV-187-3-4-1, ‘Negro Papaloapan’/SEN-46-5-5 y ‘Negro Citlali’/XRAV-187-3-1-9 se detectaron de una y tres plantas asintomáticas a la inoculación con BCMNV NL-3 que poseían MM SW13 ligado al gen I, pero no MM SBD5 ligado al gen bc1 2 y MM ENM ligado al gen bc-3, por lo que no se pudo precisar si la resistencia bservada se debió a algún otro gen aún no descrito, a un error en el proceso de detección de los MM o de la inoculación de estas plantas en particular.
Los genotipos donde se detectaron plantas únicamente con el MM SW13 fueron ‘Negro Papaloapan’/SEN-46-4-5 (una planta), ‘Negro Citlali’/XRAV-187-3-1-8 (una planta), SCN-2 (una planta), ‘Jamapa Plus’/XRAV-187-3-4-1 (una planta) y T-39 (cuatro plantas), por lo que se esperaba que desarrollaran síntomas de necrosis al inocularlos con la cepa BCMNV NL-3. Sin embargo, únicamente presentaron mosaicos en los trifolios. Esta situación pudo deberse a que el MM SW13 puede identificar falsos negativos, como lo reportaron Bello et al. (2014) quienes desarrollaron un MM de tipo codominante más preciso que en teoría resuelve esta situación.
Una planta de cada uno de los genotipos ‘Negro Papaloapan’/SEN-46-7-6, ‘Negro Papaloapan’/SEN 46-7-13 y ‘Jamapa Plus’/XRAV-187-3-4-4 tuvieron solo el MM ENM en estado homocigoto (eIF4E 2 /eIF4E 2 ), mientras que 15 genotipos tuvieron entre uno y 11 individuos con la combinación de genes I + bc-3 (Cuadro 2), de los cuales seis sobresalieron por su mayor proporción de plantas con esta combinación genética: ‘Negro Papaloapan’/SEN-46-7-10 (92%); ‘Jamapa Plus’/XRAV-187-3-4-4 (88%); ‘Negro Papaloapan’/SEN 46-5-5 (82%); ‘Negro Papaloapan’/SEN-46-7-7, ‘Negro Citlali’/XRAV-187-3-1-9, y SCN-2 (75%); los otros nueve genotipos tuvieron entre 8% y 67% de plantas con ambos genes (Cuadro 2). Las variedades y LR con mayor proporción de plantas con la combinación genética I + bc-3 representan fuentes de resistencia a BCMNV y BCMV en el acervo de frijol negro opaco. Es importante destacar que en algunas plantas con la combinación I + bc-3 se observaron síntomas débiles de lo que parecen mosaicos. Sin embargo, podría deberse a alguna deficiencia nutricional.
Cuadro 2 Porcentaje de genotipos con marcadores moleculares ligados a los genes I, bc-3 y bgm-1 de resistencia a BCMV, BCMNV y BGYMV.
| Línea recombinante o variedad | Genes de resistencia a | |||
| bgm-1 | I | bc-3 | I + bc-3 | |
| ‘Negro Papaloapan’/SEN-46-1-8 | 50 | 100 | - | - |
| ‘Negro Papaloapan’/SEN-46-4-5 | - | 92 | - | 8 |
| ‘Negro Papaloapan’/SEN-46-5-5 | - | 10 | - | 82 |
| ‘Negro Papaloapan’/SEN-46-6-2 | 100 | 100 | - | - |
| ‘Negro Papaloapan’/SEN-46-6-4 | 75 | 100 | - | - |
| ‘Negro Papaloapan’/SEN-46-7-6 | - | 30 | 10 | 60 |
| ‘Negro Papaloapan’/SEN-46-7-7 | - | 17 | - | 75 |
| ‘Negro Papaloapan’/SEN-46-7-8 | 100 | 33 | - | 67 |
| ‘Negro Papaloapan’/SEN-46-7-9 | - | 90 | - | 10 |
| ‘Negro Papaloapan’/SEN-46-7-10 | - | 8 | - | 92 |
| ‘Negro Papaloapan’/SEN-46-7-11 | 67 | 83 | - | 17 |
| ‘Negro Papaloapan’/SEN-46-7-12 | 67 | 75 | - | 25 |
| ‘Negro Papaloapan’/SEN-46-7-13 | 100 | 25 | 8 | 67 |
| ‘Negro Citlali’/XRAV-187-3-1-5 | 100 | 100 | - | - |
| ‘Negro Citlali’/XRAV-187-3-1-6 | 100 | 100 | - | - |
| ‘Negro Citlali’/XRAV-187 3-1-8 | - | 38 | - | 63 |
| ‘Negro Citlali’/XRAV-187 3-1-9 | - | 25 | - | 75 |
| ‘Negro Citlali’/XRAV-187-3-2-2 | 100 | 100 | - | - |
| ‘Negro Citlali’/XRAV-187-3-16-7 | 25 | 100 | - | - |
| ‘Jamapa Plus’/XRAV-187-3-4-1 | - | 44 | - | 56 |
| ‘Jamapa Plus’/XRAV-187-3-4-4 | - | 0 | 12 | 88 |
| ‘Negro Papaloapan’ | 100 | 92 | - | - |
| T-39 | 67 | 82 | - | - |
| ‘Verdín’ | 67 | 100 | - | - |
| SCN-2 | - | 25 | - | 75 |
a= (%) de plantas con los genes de resistencia bgm-1, I y bc-3 determinado con los MM SR2, SW13 y ENM, respectivamente; - = ausencia del MM ligado al gen de resistencia.
Aunque hasta ahora no se ha reportado la ruptura de resistencia de la combinación de los genes I + bc-3 por efecto de alguna cepa necrótica como BCMNV NL-3 y los estudios en que se han evaluado la resistencia a “altas temperaturas” se realizaron a 32 °C (Pasev et al., 2013), si hay registros de que la resistencia conferida por el gen I a la cepa BCMV NY-15 en la variedad diferencial Black Turtle del GR 8 (Drifjhout, 1978) es dependiente de la dosis del gen (II, Ii o ii) y se rompe a temperaturas superiores a los 34 °C (Witmer-Collmer et al., 2000). Drijfhout, (1978) también reportó la ruptura de la resistencia de las variedades Black Tourtle Soup (I), Widusa (I), Jubila (I + bc1), Impr. Tendergr. (I + bc1), Top Crop (I +bc1) y Amanda (I + bc1 2 ) cuando se inocularon con las cepas NL-3, NL-5, y NL-6 a 30 °C, y algunas de ellas también desarrollaron necrosis sistémica con las cepas NL-2 y NL-8.
Genotipificación con el marcador molecular SR2 ligado al gen bgm-1
En algunas plantas de un grupo de once LR: siete de la cruza ‘Negro Papaloapan’/SEN-46 y cuatro de ‘Negro Citlali’/XRAV-187-3, y en las variedades DOR 448, ‘Negro Papaloapan’, ‘Verdín’ y T-39 no se observaron síntomas, ni se detectó a BGYMV mediante PCR. En estas plantas se obtuvo un solo amplicón de 530 pb, lo que indicó que fueron homocigotas resistentes (bgm-1/bgm-1). Sin embargo, en otro grupo de cinco LR y las variedades ‘Negro 8025’, ‘Negro Veracruz’, ‘Negro Huasteco-81’ y ‘Negro Comapa’, se observaron síntomas de la infección por BGYMV a pesar de tener el MM SR2 ligado al gen bgm-1.
Aunque en términos prácticos el gen bgm-1 es el más importante para conferir resistencia a BGYMV (Beebe et al., 1995; Singh et al., 2000), el MM SR2 ligado a este gen está asociado con la resistencia a los síntomas generales de la enfermedad como amarillamiento o clorosis, pero no con síntomas como el enanismo, que se relaciona con otros factores de resistencia como el gen Dwf (Blair et al., 2007). Otros genes de resistencia como Bgp1, ligado al desarrollo normal de las vainas durante la infección (Acevedo-Román et al., 2004), o el locus W12 de resistencia a BGYMV (Miklas et al., 1996, 2000b) son más eficaces cuando están presentes con el gen bgm-1.
La línea DOR-364, con el QTL de resistencia a BGYMV, incrementó significativamente la resistencia a este virus con la incorporación del gen bgm-1 recuperado de la accesión mexicana G2402 (‘Garrapato’). Líneas subsecuentes como DOR-482 tuvieron un índice de enfermedad de 2, en una escala de 1= inmune a 9= totalmente susceptible, mientras que DOR-364 recibió una calificación de 4 (Miles y Pandey, 2004). Debido a que en el presente estudio se utilizó únicamente el MM SR2, es probable que la ausencia de síntomas en las LR y variedades resistentes se deba a la acción conjunta del gen bgm-1 con algunos otros genes, como el QTL mayor de resistencia a BGYMV presente en el pedigrí de ‘Negro Papaloapan’ y XRAV-187-3.
Todas las LR tuvieron una alta proporción de plantas con el gen I, que les confiere resistencia a las cepas no inductoras de necrosis de BCMV; seis LR derivadas de la cruza ‘Negro Papaloapan’/SEN-46 y dos LR de cada una de las cruzas ‘Negro Citlali’/XRAV-187-3 y ‘Jamapa Plus’/XRAV-187-3-4-1 tuvieron entre 8% y 92% de plantas con la combinación genética I + bc-3, que confiere resistencia a BCMV y BCMNV; mientras que los genes I y bgm-1, que confiere resistencia a BCMV y BGYMV, se detectaron en siete LR, tres de la cruza ‘Negro Papaloapan’/SEN-46 y cuatro de la cruza ‘Negro Citlali’/XRAV-187-3, algunas de las cuales fueron homogéneas en el porcentaje de plantas con ambos genes (Cuadro 2).
Cuatro LR derivadas de la cruza ‘Negro Papaloapan’/SEN-46: ‘Negro Papaloapan’/SEN-46-7-8, ‘Negro Papaloapan’/SEN-46-7-11, ‘Negro Papaloapan’/SEN-46-7-12 y ‘Negro Papaloapan’/SEN-46-7-13 destacaron por el porcentaje de plantas con los genes I, bc-3 y bgm-1 (Cuadro 2) que les confiere resistencia a BCMV, BCMNV y BGYMV.
La heterogeneidad de las LR en la proporción de plantas con cada uno de los genes de resistencia destaca la necesidad de homogenizarlas mediante el uso de MM para desarrollar variedades de frijol de tipo negro opaco con resistencia general o específica a tres de los virus que más afectan la producción de frijol en América Latina. El uso de variedades con resistencia específica a los virus predominantes en cada región contribuirá a reducir las pérdidas y la diseminación de estos virus dentro y entre regiones productoras.
Conclusiones
En la colección de 70 materiales de frijol de tipo negro opaco del INIFAP se identificaron 21 líneas recombinantes con distintos porcentajes de plantas con los genes I, bc-3 y bgm-1, y resistencia general o específica a BCMV, BCMNV y BGYMV. Las líneas recombinantes ‘Negro Papaloapan’/SEN-46-7-8, ‘Negro Papaloapan’/SEN-46-7-11, ‘Negro Papaloapan’/SEN-46-7-12 y ‘Negro Papaloapan’/SEN-46-7-13 destacaron por el porcentaje de plantas con la combinación I + bc-3 y el gen bgm-1, así como por su resistencia de amplio espectro a los tres virus. La heterogeneidad de las LR en la proporción de plantas con cada uno de los genes de resistencia destaca la necesidad de implementar estrategias de selección asistida por marcadores moleculares para homogenizarlas en función a sus genes de resistencia, y desarrollar variedades de frijol de tipo negro opaco con adaptación a las regiones de cultivo de este tipo de frijol y resistencia general o específica a tres de los virus que más afectan la producción de frijol en América latina.











 texto en
texto en 


