Introducción
Los chiles son conocidos por su riqueza en micronutrientes y compuestos bioactivos (compuestos fenólicos), por lo que su consumo ha sido claramente reconocido como factor importante para la buena salud (Rodríguez et al., 2012). Los antioxidantes en chiles son numerosas y destacan, el ácido ascórbico, flavonoides, capsaicinoides, y una amplia variedad de ácidos fenólicos (Howard et al., 2000). Su sabor picante está relacionado con la concentración de cinco compuestos: capsaicina, nordihidrocapsaicina, dihidrocapsaicina, homocapsaicina y homodihidrocapsaicina, los cuales se clasifican como capsaicinoides (Krajewska, 1988; Antonious et al., 2006, 2009). Vázquez-Flota et al. (2007) mencionan que existen 20 diferentes tipos de estos compuestos en chiles. La capsaicina y la dihidrocapsaicina son los capsaicinoides dominantes detectados en diferentes tipos de chile picante (Antonious et al., 2006).
Los colores amarillo, naranja y rojo en frutos de capsicum son originados por los carotenoides producidos durante la maduración, los cuales tienen un inmenso valor nutricional como provitamina A y antioxidantes. Los β-carotenos son precursores de los pigmentos naranja y rojo en chiles. Los chiles con altas concentración de β-carotenos demostraron ser ricos en carotenoides totales (Wall et al., 2001). Los chiles frescos son excelente fuente de ácido ascórbico, que participa en varios procesos antioxidantes de las plantas además de actuar en la prevención de enfermedades crónicas humanas, incluyendo ciertos tipos de cáncer, enfermedad coronaria, arteriosclerosis y cataratas (Howard et al., 2000), por lo que resulta una buena alternativa el uso de bioreguladores como estimulantes de aumentar el contenido de antioxidantes en plantas, que a su vez, contribuyen a disminuir estrés fisiológico y mejorar la calidad nutracéutica en el fruto.
En años recientes el uso de biorreguladores y promotores de oxidación en tomate, brócoli y repollo han mostrado ser una alternativa para mejorar su producción y la calidad del producto cosechado (Ramírez et al., 2009). El uso de estas sustancias tiene la ventaja de producir efectos que no son permanentes y por lo tanto, de ser modificados de acuerdo a las necesidades del horticultor (Ramírez, 2003). P-Ca es un retardante de crecimiento que se usa actualmente en la fruticultura y es considerado como una alternativa prometedora en la horticultura moderna (Ramírez et al., 2010c). P-Ca (3-oxído-4-propionil-5-oxo-3-ciclohexano- carboxilato) inhibe la biosíntesis de giberelinas activas de crecimiento, lo que reduce el desarrollo longitudinal de brotes.
Tiene un efecto en la reducción de crecimiento vegetativo en la planta, lo que estimula un cambio en la translocación de asimilados y un aumento en la formación de yemas f lorales y por lo tanto en más frutos por planta (Ramírez et al., 2009). El uso de P-Ca en frutales incrementa los niveles de sólidos solubles, antocianinas y aromas en el producto cosechado y aumenta sustancialmente la capacidad antioxidante total y la concentración de licopeno en los grados de madurez; además, reduce los niveles de giberelinas biológicamente activas y aumenta los de citocininas en meristemos apicales en frutos de tomate (Ramírez et al., 2010b; Ramírez et al., 2005). En chile jalapeño incremento niveles de capsaicina y rendimiento por planta (Ramírez et al., 2009).
Por lo anterior el objetivo de esta investigación fue evaluar los efectos de P-Ca sobre el fenotipo, rendimiento y calidad antioxidante del fruto en chile habanero cultivar Jaguar y generar una tecnología para el potencial uso de Prohexadiona de Ca en la producción de chile habanero. La hipótesis planteada fué que P-Ca modifica el fenotipo de la planta y calidad de fruto en chile habanero variedad Jaguar.
Materiales y métodos
El experimento se estableció en la Universidad Autónoma Agraria Antonio Narro en Saltillo, Coahuila, México, en condiciones de invernadero, localizado a 25° 23’ latitud norte y 101° 01’ latitud oriente, con una altitud de 1 743 msnm. Se utilizó semilla de chile habanero (Capsicum chinense Jacq.) variedad Jaguar. Las semillas fueron sembradas el día 30 de mayo de 2014 en charolas de poliestireno de 200 cavidades, utilizando peat moss premier mix como sustrato. El trasplante se realizó el 11 de julio de 2014, cuando las plantas presentaron una altura de 10 cm dentro de un invernadero tipo cenital de estructura metálica con láminas laterales de policarbonato y plástico blanco lechoso (calibre 720) en el techo.
Lo anterior se realizó en bolsas de plástico negro de 20 litros, se utilizó sustrato peat moss y perlita (70:30 v/v). Las bolsas con el material vegetativo fueron ordenadas a una distancia de 40 cm entre plantas y 70 cm entre hileras.
Cuando las plantas presentaron primordios florales se realizó la aplicación foliar con P-Ca a las dosis de 0 (control-agua), 50, 100 y 150 mg L-1. Se realizó una segunda aspersión con P-Ca con las mismas concentraciones 15 días después de la primera aplicación. Las variables evaluadas fueron tasa de crecimiento de altura y diámetro de tallo, número de frutos, longitud de fruto y rendimiento por planta; contenido de capsaicina, carotenoides totales, vitamina C en frutos maduros. Se utilizó un diseño estadístico completamente al azar con 3 repeticiones por tratamiento. Los resultados obtenidos fueron analizados con el programa estadístico SAS versión 9.1, para obtener el análisis de varianza y comparación de medias mediante LSD (p≤ 0.05).
Evaluación hortícola. La tasa de crecimiento de la planta en altura y diámetro de tallo se obtuvo al medirse semanalmente durante su ciclo biológico. Para medir la altura, se utilizó una cinta métrica con escala 0 a 2 m, midiendo desde la base del tallo hasta el ápice de la planta. El diámetro de tallo se midió en su parte media con un vernier a una escala de 0 a 10 cm. El número de f lores por planta se registró en cada floración. La longitud y número de frutos, así como el rendimiento se determinaron en cada uno de los cuatro cortes y se sumaron al final. Para el pesado de los frutos se utilizó una báscula Ohaus modelo SP602, capacidad máxima 600 gramos con aproximación de 0.1 gramos.
Determinación de antioxidantes. El contenido de capsaicina en frutos se determinó con el método de Bennet y Kirby (1968). Se tomaron 5 frutos maduros por repetición por tratamiento, se liofilizaron y maceraron en mortero. Se pesó 1 g de muestra y se le agregaron 10 ml de etanol absoluto y se agitó la mezcla por 15 min. Se filtró en papel Whatman No. 1 y se aforó a 25 ml con etanol. La muestra se trasladó a un embudo de separación y se agregaron 2.5 ml de solución amortiguadora a pH de 2.8 más 0.5 ml de etanol, 20.5 ml de agua destilada y 10 ml de solución Adogen-Tolueno. Se agitó vigorosamente la mezcla por 1 min. Posteriormente, se determinó la absorbancia de la capsaicina en la fase orgánica en un espectrofotómetro (Thermo Electron Corporation Biomate 5) a una longitud de onda de 286 nm. Se realizó una lectura por repetición. Para determinar la concentración de capsaicina en las muestras, se construyó una curva de calibración con este antioxidante (Sigma, Co) en un intervalo de 0 - 0.40 mg ml-1, disuelta en los disolventes mencionados.
La determinación del contenido de carotenoides totales en los tejidos se realizó utilizando la técnica descrita por Tomas (1975), con algunas modificaciones. Se pesaron 10 g de fruto fresco y se agregó 50 ml de acetona y se dejó 24 h en refrigeración. En un mortero se trituró y el líquido se filtró en una gasa a través de un embudo de separación, se lavó la muestra a través de una gasa con 20 ml de acetona cuatro veces. Se le agregó 20 ml de éter de petróleo y 100 ml de agua destilada y se mezcló suavemente, al separar la capa superior contenedora de los carotenoides se volvió agregar 20 ml de éter de petróleo y 100 ml de agua destilada de ocho a nueve veces y se le adicionó 10 ml de NaOH al 40%. Posteriormente se lavó la muestra con 50 ml de agua destilada para eliminar NaOH al 40% utilizado como indicador fenolftaleína y se agregó 20 ml de sulfato de sodio al 10%. La mezcla se filtró a través de una gasa que contenía sulfato de sodio anhidro y se tomó el volumen final de la solución. Se determinó la absorbancia de carotenoides en un espectrofotómetro (Thermo Electron Corporation Biomate 5) a una longitud de onda de 454 nm utilizando como blanco el éter de petroleo. El contenido de carotenoides totales se determinó mediante la siguiente fórmula:
Donde: (%) ABS= por ciento de absorbancia; 3857= factor establecido; V= volumen medido de la probeta, y P= peso de la muestra en gramos.
El contenido de vitamina C en los frutos se determinó con la metodología reportada por Padayatt et al. (2001). Se pesaron 10 g de peso fresco de fruto y se colocaron en un mortero, se trituró con 10 ml de ácido clorhídrico al 2% (v/v). Se homogeneizó la mezcla en 40 ml de agua destilada. Se filtró a través de gasa y se colectó en un matraz Erlenmeyer. Se tomaron 10 ml del sobrenadante y se titularon con 2,6-diclorofenolindofenol (1 X 10-3 N), cuando la solución alcanzó un color rosa. El contenido de vitamina C se determinó utilizando la siguiente fórmula:
Vitamina C (mg 100 g PF)= (ml utilizados de 2,6 diclorofenolindofenol x 0.088 x volumen total x 100) / (volumen de la alícuota x peso de la muestra).
Resultados y discusión
Crecimiento de tallo
La altura de las plantas y el diámetro de tallo de chile habanero se redujeron significativamente (p≤ 0.5) a partir de la novena y cuarta semana respectivamente con las dósis crecientes de P-Ca al compararse con el control (Figuras 1 y 2). Este comportamiento se mantuvo en ambos tejidos durante el ciclo de crecimiento. Los valores máximos observados en la reducción de crecimiento fueron de 52% en la altura del tallo y de 30.5% en el diámetro de ese orgáno al compararse con el control. Prohexadiona de Calcio es un retardante de crecimiento que inhibe la síntesis de las giberelinas biológicamente activas A1, A4, y A7 (Brown et al., 1997; Evans et al., 1999). Este efecto se relaciona directamente con la reducción en el crecimiento vegetativo observado en las Figuras 1 y 2, el cual refleja una disminución en la elongación celular (Evans et al., 1999; Rademacher y Kober et al., 2003).

Figura 1 Efecto de prohexadiona de calcio sobre la tasa de crecimiento en altura del tallo en chile habanero var. Jaguar. Cada punto representa el promedio de nueve plantas. *indica diferencia estadísticamente significativa de acuerdo con la prueba de LSD (p≤ 0.05).

Figura 2 Efecto de prohexadiona de calcio sobre la tasa de crecimiento del diámetro del tallo en chile habanero var. Jaguar. Cada punto representa el promedio de nueve plantas. *indica diferencia estadísticamente significativa de acuerdo con la prueba de LSD (p≤ 0.05).
Ramírez et al. (2008) identificaron en ápices de tomate saladette y chile pimiento tratados con P-Ca las giberelinas biológicamente inactivas GA20 y GA53, y demostraron el bloqueo de la síntesis de GA1, GA4 y GA7 las cuáles son responsables del crecimiento de tallo y diámetro en ambas especies. Este efecto de disminución de crecimiento se ha observado en chile mirador (Ramírez et al., 2010a), tomate de cascara (Ramírez et al., 2010c), chile jalapeño (Ramírez et al., 2015) y frutales como manzano (Unrath 1999; Miller 2002; Basak 2007); y en ornamentales como petunia (Ilias y Rajapakse et al., 2005). El efecto de P-Ca en el diámetro de tallo también se ha observado previamente en chile jalapeño (Ramírez et al., 2015).
Al final del ciclo vegetativo, se observó en la mayoría de los tratamientos con P-Ca una tendencia a restaurar el crecimiento, aunque sin alcanzar al desarrollo de las plantas del control (Figuras 1 y 2). La restauración en el crecimiento del tallo principal y diámetro en la última etapa de desarrollo se ha observado en otras especies hortícolas tratadas con P-Ca, y se relaciona con el retorno de la síntesis de las giberelinas biológicamente activas en el ápice de esas plantas (Rademacher, 2004).
Floración, frutos y rendimiento
Se observó una tendencia a mayor número de flores por planta conforme se incrementó la concentración de P-Ca (Figura 3). La dosis del bioregulador a 50 mg L-1 X 2 mostró la mayor floración y superó significativamente al control en 50%. Ramírez et al. (2009) mencionan que es probable que exista un sinergismo entre P-Ca y el aumento de citocininas en la yema estimulada a ser floral, condición que resulta en un mayor número de flores por planta. Ramírez et al. (2005) realizaron aplicación de diferentes concentraciones de P-Ca en híbridos de tomate y observaron que el retardante de crecimiento indujo un incremento significativo en el contenido de citocininas. Este efecto también se ha reportado en chile mirador en donde hubo un aumento en el número de flores (Ramírez et al., 2010a); y en frutales como cereza (Elfving et al., 2003), manzana, pera y ciruelo (Basak y Rademacher et al., 1998).

Figura 3 Efecto de prohexadiona de calcio sobre número de flores y frutos en chile habanero var. Jaguar. Barras con la misma letra son iguales (LSD p≤ 0.05).
Al sumar el número de frutos en los cuatro cortes por planta efectuados, se observó que cualquier tratamiento con P-Ca superó significativamente al control (Figura 3). El tratamiento con P-Ca a 150 mg L-1 causó el incremento más sobresaliente al duplicar practicamente el número total de frutos del producido en el control. Cuando se aplicó la misma dósis de P-Ca en dos ocasiones, se alcanzó un incremento de 60% contra el control. El rendimiento por planta reflejó también el efecto anterior. La producción aumentó significativamente en todos los tratamientos con prohexadiona de calcio (Cuadro 1); sobresaliendo nuevamente los tratamientos con P-Ca a 150 mg L-1 en una o dos aplicaciones en donde se observaron incrementos de 43% y 36% respectivamente al compararse con el control. El tamaño del fruto se redujo con la mayoría de las dosis con P-Ca (Cuadro 1).
Cuadro 1 Efecto de P-Ca sobre la longitud de fruto y rendimiento en chile habanero var. Jaguar.

*,significativo a una p≤ (0.05); C.V. : coeficeinte de variación, x Valores con la misma letra en cada factor son iguales (LSD p≤ 0.05), cada factor representa el promedio de 9 plantas. X2= P-Ca aplicado dos veces.
Deka y Shadeque et al. (1996) mencionan que el rendimiento depende de la acumulación de fotoasimilados y particiones en diferentes partes de la planta. P-Ca es un retardante del crecimiento capaz de modificar la translocación de asimilados y la redistribución de la materia seca ocasionando con ello una mejora en el rendimiento (Chetti, 1991); además, estimula la inducción f loral y cuajado de frutos (Ramírez et al., 2010c; Ramírez et al., 2005). El incremento en número de flores y frutos observados en la Figura 1 y el aumento en el rendimiento reportado en el Cuadro 1, sustentan lo anterior. La inhibición del crecimiento vegetativo posiblemente hizo disponibles mayores reservas de alimentos para el cuajado y desarrollo de frutos (Ma y Smith, 1992). Se han reportado trabajos con resultados similares en chile jalapeño con P-Ca en donde se observó un aumento en el rendimiento (Ramírez et al., 2009; Ramírez et al., 2010a; Ramírez et al., 2015) y en tomate de cascara y saladette (Ramírez et al., 2005; Ramírez et al., 2010c). La reducción en la longitud del fruto causado por P-Ca podría estar ligada al notable incremento en el cuajado de fruto que se observó entre los tratamientos con el retardante de crecimiento; sin embargo, este fenotipo puede ser compensado con el enriquecimiento qualitativo del fruto cosechado como ya ha sido demostrado en cereza y otros frutales (Rademacher y Kober, 2003).
Antioxidantes
Capsaicina
La prohexadiona de Ca incrementó el contenido de capsaicina en frutos a cualquier dósis evaluada (Figura 4). El tratamiento con P-Ca a 150 mg L-1 provocó el mayor contenido de capsaicina. La dósis a 50 mg L-1 aplicados en una o dos ocasiones también ocasionaron incrementos substanciales en este antioxidante.

Figura 4 Efecto de prohexadiona de calcio sobre los niveles de capsaicina en frutos de chile habanero var. Jaguar. Cada barra representa la media de tres repeticiones. Barras con la misma letra son iguales (LSD p≤ 0.05).
La información sobre los efectos de P-Ca en chile habanero es muy escasa; sin embargo, existen reportes de incrementos en el nivel de capsaicina en frutos de chile jalapeño tratado con P-Ca (Ramírez et al., 2009; Ramírez et al., 2010a). Es posible que prohexadiona de calcio modifique a nivel enzimático la ruta biosintética de los f lavonoides, generando f lavonoides modificados ligados a la actividad antioxidante en tejidos jóvenes (Rademacher, 2004; Ramírez et al., 2010a). Se conoce la síntesis de capsaicina donde su estructura química consiste en un nucleo fenólico unido mediante un enlace amida a un ácido graso; en donde la porción fenólica es la vainillilamina, que se forma a partir de la fenilalanina por medio de la ruta de los fenilporpanoides y el ácido graso se forma a partir aminoácidos de cadena lateral ramificada, ya sea valina o leucina (Vázquez et al., 2007). Se sugiere entonces que P-Ca podría prolongar este proceso resultando en mayor producción de capsaicna (Evans et al., 1999).
Carotenoides totales
La mayoría de los tratamientos con P-Ca modificaron el contenido de carotenoides totales en frutos de chile habanero (Figura 5). Este efecto fue mayor cuando se aplicó el P-Ca a las dósis de 50 mg L-1 en una o dos aplicaciones causando un incremento de carotenoides totales de 22% y 38% respectivamente al compararse con el control.

Figura 5 Efecto de prohexadiona de calcio sobre el contenido de carotenoides totales en frutos de chile habanero var. Jaguar. Cada barra representa la media de tres repeticiones. Barras con la misma letra son iguales (LSD p≤ 0.05).
La información sobre los posibles efectos y de prohexadiona de calcio sobre el metabolismo y síntesis de carotenos en frutos de chile habanero es muy limitada. En chile jalapeño se ha reportado evidencia de un incremento en carotenos con la aplicación de P-Ca. Este efecto es muy contundente con aumento en los niveles de luteolina en frutos maduros (Ramírez et al., 2015). En tomate floradade P-Ca aumentó el contenido de licopeno en frutos maduros (Ramírez et al., 2010b). El retardante de crecimiento provocó incrementos en el contenido de carotenoides, mejorando con ello el color de la cáscara de mandarina y naranja (Barry y Roux, 2010). Por lo tanto, es conveniente investigar más sobre la influencia de P-Ca en el metabolismo de maduración de frutos.
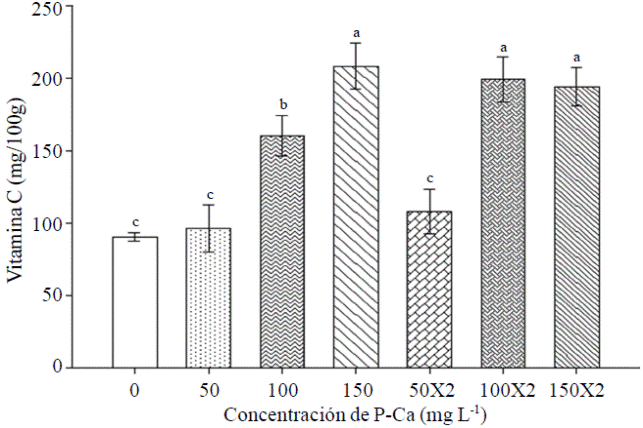
Vitamina C
La prohexadiona de calcio estimuló un aumento en el contenido de vitamina C en frutos maduros de chile habanero var. Jaguar (Figura 6). Los tratamientos con el bioregulador aplicados en las concentraciones de 100 y 150 mg L en una o dos asperciones causaron en promedio un aumento de 148% en el contenido de vitamina C al compararse con los frutos del control. Este efecto se observó previamente en chile jalapeño (Ramírez et al., 2009; Ramírez et al., 2010a) y en tomate de cascara (Ramírez et al., 2010c). Rademacher y Kober (2003) mencionan que el etileno se genera a partir de ácido aminociclopropanocarboxílico (ACC) en una reacción catalizada por la ACC oxidasa. Esta es una dioxigenasa que requiere ácido ascórbico como un co-sustrato y P-Ca también es inhibidora para esta enzima. Por lo anterior, se plantea la hipotesis que P-Ca al inhibir la síntesis de etileno provoca una acumulación de ácido ascórbico ya que P-Ca compite por el sito activo en la síntesis de etileno.
Conclusiones
Con los resultados obtenidos y bajo las condiciones en que se realizó esta investigación se concluye que P-Ca reduce el crecimiento de altura y diámetro de tallo; aumenta floración, número de frutos y rendimiento por planta y provoca un incremento en el contenido de capsaicina, carotenoides totales y vitamina C en frutos maduros de chile habanero var. Jaguar.











 texto em
texto em