Introducción
El cobalto (Co) es un elemento esencial para los seres humanos, animales y procariotas. En plantas superiores no se ha identificado una función fisiológica de este elemento; con excepción de las leguminosas que lo requieren para la fijación de nitrógeno que realizan bacterias simbiontes (Witte et al., 2002). A pesar de su no esencialidad, se ha identificado que concentraciones de Co en tejido vegetal, menores a 10 mg g-1 de peso seco, pudieran ser benéficas (Palit et al., 1994).
En tomate (Solanum lycopersicum L.) cultivado en hidroponía, se evidenció que la adición de Co en una concentración de 2.5 mg L-1 de solución nutritiva, favoreció la absorción de nitrógeno (N), fósforo (P) y potasio (K) (Boureto et al., 2001). Gad (2005) también en tomate, indica que el suministro de Co en dosis de 7.5 mg L-1 de solución nutritiva, incrementa significativamente parámetros de crecimiento, rendimiento y la concentración nutrimental; mientras que en frutos aumentó los sólidos solubles totales, azúcares solubles totales y la concentración de ácido ascórbico y redujo la acidez titulable. En maíz (Zea mays L.) establecido en suelo, se encontró que concentraciones de Co de 50 mg kg-1 incrementan el vigor de plántulas, el número de mazorcas por planta y de semillas por mazorca; así también aumentan la concentración de pigmentos fotosintéticos como clorofilas a, b y totales, contenido de aminoácidos, proteínas y almidones (Jaleel et al., 2009).
Bajo condiciones de estrés osmótico, también se ha reportado el efecto positivo de la adición de Co; por ejemplo, en plántulas de papa sometidas a estrés osmótico, la adición de éste en concentraciones de 25 µmol L-1 inhibió la tasa de producción de etileno de manera significativa, disminuyó las concentraciones de radicales libres de oxígeno e incrementó la actividad de enzimas antioxidantes (Li et al., 2005). Asimismo, el efecto del Co en parámetros poscosecha de distintas especies ornamentales ha sido estudiado. En rosa (Rosa hybrida ) cv. Samantha, el Co inhibió el bloqueo vascular de los tallos, lo que permitió un alto flujo de agua a través de éstos, conduciendo a un incremento significativo en la absorción de agua de las flores cortadas (Reddy, 1998). En clavel (Dianthus caryiohyllus L.), el tratamiento con Co en concentraciones de 50 a 100 mg L-1, incrementaron significativamente la vida de florero, en comparación con el testigo; asimismo, se observó una reducción en la tasa de producción de etileno (Jamali y Rahemi, 2011). En Lilium híbrido oriental “Star Gazer” y “Star Fighter” se mostró que concentraciones de Co de 0.1 y 0.2 mM retrasan los síntomas de senescencia de los tallos florales (Mandujano-Piña et al., 2012).
La gladiola es una especie de alta demanda en nuestro país, pero la longevidad de sus flores es muy corta. La vida de florero de varas individuales es de entre 4 y 6 días (Hatamzadeh et al., 2012). Si bien, existen investigaciones que han evidenciado que la senescencia de pétalos de gladiola no es afectada por etileno exógeno, así como por inhibidores de etileno (Ezhilmathi et al., 2007), ésta última respuesta atribuida al Co, esta investigación tiene por objetivo evaluar efectos de este metal en otros parámetros poscosecha de gladiola.
Materiales y métodos
Condiciones experimentales. Esta investigación se desarrolló bajo condiciones de laboratorio, con temperaturas medias durante el día de 25.8 oC y nocturnas de 25.3 oC; humedad relativas de 33.4 y 39.8% diurnas y nocturnas, respectivamente. La intensidad luminosa promedio fue de 19 y 2 lumens, durante el día y la noche, respectivamente
Material vegetal. Varas florales de gladiola (Gladiolus grandiflorus Hort.) cv. Borrega Roja fueron adquiridas en el mercado local, las flores que conforman la inflorescencia se encontraban cerradas en su totalidad. Las inflorescencias estuvieron constituidas por entre 12 y 16 flores y su longitud fue de 92 cm.
Diseño de tratamientos y diseño experimental. A partir de CoCl2 6H2O (Sigma Aldrich, ACS Reagent 98%), se prepararon con agua desionizada soluciones con concentraciones de Co de 0.3 y 0.6 mM, empleándose como testigo agua desionizada. 250 ml de cada una de las soluciones se colocaron en floreros de cristal, con una vara floral, misma que constituyó la unidad experimental. Cada uno de los tratamientos evaluados tuvo 10 repeticiones y se distribuyeron sobre mesas completamente al azar.
Variables evaluadas
Absorción de agua por varas florales. Después de 48, 96 y 144 h de tratamiento se evaluó la cantidad de agua consumida por cada una de las varas florales usando una probeta de cristal. Una vez realizada la medición, el volumen de cada florero se llevó nuevamente a 250 mL.
Pérdida porcentual de peso de varas florales. El peso de cada vara floral se determinó a los 2, 3, 5 y 7 días después de establecidos los tratamientos usando una balanza digital (Mod. EK 3052-P, cap. 5 kg/11 lb). Los resultados fueron referenciados al peso inicial de cada vara floral para la obtención del porcentaje de pérdida de peso de éstas. La pérdida porcentual presentada en cada muestreo es acumulada.
Cinética de apertura floral. La apertura floral fue evaluada después de 2, 3, 5 y 7 días de tratamiento. El grado de apertura floral se agrupó en cinco clases, de acuerdo a lo descrito por Serek et al. (1994), los cuales son: 1) botón cerrado en el cual se advierte inicio de pigmentación (A1); 2) botón con apertura inicial (A2); 3) botón con apertura de 50% (A3); 4) botón con apertura de 100% (A4); y 5) senescencia incipiente (S, indicada por inicio de marchitez en márgenes de los pétalos). Se contabilizaron los botones en cada fase, determinándose el porcentaje en cada grupo tomando el total de flores que conformaba cada una de las inflorescencias.
Materia seca por órgano. Después de siete días de tratamiento, las varas florales fueron divididas en hojas, tallo e inflorescencias. Las muestras resultantes fueron secadas hasta peso constante a 70 °C y se determinó el peso de materia seca de cada órgano usando una balanza analítica (marca Riossa modelo HCF-125D. México).
Concentración de N. Se determinó la concentración de N en tejido seco en los órganos provenientes de las varas florales tratadas, empleando el método Semimicro-Kjeldahl (Bremner, 1965).
Contenido de N por órgano y total. Con los resultados obtenidos de concentración de N en cada órgano y su peso promedio de materia seca, se estimó el contenido de N en cada uno de ellos y total.
Concentración foliar de clorofilas. En hojas de varas florales tratadas por siete días con distintas concentraciones de Co, se determinó la concentración de clorofilas a, b y total, de acuerdo a lo descrito por Harborne (1973), empleando un espectrofotómetro (Spectronic, GenesysTM serie 10uv. EU).
Análisis de resultados. Los resultados obtenidos fueron analizados estadísticamente empleando un análisis de varianza y una prueba de comparación de medias por Tukey (α= 0.05), utilizando el software SAS (SAS, 2002).
Resultados y discusión
Absorción de agua por varas florales. La absorción de agua de las varas florales después de 48, 96 y 144 h de establecidas en florero, se muestra en el Cuadro 1.
Cuadro 1 Absorción de agua por varas florales de gladiola tratadas con diferentes concentraciones de cobalto.
| Cobalto, | 48 h | 96 h | 144 h |
| mM | mL | ||
| 0 | 100 ± 5.78 a | 73.6 ± 7.06 a | 50.2 ± 2.3 b |
| 0.3 | 109 ± 6.32 a | 76.6 ± 2.49 a | 60.8 ± 1.95 a |
| 0.6 | 110.22 ± 5.4 a | 75.8 ± 3.85 a | 66 ± 4.34 a |
| DMS | 19.74 | 16.4 | 10.3 |
| CV, % | 10.99 | 12.9 | 10.35 |
Medias ± DE con letras distintas entre columnas, indican diferencias estadísticas significativas (Tukey, 0.05).
El término de la vida en el florero para las flores cortadas es caracterizado por un marchitamiento asociado con un desequilibrio entre el desarrollo de la absorción de agua a través de los conductos del xilema en los tallos y el agua pérdida a través de los estomas y otras estructuras en hojas y otros órganos (Lü et al., 2011). El Co es un elemento que ha mostrado efectos positivos en el consumo de agua de tallos florales. En nardo (Polianthes tuberosa L.), el tratamiento en florero con CoCl2 a una concentración de 300 mg L-1 (2.3 mM de Co), incrementó 9.3% el volumen de agua absorbida respecto a tallos que no fueron tratados con este elemento (Mohammad et al., 2012). Así también en vara de oro de Canadá (Solidago canadensis L.) se reportó que el Co en concentración de 0.5 mM con sacarosa a 4% incrementaron significativa la absorción de agua (Patil y Reddy, 1997).
En Rosa hybrida cv. Samantha Mandujano-Piña et al. (2012) reportan un incremento de 39% en el consumo de agua de tallos florales de Lilium híbrido oriental ‘Star Gazer’y ‘Star Fighter’, cuando éstos fueron tratados en florero por tres días con 0.1 mM de Co. En esta investigación se observó efecto positivo de Co en la absorción de agua, solo en el muestreo realizado después de 144 h de tratamiento (6 días). Las varas tratadas con 0.3 y 0.6 mM de Co absorbieron un volumen superior 21.11 y 31.48%, respectivamente, en comparación con el testigo. Si bien, en las evaluaciones realizadas después de 48 y 96 h, no existieron diferencias estadísticas en volúmenes absorbidos entre tratamientos, no obstante éstos siempre fueron mayores en varas tratadas con Co, independientemente de la concentración (Cuadro 1). El efecto positivo del Co en la absorción de agua obedece a que este elemento disminuye el bloqueo vascular mediante la supresión del desarrollo microbiano (Patil y Reddy, 1997).
Pérdida porcentual de peso de varas florales. Después de 48 h de tratamiento, la pérdida de peso de varas florales fue de 2.56, 1.86 y 1.64% en los tratamientos testigo, 0.3 y 0.6 mM de Co, respectivamente, no obstante, no hubo diferencia estadística entre ellos. En la segunda evaluación (96 h) se presentaron diferencias estadísticas entre tratamientos; evidenciándose que la mayor pérdida en peso (8.2%) se presentó en varas tratadas con la concentración más alta de Co; no obstante, este tratamiento no fue estadísticamente diferente al testigo. Por el contrario, el menor porcentaje pérdida de peso (5.28%) se registró en varas del tratamiento con la dosis menor de Co; pero de igual manera, éste no fue diferente estadísticamente al testigo (Figura 1).
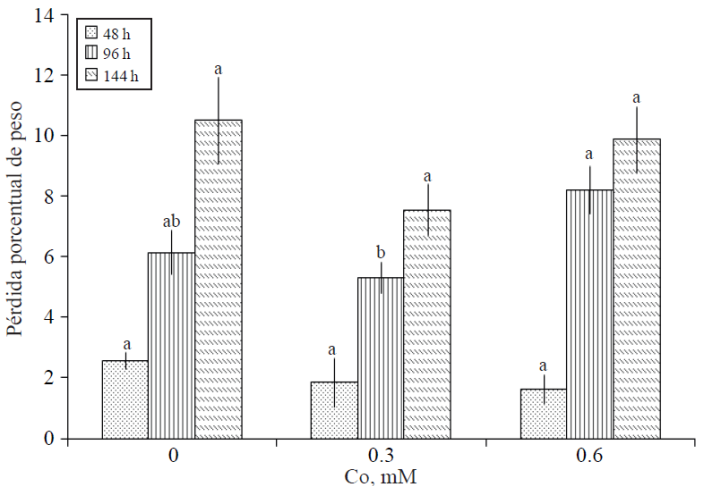
Figura 1 Pérdida porcentual de peso de varas florales de gladiola tratadas con distintas concentraciones de cobalto. Medias ± DE con letras distintas en cada medición indican diferencias significativas (Tukey, p≤ 0.05) entre tratamientos.
En rosa (Rosa hybrida) cv. Samantha, se encontró que el Co, además de inhibir el bloqueo vascular en tallos, ocasiona un cierre parcial de estomas, por tanto reduce la relación pérdida de agua/absorción de agua y mantiene un alto potencial de agua en la rosa cortada. Lo anterior resulta en el mantenimiento de altos pesos en fresco que conducen a un incremento en la vida de florero (Reddy, 1988).
En esta investigación, es evidente que con la concentración baja de Co adicionada, se tuvieron en los tres muestreos realizados los menores porcentajes de pérdida de peso en las varas florales. En el testigo, después de 144 h se registró la mayor pérdida en peso, 10.5% del peso inicial. Moraes et al. (1999) reportan que pérdidas en peso fresco de tallos florales entre 10 y 15% pueden causar muerte tisular.
Cinética de apertura floral. Dos días después del establecimiento de las varas en florero, se observaron flores en tres estados de apertura, no registrándose diferencias estadísticas entre los tratamientos (Figura 2A). La fase de apertura A4 (apertura floral a 100%) se observó después de tres días de tratamiento, en 1.25% de las flores de varas correspondientes al testigo, sin ser este porcentaje significativo; asimismo, en las fases A1, A2 y A3 no fueron estadísticamente diferentes entre tratamientos (Figura 2B). En el muestreo realizado cinco días después del establecimiento de la investigación, se registraron diferencias estadísticas entre tratamientos en flores en estado de apertura A1 (inicio de pigmentación en botones apretados), siendo mayor el porcentaje en inflorescencias del testigo; en consecuencia, en las tres fases cronológicamente posteriores (A2, A3 y A4), el testigo tuvo un menor porcentaje de inflorescencias pero no fueron estadísticamente diferentes al resto de los tratamientos. En este muestreo, tuvo lugar el inició la senescencia floral (S), no siendo diferente estadísticamente entre tratamientos, con porcentajes de 5.95, 7.09 y 7.43% en los tratamientos testigo, 0.3 y 0.6 mM de Co, respectivamente (Figura 2C). Después de 7 días en florero, no se observaron diferencias estadísticas entre tratamientos en los estadíos de apertura floral y senescencia, destacando que en los tratamiento con Co, el porcentaje de flores por inflorescencia que mostraron senescencia fue superior a 10%, mientras que en el testigo 8.21% (Figura 2D).
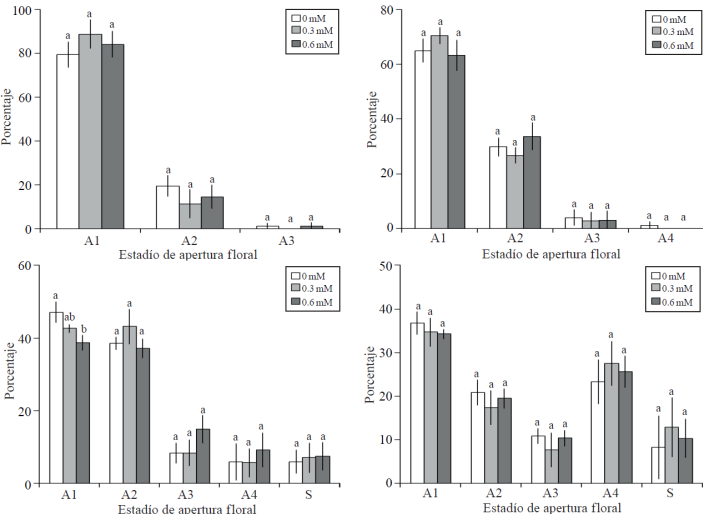
Figura 2 Porcentaje de apertura floral a los 2, 3, 5 y 7 días (A, B, C y D respectivamente), en varas florales de gladiola tratadas con distintas concentraciones de cobalto. A1= botón cerrado en el cual se advierte inicio de pigmentación; A2= botón con apertura inicial; A3= botón con apertura de 50%; A4= botón con apertura del 100%; y S= senescencia incipiente indicada por inicio de marchitez en márgenes de los pétalos. Medias ± DE con letras distintas en cada medición indican diferencias significativas (Tukey, p≤ 0.05) entre tratamientos.
En estudios previos en gladiola cv. Friendship, se reportó que el tratamiento con CoCl 2, tuvo un efecto positivo en la longevidad y apertura de las flores (Murali y Reddy, 1993); no obstante, los autores no consideran el efecto que pudo tener el transporte de la sacarosa adicionada, además del Co, dado que ha sido mostrado que este elemento incrementa la absorción de agua, en este caso, en consecuencia la absorción de sacarosa.
Partición de biomasa seca en varas florales. Después de 7 días en florero, el peso de materia seca total (Figura 3A) fue estadísticamente superior en varas tratadas con 0.3 mM de Co; entre varas del tratamiento testigo y las tratadas con 0.6 mM de Co no hubo diferencia estadística. En lo que respecta a peso de materia seca de hojas por cada vara, la media más alta se registró en el tratamiento 0.3 mM, superando 3.15% al peso de hojas registrado en varas del testigo, siendo este incremento estadísticamente no diferente al testigo (Figura 3B). El peso de materia seca de las inflorescencias no fue estadísticamente diferente entre tratamientos (Figura 3C). El tratamiento con Co, particularmente a una concentración de 0.3 mM, ocasionó un incremento significativo del peso de materia seca de tallo (Figura 3D).
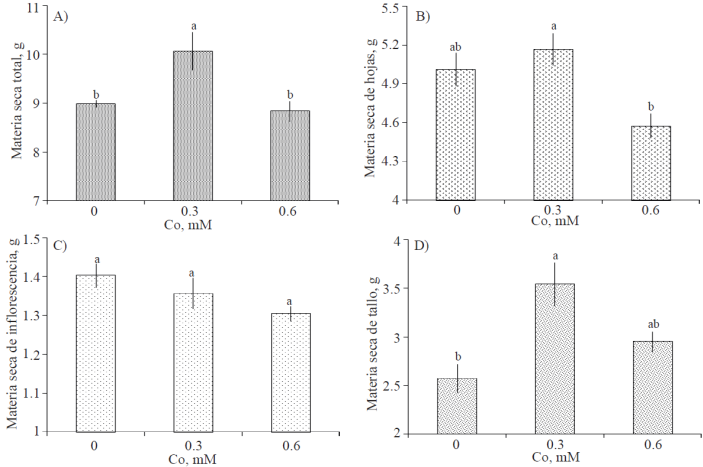
Figura 3 Biomasa seca total por vara floral y por órgano (hoja, inflorescencia y tallo) de gladiola tratada durante diez días en florero con distintas concentraciones de cobalto. Medias ± DE con letras distintas en cada subfigura indican diferencias significativas (Tukey, p≤ 0.05) entre tratamientos.
El efecto positivo del Co en el peso de la biomasa seca de flores de corte ha sido reportado en otras especies. En clavel (Dianthus caryophyllus L.), concentraciones de Co de 75 y 100 mg L-1 en poscosecha (1.27 y 1.7 mM de Co, respectivamente), no afectaron la biomasa seca de los tallos; mientras que 50 mg L-1 de este elemento (0.85 mM), redujeron significativamente el peso de los tallos florales, en comparación con el tratamiento con ausencia de Co (Jamali y Rahemi, 2011). Asimismo, Noghani et al. (2012), reportan que el tratamiento con 6.13 mM de Co (800 mg L-1 de CoCl2) y 0.2% de (NH4)2SO4, incrementaron significativamente la biomasa seca de varas florales de nardo (Polianthes tuberosa L.).
Es importante notar que los tratamientos evaluados no afectaron el peso en seco de las inflorescencias, no obstante, se advierte una relación negativa entre éste y la concentración de Co. Esta tendencia ha sido reportada en flores de corte tratadas con otros metales; tal es el caso de tallos de rosa cv. Black Magic, que al ser tratados con Al, Cu y Ag presentaron menor peso seco de pétalos que el testigo, no obstante estas reducciones no fueron significativas (Hajizadeh et al., 2012).
También es destacable, la relación inversa entre biomasa seca de pétalos (Figura 3) y el porcentaje de flores senescentes después de 7 días en florero (Figura 2D); es decir, la menor biomasa seca de pétalos se asocia con un mayor porcentaje de flores senescentes, debido a que los pétalos son marchitados visiblemente cuando las células epidermales pierden turgor (Van Doorn, 2001).
Concentración foliar de clorofilas. La Figura 4 muestra los resultados de concentración de clorofilas en hojas de varas florales de gladiola tratadas con los diferentes niveles de Co. La concentración de clorofila b fue estadísticamente superior en hojas de varas tratadas con Co, independientemente de la concentración de éste. Las concentraciones de clorofilas a y total, son superiores con el tratamiento con 0.3 mM sin presentar éstas diferencia estadística con el tratamiento consistente en 0.6 mM de Co; mientras que, sí superior estadísticamente al testigo (Figura 4).
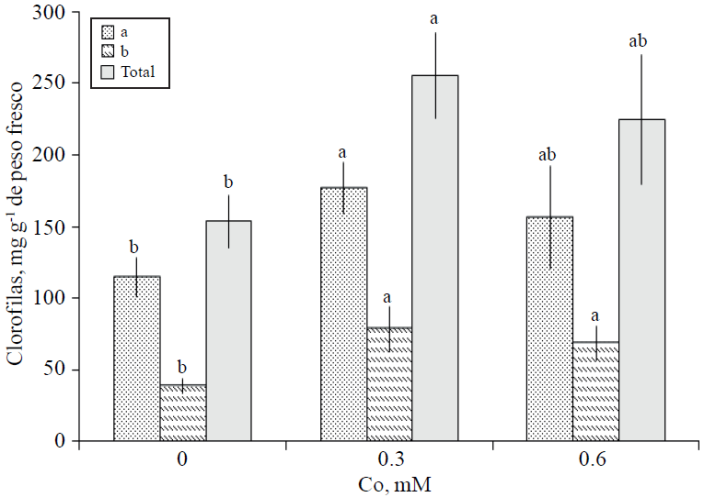
Figura 4 Concentración foliar de clorofilas a, b y totales en varas de gladiola tratadas durante 10 días en florero con distintas concentraciones de cobalto. Medias ± DE con letras distintas en cada variable indican diferencias significativas (Tukey, p≤ 0.05) entre tratamientos.
El síntoma visible de la senescencia foliar es la pérdida del color verde, causado por la degradación de clorofila; en particular en flores de corte la senescencia es un proceso estrechamente relacionado a una reducción considerable de la energía necesaria para reacciones de síntesis (Faraji et al., 2011) . En esta investigación los resultados permiten afirmar que el Co, es un elemento que retrasó este proceso, especialmente en la dosis más baja (Figura 4). En tallos florales de Lilium “Star Gazer” y “Star Fighter”, han sido reportados también efectos positivos en la degradación de la clorofila durante la vida de florero después de 13 días, donde la adición de Co en concentraciones de 0.2 y 0.8 mM presentó valores de lecturas SPAD significativamente mayores a aquellas registradas sin el suministro de Co (Mandujano-Piña et al., 2012).
Otros metales como el Al, adicionado a partir de Al2(SO4)3 en rosa cv. “Cherry Brandy” a una concentración de 100 mg L-1, resultó en un mayor valor de lecturas SPAD, en comparación con el testigo; concluyéndose que este efecto positivo del Al en la clorofila es debido a la mejora de las relaciones hídricas en los tallos florales (Jowkar et al., 2012); resultados coincidentes con los aquí presentados del consumo de agua y de la materia seca en las Figuras 1 y 3, respectivamente.
Concentración y contenido de N. La concentración de N en hojas, flores e inflorescencias que constituyen las varas florales de gladiola, no fue estadísticamente diferente entre tratamientos, observándose el siguiente orden de concentración por órgano: inflorescencia > hojas > tallos (Cuadro 2).
Cuadro 2 Concentración de nitrógeno por órgano de tallos florales de gladiola tratados en florero por diez días con diferentes concentraciones de cobalto.
| Cobalto, mM | Hojas | Inflorescencia | Tallo |
| g kg-1 de materia seca | |||
| 0 | 25.44 ± 0.99 a | 30.45 ± 0.23 a | 14.96 ± 0.1 a |
| 0.3 | 23.06 ± 0.54 a | 30.15 ± 0.91 a | 15.14 ± 1.31 a |
| 0.6 | 23.59 ± 0.38 a | 31.69 ± 0.48 a | 13.47 ± 0.36 a |
| DMS | 2.72 | 2.39 | 3.11 |
| CV, % | 5.73 | 3.94 | 10.83 |
Medias ± DE con letras distintas entre columnas, indican diferencias estadísticas significativas (Tukey, 0.05).
En Gladiolus caryophyllaceus en fase de madurez (210 días después de la brotación) las concentraciones de N en tallo y flores fueron 11.19 y 4.12 mg kg-1 de materia seca, respectivamente (Hocking, 1993). Ambas concentraciones fueron menores a las encontradas en este estudio; particularmente en la inflorescencia. No obstante, es importante mencionar que la removilización de nutrimentos en la senescencia es variable entre tallos florales cortados y aquellos tallos que permanecen en la planta (Jones, 2013).
Coincidiendo con esta investigación, el Co no tuvo efecto significativo en la concentración de N en tallos florales de dos cultivares de Lilium híbrido en poscosecha; por el contrario, la adición de este metal en dosis de 0.1, 0.2, 0.4 y 0.8 mM incrementaron significativamente la concentración de N en hojas (Mandujano-Piña et al., 2012).
Los resultados muestran que no existió una relación entre la concentración foliar de N (Cuadro 2) y las concentraciones foliares de clorofilas (Figura 3). En gladiola cultivada, de manera general se ha encontrado una relación positiva entre el nitrógeno y las clorofilas, dado que el primero es un componente estructural de las segundas; por ejemplo, en cultivo en maceta de Gladiolus hybrida cv. Sancerre, se observó una relación positiva y altamente significativa entre la dosis de fertilización nitrogenada y la concentración foliar de clorofilas (Sewedan et al., 2012).
El contenido total de N en varas florales mostró una reducción significativa con el tratamiento consistente en 0.6 Mm (Figura 5A). Asimismo, el contenido foliar de N fue reducido en forma significativa cuando las varas fueron tratadas con Co; observándose una relación negativa entre éste y la concentración de Co suministrada (Figura 5B). El contenido de N en inflorescencias no fue diferente estadísticamente entre tratamientos (Figura 5C). La cantidad de N en tallos, fue estadísticamente superior cuando las varas florales fueron tratadas con 0.3 mM de Co (Figura 5D).
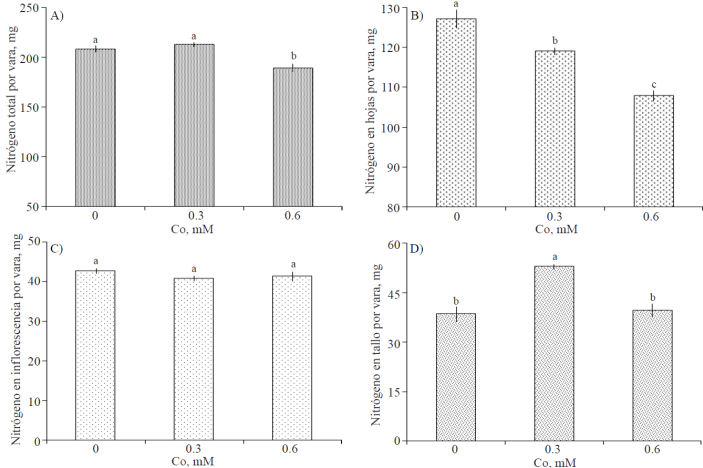
Figura 5 Contenido de nitrógeno total y por órgano de varas de gladiola tratadas durante diez días en florero con distintas concentraciones de cobalto. Medias ± DE con letras distintas en cada subfigura indican diferencias significativas (Tukey, p≤ 0.05) entre tratamientos.
Se ha reportado en Gladiolus grandiflorus, que el déficit de agua ocasiona retraso en la translocación de fotoasimilados desde las hojas fuente hacia órganos de demanda (Robinson, 1983). Considerando lo anterior, los resultados obtenidos permiten afirmar que si bien el Co no tuvo influencia en el contenido total de N de varas florales; este elemento si afecta la partición del N debido su efecto positivo en el estatus hídrico, favoreciendo su translocación desde las hojas hacia tallos (Figura 5); esta afirmación soportada por el incremento significativo en la biomasa seca de tallas (Figura 3).
Conclusiones
Los resultados obtenidos permiten concluir que el Co tiene efectos positivos en parámetros poscosecha de gladiola; en particular aquellos relacionados con el estatus hídrico de la vara floral: menor pérdida de peso en fresco, peso de materia seca y partición de N. Así también, el Co retrasa la degradación de pigmentos fotosintéticos.











 texto en
texto en 


