Introducción
El éxito en la producción equina depende de aspectos como la nutrición, el control de enfermedades, las instalaciones y el manejo reproductivo; este último es un pilar fundamental para la crianza adecuada. La etapa reproductiva es considerada una de las más importantes en la vida de las yeguas, puesto que el éxito se basa en su desempeño reproductivo (Fernández et al., 2008).
Una de las mayores dificultades para la producción equina es la fertilidad (Iacono et al., 2014), pues se han llegado a detectar tasas de preñez bajas, de 20 %, en yeguas sin ningún tratamiento (Fernández et al., 2008). Esto se atribuye a ovulaciones silenciosas, cuerpos lúteos persistentes, quistes foliculares y lesiones cervicales, etc.
Con el fin de reducir la incertidumbre asociada con el ciclo estral de la yegua y mejorar la fertilidad, se utilizan métodos como la palpación y la ultrasonografía, y tratamientos hormonales con gonadotropina coriónica humana, hormona luteinizante y hormona liberadora de las gonadotropinas (Barrier-Battut et al., 2001). Con este último tratamiento se han obtenido mejoras de hasta 90 % para la tasa de ovulación (Grimmett y Perkins, 2001) y 80 % para tasa de preñez (Fernández et al., 2008). Palmer y Driancourt (1980) utilizaron ecografía en tiempo real en equinos por primera vez para diagnóstico de gestación. Desde entonces, esta tecnología se utiliza regularmente en estudios para diagnóstico de preñez y revisión del tracto reproductivo de la yegua (Cuervo-Arango et al., 2009; Lemes et al., 2017), como apoyo a la investigación y su aplicación en explotaciones comerciales de caballos. Con respecto a la inseminación artificial (IA) en equinos, se han estudiado dosis de semen adecuadas (Brinsko, 2006); tipo de semen (Loomis y Squires, 2005; Cuervo-Arango et al., 2009); técnica (Brinsko et al., 2003), y tiempo de inseminación (Cuervo-Arango et al., 2009).
En la crianza equina comercial, la meta es obtener una cría por yegua por año. Para ello, es relevante el manejo posparto de la yegua, el uso adecuado del macho y la inseminación en el momento más propicio, de acuerdo con la ovulación (Lemes et al., 2017). Si bien la ovulación generalmente ocurre de 24 a 48 h antes del fin del celo, la variabilidad en la duración del celo dificulta determinar con certeza el momento preciso en que sucede (Aurich, 2011). Por otro lado, el diámetro folicular se relaciona con la ovulación y la fertilidad; la ovulación ocurre cuando el folículo preovulatorio (FP) mide aproximadamente 40 mm de diámetro (Ginther et al., 2008). Por tanto, el monitoreo del diámetro preovulatorio puede utilizarse con el fin de predecir la ovulación y de esta manera realizar la inseminación en el momento más adecuado.
Con base en lo anterior, los objetivos del presente estudio fueron caracterizar la dinámica ovárica durante el ciclo estral en yeguas aptas para reproducirse, determinar las variables que ayuden a predecir el momento de la ovulación y estudiar algunos factores que influyen en la determinación o presencia del ciclo estral y el porcentaje de gestación 16 días después del servicio.
Materiales y métodos
Lugar del experimento
El experimento se realizó en el criadero caballar de la Unidad de la Policía Metropolitana Montada de la Ciudad de México (CDMX), unidad que dirige la operatividad de los destacamentos a caballo de la Secretaría de Seguridad Pública de la CDMX, como apoyo a elementos de a pie y grupos móviles. La unidad se ubica en la alcaldía Iztapalapa de la CDMX, México, coordenadas 19° 22' 19.4" N y 99° 02' 38.1" O, a 2232 msnm. El clima es templado subhúmedo con lluvias en verano, con 17.3 °C de temperatura media anual (1981-2010), mayo es el mes más cálido (19.7 °C), enero el más frío (13.9 °C); la precipitación media anual es 608.2 mm (SMN, 2018). El experimento se realizó de febrero a abril, por lo que el fotoperiodo fue relativamente neutro, 11.2 h luz el 01 de febrero a 12.7 h luz el 30 de abril (Educaplus, 2021).
Selección y alimentación de las yeguas
Para el estudio se seleccionaron 43 yeguas de raza Azteca, de entre 3 y 11 años, aptas para reproducirse, con peso vivo promedio de 550 ± 34 kg y 4 puntos de condición corporal (CC, escala 1 a 5; Carroll y Huntington, 1988). Las yeguas estuvieron en confinamiento y consumieron una dieta basada en forraje (10 % de PV), grano (con 12% PC), 2.0 Mcal EM kg-1 MS, y agua fresca y limpia a libertad. Además, se seleccionaron cuatro sementales de fertilidad conocida del criadero, en buenas condiciones, que se usaron para la producción de semen y el recelo de las yeguas. Los sementales fueron de la raza Azteca, de entre 3 y 6 años de edad, a los cuales se les extrajo semen y se les evaluó durante ocho días para conocer de manera anticipada su capacidad de fertilización.
Evaluación del crecimiento folicular
Diariamente, entre las 7 y las 10 a. m., se realizó la detección de celo con ayuda de un semental que se rotó a diario. Durante el recelo, el semental se expuso a la yegua para que permitiera la monta, en caso de que estuviera en celo. Los sementales se utilizaron tanto para el recelo como para la extracción de semen.
Con la finalidad de registrar el crecimiento folicular, durante un ciclo estral completo se midió diariamente (cada 24 h, del día 7 al 21 del ciclo estral; DF7-DF21, mm) el diámetro de los dos folículos de mayor tamaño, escaneando para ello ambos ovarios. Lo anterior se realizó con el fin de caracterizar el desarrollo de las ondas foliculares, establecer el diámetro del FP y determinar el momento más cercano a la ovulación para decidir y obtener el momento óptimo para realizar la inseminación. El diámetro folicular ideal del FP fue de entre 38 y 40 mm, de acuerdo con Donadeu y Pedersen (2008) y Ginther et al. (2008). El diámetro del folículo preovulatorio se midió en cada yegua cada 24 h a partir del día siete del ciclo estral, para lo cual todas las yeguas que entraron a la medición fueron previamente inyectadas con 100 microgramos de GnRH para inducir su ovulación y esperar la presentación del celo, considerando el primer día de la manifestación del celo como el día uno en un ciclo estral de 21 d. El diámetro del CL se determinó al momento del diagnóstico de gestación (16 d post-IA); ambas mediciones se realizaron con un ultrasonido con transductor rectal de 7.5 MHz (Sunway Medical, Hand Scan V8, Malasia).
Extracción de semen
El semen se recolectó por la mañana, después de revisar a las yeguas. Antes de la recolección, los sementales se estimularon con la presencia de una yegua en celo; los órganos externos del aparato reproductor del macho se limpiaron para evitar la contaminación del semen. La recolección de semen se hizo con una vagina artificial tipo Colorado, que tiene una cubierta plástica dura y dos camisas de látex que componen una cámara de agua para mantener la temperatura. La vagina se preparó a una temperatura de 42 a 45 °C, lubricada con gel no espermicida. En la extracción se utilizó como maniquí una yegua en celo. Durante el resto del día los sementales se mantuvieron alejados de las yeguas.
Después se evaluaron las muestras de semen y se hizo la prueba de motilidad y conteo espermático en la cámara Neubauer. De acuerdo con la calidad, volumen y concentración espermática del eyaculado, las dosis se prepararon con 4 mL de semen fresco (400 millones de espermatozoides con motilidad progresiva); posteriormente, se almacenaron a 5 °C hasta utilizarse.
Inseminación artificial
Antes de la IA, la cola de la yegua se sujetó y se lavó la zona perianal para evitar la contaminación de los genitales y reducir el riesgo de infecciones inducidas. La IA se realizó con la técnica transvaginal, usando un aplicador de semen tipo americano, flexible, con semen refrigerado, 3-4 d después de iniciado el celo y una vez alcanzado un diámetro del FP de entre 38 y 40 mm. El aplicador se pasó a través del cérvix hasta el cuerpo del útero, dirigiéndolo con el dedo de manera suave, una vez pasado el cérvix se depositó el semen.
Diagnóstico de preñez
El diagnóstico de preñez se realizó 16 d después de la IA con ultrasonografía en tiempo real, utilizando un transductor de 7.5 MHz. El diagnóstico para confirmar la gestación y revisar que no hubo reabsorción embrionaria se repitió 35 d post inseminación artificial.
Variables evaluadas
En el estudio se evaluaron variables continuas y categóricas. Las variables continuas fueron: duración del ciclo estral (Dciclo, d); duración del celo (Dcelo, d) evaluada del primer al último día que la yegua aceptó la monta; diámetro del CL (DCL, mm); diámetro folicular (determinado cada 24 h del día 7 al 21; DF7-DF21, mm); tiempo que tardó en presentarse el celo después del día 21 (Celoh, h); diámetro folicular al inicio del celo (DFcelo, mm) y al momento de la inseminación (DFIA, mm), y tasa de crecimiento folicular (TC; mm d-1) para los folículos más grandes. La variable categórica evaluada fue tasa de preñez (TP) 16 d después de la inseminación (TP16).
Análisis estadístico
La información se analizó utilizando SAS (SAS Institute Inc. Cary, NC, USA). Dado que es un estudio de caracterización, primero se determinó el modelo más adecuado para cada variable de respuesta, considerando aspectos estadísticos y la relación biológica entre ellas. Por tanto, algunas variables de respuesta se consideraron como efectos fijos o covariables en el análisis de otras. Los efectos fijos incluidos en el modelo inicial general fueron: edad de la yegua, CC, Dciclo, Dcelo, número de folículos (NF), Celoh, DFcelo y DF21, dependiendo de la variable a analizar. Para edad de la yegua se formaron las siguientes categorías: jóvenes (3-7 años) y adultas (8-11 años). El efecto de yegua se consideró aleatorio. Los análisis preliminares se realizaron con el procedimiento GLM de SAS; dentro de estos análisis se incluyó la distribución de las variables analizadas. Algunos efectos principales o sus interacciones se eliminaron del modelo final considerando el nivel de significancia (p < 0.05) y la biología de la variable de respuesta.
El modelo de análisis final incluyó los efectos fijos y las interacciones significativas (p < 0.05) que debían estar, ya fuera por la relación biológica con la variable de respuesta o por interés del estudio. En los análisis para determinar el mejor modelo y en los finales para cada variable, se utilizaron los procedimientos MIXED y GLIMMIX. Los criterios de información de Akaike (AIC) y Bayesiano (BIC) se utilizaron para determinar el mejor modelo de análisis. La Tabla 1 muestra los modelos finales para cada variable analizada. En todos los análisis se asumió una distribución normal de los datos y la función liga identidad, con excepción de TP16, para la que se asumió una distribución binomial y función liga logit.
Tabla 1 Modelos finales para duración del ciclo (Dciclo), duración del celo (Dcelo), diámetro del cuerpo lúteo (DCL), inicio del celo después del día 21 (Celoh), diámetro folicular al inicio del celo (DFcelo), diámetro folicular a la inseminación artificial (DFIA) y diámetro folicular del día 7 al 21 del ciclo (DF7-21) de yeguas en confinamiento.
| Variable de respuesta | Edad | CC1 | Dciclo | Dcelo | NF2 | Celoh | DFcelo DF21 |
|---|---|---|---|---|---|---|---|
| Dciclo | √3 | √ | √ | √ | C4 | ||
| Dcelo | √ | √ | C | C | V | ||
| DCL | √ | √ | C | C | C | ||
| Celoh | √ | √ | V | √ | √ | C | |
| DFcelo | √ | √ | C | √ | √ | C | C |
| DFIA | √ | √ | V | √ | √ | C | |
| DF 7, 8, 9, 11-17 | √ | √ | V | ||||
| DF10 | √ | √ | V | C | |||
| DF 10, 19, 20, 21 | √ | √ | V | C | C |
Nota: 1CC, condición corporal; 2NF, número de folículos; 3√ y 4C efecto fijo principal y efecto incluido como covariable en el modelo final de análisis.
El diámetro folicular (DF) se analizó mediante medidas repetidas con el procedimiento MIXED; el término repetido fue día de medición (DM). El modelo se definió de manera similar a las demás variables de respuesta e incluyó los efectos principales edad, CC y Dciclo. Adicionalmente, se incluyeron las interacciones edadxDM y Dciclo^DM. Para edad de la yegua se crearon las subclases 3-5 (n = 19), 6-8 (n = 16) y 9-11 años (n = 8); un procedimiento similar se realizó para Dciclo. Lo anterior se hizo para evitar subclases vacías o con pocas observaciones, y así prevenir posibles problemas de estimabilidad.
El crecimiento folicular se analizó mediante regresión lineal, cuadrática y cúbica en SAS. Posteriormente, se calculó la pendiente de la curva en los días 10, 15 y 21. Para determinar el mejor modelo para TP16 se utilizó la herramienta de árboles de decisión del programa R (R Core Team, 2017). En un primer análisis, el programa arrojó al DFIA como mejor variable para describir TP16; en un segundo análisis se encontró que DFcelo fue la variable más apropiada para predecirla. Con estos resultados y con el apoyo de los criterios estadísticos de ajuste AIC y BIC, se construyó el modelo para analizar TP16, incluyéndose DFIA como covariable y el efecto aleatorio de yegua. Este análisis se hizo con el procedimiento GLIMMIX de SAS asumiendo una distribución binomial y la función liga logit.
Resultados y discusión
Las yeguas utilizadas en el experimento tuvieron los siguientes promedios (± desviación estándar): Edad, 6.00 ± 2.30 años; CC, 4.42 ± 0.39; Dciclo, 24.11 ± 3.02 d y Dcelo, 5.67 ± 1.55 d. Los DCL, DF21, DFcelo y DFIA fueron 43.07 ± 3.62, 36.01 ± 2.43, 37.22 ± 1.35 y 39.92 ± 2.39 mm, respectivamente. Las yeguas tardaron 9.91 ± 13.96 h en entrar en celo después del día 21. La tasa de preñez obtenida en el estudio fue 79.06 % (34 yeguas preñadas de 43 inseminadas).
Efecto de la edad de la yegua
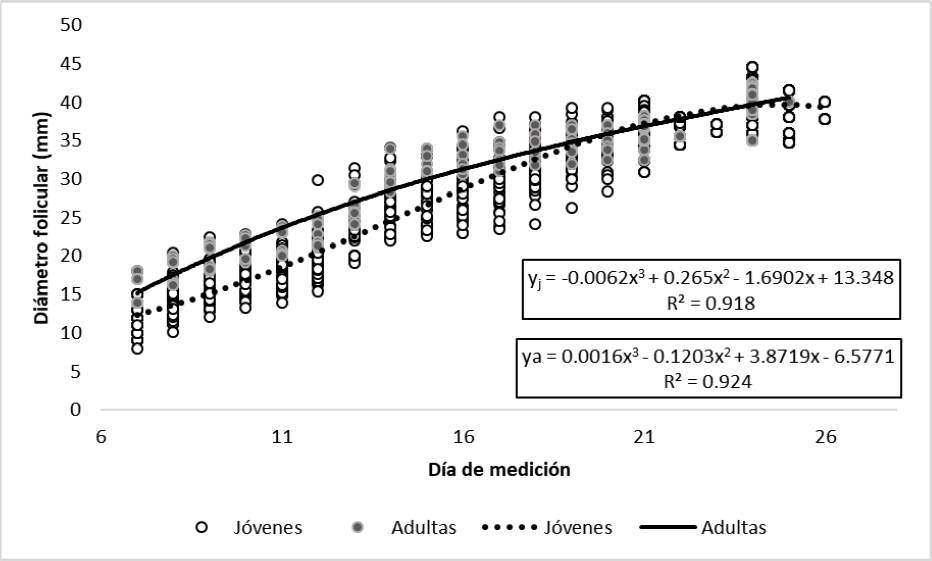
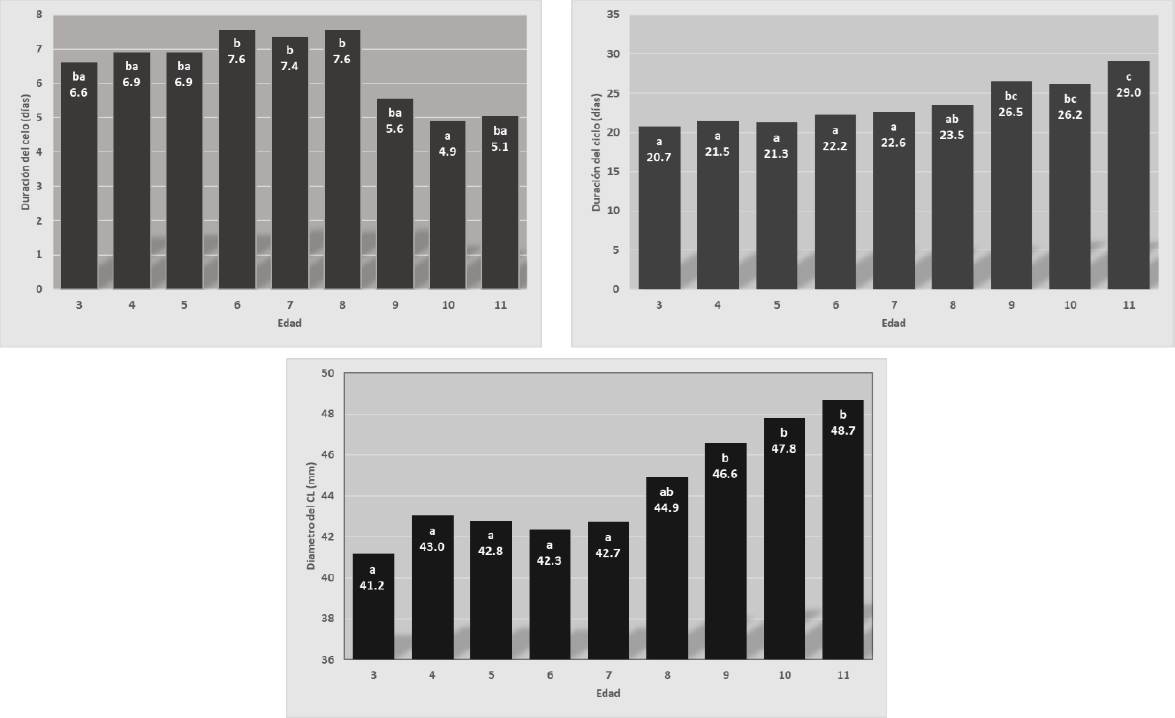
Morris y Allen (2002), Allen et al. (2010), Bosh et al. (2009) y Nath et al. (2010) estudiaron el efecto de edad en la reproducción de las yeguas y observaron que las hembras mayores de ocho años tienen tasa de preñez menor y una mayor incidencia de infecciones del tracto reproductivo. De acuerdo con Ginther et al. (2008), aunque no existe una senescencia reproductiva notoria en yeguas adultas, estas tienen Dciclo mayor que las jóvenes, debido a su tasa de crecimiento mayor. En el presente estudio, además de la fertilidad, se relacionó la edad con la dinámica ovárica; las yeguas jóvenes (3-7 años) tuvieron Dciclo menor (p ≤ 0.05) que las adultas (8-11 años). Así mismo, hubo diferencias para Dcelo (p ≤ 0.05) entre yeguas jóvenes (6-8 años) y adultas (10 años); los valores menores fueron para yeguas de 9-11 años, aunque no hubo diferencias de estas con las de 3-5 años (Figura 1).
Note: Literales distintas en las barras de categoría de edad son estadísticamente diferentes (p < 0.05).
Figura 1 Efecto de la edad en la duración del celo (d), duración del ciclo (d) y diámetro del cuerpo lúteo (mm).
El DCL fue mayor en yeguas de 9-11 años comparado con las de menor edad (Figura 1). Las yeguas de siete años tuvieron DFcelo mayor que las de tres, cinco y seis años. Así mismo, para DF analizado con medidas repetidas, se encontraron diferencias significativas (p≤0.0397) para edad. Similarmente, Morris y Allen (2002) y Nath et al. (2010) observaron que hembras jóvenes (< 13 años) presentan mayor TP que las adultas (> 14 años) en el diagnóstico de preñez al día 15. Sin embargo, en el presente estudio no hubo diferencias significativas (p > 0.05) de TP16 por edad, lo que fue apoyado por los resultados del análisis con árboles de decisión de R, donde no fue un factor importante y se excluyó del modelo. Este resultado confirma que en las yeguas utilizadas (3-11 años) la edad no fue un factor relevante para esta variable.
Efecto de condición corporal
Aunque la nutrición de la yegua es un factor relevante en su reproducción, afectando a yeguas con baja y alta CC (Gentry et al., 2002; Huff et al., 2008). Este efecto no fue significativo (p > 0.05) para la mayoría de las variables analizadas en el presente estudio (Tabla 2), afectando solamente a Dcelo, que fue mayor (p < 0.05) en yeguas con menor CC. Los resultados obtenidos en el presente estudio pueden atribuirse a que las yeguas del experimento estuvieron alimentadas adecuadamente.
Tabla 2 Nivel de significancia de los efectos fijos principales y covariablcs para duración del ciclo (Dciclo), duración del celo (Dcelo), diámetro del cuerpo lúteo (DCL), tiempo en iniciar el celo después del día 21 (Celoh), diámetro folicular al celo (DFcelo), a la inseminación artificial (DFIA) y al día 21 (DF21).
| Variable | Edad | CC1 | Dciclo | Dcelo | NF2 | Celoh | DFcelo | DF21 |
|---|---|---|---|---|---|---|---|---|
| Dciclo | < 0.0001 | 0.577 | 0.0012 | 0.363 | 0.628 | |||
| Dcelo | 0.0221 | 0.0256 | 0.0012 | 0.282 | 0.333 | |||
| DCL | < 0.0001 | 0.203 | 0.0005 | 0.129 | 0.0056 | |||
| Celoh | 0.412 | 0.715 | 0.204 | 0.338 | 0.236 | < 0.0001 | ||
| DFcelo | 0.075 | 0.657 | 0.043 | 0.035 | 0.036 | 0.030 | < 0.0001 | |
| DFIA | 0.022 | 0.501 | 0.164 | 0.036 | 0.082 | < 0.0001 | ||
| DF21 | 0.348 | 0.524 | 0.344 | < 0.0001 | < 0.0001 |
Nota: 1 CC, condición corporal; 2NF, número de folículos.
Duración del celo y del ciclo estral, y diámetro del cuerpo lúteo
La Dciclo se atribuye, en gran medida, al largo del celo (Ginther et al., 2008; Aurich, 2011). Esto se confirmó en el presente estudio: Dciclo fue afectada por Dcelo y viceversa (p < 0.0012). Además, la edad fue un factor importante para estas variables (p ≤ 0.0221, Tabla 2), y CC influyó (p < 0.0256) en Dcelo. Algunos factores reportados que afectan a Dcelo son DFcelo, TC y DFIA (Ginther et al., 2004); no obstante, en el presente estudio estos factores no fueron significativos (p > 0.1). Por otra parte, Lemes et al. (2017) mencionan que el principal factor que afecta a Dcelo es la dinámica folicular.
Dcelo y DFcelo influyeron en la DCL; un incremento de un día en Dcelo se asoció con un aumento de 0.97 mm en DCL (r = 0.70; p < 0.0005). Este resultado es similar al obtenido por Ishak (2019), quien menciona que FP grandes tienen potencial para producir CL mayores y con mayor flujo sanguíneo, lo que conlleva a un mejor mantenimiento de la gestación.
Diámetros foliculares
Cuervo-Arango y Newcombe (2008) mencionan que raza, número de folículos y época del año influyen en el diámetro del FP. En el presente estudio no se registró la raza. Con respecto a los diámetros foliculares cercanos a la ovulación que se estudiaron, NF fue importante para DFcelo (p ≤ 0.036) y mostró cierta tendencia a serlo para DFIA (p ≤ 0.082); sin embargo, su efecto no fue significativo sobre DF21 (Tabla 2).
Cuando DF21 se analizó como variable de respuesta, la edad y CC de la yegua no lo afectaron significativamente (p > 0.348), pero Celoh y DFcelo sí (p < 0.0001); la entrada en celo se redujo 0.11 h al incrementar 1 mm el DF21, y DFcelo fue 0.86 mm mayor al incrementarse 1 mm el DF21. La edad tendió a ser significativa para DFcelo (p = 0.075), mientras que CC fue irrelevante (p ≥ 0.657). La Dcelo (p ≤ 0.043) y Dciclo (p ≤ 0.035) afectaron DFcelo, esto fue mayor en yeguas con Dcelo mayor, y menor en aquellas con menor duración (Tabla 2). En suma, Celoh fue importante para DFcelo (p < 0.035).
Así mismo, Dcelo (p ≤ 0.030) y DF21 (p < 0.0001) influyeron en DFIA, aumentándose 0.76 mm el DF21 por un incremento en 1 mm en DFIA. Sin embargo, debe considerarse que hay otros factores, como el control endocrino y paracrino, que afectan al diámetro del FP (Rodríguez et al., 2013) y que no se consideraron en este estudio.
Crecimiento folicular
Aunque el crecimiento folicular en yeguas se ha estudiado ampliamente (Gastal et al., 2004), y se reportan tasas de crecimiento de 2 a 3 mm d-1 (Donadeu y Pedersen, 2008), en ninguno de estos estudios se relacionó el DF en distintos momentos de la dinámica ovárica, como se hizo en el presente estudio.
La Figura 2 muestra que el crecimiento folicular tuvo una tendencia cúbica. Las TC en los días 10 y 15 fueron 1.89 y 1.79 mm d-1. Estos resultados son menores que los reportados por otros autores (2-3 mm d-1, Donadeu y Pedersen, 2008), debido, posiblemente, a la época del año, pues aunque en la latitud del lugar del estudio no hay estacionalidad marcada en las yeguas, la duración del ciclo es mayor en la época de transición invierno-primavera. Sin embargo, el comportamiento del crecimiento folicular es semejante al observado por Ginther et al. (2004), quienes reportaron una tasa de crecimiento mayor en la primera fase de crecimiento, y menor en el momento de la diferenciación. Además, la TC se redujo en los días previos a la ovulación (1.01 mm d-1), lo que concuerda con lo encontrado por Palmer y Diancourt (1980).
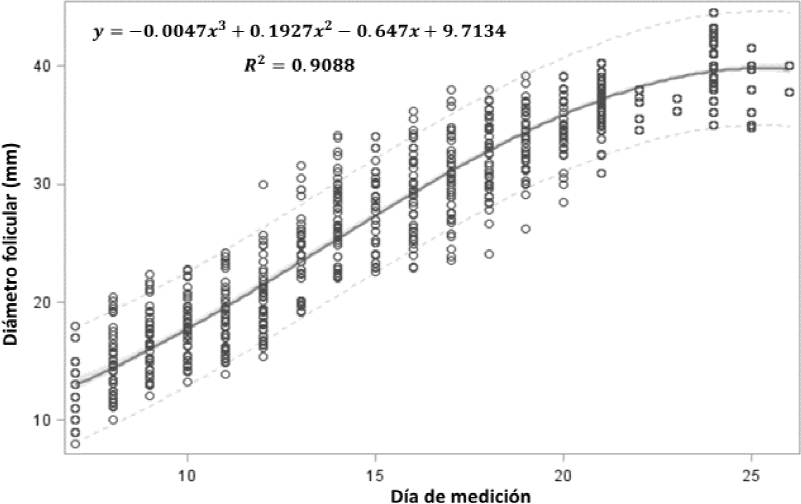
Figura 2 Curva ajustada de crecimiento folicular en yeguas, del día 7 al momento de la inseminación artificial.
El análisis del diámetro folicular con el enfoque de medidas repetidas mostró que la edad fue un factor importante (p < 0.05), mientras que CC no (p > 0.05). Adicionalmente, Dciclo y las interacciones edad×DM y Dciclo×DM fueron altamente significativos (p < 0.01). En la Tabla 3 se observa que TC promedio es mayor en yeguas de 3 a 9 que en las de 10 o más años (p < 0.05), esto concuerda con lo reportado por Ginther et al. (2008), quienes mencionan que las yeguas adultas tienen TC menor.
Tabla 3 Tasa de crecimiento folicular promedio de acuerdo con la edad en yeguas inseminadas artificialmente.
| Edad (años) | n | Crecimiento total (mm; día 7-IA) | Tasa de crecimiento (mm d-1) |
|---|---|---|---|
| 3-9 | 39 | 27.8 | 1.6a |
| ≥ 10 | 4 | 22.9 | 1.3b |
Nota: Medias con diferente letra dentro de la misma columna son diferentes (p < 0.05).
La Figura 3 muestra que las yeguas jóvenes tienen diferente curva de crecimiento folicular, comparadas con las adultas. Las yeguas jóvenes tienen mayor crecimiento folicular total, es decir, a los siete días tienen un DF menor, el folículo crece más rápido y al final del ciclo tienen DF similar al de las adultas. Esto permite afirmar que yeguas de diferente edad y Dciclo, tienen distinta curva de crecimiento folicular.
Tasa de preñez
El análisis de los datos con la herramienta árboles de decisión de R permitió determinar que solo DFIA y DFcelo se relacionan con la tasa de preñez en yeguas, lo que permite predecir con 94 % de confianza que aquellas con DFIA mayor de 38 mm quedarán preñadas. Similarmente, un DFcelo mayor de 36 mm predice la gestación con 86 % de confianza.
El análisis mostró que edad y DCL no fueron factores importantes (p ≥ 0.05) para TP16 de las yeguas (Tabla 4), aunque sí lo fueron DFIA y TC (p<0.05). Algunos estudios (Morris y Allen 2002; Bosh et al., 2009; Katila et al., 2010; Nath et al., 2010), han demostrado que la edad es un factor importante en la fertilidad de las yeguas, no obstante, en el presente estudio, no se alcanzaron a detectar diferencias en TP16, debido, posiblemente, a que no hubo un número grande de yeguas adultas, siendo la mayoría jóvenes.
Tabla 4 Tasa de preñez de acuerdo con la edad, diámetro del cuerpo lúteo y del folículo preovulatorio, y tasa de crecimiento folicular en yeguas inseminadas artificialmente.
| Edad (años) | n | Gestantes | Tasa de preñez |
|---|---|---|---|
| 3-9 | 39 | 31 | 0.79a |
| ≥ 10 | 4 | 3 | 0.75a |
| DCL (mm) | |||
| < 42 | 16 | 13 | 0.81a |
| ≥ 42 | 27 | 21 | 0.78a |
| Diámetro folicular (mm) | |||
| < 38 | 7 | 1 | 0.14a |
| ≥ 38 | 36 | 33 | 0.92b |
| Tasa de crecimiento (mm d-1) | |||
| < 1.6 | 17 | 11 | 0.57a |
| ≥ 1.6 | 26 | 23 | 0.83b |
Nota: a,b, Medias seguidas por diferente letra dentro de la misma columna, son diferentes (p ≤ 0.05).
Las yeguas con DFIA < 38 mm tuvieron TP16 de 0.14, mientras que aquellas con DFIA ≥ 38 mm de 0.92 (Tabla 4). Estos resultados concuerdan con lo observado por otros autores, que mencionan que el diámetro adecuado del FP está entre 35 y 40 mm (Donadeu y Pedersen, 2008; Ginther et al., 2008). La TP16 en yeguas con TC<1.6 mm d-1 fue 0.57 y para TC 1.6 mm d-1 fue 0.83 (Tabla 4). Lo anterior concuerda con los descubrimientos de Morris y Allen (2002), Bosh et al. (2009), Katila et al. (2010) y Nath et al. (2010), quienes compararon la fertilidad de yeguas jóvenes y adultas, encontrando que las yeguas jóvenes presentan mayor TP. En la Tabla 3 se observa que las yeguas adultas presentan TC = 1.3 mm d-1, por lo que es coherente que TC bajas se relacionen con menor TP16.
Conclusiones
La edad de la yegua fue un factor importante en la dinámica ovárica. Las yeguas de tres a siete años tuvieron menor diámetro folicular al celo y a la inseminación artificial que las de mayor edad. El ciclo estral fue más largo en yeguas mayores de siete años. Las correlaciones encontradas, junto con la tasa de crecimiento folicular, ayudan a predecir la ovulación y el diámetro folicular al inicio del celo. El diámetro del folículo al inicio del celo permite determinar el tiempo que tardará la yegua en ovular para inseminar en el momento correcto. Los diámetros foliculares a la inseminación artificial mayores que 38 mm y al celo mayores que 36 mm permitieron predecir, con 94 % y 86 % de confianza respectivamente, que las yeguas quedarán preñadas.











 nueva página del texto (beta)
nueva página del texto (beta)