Introducción
El cáncer de pulmón es una enfermedad del hombre moderno; fue hasta 1842 que se realizó la primera descripción completa de un caso de cáncer de pulmón.1 Para 1878, los tumores de pulmón representaban sólo el 1% de los cánceres observados durante las autopsias. La cifra se elevó a 10-15% en la primera parte del siglo XX.2 Los cánceres de pulmón de células no pequeñas (CPCNP) son los tumores malignos más frecuentes del pulmón y son la causa más común de ingreso en los servicios de neumología.
En la actualidad, éste es el tipo de cáncer más frecuente en los países desarrollados, representando la primera causa de muerte tanto en hombres como en mujeres; al momento del diagnóstico, más del 40% de los pacientes tienen enfermedad localmente avanzada.1,2
Las neoplasias ocupan en Cuba el primer lugar entre las tasas de defunción global, con 200/100,000 habitantes cada año. Dentro de éstas, los tumores malignos de tráquea, bronquios y pulmón presentan la mayoría de todas las muertes ocurridas por tumores malignos.3 Según estadísticas nacionales, en el 2007 enfermaron más de 3,000 personas de uno y otro sexo por este tipo de tumores (una tasa aproximada de 28/100,000 habitantes). El 86% de las muertes en ese año fueron atribuidas a la exposición al tabaco.4
Después del diagnóstico de cáncer de pulmón y la clasificación histológica, la determinación del estadio es un aspecto de gran importancia, con implicaciones terapéuticas y pronósticos.5 En el estadio IIIA, donde la enfermedad avanzada es aún locorregional, el individuo puede presentar un tumor abordable quirúrgicamente (tumor seco), donde está indicada la quimioterapia como tratamiento adyuvante y, en ocasiones, se manda radioterapia para controlar la infiltración local.6,7
Los protocolos terapéuticos actuales, que incluyen combinaciones de radioterapia y quimioterapia, suponen una mayor agresividad del tratamiento y, por tanto, la posibilidad de mayores efectos adversos en sujetos con una enfermedad rápidamente debilitante. Esta combinación puede administrarse de forma secuencial, de manera simultánea o alternante.8
La conducta estándar en nuestro servicio con las personas que poseen diagnóstico citohistológico de CPCNP en el estadio IIIA son tres opciones: la cirugía en el grupo que tiene criterios iniciales de la misma, la quimioterapia neoadyuvante (tres ciclos y reevaluación posterior) o la quimioterapia (con o sin radioterapia) en quienes en ningún momento de su evolución, desde el diagnóstico o durante la quimioterapia, cumplan con el criterio quirúrgico.
Hasta el momento, aproximadamente entre el 50 y 70% de los individuos son diagnosticados en estadio avanzado y usualmente incurable (etapas IIIB y IV); sin embargo, la etapa IIIA no tiene cifras despreciables: en nuestro centro (Hospital Neumológico Benéfico Jurídico) representó el 19% durante el año 2012. Por esta razón, nos motivamos a conocer la evolución clínica y radiológica de estos sujetos luego de recibido el tratamiento oncoespecífico no quirúrgico en el Hospital Neumológico “Benéfico Jurídico” (HNBJ) desde el año 2011 hasta el 2013, por la importancia de conocer la evolución clínica y radiológica en las personas con CPNCP en estadio IIIA no quirúrgico y la utilidad del uso de la quimioterapia y/o radioterapia en esta etapa.
Diseño metodológico
Se realizó un estudio descriptivo, ambispectivo para evaluar la evolución clínica y radiológica de los pacientes con cáncer de pulmón de células no pequeñas en estadio IIIA no quirúrgico tratados con poliquimioterapia y/o radioterapia en el Hospital “Benéfico Jurídico” entre enero de 2011 y diciembre de 2013. El universo estuvo constituido por el 100% de los individuos atendidos con diagnóstico confirmado de cáncer de pulmón de células no pequeñas en estadio IIIA no quirúrgico en el Hospital Benéfico Jurídico en el periodo de estudio. La muestra estuvo constituida por 61 sujetos diagnosticados de cáncer de pulmón de células no pequeñas en estadio IIIA confirmado histológicamente y tratados en nuestro centro con quimioterapia: cisplatino 100 mg/m2 EV el primer día, más etopósido 100-120 mg/m2 EV el primer, segundo y tercer días hasta un total de cuatro a seis ciclos, así como radioterapia concurrente; las personas con estado funcional (según escala de Zubrod) entre cero y dos, así como quienes tuvieron estudio tomográfico al diagnóstico y al finalizar el tratamiento. Se excluyeron del estudio los individuos en etapa IIIA con criterio quirúrgico al diagnóstico o durante el tratamiento y los que fallecieron durante el estudio.
La fuente de datos primaria fue el registro del grupo multidisciplinario de atención al paciente oncológico de la institución, así como las estadísticas de cumplimiento de tratamiento del Departamento de Quimioterapia. Se revisaron, además, las historias clínicas de los sujetos que completaron como mínimo cuatro ciclos de tratamiento con citostáticos. Finalmente, se valoraron las tomografías de las personas objeto de estudio realizadas en un equipo multidetector de 64 canales, Somatom Sensation 64 (Siemens Healthcare, Erlangen, Alemania), llevando a cabo reconstrucciones a una distancia de 1 × 0.5 mm en dirección craneocaudal con una dosis de radiación de 77 mAs. Las imágenes fueron interpretadas por el mismo médico especialista.
En cuanto a la recolección de la información, se utilizaron dos métodos: empírico y estadístico. Método empírico: planilla recopiladora de datos, donde se recogieron aspectos demográficos y clínicos: la edad en años; género: masculino y femenino, las manifestaciones clínicas al diagnóstico y al final del tratamiento. Los síntomas que se tuvieron en cuenta fueron tos, disnea, hemoptisis, dolor torácico, pérdida de peso, expectoración y disfonía. Para evaluar el estado general del enfermo y determinar el grado de actividad al inicio y final del tratamiento, se empleó la escala de Zubrod. Para calificar la respuesta objetiva antitumoral del paciente se utilizaron los criterios internacionales propuestos por el Comité de Criterios de Evaluación de la Respuesta en Tumores Sólidos, conocido por sus siglas en inglés como RECIST,9 que emplea como método imagenológico la tomografía computarizada al diagnóstico y al final del tratamiento. La respuesta se clasificó en: respuesta completa, respuesta parcial, estabilidad y progresión. Método estadístico: se aplicó la prueba de Mc Nemar para el análisis de la evolución de los síntomas al inicio y final del tratamiento, así como el test de independencia chi cuadrado (χ2) para el análisis del grado de actividad antes y después del abordaje oncoespecífico no quirúrgico etapa IIIA. En el análisis estadístico también se utilizó el cálculo porcentual. Para el análisis de significación estadística se usó el intervalo de confianza (IC) del 95% y un nivel de significación p < 0.05.
Los resultados obtenidos se mostraron en textos, tablas y gráficos (media, desviación estándar, mínimo y máximo), frecuencias acumuladas y porcentuales, estadígrafos de significación y contrastes de hipótesis para muestras relacionadas.
Esta investigación no representó un riesgo para la vida de los participantes porque toda la información fue recopilada de las historias clínicas y plasmada en una planilla de vaciamiento, tratada de forma confidencial y con fines puramente científicos. Se solicitó la autorización de la dirección del hospital, a través del Consejo Científico y la Comisión de Ética Médica. Se asegura la no existencia de conflicto de intereses para el estudio.
Resultados
Del total de 61 individuos incluidos, 70.5% (n = 43) era del sexo masculino, mientras que el 29.5% (n = 18) restante era del sexo femenino.
Respecto a la distribución de los sujetos según grupos de edad, predominaron aquéllos con edad entre 60 y 69 años (42.6%, n = 26), seguidos por el grupo entre 40 y 59 años (36.1% n = 22). El 19.7% tenía edad entre 70 y 79 años (n = 12), mientras que se encontró sólo una persona con edad mayor de 80 años (1.6%).
Los síntomas que predominaron antes del tratamiento fueron la tos (75.4%), la disnea (63.9%), el dolor torácico (55.7%) y la pérdida de peso (52.5%), en ese orden. El síntoma menos frecuente fue la disfonía (6.6%). Después del tratamiento, los síntomas que obtuvieron una reducción significativa fueron, en orden, la pérdida de peso (52.5% versus 13.1%, p = 0.007), el dolor torácico (55.7% versus 27.9%, p = 0.015) y la expectoración (31.1% versus 18.0%, p = 0.043). La disnea se redujo de manera no significativa en aproximadamente un 20% (Cuadro 1).
Cuadro 1: Manifestaciones clínicas antes y después del tratamiento oncoespecífico.
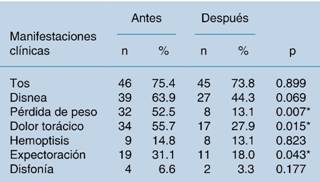
* Asociación significativa en el análisis univariado.
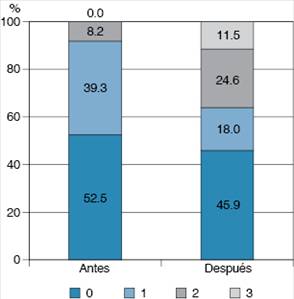
Antes de iniciar el tratamiento, aproximadamente la mitad de los pacientes tenía un estado funcional grado 0 (52.5%), y un 39.3% grado 1. Después de finalizado el tratamiento, si bien no se encontraron diferencias importantes en aquéllos con estado funcional sin restricción de las actividades físicas (52.5% versus 45.9%), el porcentaje de individuos con grado I se redujo (39.3% versus 18.0%) y los sujetos con grado 2 (8.2% versus 24.6%) y grado 3 (0.0% versus 11.5%) aumentaron. Estas diferencias fueron significativas (p = 0.015) (Figura 1). Es importante señalar que los síntomas que mejoraron fueron síntomas que tienen poca influencia sobre el estado funcional de los pacientes oncológicos, por lo que durante el estudio, aunque algunos síntomas mejoraron, otros permanecieron en el tiempo, asociados a las reacciones adversas del tratamiento oncológico y la progresión de la enfermedad, lo que puede ser la causa del empeoramiento del estado funcional a pesar de la mejoría de algunos síntomas.
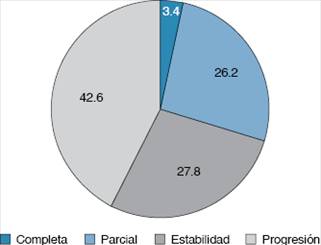
La respuesta completa se alcanzó sólo en dos personas (3.4%), mientras que el 26.2% (n = 16) logró alcanzar una respuesta parcial y el 27.8% (n = 17) se encontraba en estabilidad. No obstante, el 42.6% (n = 26) de los individuos se halló en progresión de la enfermedad (Figura 2).
Discusión
En nuestro estudio predominaron los sujetos del sexo masculino, con edad mayor de 60 años. Resultados de estudios como el de Moraleja y cols.10 evidencian una mayor afectación en el grupo etario de 60 a 69 años, con una relación varones/féminas de 2:1. En Estados Unidos, la incidencia de cáncer de pulmón ha pasado de una relación varón/mujer 7:1 hace algo más de una década a una relación 2:1, esperándose un incremento exponencial en los próximos años de esta enfermedad en el sexo femenino, en relación con el aumento del hábito de fumar.11
En nuestro trabajo, los síntomas más frecuentes de presentación fueron la disnea, la tos, el dolor torácico y la pérdida de peso, en ese orden, observables en más de la mitad de las personas. La disnea es un síntoma referido por la bibliografía hasta en un 60%;12,13 en nuestro estudio fue de 63.9%, lo cual se puede atribuir a varios factores, como son la adicción tabáquica, que en la mayoría es la explicación del cuadro de insuficiencia respiratoria crónica que padecen estos pacientes.
Se recoge por la literatura que el síntoma inicial más frecuente en el cáncer de pulmón es la tos, ya que está presente en un 70-80% de los individuos en el momento del diagnóstico.14 A pesar de ello, es un síntoma muy inespecífico y, por tanto, en muchas ocasiones no es tomado en cuenta por ellos. En nuestra investigación se observó en un 75.4% de la muestra. Estas cifras están por encima de las obtenidas en un estudio multicéntrico realizado en España en 2003, en el cual la presencia de tos en los sujetos con cáncer de pulmón alcanzó cifras que oscilaron de 15.7% a 55.8%.15 Muchas veces, el síndrome general caracterizado por astenia, anorexia y pérdida de peso puede ser la carta de presentación en la neoplasia de pulmón, pudiendo aparecer hasta en el 80% de las personas a lo largo de su enfermedad. Sin embargo, al ser estos síntomas inespecíficos y comunes a disímiles enfermedades los hace poco útiles para un diagnóstico certero de este padecimiento. En la muestra, la pérdida de peso se presentó en el 67.9%, lo cual es un dato alarmante, teniendo en cuenta que en estudios realizados se elevaba al 50% de pacientes con cáncer de pulmón inoperable y hasta al 78% en los que estaban en cuidados paliativos.14 Las manifestaciones clínicas halladas en la presente investigación concuerdan con otras similares referidas por Montero y su grupo15 en España, en un trabajo descriptivo y prospectivo realizado en el área de Coruña. En el presente estudio, el tratamiento oncoespecífico no se relacionó con una mejoría del estado funcional y, si bien más de la mitad de los individuos se encontraban estables o con alguna respuesta objetiva antitumoral, el 42.6% se hallaba en progresión de la enfermedad. Desde 1972, el tratamiento con radioterapia se consideró un estándar en estos sujetos, con una supervivencia a cinco años menor del 10%. Un metaanálisis probó que el beneficio de agregar quimioterapia al tratamiento con radioterapia se traduce en una disminución del 10-20% en el riesgo de muerte. Otro metaanálisis con quimiorradioterapia produjo un beneficio absoluto en la supervivencia global de 5.7% a tres años y en el control locorregional.16
De acuerdo con la más reciente revisión del American Joint Committee on Cancer staging system, el estadio IIIA del CPCNP consiste en T3N1M0, T1-3N2M0 y T4N0-1M0. En las personas con CPCNP estadio IIIA con situación N2 preoperatoria y/o enfermedad Bulky, se recomienda la radioquimioterapia a base de platino, que puede administrarse simultáneamente en pacientes con buen estado general, aunque se mantiene como tema de debate la incorporación o no de la cirugía como tratamiento multimodal.17 En nuestro estudio, se incluyeron individuos en estadio IIIA sin criterio quirúrgico. En un metaanálisis realizado por Sánchez de la Rosa,18 se evaluaron los resultados del tratamiento con diferentes esquemas de quimioterapia; de ellos, el más frecuente fue el paclitaxel con cisplatino, que mostró una respuesta objetiva antitumoral que varió entre 21% y 40.6%. Los hallazgos de nuestro estudio se encuentran en este rango, pues la respuesta objetiva se alcanzó sólo en el 29.6%.
En el SWOG8805, los sujetos recibieron dos ciclos de cisplatino/etopósido en forma concurrente con radioterapia (45Gy). Las tasas de respuesta fueron del 59%, y de enfermedad estable del 29%.19
En el presente trabajo se describe la respuesta al tratamiento oncoespecífico en la etapa IIIA, evidenciándose mejoría de alguno de los síntomas clínicos y la respuesta objetiva al tratamiento antitumoral, aun cuando el estado funcional empeoró en este grupo de investigación; por lo tanto, hubo respuesta al tratamiento oncoespecífico en la etapa IIIA para las personas incluidas, aun cuando un elevado porciento de ellas presentaron progresión de la enfermedad.











 nueva página del texto (beta)
nueva página del texto (beta)