Introducción
Los colibríes han sido utilizados frecuentemente como modelos para el estudio de las interacciones mutualistas que establecen con las plantas de las que se alimentan, y de las interacciones competitivas inter e intraespecíficas generadas por el acceso al néctar (Cotton, 2007). Aunque aún se desconocen aspectos básicos de la biología de muchas especies de colibríes y de los procesos que estructuran sus comunidades, recientemente se ha sugerido el posible papel de las relaciones evolutivas (e.g., coevolución entre plantas y polinizadores), alterando o limitando las interacciones biológicas, así como la distribución de las especies (Abrahamczyk y Kessler, 2014; Vizentin-Bugoni et al., 2014).
El desarrollo y mejoramiento de hipótesis filogenéticas robustas ha permitido que las relaciones evolutivas se incorporen al estudio de la ecología de comunidades (Johnson y Stinchcombe, 2007; Webb et al., 2002). En este sentido, McGuire et al. (2014) desarrollaron una hipótesis filogenética basada en datos de 284 de las 338 especies de colibríes. Dicha hipótesis ubica el origen de los colibríes en Eurasia (≈ 40 millones de años) y que su llegada al continente americano ocurrió a través de Norteamérica, región de la cual se dispersaron hacía el sur. Posteriormente, en Sudamérica el grupo se diversificó tras los cambios geográficos que ocurrieron en la región (e.g., el surgimiento de la Cordillera de los Andes). Siete de los nueve clados de colibríes se diversificaron en Sudamérica (i.e., Ermitaños, Topacios, Mangos, Brillantes, Coquetas, Patagona y Esmeraldas), mientras que el ancestro común de las Abejas y las Gemas de Montaña recolonizó Norteamérica (≈ 12 millones de años) donde posteriormente ambos clados se diversificarían. Esta hipótesis sugiere que los 9 clados aparecieron diferencialmente en el tiempo (i.e., Ermitaños y Topacios ≈ 22 millones de años, Mangos ≈ 18 millones de años, Brillantes y Coquetas ≈ 15 millones de años, Patagona gigas ≈ 14 millones de años, Esmeraldas ≈ 12 millones de años, Gemas de montaña ≈ 10 millones de años y Abejas ≈ 5 millones de años) (McGuire et al., 2014). Pese a estas diferencias, las comunidades de colibríes usualmente están integradas por especies que tienen cierto grado de parentesco o incluso pertenecen al mismo clado. Este patrón da como resultado que las especies que integran a cada comunidad tiendan a ser ecológicamente parecidas y que compartan características morfológicas tales como, tamaño corporal o el largo del pico. Esta similitud intensifica la competencia inter e intraespecífica por el acceso a los recursos florales (Freshwater et al., 2014).
Se ha encontrado que las especies de colibríes de mayor tamaño corporal tienden a dominar a las especies más pequeñas, limitándoles el acceso a los mejores recursos (Dearborn, 1998). Dicho patrón también ocurre a nivel intraespecífico (Carpenter et al., 1993). Sin embargo, existen reportes en donde las especies pequeñas de colibríes pueden ganar contiendas agresivas contra especies más grandes (Justino et al., 2012). En este sentido, Martin y Ghalambor (2014) postulan que una especie de ave de menor talla tiene más probabilidades de ganar un encuentro agresivo contra otra especie de mayor tamaño cuando la distancia evolutiva aumenta entre ellas. Esta hipótesis fue puesta a prueba utilizando como modelo las interacciones agonísticas originadas por el acceso a recursos en 3 grupos de aves: buitres, colibríes y pájaros hormigueros. Los autores sugieren que a lo largo del tiempo evolutivo, las especies pequeñas pueden acumular características que les permitan superar las desventajas competitivas asociadas a un menor tamaño corporal, por ejemplo, un incremento en la aceleración y maniobrabilidad que les permite ser más eficientes energéticamente al defender sus territorios de forrajeo en comparación a especies más grandes, mientras que las especies de mayor tamaño pudieron desarrollar otras características que comprometen su habilidad de competir agresivamente, por ejemplo la especialización hacía recursos particulares (e.g., los colibríes ermitaños del género Phaethornis y las plantas que visitan del género Heliconia). Es decir, las ventajas de un mayor tamaño corporal declinan conforme aumenta la distancia evolutiva entre las 2 especies participantes en un encuentro agonístico. Sin embargo, en el caso de los colibríes la diferencia entre el peso corporal del colibrí ganador y perdedor puede ser muy pequeña para determinar claramente a la especie con mayor o menor masa corporal de la interacción. Esto es particularmente importante en aquellas especies que realizan movimientos migratorios latitudinales, ya que su masa corporal puede cambiar significativamente en un solo día (Carpenter et al., 1983). Lo anterior sugiere que otros factores como la historia filogenética y de diversificación del grupo, o las características conductuales asociadas a la forma de explotar los recursos de las especies contendientes, pueden estar involucrados en determinar el resultado final de una interacción agonística.
El presente estudio fue diseñado para evaluar el efecto del tamaño corporal y la distancia genética entre colibríes en el resultado de las contiendas agonísticas generadas por el acceso a los recursos. Para lograr esto evaluamos: 1) la frecuencia con la que especies de colibríes de menor tamaño ganan encuentros agonísticos contra especies más grandes, 2) si la frecuencia de encuentros ganados y perdidos es influenciada por el tamaño corporal y el clado de pertenencia de los colibríes contendientes y 3) si la distancia genética entre contendientes es significativamente diferente entre las contiendas ganadas por colibríes más grandes y pequeños que su competidor y si debido a la historia de diversificación de los clados de colibríes en América, este patrón cambia en Norte, Centro y Sudamérica. Para explorar esta hipótesis, se generó una base de datos derivada de una compilación bibliográfica exhaustiva.
Materiales y métodos
Los datos utilizados en este estudio se obtuvieron a partir de una búsqueda de trabajos publicados en revistas científicas que reportaron la jerarquía de dominancia en una comunidad de colibríes o explícitamente indicaron las especies de colibríes que estuvieron involucradas en contiendas agonísticas por el acceso a los recursos. Los artículos se obtuvieron de forma electrónica a través de una búsqueda intensiva en bases de datos públicas como Scientific Electronic Library Online (SciELO), Searchable Ornithological Research Archive (SORA) y Google Scholar. Las búsquedas se realizaron utilizando las siguientes palabras claves y sus combinaciones en español e inglés: territorialidad colibríes, jerarquía colibríes, dominancia colibríes, comunidad colibríes y ensamble colibríes. Los artículos utilizados en este trabajo debían cumplir con los siguientes criterios: 1) mencionar de forma explícita la jerarquía de dominancia de los colibríes de una localidad, 2) la especie del colibrí ganador del encuentro agonístico y la especie desplazada o expulsada (solo se incluyeron interacciones agonísticas interespecíficas), y 3) que las contiendas agonísticas ocurrieran por el acceso a un recurso alimenticio (incluyendo aquellos estudios donde se utilizaron bebederos) por el cual competían al momento de la observación. Se incluyeron artículos que cuantificaron las interacciones entre las especies (i.e., número de encuentros agonísticos) y aquellos que mencionaron las interacciones agonísticas de forma anecdótica o cualitativa. Treinta y dos artículos entre 1969 y 2016 cumplieron con dichos criterios. Cada interacción entre 2 especies diferentes de colibríes en una localidad específica se consideró como un caso de estudio. Se obtuvieron 160 pares de interacciones o casos de estudio (Tabla 1) que incluyeron a 74 especies de colibríes de 7 países de América, los cuales fueron agrupados en Norteamérica (EUA y México), Centroamérica (Costa Rica y Panamá) y Sudamérica (Ecuador, Brasil y Colombia).
Tabla 1 Resumen de la información contenida en este estudio. Se indica el país (i.e., Estados Unidos = U, México = M, Panamá = P, Costa Rica = R, Colombia = C, Ecuador = E y Brasil = B), la especie del colibrí ganador y perdedor de cada contienda, la distancia genética entre contendientes, la secuencia del gen mitocondrial NADH deshidrogenasa subunidad 2 de Genbank y el peso promedio en caso de haberlo indicado el autor, el rango de peso de acuerdo a Schuchmann (1999) o Contreras-Martínez (2014) para aquellos pesos marcados con *. El número está asociado a las siguientes referencias: 1) Antunes, 2003; 2) Araujo-Silva y Bessa, 2010; 3) Arizmendi y Ornelas, 1990; 4) Ayala, 1986; 5) Boyden, 1978; 6) Chaves, 1997; 7) Colwell, 1973; 8) Copenhaver y Ewald, 1980; 9) Cotton, 1998; 10) Dearbon, 1998; 11) Ewald y Bransfield, 1987; 12) Fraga, 1989; 13) Justino et al., 2012; 14) Kuban et al., 1983; 15) Kuban y Neill, 1980; 16) Lara, 2006; 17) Lara et al., 2009; 18) Lara et al., 2011; 19) Lyon, 1976; 20) Ornelas et al., 2002; 21) Persegona et al., 2009; 22) Pimm et al., 1985; 23) Powers y Mckee, 1994; 24) Primack y Howe, 1975; 25) Ramírez-Burbano et al., 2007; 26) Rodríguez-Flores y Arizmendi, 2016; 27) Salamanca-Reyes, 2011; 28) Taylor, 2005; 29) Toloza-Moreno et al., 2014; 30) Wolf, 1969; 31) Wolf et al., 1976; 32) Woods y Ramsay, 2001.
| Especie ganadora | Peso (gramos) | Secuencia | Especie perdedora | Peso (gramos) | Secuencia | Distancia genética |
País | Referencia |
|---|---|---|---|---|---|---|---|---|
| Aglaectis cupripennis | 7.6-8.1 | KM389474.1 | Lesbia victoriae | 5.1-5.3 | AY830499.1 | 0.157 | E | 32 |
| Aglaectis cupripennis | 7.6-8.1 | KM389474.1 | Oreotrochilus estella | 8.8 | AY830507.1 | 0.177 | E | 32 |
| Aglaectis cupripennis | 7.6-8.1 | KM389474.1 | Eriocnemis mosquera | 5.2-5.8 | EU042550.1 | 0.172 | E | 32 |
| Aglaectis cupripennis | 7.6-8.1 | KM389474.1 | Patagona gigas | 18.5-20.2 | AY830510.1 | 0.203 | E | 32 |
| Aglaectis cupripennis | 7.6-8.1 | KM389474.1 | Pterophanes cyanopterus | 9.6-11.2 | AY830520.2 | 0.18 | E | 32 |
| Aglaectis cupripennis | 7.6-8.1 | KM389474.1 | Chalcostigma herrani | 6.4 | EU042536.1 | 0.163 | E | 32 |
| Amazilia beryllina | 4.6+0.513 n=30 | KJ602161.1 | Amazilia violiceps | 6.2 n=1 | KJ602176.1 | 0.099 | M | 26 |
| Amazilia beryllina | 4.6+0.513 n=30 | KJ602161.1 | Atthis heloisa | 2.293+0.24 n=14 | KJ602190.1 | 0.177 | M | 26 |
| Amazilia beryllina | 4.6+0.513 n=30 | KJ602161.1 | Eugenes fulgens | 7.233+0.764 n=3 | AY830481.1 | 0.194 | M | 26 |
| Amazilia beryllina | 4.6+0.513 n=30 | KJ602161.1 | Hylocharis leucotis | 3.595+0.303 n=40 | KJ602252.1 | 0.165 | M | 26 |
| Amazilia beryllina | 4.6+0.513 n=30 | KJ602161.1 | Lampornis amethystinus | 6.170+0.675 n=27 | KJ602255.1 | 0.196 | M | 26 |
| Amazilia beryllina | 4.6+0.513 n=30 | KJ602161.1 | Selasphorus calliope | 2.482+0.197 n=136* | EU042593.1 | 0.188 | M | 26 |
| Amazilia beryllina | 4.6+0.513 n=30 | KJ602161.1 | Selasphorus platycercus | 3.029+0.355 n=7 | AY830522.1 | 0.179 | M | 26 |
| Amazilia beryllina | 4.6+0.513 n=30 | KJ602161.1 | Selasphorus rufus | 3.128+0.171 n=29 | EU042590.1 | 0.183 | M | 26 |
| Amazilia beryllina | 4.6+0.513 n=30 | KJ602161.1 | Tilmatura dupontii | 2.250+0.086 n=5* | KJ602351.1 | 0.192 | M | 26 |
| Amazilia fimbriata | 4.89+0.1 n=76 | EU042520.1 | Eupetomena macroura | 8-9.7 | GU167228.1 | 0.152 | B | 13 |
| Amazilia fimbriata | 4.89+0.1 n=76 | EU042520.1 | Colibri serrirostris | 5.6-6.8 | GU167222.1 | 0.231 | B | 13 |
| Amazilia fimbriata | 4.89+0.1 n=76 | EU042520.1 | Phaethornis pretrei | 4.5-7 | GU167247.1 | 0.241 | B | 13 |
| Amazilia fimbriata | 4.89+0.1 n=76 | EU042520.1 | Chlorostilbon aureoventris | 3-3.8 | KJ602211.1 | 0.201 | B | 13 |
| Amazilia fimbriata | 4.89+0.1 n=76 | EU042520.1 | Calliphlox amethystina | 2.3-2.5 | GU167211.1 | 0.184 | B | 13 |
| Amazilia fimbriata | 4.89+0.1 n=76 | EU042520.1 | Chrysuronia oenone | 4.30+0.1 n=12 | AY830472.1 | 0.104 | C | 9 |
| Amazilia fimbriata | 4.89+0.1 n=76 | EU042520.1 | Chlorostilbon mellisugus | 2.60 n=1 | AY830471.1 | 0.191 | C | 9 |
| Amazilia lactea | 4.3+0.35 | GU167203.1 | Aphantochroa cirrhochloris | 7.1-9 | EU042528.1 | 0.16 | B | 1 |
| Amazilia lactea | 4.3+0.35 | GU167203.1 | Chlorostilbon aureoventris | 3.2+0.29 | KJ602211.1 | 0.2 | B | 1 |
| Amazilia lactea | 4.3+0.35 | GU167203.1 | Calliphlox amethystina | 2.3-2.5 | GU167211.1 | 0.186 | B | 1 |
| Amazilia lactea | 4.3+0.35 | GU167203.1 | Leucochloris albicollis | 6.6+0.20 | KJ602266.1 | 0.11 | B | 1 |
| Amazilia lactea | 4.3+0.35 | GU167203.1 | Hylocharis cyanus | 2.8-3.5 | EU04256.1 | 0.12 | B | 1 |
| Amazilia rutila | 4.3+0.1 | EU042522.1 | Heliomaster constantii | 7.5+09 | KJ602250.1 | 0.168 | M | 3 |
| Amazilia rutila | 4.3+0.1 | EU042522.1 | Cynanthus latirostris | 2.9+0.3 | KJ602233.1 | 0.179 | M | 3 |
| Amazilia rutila | 4.3+0.1 | EU042522.1 | Chlorostilbon auriceps | 2.1+0.3 | X | X | M | 3 |
| Amazilia tzacatl | 4.4-5.5 | EU983390.1 | Microchera albocoronata | 2.5 | EU042571.1 | 0.16 | R | 10 |
| Amazilia tzacatl | 4.4-5.5 | EU983390.1 | Klais guitmeti | 2.9 | AY830495.1 | 0.175 | R | 24 |
| Amazilia violiceps | 5 | KJ602176.1 | Calothorax pulcher | 2.6-3.1 | KU375421.1 | 0.115 | M | 20 |
| Anthracothorax nigricollis | 5.5-7.5 | EU042527.1 | Thalurania furcata | 3.6-6 | KJ602346.1 | 0.238 | B | 2 |
| Anthracothorax nigricollis | 5.5-7.5 | EU042527.1 | Leucochloris albicollis | 5.1-8 | KJ602266.1 | 0.248 | B | 21 |
| Anthracothorax nigricollis | 5.5-7.5 | EU042527.1 | Amazilia versicolor | 3.1-4 | EU042525.1 | 0.239 | B | 21 |
| Aphantochroa cirrhochloris | 7.1-9 | EU042528.1 | Amazilia lactea | 4.3+0.35 | GU167203.1 | 0.16 | B | 1 |
| Aphantochroa cirrhochloris | 7.1-9 | EU042528.1 | Amazilia versicolor | 3.9+0.29 | EU042525.1 | 0.141 | B | 1 |
| Aphantochroa cirrhochloris | 7.1-9 | EU042528.1 | Calliphlox amethystina | 2.3-2.5 | GU167211.1 | 0.176 | B | 1 |
| Aphantochroa cirrhochloris | 7.1-9 | EU042528.1 | Colibri serrirostris | 6.7+0.34 | GU167222.1 | 0.243 | B | 1 |
| Aphantochroa cirrhochloris | 7.1-9 | EU042528.1 | Leucochloris albicollis | 6.6+0.20 | KJ602266.1 | 0.148 | B | 1 |
| Archilochus alexandri | 2.7-4.3 | EU042529.1 | Calothorax lucifer | 2.9-3.5 | KP136391.1 | 0.078 | U | 15 |
| Atthis heloisa | 2.293+0.24 n=14 | KJ602190.1 | Hylocharis leucotis | 3.595+0.303 n=40 | KJ602252.1 | 0.164 | M | 26 |
| Atthis heloisa | 2.293+0.24 n=14 | KJ602190.1 | Selaphorus rufus | 3.128+0.171 n=29 | EU042590.1 | 0.041 | M | 26 |
| Boissonneaua flavescens | 8-8.6 | EU042530.1 | Eriocnemis mirabilis | 3.8+0.2 | X | X | C | 25 |
| Calypte anna | 3.3-5.8 | EU042532.1 | Selasphorus sasin | 2.5-3.8 | KJ602332.1 | 0.068 | U | 8 |
| Calypte anna | 3.3-5.8 | EU042532.1 | Archilochus alexandri | 2.7-4.3 | EU042529.1 | 0.105 | U | 11 |
| Campylopterus largipennis | 8.48+0.2 n=12 | AY830467.1 | Amazilia fimbrata | 4.89+0.1 n=76 | EU042520.1 | 0.173 | C | 9 |
| Campylopterus largipennis | 8.48+0.2 n=12 | AY830467.1 | Chrysuronia oenone | 4.30+0.1 n=12 | AY830472.1 | 0.173 | C | 9 |
| Campylopterus largipennis | 8.48+0.2 n=12 | AY830467.1 | Chlorostilbon mellisugus | 2.60 n=1 | AY830471.1 | 0.172 | C | 9 |
| Chalcostigma herrani | 6.4 | EU042536.1 | Lesbia victorae | 5.1-5.3 | AY830499.1 | 0.103 | E | 32 |
| Chalybura buffonii | 6-7.3 | EU042537.1 | Chlorostilbon canivetii | 2.1-2.8 | KJ602212.1 | 0.166 | P | 5 |
| Chalybura buffonii | 6-7.3 | EU042537.1 | Phaethornis superciliosus | 4.1-6 | JQ445678.1 | 0.204 | P | 12 |
| Chrysuronia oenone | 4.30+0.1 n=12 | AY830472.1 | Chlorostilbon mellisugus | 2.60 n=1 | AY830471.1 | 0.178 | C | 9 |
| Colibri coruscans | 6.9+1.36 n=27 | AY830476.1 | Eriocnemis vestita | 4.7+.58 n=137 | EU042551.1 | 0.243 | C | 29 |
| Colibri coruscans | 6.9+1.36 n=27 | AY830476.1 | Metallura tyrianthina | 3.4+0.52 n=85 | AY830502.1 | 0.223 | C | 29 |
| Colibri serrirostris | 5.6-6.8 | GU167222.1 | Eupetomena macroura | 8-9.7 | GU167228.1 | 0.232 | B | 13 |
| Colibri serrirostris | 5.6-6.8 | GU167222.1 | Amazilia fimbriata | 4.89+0.1 n=76 | EU042520.1 | 0.23 | B | 13 |
| Colibri serrirostris | 5.6-6.8 | GU167222.1 | Leucochloris albicollis | 5 | KJ602266.1 | 0.24 | B | 21 |
| Colibri serrirostris | 5.6-6.8 | GU167222.1 | Florisuga fusca | 9 | GU167229.1 | 0.21 | B | 21 |
| Colibri thalassinus | 5.11+0.07 | EU042544.1 | Eugenes fulgens | 7-7.5 | AY830481.1 | 0.223 | M | 16 |
| Colibri thalassinus | 5.11+0.07 | EU042544.1 | Archilochus colubris | 3.03+0.02 | KJ602257.1 | 0.203 | M | 17 |
| Colibri thalassinus | 5.11+0.07 | EU042544.1 | Selasphorus rufus | 3.17+0.03 | EU042529.1 | 0.219 | M | 17 |
| Colibri thalassinus | 5.11+0.07 | EU042544.1 | Selasphorus sasin | 3.09+0.04 | KJ602257.1 | 0.22 | M | 17 |
| Colibri thalassinus | 5.11+0.07 | EU042544.1 | Selasphorus platycercus | 3.16+0.02 | KJ602255.1 | 0.225 | M | 17 |
| Colibri thalassinus | 5.7+0.10 n=15 | EU042544.1 | Selasphorus flammula | 2.6+0.07 n=8 | EU042589.1 | 0.232 | R | 31 |
| Colibri thalassinus | 5.7+0.10 n=15 | EU042544.1 | Eugenes fulgens | 9.8+0.20 n=11 | AY830481.1 | 0.223 | R | 31 |
| Colibri thalassinus | 4.850+0.751 n=4 | EU042544.1 | Atthis heloisa | 2.293+0.24 n=14 | KJ602190.1 | 0.232 | M | 26 |
| Colibri thalassinus | 4.850+0.751 n=4 | EU042544.1 | Eugenes fulgens | 7.233+0.764 n=3 | AY830481.1 | 0.226 | M | 26 |
| Colibri thalassinus | 4.850+0.751 n=4 | EU042544.1 | Hylocharis leucotis | 3.595+0.303 n=40 | KJ602252.1 | 0.209 | M | 26 |
| Colibri thalassinus | 4.850+0.751 n=4 | EU042544.1 | Lampornis amethystinus | 6.170+0.675 n=27 | KJ602255.1 | 0.225 | M | 26 |
| Colibri thalassinus | 4.850+0.751 n=4 | EU042544.1 | Selasphorus calliope | 2.482+0.197 n=136* | EU042593.1 | 0.221 | M | 26 |
| Colibri thalassinus | 4.850+0.751 n=4 | EU042544.1 | Selasphorus platycercus | 3.029+0.355 n=7 | AY830522.1 | 0.228 | M | 26 |
| Colibri thalassinus | 4.850+0.751 n=4 | EU042544.1 | Selasphorus rufus | 3.128+0.171 n=29 | EU042590.1 | 0.221 | M | 26 |
| Colibri thalassinus | 5.7 | EU042544.1 | Eugenes fulgens | 7-7.5 | AY830481.1 | 0.224 | R | 7 |
| Cynanthus latirostris | 2.9+0.3 | KJ602233.1 | Chlorostilbon auriceps | 2.1+0.3 | X | X | M | 3 |
| Eriocnemis mirabilis | 3.8+0.2 | X | Coeligena torquata | 7.3 | FJ960712.1 | X | C | 25 |
| Eriocnemis vestita | 4.7+.58 n=136 | EU042551.1 | Metallura tyrianthina | 3.4+0.52 n=85 | AY830502.1 | 0.168 | C | 29 |
| Eriocnemis vestita | 4.7+.58 n=137 | EU042551.1 | Chaetocercus mulsant | 4 | AY830456.1 | 0.18 | C | 29 |
| Eugenes fulgens | 7.03+0.04 | AY830481.1 | Colibri thalassinus | 5.11+0.07 | EU042544.1 | 0.226 | M | 18 |
| Eugenes fulgens | 9.8+0.20 n=11 | AY830481.1 | Panterpe insignis | 6.2+0.08 n=33 | AY830509.1 | 0.149 | R | 31 |
| Eugenes fulgens | 9.8+0.20 n=11 | AY830481.1 | Colibri thalassinus | 5.7+0.10 n=15 | EU042544.1 | 0.226 | R | 31 |
| Eugenes fulgens | 9.8+0.20 n=11 | AY830481.1 | Selasphorus flammula | 2.6+0.07 n=8 | EU042589.1 | 0.166 | R | 31 |
| Eugenes fulgens | 7.7+0.4 n=24 | AY830481.1 | Hylocharis leucotis | 3.6+0.3 n=11 | KJ602252.1 | 0.176 | M | 19 |
| Eugenes fulgens | 7.233+0.764 n=3 | AY830481.1 | Amazylia beryllina | 4.6+0.513 n=30 | KJ602161.1 | 0.194 | M | 26 |
| Eugenes fulgens | 7.233+0.764 n=3 | AY830481.1 | Hylocharis leucotis | 3.595+0.303 n=40 | KJ602252.1 | 0.176 | M | 26 |
| Eugenes fulgens | 7.233+0.764 n=3 | AY830481.1 | Selasphorus platycercus | 3.029+0.355 n=7 | AY830522.1 | 0.164 | M | 26 |
| Eupetomena macroura | 8-9.7 | GU167228.1 | Colibri serrirostris | 5.6-6.8 | GU167222.1 | 0.233 | B | 13 |
| Eupetomena macroura | 8-9.7 | GU167228.1 | Phaethornis pretrei | 4.5-7 | GU167247.1 | 0.205 | B | 13 |
| Eupetomena macroura | 8-9.7 | GU167228.1 | Amazilia fimbriata | 4.89+0.1 n=76 | EU042520.1 | 0.152 | B | 13 |
| Eupetomena macroura | 8-9.7 | GU167228.1 | Calliphlox amethystina | 2.3-2.5 | GU167211.1 | 0.158 | B | 13 |
| Eupetomena macroura | 9.2+0.33 | GU167228.1 | Amazilia lactea | 4.3+0.35 | GU167203.1 | 0.153 | B | 1 |
| Eupetomena macroura | 9.2+0.33 | GU167228.1 | Chlorostilbon aureoventris | 3.2+0.29 | KJ602211.1 | 0.17 | B | 1 |
| Florisuga fusca | 8.7+0.29 | GU167229.1 | Eupetomena macroura | 9.2+0.33 | GU167228.1 | 0.228 | B | 1 |
| Florisuga fusca | 8.7+0.29 | GU167229.1 | Amazilia lactea | 4.3+0.35 | GU167203.1 | 0.231 | B | 1 |
| Florisuga fusca | 8.7+0.29 | GU167229.1 | Calliphlox amethystina | 2.3-2.5 | GU167211.1 | 0.21 | B | 1 |
| Florisuga fusca | 8.7+0.29 | GU167229.1 | Colibri serrirostris | 6.7+0.34 | GU167222.1 | 0.212 | B | 1 |
| Florisuga fusca | 8.7+0.29 | GU167229.1 | Heliomaster squamosus | 7.3+1.32 | KJ602251.1 | 0.225 | B | 1 |
| Florisuga fusca | 9 | GU167229.1 | Leucochloris albicollis | 5.1-8 | KJ602266.1 | 0.235 | B | 21 |
| Florisuga fusca | 9 | GU167229.1 | Anthracothorax nigricollis | 5.5-7.5 | EU042527.1 | 0.225 | B | 21 |
| Florisuga fusca | 9 | GU167229.1 | Amazilia versicolor | 3.1-4 | EU042525.1 | 0.222 | B | 21 |
| Glaucis hirsuta | 6.33+0.1 n=186 | AY830486.1 | Chrysuronia oenone | 4.30+0.1 n=12 | AY830472.1 | 0.213 | C | 9 |
| Helidoxa jacula | 7-9.5 | AY830491.1 | Phaethornis guy | 4-8.1 | AY830511.1 | 0.229 | R | 28 |
| Heliomaster constantii | 7.5+09 | KJ602250.1 | Amazilia rutila | 4.3+0.1 | EU042522.1 | 0.168 | M | 3 |
| Heliomaster constantii | 7.5+09 | KJ602250.1 | Cynanthus latirostris | 2.9+0.3 | KJ602233.1 | 0.157 | M | 3 |
| Hylocharis leucotis | 3.6+0.3 n=11 | KJ602252.1 | Atthis heloisa | 2-2.7 | KJ602190.1 | 0.164 | M | 18 |
| Hylocharis leucotis | 3.6+0.3 n=11 | KJ602252.1 | Archilochus colubris | 3.03+0.02 | EU042544.1 | 0.147 | M | 17 |
| Hylocharis leucotis | 3.6+0.3 n=11 | KJ602252.1 | Selasphorus rufus | 3.17+0.03 | KJ602252.1 | 0.165 | M | 17 |
| Hylocharis leucotis | 3.6+0.3 n=11 | KJ602252.1 | Selasphorus sasin | 3.09+0.04 | EU042590.1 | 0.164 | M | 17 |
| Hylocharis leucotis | 3.6+0.3 n=11 | KJ602252.1 | Selasphorus platycercus | 3.16+0.02 | AY830522.1 | 0.163 | M | 17 |
| Hylocharis leucotis | 3.595+0.303 n=40 | KJ602252.1 | Amazilia beryllina | 4.6+0.513 n=30 | KJ602161.1 | 0.165 | M | 26 |
| Hylocharis leucotis | 3.595+0.303 n=40 | KJ602252.1 | Atthis heloisa | 2.293+0.24 n=14 | KJ602190.1 | 0.164 | M | 26 |
| Hylocharis leucotis | 3.595+0.303 n=40 | KJ602252.1 | Colibri thalassinus | 4.850+0.751 n=4 | EU042544.1 | 0.209 | M | 26 |
| Hylocharis leucotis | 3.595+0.303 n=40 | KJ602252.1 | Eugenes fulgens | 7.233+0.764 n=3 | AY830481.1 | 0.176 | M | 26 |
| Hylocharis leucotis | 3.595+0.303 n=40 | KJ602252.1 | Lampornis amethystinus | 6.170+0.675 n=27 | KJ602255.1 | 0.173 | M | 26 |
| Hylocharis leucotis | 3.595+0.303 n=40 | KJ602252.1 | Selasphorus calliope | 2.482+0.197 n=136* | EU042593.1 | 0.157 | M | 26 |
| Hylocharis leucotis | 3.595+0.303 n=40 | KJ602252.1 | Tilmatura dupontii | 2.250+0.086 n=5* | KJ602351.1 | 0.173 | M | 26 |
| Lampornis amethystinus | 6.170+0.675 n=27 | KJ602255.1 | Amazilia beryllina | 4.6+0.513 n=30 | KJ602161.1 | 0.196 | M | 26 |
| Lampornis amethystinus | 6.170+0.675 n=27 | KJ602255.1 | Atthis heloisa | 2.293+0.24 n=14 | KJ602190.1 | 0.155 | M | 26 |
| Lampornis amethystinus | 6.170+0.675 n=27 | KJ602255.1 | Hylocharis leucotis | 3.595+0.303 n=40 | KJ602252.1 | 0.173 | M | 26 |
| Lampornis amethystinus | 6.170+0.675 n=27 | KJ602255.1 | Selasphorus platycercus | 3.029+0.355 n=7 | AY830522.1 | 0.151 | M | 26 |
| Lampornis amethystinus | 6.170+0.675 n=27 | KJ602255.1 | Tilmatura dupontii | 2.250+0.086 n=5* | KJ602351.1 | 0.162 | M | 26 |
| Lampornis clemenciae | 8.4+0.4 n=62 | KJ602257.1 | Archilochus alexandri | 2.7-4.3 | EU042529.1 | 0.162 | U | 23 |
| Lampornis clemenciae | 8.4+0.4 n=62 | KJ602257.1 | Eugenes fulgens | 7.0-7.5 | AY830481.1 | 0.167 | U | 22 |
| Lampornis clemenciae | 8.4+0.4 n=62 | KJ602257.1 | Lampornis amethystinus | 6.8+0.8 n=5 | KJ602255.1 | 0.111 | M | 19 |
| Lampornis clemenciae | 8.4+0.4 n=62 | KJ602257.1 | Colibri thalassinus | 6.3+0.2 n=11 | EU042544.1 | 0.243 | M | 19 |
| Lampornis clemenciae | 8.4+0.4 n=62 | KJ602257.1 | Hylocharis leucotis | 3.6+0.3 n=11 | KJ602252.1 | 0.185 | M | 19 |
| Lampornis clemenciae | 8.4+0.4 n=62 | KJ602257.1 | Selasphorus rufus | 2.9-3.9 | EU042590.1 | 0.149 | U | 14 |
| Lampornis clemenciae | 8.4+0.4 n=62 | KJ602257.1 | Selasphorus platycercus | 2.6-4.1 | AY830522.1 | 0.151 | U | 14 |
| Lesbia victoriae | 5.1-5.3 | AY830499.1 | Aglaeactis cupripennis | 7.6-8.1 | KM389474.1 | 0.157 | E | 32 |
| Leucochloris albicollis | 5.1-8 | KJ602266.1 | Florisuga fusca | 9 | GU167229.1 | 0.232 | B | 21 |
| Leucochloris albicollis | 5.1-8 | KJ602266.1 | Amazilia versicolor | 3.1-4 | EU042525.1 | 0.107 | B | 21 |
| Leucochloris albicollis | 5.1-8 | KJ602266.1 | Chlorostilbon aureoventris | 3-3.8 | KJ602211.1 | 0.185 | B | 21 |
| Oxypogon guerinii | 5.7+0.7 n=16 | EU042573.1 | Lesbia victoriae | 5.1-5.3 | AY830499.1 | 0.119 | C | 27 |
| Oxypogon guerinii | 5.7+0.7 n=16 | EU042573.1 | Aglaectis cupripennis | 7.6-8.1 | KM389474.1 | 0.173 | C | 27 |
| Panterpe insignis | 6.2+0.4 n=33 | AY830509.1 | Colibri thalassinus | 5.7 | AU042544.1 | 0.225 | R | 30 |
| Panterpe insignis | 6.2+0.08 n=33 | AY830509.1 | Selasphorus flammula | 2.6+0.07 n=8 | EU042589.1 | 0.144 | R | 31 |
| Panterpe insignis | 6.2+0.08 n=33 | AY830509.1 | Eugenes fulgens | 9.8+0.20 n=11 | AY830481.1 | 0.148 | R | 31 |
| Panterpe insignis | 5.9-6.2 | AY830509.1 | Eugenes fulgens | 7-7.5 | AY830481.1 | 0.147 | R | 7 |
| Patagona gigas | 18.5-20.2 | AY830510.1 | Aglaectis cupripennis | 7.6-8.1 | KM389474.1 | 0.203 | E | 32 |
| Phaethornis superciliosus | 4.1-6 | JQ445678.01 | Phaethornis longuemareus | 1.5-3.8 | EU042580.1 | 0.131 | R | 6 |
| Phaethornis superciliosus | 4.1-6 | JQ445678.01 | Threnetes ruckeri | 5.5-7 | FJ175727.1 | 0.15 | R | 6 |
| Pterophanes cyanopterus | 9.6-11.2 | AY830520.1 | Lesbia victoriae | 5.1-5.3 | AY830499.1 | 0.174 | E | 32 |
| Pterophanes cyanopterus | 9.6-11.2 | AY830520.2 | Aglaectis cupripennis | 7.6-8.1 | KM389474.1 | 0.18 | E | 32 |
| Selasphorus calliope | 2.482+0.197 n=136* | EU042593.1 | Hylocharis leucotis | 3.595+0.303 n=40 | KJ602252.1 | 0.157 | M | 26 |
| Selasphorus platycercus | 3.029+0.355 n=7 | AY830522.1 | Eugenes fulgens | 7.233+0.764 n=3 | AY830481.1 | 0.164 | M | 26 |
| Selasphorus rufus | 3.128+0.171 n=29 | EU042590.1 | Amazilia beryllina | 4.6+0.513 n=30 | KJ602161.1 | 0.183 | M | 26 |
| Selasphorus rufus | 3.128+0.171 n=29 | EU042590.1 | Atthis heloisa | 2.293+0.24 n=14 | KJ602190.1 | 0.041 | M | 26 |
| Selasphorus rufus | 3.128+0.171 n=29 | EU042590.1 | Selasphorus calliope | 2.482+0.197 n=136* | EU042593.1 | 0.024 | M | 26 |
| Thalurania furcata | 3.6-6 | KJ602346.1 | Chlorostilbon gibsoni | 2.8 | X | X | C | 4 |
| Thalurania furcata | 3.6-6 | KJ602346.1 | Coeligena prunellei | 6.6-7 | GU167221.1 | 0.172 | C | 4 |
| Thalurania furcata | 3.6-6 | KJ602346.1 | Ocreatus unnderwoodii | 2.6-3.2 | AY830504.1 | 0.196 | C | 4 |
| Thalurania furcata | 3.6-6 | KJ602346.1 | Anthracothorax nigricollis | 5.5-7.5 | EU042527.1 | 0.239 | B | 2 |
| Thalurania glaucopis | 5 | GU167251.1 | Leucochloris albicollis | 5.1-8 | KJ602266.1 | 0.167 | B | 21 |
| Thalurania glaucopis | 5 | GU167251.1 | Amazilia versicolor | 3.1-4 | EU042525.1 | 0.151 | B | 21 |
| Thalurania glaucopis | 5 | GU167251.1 | Florisuga fusca | 9 | GU167229.1 | 0.202 | B | 21 |
| Threnetes ruckeri | 5.5-7 | FJ175727.1 | Phaethornis superciliosus | 4.1-6 | JQ445678.1 | 0.15 | R | 6 |
| Threnetes ruckeri | 5.5-7 | FJ175727.1 | Phaethornis longuemareus | 1.5-3.8 | EU042580.1 | 0.154 | R | 6 |
| Tilmatura dupontii | 2.250+0.086 n=5* | KJ602351.1 | Amazilia beryllina | 4.6+0.513 n=30 | KJ602161.1 | 0.192 | M | 26 |
| Tilmatura dupontii | 2.250+0.086 n=5* | KJ602351.1 | Lampornis amethystinus | 6.170+0.675 n=27 | KJ602255.1 | 0.162 | M | 26 |
En cada caso de estudio, se determinó si la especie ganadora de cada interacción agonística fue de mayor o menor masa corporal (g) que su competidor. Para lo anterior, se consideró que el peso corporal promedio y los errores estándar que reportaron los autores de cada artículo no se empalmaran. Esto permitió asegurar que la asimetría entre ambas especies fuera la suficiente para poder considerar a una especie más grande que otra (Tabla 1). En caso de que el artículo no mencionara la masa corporal de las especies interactuantes, se utilizaron los rangos de peso propuestos por Schuchmann (1999). En estos casos se consideró una diferencia de al menos un gramo entre el peso máximo registrado para ambas especies como diferencia suficiente.
Para los análisis, a cada especie se le asignó el clado de pertenencia de acuerdo a McGuire et al. (2014). En la búsqueda se encontraron interacciones que involucraron a especies pertenecientes a los 9 clados de colibríes: Ermitaños, Topacios, Mangos, Brillantes, Coquetas, Esmeraldas, Gemas de Montaña, Abejas y al compuesto por Patagona gigas; este último conformado únicamente por la especie de colibrí de mayor tamaño corporal (i.e., colibrí gigante; 20-22 cm y 18.5-20.2 g; Schuchmann, 1999). La distancia genética entre cada par de colibríes contendientes se calculó utilizando secuencias genéticas mitocondriales del gen NADH deshidrogenasa subunidad 2, (sensuMartin y Ghalambor, 2014) disponibles en Genbank (Tabla 1). Las secuencias fueron alineadas mediante el algoritmo de alineamiento ClustalW (Thompson et al., 1994) y posteriormente se calculó la distancia genética entre cada par de especies mediante el modelo de Tamura-Nei (Tamura y Nei, 1993), el cual corrige las sustituciones múltiples en un sitio considerando las diferencias en la tasa de sustitución nucleotídica entre secuencias de DNA. Estas fueron obtenidas en MEGA versión 7.0 (Kumar et al., 2016).
Evaluamos las diferencias entre la frecuencia de encuentros agonísticos ganados y perdidos por colibríes a través de 2 modelos lineales generalizados (GLM) con distribución Poisson y función de enlace log (Nelder y Wedderburn, 1972). Para el primer modelo utilizamos como variable de respuesta la frecuencia de encuentros ganados por los colibríes y como variables predictoras se incluyeron la identidad del clado del colibrí ganador con 9 niveles (i.e., Ermitaños, Topacios, Mangos, Brillantes, Coquetas, Esmeraldas, Gemas de Montaña, Abejas, y Patagona) y el tamaño corporal del colibrí ganador respecto al de su competidor con 2 niveles (i.e., grande y pequeño). En el segundo modelo incluimos como variable de respuesta la frecuencia de encuentros perdidos por los colibríes y como variables predictoras la identidad del clado del colibrí perdedor con 9 niveles y el tamaño corporal del perdedor respecto al de su competidor con 2 niveles. Finalmente, utilizamos pruebas de Kruskal-Wallis para evaluar si existieron diferencias significativas entre la distancia genética de los colibríes que ganaron enfrentamientos contra contendientes más grandes en cada una de las regiones de América (i.e., Norteamérica, Centroamérica y Sudamérica). Los análisis estadísticos se realizaron en el software R (R Core Team, 2013) y las gráficas se realizaron mediante el paquete ggplot2 (Wickham, 2009).
Resultados
De los 160 encuentros agonísticos incluidos en este estudio, el 74% (119 casos de estudio) fueron ganados por el contendiente más grande y el 26% (41 casos de estudio) restante los ganó una especie más pequeña. En Norteamérica (EUA y México), los colibríes de especies más grandes vencieron en el 74% (51 casos de estudio) de las contiendas en las que participaron, mientras que el resto (26%; 18 casos de estudio) fue ganada por colibríes de especies de menor tamaño corporal. En Centroamérica (Costa Rica y Panamá), el 74% (14 casos de estudio) de las interacciones agonísticas fue ganada por colibríes de especies grandes y el 26% (5 casos de estudio) por colibríes de especies pequeñas. Finalmente, en Sudamérica (Ecuador, Brasil y Colombia), el 75% (54 casos de estudio) de las contiendas fueron dominadas por especies grandes y el 25% (18 casos de estudio) por colibríes de especies pequeñas.
La identidad de los clados tuvo un efecto significativo en la frecuencia de contiendas agonísticas ganadas (x 2 = 176.96, g.l. = 8, p < 0.001) y perdidas (x 2 = 145.59, g.l. = 8, p < 0.001). Los clados de aquellas especies que dominaron la mayor cantidad de encuentros agonísticos fueron: Esmeraldas, Gemas de Montaña y los Mangos. Los colibríes Esmeraldas dominaron el 45% (n = 72 contiendas), las Gemas de Montaña dominaron el 16% (n = 26 contiendas) y los Mangos el 15% (n = 24 contiendas) de los casos de estudio incluidos en este estudio. El tamaño corporal de los contendientes tuvo un efecto significativo en el resultado de los enfrentamientos (x 2 = 39.69, gr.l. = 1, p < 0.001), ya que las especies de todos los clados ganaron más encuentros agonísticos cuando fueron la especie más grande de la contienda (Fig. 1a) y perdieron mayor cantidad de encuentros al ser el contendiente más pequeño (Fig. 1b).
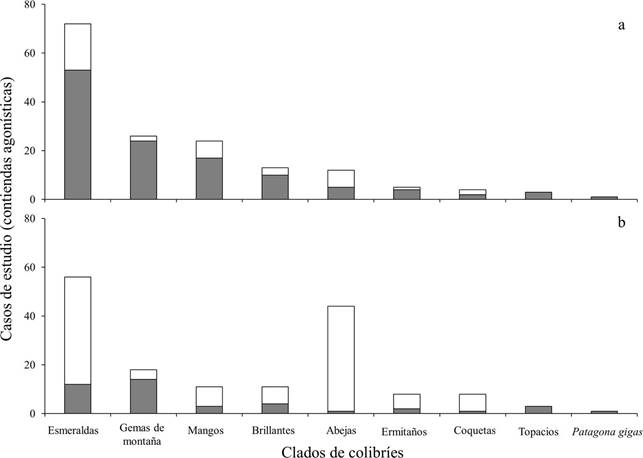
Figura 1 Frecuencia de contiendas ganadas (a) y perdidas (b) por los clados de colibríes. El color de las barras representa el tamaño corporal del colibrí dentro de la contienda respecto al de su competidor (barras grises = colibríes grandes y barras blancas = colibríes pequeños).
Para el análisis de las diferencias entre la distancia genética de colibríes de especies grandes y pequeñas que ganaron enfrentamientos agonísticos solo se incluyeron 155 de los 160 casos de estudio. Esto se debió a la falta de secuencias del gen mitocondrial NADH deshidrogenasa subunidad 2 para las siguientes especies: Eriocnemis mirabilis, Chlorostilbon gibsoni y C. auriceps. En estos 155 casos, no se encontraron diferencias significativas entre la distancia genética de los contendientes que participaron en los encuentros ganados por colibríes de especies más grandes y pequeñas (H = 0.204, p = 0.651; Fig. 2). Al analizar los casos de estudio por región geográfica tampoco se encontraron diferencias significativas entre la distancia genética de los colibríes que ganaron contiendas contra competidores de especies de tamaños distintos (Norteamérica, H = 0.432, p = 0.510; Centroamérica, H = 0.482, p = 0.487 y Sudamérica, H = 0.141, p = 0.706; Fig. 2).
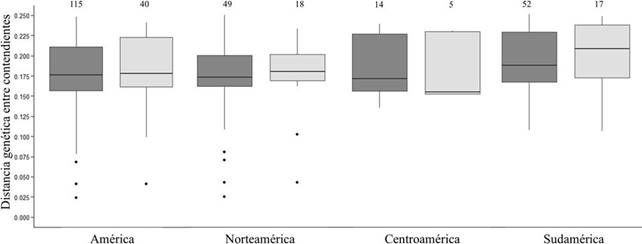
Figura 2 Distancia genética entre colibríes de América, Norteamérica, Centroamérica y Sudamérica. El color de las cajas indica el tamaño corporal del colibrí ganador del encuentro respecto a su competidor (cajas gris obscuro = colibríes grandes y cajas gris claro = colibríes pequeños). En la parte superior de cada caja se indica el número de contiendas agonísticas que conforman cada muestra. Las cajas representan el 50% de los datos divididos por la mediana de cada muestra, las líneas verticales indican los límites de 0.95 y 0.05. Los números sobre las cajas representan el tamaño de cada muestra (casos de estudio). Los puntos representan los outliers de cada distribución.
Discusión
Los resultados obtenidos en este estudio indican que los colibríes de especies de mayor tamaño corporal dominaron a las especies de menor talla cuando disputan el acceso a los recursos alimenticios en la mayoría de los encuentros (74%; 119 casos de estudio). Este patrón ha sido previamente reportado en diferentes comunidades de colibríes, sugiriendo que el mayor tamaño corporal de una especie suele estar correlacionado con un comportamiento agresivo (Cotton, 1998; Justino et al., 2012), y asociado al menor costo energético de enfrentarse a un intruso más pequeño (Dearbon, 1998). Sin embargo, los colibríes de especies de menor talla dominaron el 26% de las interacciones agonísticas (41 casos de estudio). Esta misma tendencia se presentó en Norte, Centro y Sudamérica con un porcentaje de encuentros ganados por contendientes de menor tamaño de 26% (18 casos de estudio), 26% (5 casos de estudio) y 25% (18 casos de estudio), respectivamente. Esto implica que la dominancia de los colibríes de especies grandes sobre competidores de menor masa corporal no es absoluta.
El hecho de que los colibríes de especies pequeñas ganen encuentros contra colibríes de especies más grandes podría deberse a factores asociados al contexto en el cual ocurre la contienda. Por ejemplo, el colibrí pechizafiro (Amazilia lactea) pesa 4.3 g en promedio, mientras que el colibrí sombrío (Aphantochroa cirrochloris) alcanza los 7 g. Cuando estas 2 especies compiten por el acceso a las flores de Eucalyptus spp., A. lactea tiende a ganar más encuentros agonísticos (56 de 95 encuentros). Sin embargo, en un mismo individuo de Eucalyptus, existe una estratificación en los territorios de ambas especies: Amazilia lactea establece territorios de forrajeo en las flores que se encuentran entre 6 y 15 m de altura, mientras que A. cirrochloris defiende las flores que se encuentran entre 20 y 30 m en la copa de los árboles (Antunes, 2003). Además de lo anterior, A. lactea establece territorios de forrajeo durante toda la época de floración de Eucalyptus, incluso al inicio y final de la misma, cuando la abundancia floral es baja. Por otro lado, A. cirrochloris solo establece territorios de forrajeo durante el pico de abundancia floral de Eucalyptus (Antunes, 2003). Es decir, el comportamiento territorial en A. cirrochloris depende de una mayor abundancia de flores de Eucalyptus. En contraste, A. lactea requiere una menor cantidad de recursos para establecer y defender un territorio.
Debe considerarse además que no todas las especies de colibríes establecen territorios de forrajeo o participan en contiendas agonísticas. Lo anterior ha sido descrito con base en los roles primarios que pueden ocupar los colibríes dentro de una comunidad. Al respecto, Feinsinger y Colwell (1978) postulan que los colibríes pueden desempeñar diferentes roles dentro de una comunidad para obtener acceso a los recursos disponibles en el ambiente, clasificándolos de acuerdo a sus características morfológicas (tamaño corporal, longitud del pico y patas) como ruteros (i.e., colibríes que establecen una ruta de forrajeo haciendo visitas secuenciales a diferentes puntos de alimentación) de baja calidad y ladrones (< 4 g y pico corto), generalistas y territoriales (4-5 g y pico de corto a medio) y ruteros de alta calidad y merodeadores (> 5 g y pico de medio a largo). No obstante, es importante enfatizar que una especie puede cambiar el rol que tiene en una comunidad y con esto la frecuencia y el resultado de las contiendas en las que participa dependiendo de la abundancia, disponibilidad y preferencia por los recursos disponibles en el ambiente, además de la composición de especies de la comunidad de colibríes (Feinsinger y Colwell, 1978). Por ejemplo, el colibrí barbudito del páramo (Oxypogon guerinii) generalmente establece rutas de alimentación; sin embargo, establece territorios de forrajeo en plantas de Espeletia spp. cuando este recurso es abundante. Tanto las rutas como los territorios son defendidos por O. guerinii, expulsando a otros colibríes de sus áreas de alimentación. Dentro de los intrusos se encuentran especies más grandes que O. guerinii, como Aglaeactis cupripennis, el colibrí cobrizo (Salamanca-Reyes, 2011). Es importante mencionar que se ha reportado que O. guerinii prefiere forrajear en flores de diferentes especies de Espletia, incluso cuando se encuentran marchitas, debido a la presencia de larvas de insectos que también consume (Schuchmann, 1999).
La variedad y plasticidad de los roles que pueden desempeñar las especies de colibríes dentro de una comunidad pueden ser el reflejo de procesos evolutivos, no solo de los colibríes, sino de las plantas que visitan. En conjunto, tales procesos podrían promover una disminución en la competencia interespecífica y aumentar el éxito reproductivo de las plantas (Brown et al., 1981). Un ejemplo de lo anterior son las características morfológicas de las corolas de algunas especies de plantas, las cuales solo pueden ser explotadas por especies de colibríes con cierta longitud y curvatura en el pico (Stiles, 1975; Vizentin-Bugoni et al., 2014).
Dominancia de los clados de colibríes
Los colibríes Esmeraldas, Gemas de Montaña y Mangos fueron los clados que protagonizaron y ganaron más encuentros agonísticos (72, 26 y 24 casos de estudio ganados, respectivamente). Sin embargo, los colibríes Esmeraldas fueron muy superiores al resto de los clados de colibríes, ya que dominaron el 45% de las interacciones agonísticas incluidas en este estudio (72 casos de estudio). De los 72 casos de estudio en donde participaron, desplazaron a colibríes más pequeños en 53 casos (74%) y a colibríes más grandes en 19 casos (26%). La dominancia de los colibríes Esmeraldas podría explicarse por la diversidad propia del clado ya que agrupa a 28 géneros de colibríes incluyendo a Amazilia, el género con mayor número de especies (30-32 especies) de la familia Trochilidae (McGuire et al., 2009; Ornelas, 1995). En este sentido, se ha reportado que las especies del género Amazilia son capaces de explotar una amplia gama de recursos florales y hábitats. Además de lo anterior, los colibríes de este género son territoriales y muy agresivos, resultando ser competidores superiores y dominantes sobre otras especies de colibríes (Arizmendi y Ornelas, 1990; Ornelas, 1995). El género Amazilia se ajusta a las características del rol de colibrí territorial descrito por Feinsinger y Colwell (1978), y la influencia de este género podría explicar la dominancia de los Esmeraldas sobre otros grupos de colibríes. Sin embargo, los Esmeraldas junto con los Abejas son los clados que perdieron mayor cantidad de contiendas cuando se enfrentaron a competidores de mayor tamaño corporal (56 y 44 casos de estudio, respectivamente). Esto puede deberse a que el clado Abejas concentra a los colibríes de menor tamaño corporal (2 - 4 g) de la familia Trochilidae. Por ejemplo, Atthis heloisa (colibrí abejorro), la especie más pequeña incluida en este estudio, regularmente forrajea en flores dispersas no defendidas o en la periferia de los territorios de otras especies de colibríes, de donde es desplazado fácilmente por otros colibríes (Lyon, 1976). Si bien, algunas especies de colibríes Abejas suelen ser territoriales, regularmente compiten contra especies de un tamaño corporal similar (e.g., especies del género Selasphorus; Camfield, 2006). En el presente estudio, muchas interacciones entre colibríes Abejas no fueron incluidas, pues podrían generar un grado de incertidumbre en los resultados al no poder determinar claramente a una de las especies como la de mayor tamaño corporal.
Finalmente, los colibríes Esmeralda fueron el clado que perdió la mayor cantidad de encuentros (44 casos de estudio) cuando se enfrentaron a especies de colibríes de mayor tamaño corporal (Fig. 1b). Este patrón podría ser explicado por la presencia de los colibríes del género Chlorostilbon (2.1 - 3.8 g) en este clado, ya que suelen ser relegados del acceso a los mejores recursos por colibríes de otras especies e incluso por abejas (e.g., Xylocopa spp.; Arizmendi y Ornelas, 1990).
Distancia genética entre contendientes
La hipótesis propuesta por Martin y Ghalambor (2014) sugiere que especies pequeñas tendrían mayor oportunidad de ganar encuentros agonísticos contra especies más grandes cuando la distancia evolutiva entre las especies interactuantes es mayor. Sin embargo, los resultados del presente estudio indican que no existe una diferencia estadísticamente significativa entre la distancia genética de las especies de colibríes que ganaron contiendas contra competidores de menor tamaño corporal. Este patrón se mantiene en las 3 regiones del continente. No obstante, parece existir una tendencia latitudinal en la cual la distancia genética entre contendientes aumenta de norte a sur del continente. Los valores más altos de distancia genética entre contendientes se registraron en los casos de estudio de Sudamérica y la menor en Norteamérica (Fig. 2, outliers). Esta tendencia puede estar relacionada con la historia de diversificación de los colibríes en América. McGuire et al. (2014) postulan que la diversificación en Sudamérica de los primeros 7 clados de colibríes (i.e., Ermitaños, Topacios, Mangos, Brillantes, Coquetas, Patagona y Esmeraldas) puede ser atribuida a 2 factores principales, las relaciones que establecieron con las plantas de las que se alimentan, además de la segregación entre especies para el uso de este recurso y el origen de la Cordillera de los Andes, la cual permitió la colonización de nuevas regiones principalmente para las especies de los clados Coquetas y Brillantes. Por otro lado, McGuire et al. (2014) indican que el ancestro común de las Gemas de Montaña y las Abejas recolonizó Norteamérica hace cerca de 12 millones de años, donde posteriormente ambos clados se diversificaron aproximadamente hace 10 y 5 millones de años, respectivamente. No obstante, recientemente Licona-Vera y Ornelas (2017) han postulado que la diversificación del clado Abejas ocurrió inicialmente hace cerca de 9.93 millones de años, pero la mayoría de los eventos de divergencia ocurrieron posteriormente (durante el Plioceno y el Pleistoceno Medio tardío). Por ello, la diversificación de los colibríes Abeja en la región pudo estar asociada a la aparición de nuevos hábitats y condiciones climáticas favorables originadas a partir de la formación de los sistemas montañosos en México y Centroamérica (Licona-Vera y Ornelas, 2017). Debido a la historia de diversificación del grupo en el continente, cada comunidad de colibríes se ha conformado diferencialmente a lo largo del tiempo con la llegada o diversificación de nuevas especies de colibríes o de recursos. Lo anterior podría reflejarse en la distancia genética entre las especies que conforman un ensamble y por lo tanto, en la frecuencia y resultado de contiendas agonísticas por el acceso a los recursos.
En conclusión, nuestro estudio indica que las especies de colibríes con mayor tamaño corporal generalmente dominan a las especies más pequeñas. Este patrón se mantiene a lo largo de la distribución del grupo y parece ser más evidente en clados como el Esmeraldas. Por otro lado, contrario a lo postulado por Martin y Ghalambor (2014), la distancia genética entre contendientes no resultó significativamente distinta entre colibríes que ganaron enfrentamientos contra competidores de menor masa corporal. Sin embargo, se debe tomar en cuenta que el presente estudio consideró cualitativamente a cada contienda (especie ganadora y especie perdedora) y que, dada la naturaleza de los datos, no se consideró la fuerza de cada interacción (es decir, cuantitativamente). Además de lo anterior, no se tomó en cuenta el contexto ecológico en el cual se desarrollan las contiendas, por lo cual se debe profundizar en el papel que juega la distancia evolutiva, en conjunto con la variabilidad en la disponibilidad y abundancia de los recursos, la calidad energética de los mismos y los cambios en la estructura de las comunidades debidos a la llegada y partida de especies migratorias en localidades particulares.











 nueva página del texto (beta)
nueva página del texto (beta)


