Introducción
La familia Rubiaceae se estima que incluye aproximadamente 13 100 especies en 611 géneros, con mayor diversidad en zonas tropicales y subtropicales (Govaerts et al., 2006). En México las rubiáceas se encuentran entre las 5 familias de plantas vasculares más diversas con 92 géneros (Villaseñor, 2004).
La familia se clasifica en 3 subfamilias Cinchonoideae, Ixoroideae y Rubioideae (Bremer y Eriksson, 2009) o 2 subfamilias Cinchonoideae y Rubioideae (Robbrecht y Manen, 2006). Robbrecht (1988) menciona que Rubiaceae consiste esencialmente de miembros maderables, resaltando que tribus como Hedyotideae y Rubieae tienen predominantemente hierbas. Bremer y Eriksson (2009) señalan que Cinchonoideae e Ixoroideae están representadas, principalmente por árboles y arbustos, mientras que Rubioideae se caracteriza por presentar hierbas o arbustos.
El entendimiento de la madera de Rubiaceae ha sido objeto de varios estudios, Jansen, Robbrecht, Beeckman y Smets (2002) mencionan que los primeros trabajos publicados son los de Solereder en el siglo xix, quien en su obra Anatomía sistemática de la madera de dicotiledóneas incluyó cerca de 40 géneros de rubiáceas. Sin embargo, no es sino a partir de la década de 1970 cuando los estudios anatómicos en Rubiaceae evalúan la utilidad de los caracteres anatómicos de la madera a diferentes niveles taxonómicos: géneros, tribus y subfamilias (Jansen et al., 2001; Jansen et al., 2002; Jansen, Robbrecht y Smets, 1997; Koek-Noorman, 1969a, b, 1970; Koek-Noorman y Hogewed, 1974; Koek-Noorman y Puff, 1983; Lens, Jansen, Robbrecht y Smets, 2000; Ter Welle, Loureiro, Lisboa y Koek-Noorman, 1983). Es importante destacar que Koek-Norman (1977) propone 2 tipos de madera para la familia, la madera tipo I, distintiva por presentar fibrotraqueidas, parénquima apotraqueal, vasos, principalmente solitarios y radios angostos; y la madera tipo II, caracterizada por sus fibras libriformes, parénquima ausente o paratraqueal escaso, vasos en hileras radiales cortas (2-4 vasos) y solitarios y radios anchos. Jansen et al. (2002), en la revisión de los caracteres anatómicos de la familia, confirman que la madera tipo I y II sensu Koek-Norman tiene valor taxonómico en la delimitación de tribus.
Los estudios de la corteza son aún más escasos (Carlquist, Schneider y Miller, 1994; Ritcher, 1985; Roth, 2005; Trockenbrodt y Parameswaran, 1986) y se cuenta con información de pocas especies de Rubiaceae como parte de las floras regionales (Roth, 1981) o una tribu (Martínez-Cabrera, Terrazas y Ochoterena, 2010).
Por otra parte, existen trabajos que han sido enfocados en la interpretación de la variación de los caracteres anatómicos de la madera en función de las formas de crecimiento (hábito) y los factores ambientales en diferentes familias de angiospermas (Baas y Schweingruber, 1987; Carlquist, 1985; Carlquist y Grant, 2005; Lens, Luteyn, Smets y Jansen, 2004; Olson y Rosell, 2013; Terrazas, Aguilar-Rodríguez y López-Mata, 2008; Vázquez-Sánchez y Terrazas, 2011). En Rubiaceae la mayoría de los estudios de anatomía de la madera tienen un enfoque sistemático y han incluido especies con distribución en Sudamérica, África y Asia (Jansen et al., 1997; Jansen et al., 2001; Koek-Noorman, 1969a, b; León, 2011; Ter Welle et al., 1983). Las especies de esta familia con distribución en México han sido pobremente estudiadas, e incluyen un número reducido de taxones, por ejemplo, el estudio de Barajas y León (1989) que se enfoca en 72 especies de una selva baja caducifolia, e incluye solo 3 especies de 3 géneros de Rubiaceae.
Este trabajo tuvo como objetivo caracterizar la anatomía de la corteza y de la madera de 42 especies de Rubiaceae con distribución en México y evaluar si los tipos de madera reconocidos para la familia permiten la separación de algunos grupos de especies, si estos corresponden a géneros y si hay una correlación con su hábito o con el tipo de comunidad vegetal donde se distribuyen.
Materiales y métodos
Se obtuvieron 98 muestras pertenecientes a 42 especies de las tribus Chiococceae, Coussareeae, Gardenieae, Guettardeae, Hamelieae, Hillieae, Psychotrieae y Spermacoceae, de las cuales 32 especies se recolectaron en el centro y sureste de México (Chiapas, Guerrero, Hidalgo, Jalisco, México y Veracruz) y 10 especies fueron proporcionadas por la xiloteca de MEXU (Tabla 1). Las muestras en campo se tomaron a 10 cm del suelo en los arbustos y en los arbolitos (< 1.0 m) y a 1.20 m del suelo en los árboles de mayor talla, seleccionando 2 o 3 individuos por especie, según la densidad poblacional en las diferentes localidades. Todas las muestras se fijaron en formol-ácido acético-etanol (FAA) o en alcohol a 70° de concentración y se almacenaron en una solución de glicerina-agua-alcohol (1:1:1) hasta su corte. Se hicieron cortes transversales, radiales y tangenciales de 20 y 35 µm de espesor con un micrótomo de deslizamiento; únicamente los cortes tangenciales fueron seriados iniciando en la peridermis o ritidoma hasta la madera. Los cortes se tiñeron con safranina-verde rápido y se montaron en resina sintética (Ruzin, 1999). También se preparó material disociado colocando astillas de madera adyacente al cámbium vascular en frascos con solución Jeffrey (Berlyn y Miksche, 1976), dejándolos en el horno a 50 °C por 24 o 48 h. Una vez disociado el material, se lavó y se hicieron preparaciones temporales para cuantificar la longitud de fibras y de elementos de vaso. Para la caracterización de las punteaduras intervasculares se hicieron cortes tangenciales de 60 µm, los cuales se deshidrataron y se fijaron a una portamuestra de aluminio con pegamento a base de carbono, secaron a punto crítico y se cubrieron con oro (Hitachi-S-2460N), para su observación en el microscopio electrónico de barrido (Hitachi-S-2460N). La descripción de la corteza se realizó utilizando la terminología de Trockenbrodt (1990) y de la madera, siguiendo las recomendaciones de la asociación internacional de anatomistas de la madera (IAWA Committee, 1989).
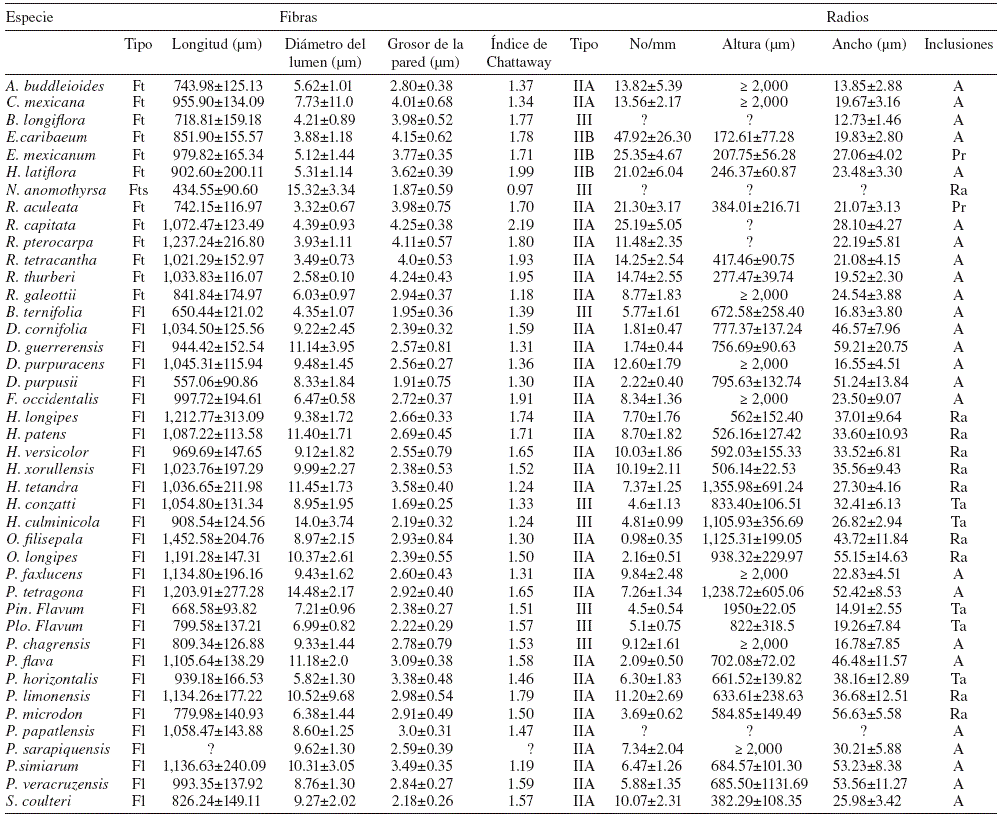
Tabla 1 Lista de especies y ejemplares estudiados de la familia Rubiaceae, presentados por tribu, su procedencia por estado y el herbario donde están depositados los especímenes de respaldo.

Se midieron 11 caracteres anatómicos de la madera con un analizador de imágenes (ImageProPlus versión 3.1, Media Cybernetics, 1997) adaptado a un microscopio Olympus BX-50, realizándose 25 mediciones por carácter de cada individuo. Solamente para P. tetragona no se pudieron cuantificar algunos caracteres debido a la calidad de la muestra. Los datos cuantitativos se analizaron en el paquete estadístico SAS versión 9.2 (SAS Institute, 2008). Se obtuvieron los datos de la media y la desviación estándar para cada carácter por especie, como datos de la estadística descriptiva. Johnson (2000) menciona que el coeficiente de correlación proporciona una medida de la asociación lineal entre 2 variables. Se utilizaron los coeficientes de correlación de Pearson o de Spearman, para evaluar la dirección y significancia de la asociación entre la altura de los individuos y la densidad y diámetro de los vasos, así como entre algunos rasgos de la madera como longitudes de elementos de vaso y fibras, y de densidad y diámetro de los vasos con el paquete estadístico SAS (2008).
La similitud anatómica entre las especies se estimó mediante el programa NTSYS-Pc versión 2.0 (Rohlf, 1997). Se construyó una matriz mixta con 51 caracteres (doble estado y multiestado) por 41 unidades taxonómicas operativas (OTUS, por sus siglas en inglés), mismas que corresponden al número de especies estudiadas. La matriz de similitud se generó a través del coeficiente de distancia taxonómica, el cual es apropiado para matrices de datos doble estado o multiestado, considerando valores de 0 a infinito, el 0 representa la máxima similitud. El fenograma se construyó con el método de ligamiento promedio de la media aritmética no ponderada UPGMA, el cual selecciona el valor de similitud promedio de los individuos y no elimina ningún valor (Crisci y López-Armengol, 1983).
Resultados
Con fines comparativos, primero se presenta la descripción de la madera tipo I distintiva de los representantes de Chiococceae y Guettardeae (subfamilia Cinchonoideae), Gardenieae (subfamilia Ixoroideae), Psychotrieae y Spermacoceae (subfamilia Rubioideae). En seguida se presenta la descripción de la madera tipo II para las tribus Hamelieae y Hillieae (subfamilia Cinchonoideae) y Psychotrieae (subfamilia Rubioideae), ilustrándose en las Figuras 1- 3 y presentando una síntesis a nivel específico en las Tablas 2 y 3 . Además, para cada tipo de madera se incluyen los caracteres anatómicos de su corteza, peridermis y floema secundario, así como el hábito y la comunidad vegetal donde se encuentran.
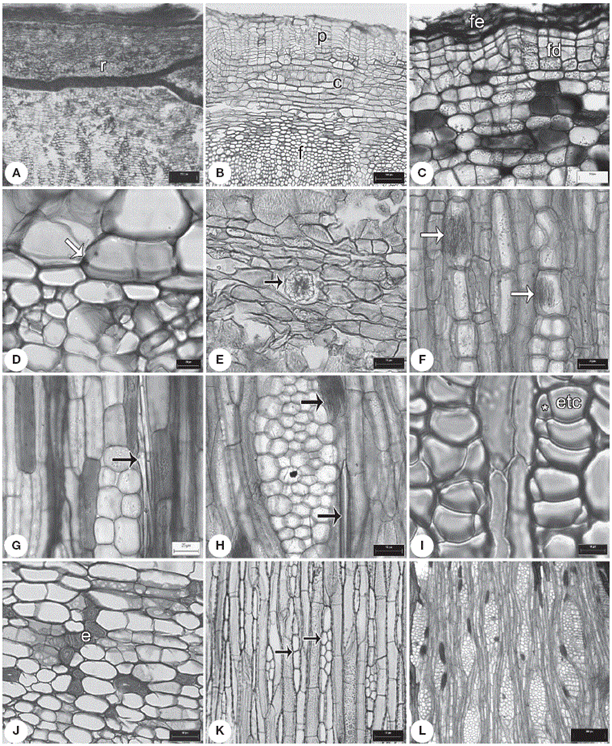
Figura 1 Caracteres de la corteza. A, ritidoma en Exostema caribaeum ; B, peridermis en Deppea purpusii ; C, felodermis en Palicourea tetragona ; D, endodermis en Notopleura anomothyrsa ; E, drusas en el parénquima axial de Randia pterocarpa ; F, rafidios en los radios de Hillia tetrandra ; G, estiloides en radios de Psychotria horizontalis ; H, rafidios y estiloides en los radios de Palicourea tetragona ;I, floema secundario con elementos de tubo criboso en Syringantha coulteri ; J, córtex con grupos de esclereidas en Omiltemia filisepala ; K, radios uni y biseriados en Hintonia latiflora ; L, radios dilatados en Palicourea faxlucens . c: córtex; e: esclereidas; fe: felema; fd: felodermis; etc: elementos de tubo criboso; p: peridermis; r: ritidoma; * célula acompañante. Escalas: A: 250 µm; B: 100 µm; C, D: 20 µm; E-F, H, J-K: 50 µm; G: 25 µm; I: 10 µm; L: 300 µm.
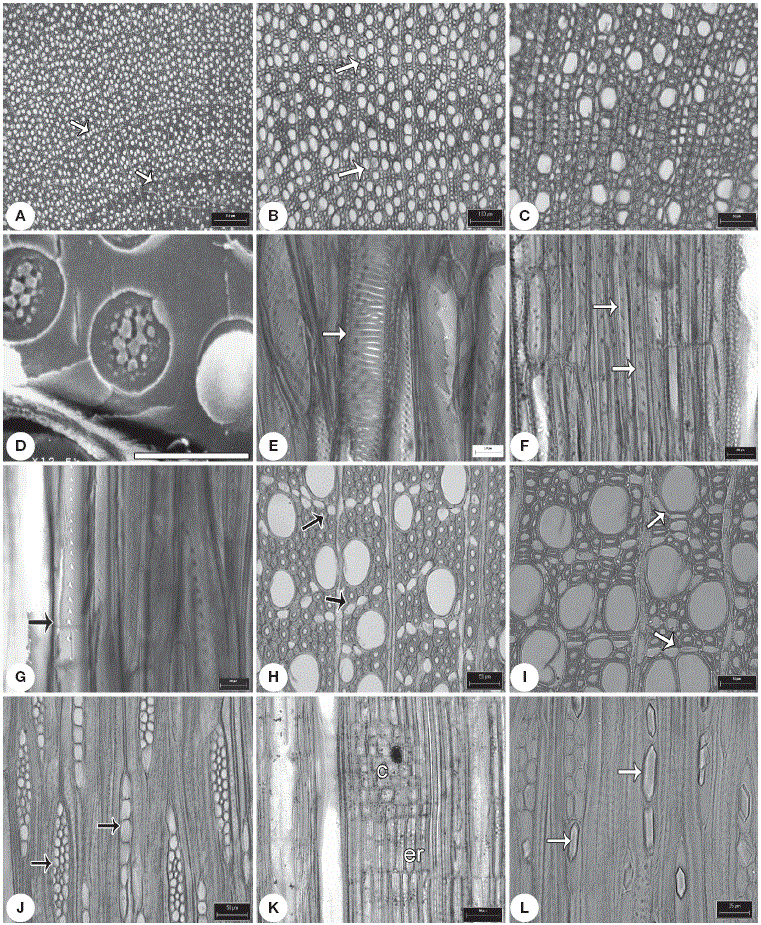
Figura 2 Caracteres de la madera tipo I. A, anillos de crecimiento conspicuos (flecha) en Hintonia latiflora ; B, porosidad semianular, anillos (flecha) en Exostema caribaeum ; C, vasos solitarios en Chione mexicana ;D, punteadura intervascular con ornamentación en Exostema. caribaeum ; E, punteaduras escalariformes (flecha) en Notopleura anomothyrsa ; F, fibrotraqueidas, punteaduras areoladas (flechas) en Arachnothryx buddleoides ; G, fibrotraqueidas septadas (septo, flecha) en Notopleura anomothyrsa ;H, parénquima apotraqueal en hileras cortas (flecha) en Randia tethracanta ; I, parénquima paratraqueal (flechas) en Randia capitata ; J, radios uniseriados y multiseriados en Exostema mexicanum ; K, radios tipo IIA en Renistipula galeottii ; L, cristales prismáticos (flechas) en los radios en Randia aculeata . c: células cuadradas, er: células erectas. Escalas: A: 250 µm; B: 100 µm; C: H-K: 50 µm; D: 4 µm; E-G: 20 µm; L: 25 µm.

Figura 3 Caracteres de la madera tipo II. A, anillos de crecimiento inconspicuos en Hillia tetrandra ; B, porosidad difusa en Palicourea tetragona ; C, vasos en hileras radiales en Psychotria chagrensis ; D, placa de perforación simple (flechas) en Deppea guerrensis ; E, vasos con punteaduras intervasculares alternas em Palicourea faxlucens ; F, punteaduras intervasculares con ornamentación en Hamelia versicolor ; G, fibras libriformes septadas (flechas) en Palicourea tetragona ; H, parénquima apotraqueal difuso en Omiltemia longipes ; I, radios uniseriados y multiseriados (flechas) en Psychotria simiarum ; J, radios heterogéneos en Syringantha coulteri ;K, radios paedomórficos en Plocaniophyllon flavum ; L, rafidios en paréquima radial en Hamelia patens . Ce: células erectas; cp: células procumbentes; fi: fibras; r: radios; v: vasos. Escalas: A, B: 300 µm; C, G, H, J: 50 µm; D, E: 20 µm; F: 4 µm; I: 100 µm; K: 25 µm.
Tabla 2 Caracteres anatómicos de la madera de 41 especies de Rubiaceae estudiadas. Se presenta la media aritmética y desviación estándar en cada carácter. No se presentan caracteres cuantitativos para P. tetragona debido a la imposibilidad de medirlos en la muestra disponible. LV: longitud del elemento de vaso; DV: diámetro tangencial de vaso con porosidad difusa; DVTE: diámetro tangencial de vaso en madera temprana con porosidad anular o semianular; DVTA: diámetro tangencial de vaso en madera tardía con porosidad anular o semianular; GPV: grosor de la pared del vaso; DP: diámetro tangencial de la punteadura intervascular.
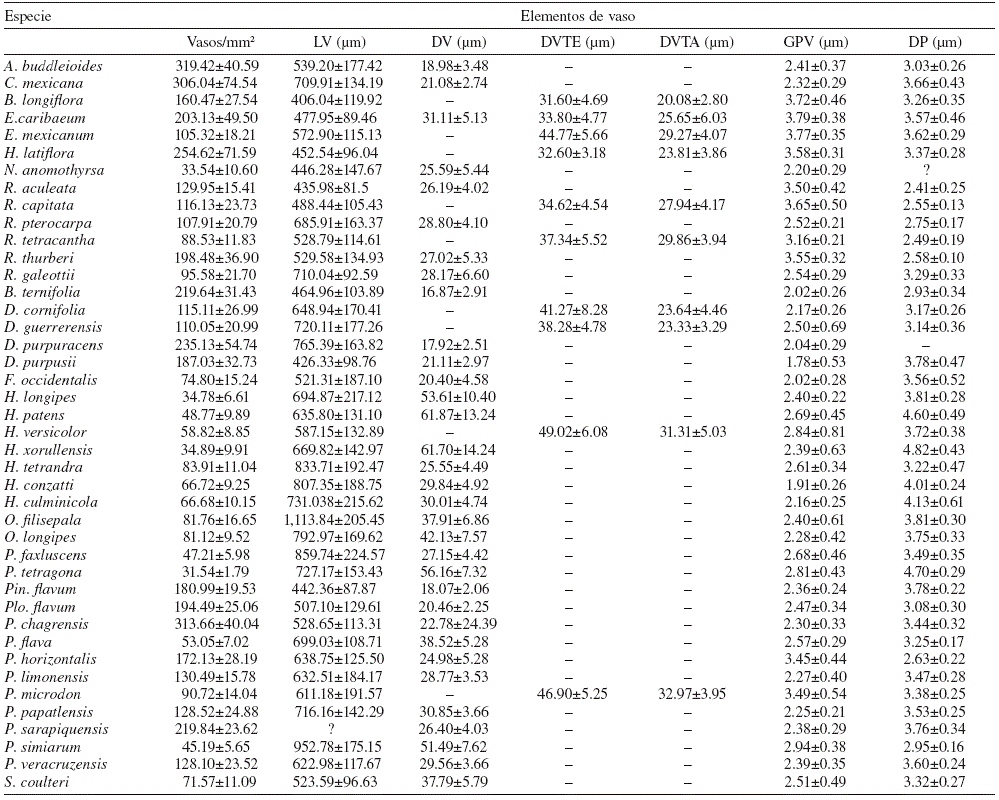
Tabla 3 Caracteres de la madera de las 42 especies de Rubiaceae. Se presenta la media aritmética y desviación estándar en cada caracter. A: ausente; Fl: fibras libriformes; Ft: fibrotraqueidas; Fts: fibrotraqueidas septadas; Pr: prismáticos; Ra: rafidios; Ta: taninos; ?: no medido.
Madera tipo I
Las especies de Archnothryx , Bouvardia (B . longiflora ), Chione , Exostema , Hintonia , Notopleura , Randia y Renistipula que se incluyeron presentaron madera tipo I. Bouvardia longiflora y N. anomothyrsa tienen hábito subarbustivo a subfrutescente, se distribuyen en matorral xerófilo, bosque de encino y selva alta perennifolia, respectivamente. Los representantes de Arachnothryx y Randia son árboles pequeños hasta de 4-5 m y arbustos de 1-2 m de altura, respectivamente, con distribución en selva alta perennifolia y selva baja caducifolia. Los representantes de Chione y Renistipula son árboles de hasta 8 m de altura presentes en selva alta perennifolia, mientras que Exostema y Hintonia miden de 3-10 m (Tabla 2) y habitan en selva baja caducifolia.
Corteza externa
Chione, Exostema , Hintonia , Randia y Renistipula presentan una corteza de color gris pardo, verde o café, de tipo heterogénea, de lisa a fisurada. Las fisuras fueron reticuladas superficiales, menores a la mitad del grosor de la corteza. Bouvardia longiflora presenta corteza lisa de color gris claro y pequeñas lenticelas, mientras que en N. anomothyrsa es lisa y de color verde.
Peridermis
Los géneros con madera tipo I presentan ritidoma, hay hasta 2-6 peridermis en Exostema (Fig. 1A). El felógeno se diferencia de las células subyacentes a la epidermis; el felema comúnmente está formado por 5-10 estratos de células rectangulares, pero Exostema tiene entre 15-20 estratos. La felodermis desarrolla de 3-5 estratos de células comúnmente rectangulares y paredes delgadas. Se observan contenidos oscuros en las células del felema.
Córtex
El córtex está constituido por células de parénquima y colénquima laminar en algunas especies de Randia , mientras que las especies de Exostema y Hintonia carecen de córtex cuando hay crecimiento secundario. Las inclusiones minerales en las especies de Randia son drusas (Fig. 1E) y rafidios en N. anomothyrsa .
Floema secundario
Los elementos de tubo criboso (ETC) tienen forma poligonal a irregular, con paredes delgadas y una célula acompañante (CA) en uno de sus extremos. Los ETC en el floema no colapsado se distribuyen en grupos de 2-3. Los ETC y CA siempre se obliteran en el floema colapsado. Las células de parénquima de forma isodiamétrica tienen una distribución difusa entre los ETC y CA en el floema no colapsado. En el floema colapsado, el parénquima es más abundante y está interrumpido por 1-4 bandas continuas de esclereidas, excepto en Hintonia que presenta grupos de más de 20 esclereidas. En corte transversal, el curso de los radios es recto en el floema no colapsado, con una dilatación moderada a fuerte en el floema colapsado hacia la peridermis. Los radios son heterogéneos, uni y multicelulares (Fig. 1K). Se presentan estiloides en B. longiflora y E. caribaeum , rafidios en N. anomothyrsa , cristales prismáticos en E. mexicanum , drusas exclusivamente en Randia y areniscas en Hintonia .
Xilema secundario. Presentan anillos de crecimiento marcados por diferencias en el grosor de la pared de la fibra (Fig. 2A). La porosidad es semianular, con 1(-2) hileras de vasos en la madera temprana con transición gradual de la madera temprana a la tardía (Fig. 2B). La densidad de vasos varía de 35 vasos/mm2 en N . anomothyrsa hasta 319 vasos/mm2 en A . buddleioides (Tabla 2). Los vasos en su mayoría son solitarios y de forma circular a oval con las paredes ligeramente angulares (Fig. 2C). El diámetro tangencial promedio de los vasos fluctúa de 18 a 44 µm (Tabla 2). Los elementos de vaso tienen una longitud promedio de 406 a 710 µm y un grosor promedio de la pared de los vasos de 2.5 a 3.7 µm (Tabla 2). La placa de perforación es simple e inclinada. Las punteaduras intervasculares son alternas, areoladas, de forma circular con apertura lenticular ornamentada y restringida a la apertura de la punteadura (Fig. 2D), con excepción de N . anomothyrsa con punteaduras escalariformes (Fig. 2E). El diámetro de la punteadura es de 3.2-3.6 µm, con excepción de Randia con punteaduras ≤ 2.7 µm. Las punteaduras radio-vaso son similares a las intervasculares.
Se presentan fibrotraqueidas no septadas con punteaduras areoladas en la mayoría de los taxones, con excepción de N . anomothyrsa con fibrotraqueidas septadas (Figs. 2F y G ). Las dimensiones de las fibras, longitud, grosor de la pared y lumen, así como el índice de Chattaway se presentan en la Tabla 3. El parénquima axial es apotraqueal en agregados, pero además, Hintonia y Renistipula presentan parénquima paratraqueal escaso (Figs. 2H e I ). Los radios son heterogéneos tipo IIA, IIB (Figs. 2J y K ; Tabla 3) y solo en B . longiflora y N . anomothyrsa son paedomórficos. El número de radios y sus dimensiones se encuentran en la Tabla 3. Las inclusiones minerales que ocluyen el lumen de algunas células de parénquima axial y radial son rafidios en N . anomothyrsa , cristales prismáticos en E . mexicanum y R. aculeata (Fig. 2L).
Madera tipo II
Las especies de Faramea , Palicourea y Psychotria estudiadas son arbustos y árboles pequeños hasta de 8-10 m de altura, con distribución en selva alta perennifolia y selva baja caducifolia. Sin embargo, H. tetrandra presenta hábito epífito, alcanzando 1.5 m y B. ternifolia tiene hábito herbáceo a subarbustivo < 1 m. De igual forma, las especies de Hamelieae incluidas en este estudio son arbustos y árboles pequeños que no sobrepasan los 4 m de altura y un dap de 1.5-10 cm (Tabla 1), son siempre verdes y habitan en el bosque mesófilo de montaña, bosque de pino-encino, selva alta perennifolia, selva mediana subperennifolia y selva baja caducifolia.
Corteza externa
La corteza de las especies de Hamelieae, de Psychotria y de B. ternifolia es lisa a finamente rugosa, de color gris o café, sin ritidoma aparente, con excepción de las especies de Faramea , Palicourea y P. microdon que presentan corteza fisurada y en la última especie con ritidoma. Hay lenticelas menores de 3 mm, de forma redonda a oval.
Peridermis
Se presenta una sola peridermis (Fig. 1B), excepto en P. microdon , que tiene ritidoma con 2-6 peridermis. El felógeno se diferencia de las células subyacentes a la epidermis; el felema está formado por 4-10 estratos de células rectangulares, con excepción de algunas especies de Hamelia y Syringantha que presentan más de 10 estratos y Psychotria con 20. La felodermis presenta de 3-6 estratos de células rectangulares a cuadradas y paredes delgadas (Fig. 1C), con excepción de algunas especies de Deppea y Hamelia donde hay hasta 12 estratos. Únicamente se observaron contenidos oscuros en el felema.
Córtex
El córtex está constituido por células de parénquima y colénquima laminar. Además, se observa una endodermis adyacente al colénquima con células rectangulares y banda de Caspari (Fig. 1D). Notoriamente sin importar el diámetro del tallo, el córtex y la endodermis se conservan entre la peridermis y el floema secundario en Faramea , Hillia , en algunas especies de Psychotria y en todos los géneros de Hamelieae. Taninos y rafidios ocluyen el lumen de algunas células del parénquima, con excepción de P . horizontalis y P . veracruzensis que presentan estiloides (Figs. 1F- H ).
Floema secundario
Los ETC tienen forma poligonal con paredes delgadas y una CA en uno de sus extremos (Fig. 1I), con excepción de Plocaniophyllon y Pinarophyllon donde son de forma redonda. Los ETC en el floema no colapsado se distribuyen en grupos de 2-3, excepto en H. xorullensis y P. microdon que presentan grupos de 3-5. Los ETC y CA siempre se obliteran en el floema colapsado. Las células de parénquima son de forma circular y tienen una distribución difusa entre los ETC y CA en el floema no colapsado. En el floema colapsado el parénquima es más abundante y está interrumpido por grupos de 2-5 fibras o esclereidas (Fig. 1J) en las especies con diámetros ≤ 2 cm (Hoffmannia , Pinarophyllon y Plocaniophyllon ) o grupos de 15-20 esclereidas y hasta 1-2 bandas de esclereidas en especies con diámetros ≥ 3 cm en Hamelieae, Psychotrieae (Palicourea y Psychotria ). En corte transversal, el curso de los radios recto en el floema no colapsado, con dilatación ligera a moderada en el floema colapsado cerca de la región de córtex (Fig. 1L). Los radios son homogéneos unicelulares en B. ternifolia , Hoffmannia , Pinarophyllon , Plocaniophyllon y en pocas especies de Psychotria , siendo heterogéneos uni y multicelulares en el resto de los géneros con madera de este grupo. Los cristales son similares a los presentes en el córtex.
Xilema secundario
Hay anillos de crecimiento distintivos, marcados por diferencias en la pared de la fibra, excepto en Hoffmannia , O. filisepala y P. flava , P . microdon y P . veracruzensis (Fig. 3A). La porosidad es difusa (Fig. 3B), con tendencia a semianular en algunas especies de Deppea , Faramea , Hamelia y O . longipes , marcada por 1(-2) hilera de vasos en la madera temprana; la transición de la madera temprana a tardía es gradual. La densidad de vasos varía de 31 vasos/mm2 en P. tetragona hasta 313 vasos/mm2 en P. chagrensis (Tabla 2). Los vasos en su mayoría se distribuyen en hileras radiales de 2-4 (6) vasos, pero tienden a ser más largas en Hamelieae de 2-6 (8) vasos y algunas especies de Psychotria (Fig. 3C), solo se observaron cúmulos de 3-4 vasos en P . simiarum . Los vasos tienen forma angular, pero hay escasos de forma circular; el diámetro tangencial promedio de los vasos va de 16 a 61 µm (Tabla 2). Los elementos de vaso tienen de 442 a 1 113 µm en longitud, el grosor promedio de su pared es de 1.7 a 3.4 µm (Tabla 2). La placa de perforación es simple (Fig. 3D) e inclinada, con excepción de las especies de Hoffmannia , P . sarapiquensis , P . simiarum y P . veracruzensis con perforación múltiple de 1-2 barras. Las punteaduras intervasculares son alternas, areoladas, de forma circular con apertura lenticular ornamentada (Figs. 3E y F ). Se reconocen 2 grados de ornamentación, la más común se restringe a la apertura de la punteadura; en el segundo tipo, la ornamentación tiene escasas prolongaciones de la pared interna y se observó en Deppea y Hoffmannia . El diámetro de la punteadura intervascular varía entre 3 y 4 µm y las punteaduras radio-vaso son similares a las intervasculares.
Las fibras libriformes son septadas, con 2-6 septos con punteaduras ligeramente areoladas (Fig. 3G). Las dimensiones de las fibras y su índice de Chattaway se presentan en la Tabla 3. El parénquima es apotraqueal difuso (Fig. 3H), con series parenquimáticas de 2-6. Los radios son heterogéneos (tipo IIA; Figs. 3I y J ), con excepción de las especies de Hoffmannia , Pinarophyllon y Plocaniophyllon , las cuales presentan radios paedomórficos (Fig. 3K). El número de radios y sus dimensiones se dan en la Tabla 3. Algunos rafidios ocluyen el lumen de las células de parénquima axial y radial en Hamelia , Omiltemia , P. limonensis y P . microdon (Fig. 3L) y los cuerpos de sílice se observaron en las especies de Deppea , Plocaniophyllon , Pinarophyllon y Syringantha .
Análisis de correlación
No se encontró una asociación significativa (P > 0.05) entre la altura de los individuos y el diámetro y la densidad de vasos. Solo se correlacionan negativamente el diámetro y la densidad de vasos con un valor de -0.62 (P < 0.0001) y positivamente la longitud de los elementos de vaso y de las fibras, con un valor de 0.74 (P < 0.0001).
Análisis fenético
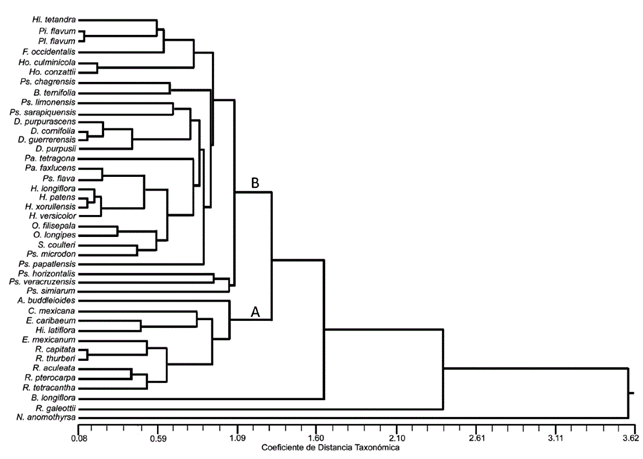
El fenograma muestra 2 grupos relacionados a una distancia de 1.32 (Fig. 4). En el primer grupo (A) se encuentran asociadas 29 especies que pertenecen a los géneros, principalmente de Hamelieae y Psychotrieae, así como Faramea , Hillia y B. ternifolia con un nivel de similitud de 1.06. Dentro de este primer grupo se encuentran relacionados los géneros Pinarophyllon y Plocaniophyllon a 0.14, mientras que las especies de Hamelia y Deppea se asocian a 0.20 y 0.44, respectivamente. Las especies de Psychotria no se constituyen en un solo grupo, aparecen asociadas a los taxones de Hamelieae y a un representante de Bouvardia . El segundo grupo (B) se recupera con un valor de similitud cercano a 1.05. Dentro de este grupo se encuentran asociadas las especies de Randia con un valor de 0.60, uniéndose a estas los representantes de Arachnothryx , Chione , Exostema y Hintonia . Bouvardia longiflora , R. galeottii y N . anomothyrsa no se anidan dentro de ninguno de estos 2 grupos y tienen valores de similitud de 1.67, 2.50 y 3.60, respectivamente.
Discusión
Análisis de similitud
A pesar de la amplia variación de los rasgos anatómicos de la madera y la corteza en las especies de Rubiaceae estudiadas, es notable que el fenograma permita reconocer 2 grupos y 3 especies que se separan del resto. El primer grupo (A) asocia a las especies con madera tipo II, y el segundo a las especies con madera tipo I sensu Koek-Noorman (1977). Las especies de las tribus Coussareeae, Hamelieae y Psychotrieae y una especie de Spermacoceae s.l. (B . ternifolia ) se asocian debido a que poseen los caracteres distintivos de la madera tipo II: fibras libriformes, vasos la mayoría agrupados en hileras radiales (2-3 vasos) y parénquima apotraqueal difuso. Este tipo de madera también ha sido descrita para otras especies de Psychotria y para los miembros de las tribus Condamineeae, Coccocypseleae, Hippotideae, Mussaendeae, Simireae y Sabiceae (Jansen et al., 1997; Jansen et al., 2002). La mayoría de las especies con madera tipo II presentan una peridermis, retienen la endodermis y tienen rafidios en córtex o floema secundario. Además, los radios en el floema no funcional muestran una ligera a moderada dilatación y pequeños grupos de fibras o esclereidas (2-5), grupos de 15-20 esclereidas o incluso una o 2 bandas de esclereidas.
Los géneros Pinarophyllon y Plocaniophyllon se agrupan por sus radios paedomórficos y de 4-5 radios/mm2; y ambos taxones se agruparon con los representantes de Hillia , Hoffmannia y Faramea por presentar grupos de 3-5 esclereidas en la corteza y en la madera una longitud de fibras entre 900-1,050 µm y ancho de radios entre 23-32 µm. Cabe destacar el hecho de que Hillia y los miembros de Hamelieae muestran una peridermis y rafidios en el córtex, así como la madera tipo II, apoyando la hipótesis de que la tribu Hillieae se encuentra cercanamente emparentada con Hamelieae como señalan varios autores (Jansen et al., 2002; Manns y Bremer, 2010; Manns, Wikström, Taylor y Bremer, 2012). En H . tetrandra no se encontraron los rafidios en la madera que otros autores han descrito en especies del género como H . tubiflora y H . parasitica (Jansen et al., 2002; Koek-Noorman, 1969b).
Las especies de los otros géneros estudiados con madera tipo II se agrupan dentro de su género porque tienen atributos tanto en la madera como en la corteza que los caracterizan (Tablas 2 y 3 ). Esto no ocurre con Psychotria , porque las especies estudiadas no se constituyen en un solo grupo, asociándose a los géneros Deppea , Hamelia , Omiltemia y Syringantha (Hamelieae) y a una especie de Bouvardia , géneros con los que tiene similitud en la longitud y diámetro de los elementos de vaso, la longitud y diámetro del lumen de la fibra, así como en las características de los radios (número/mm, altura y anchura); además de que algunas especies de Psychotria llegan a presentar rafidios y endodermis en la corteza. Posiblemente esta similitud en los caracteres cuantitativos de algunos miembros de Psychotria esté asociada a que tienen una forma de crecimiento similar a la de los géneros de Hamelieae mencionados y a B.ternifolia .
El grupo con madera tipo I conjunta a las especies de Arachnothryx , Chione , Exostema , Hintonia y Randia , cuya similitud es resultado de presentar los caracteres propios de este tipo de madera: fibrotraqueidas, vasos en su mayoría solitarios y parénquima apotraqueal en agregados. Además, las especies de este grupo tienden a presentar en la corteza los radios de moderada a fuertemente dilatados y 1-4 (8) bandas de esclereidas. Este grupo, sin embargo, es muy heterogéneo y a su interior ni las especies de Exostema ni las de Randia forman un grupo. Tres especies de Randia constituyen un subgrupo (Fig. 4), que tiene en común los elementos de vaso con una longitud entre 400-600 µm, punteaduras < 3 µm, grosor de la pared de la fibra ≥ 4 µm y radios heterogéneos tipo IIA; mientras que R . capitata y R . thurberi se agrupan con E. mexicanum por tener la pared de los elementos de vasos con un espesor ≥ 3.50 µm y radios con una altura de <300 µm, pero difieren en el tipo de cristales en su corteza, ya que las especies de Randia presentan drusas y E . mexicanum cristales prismáticos. Exostema caribaeum contiene estiloides en la corteza, mientras que H . latiflora areniscas, no obstante, comparte diversos caracteres cuantitativos de la madera (Tablas 2 y 3 ).
Bouvardia es el único taxón que muestra los 2 tipos de madera, B . longiflora (madera tipo I) se clasifica en el subgénero Bouvardioides , mientras que B. ternifolia (madera tipo II) en el subgénero Bouvardia (Blackwell, 1968). Por lo anterior, sería interesante estudiar un mayor número de representantes en dichos subgéneros y evaluar el potencial taxonómico de los tipos de madera a nivel infragenérico.
Tres taxones se distinguen por la combinación única de caracteres anatómicos y no se incluyen con las especies de alguno de los grupos (A o B). Estas 3 especies tienen madera tipo I como las del grupo B, pero a diferencia de estas, los radios son paedomórficos; además, B . longiflora presenta estiloides en la corteza, mientras que R. galeottii tiene valores similares a N . anomothyrsa en los caracteres de la madera (Tablas 2 y 3 ). Notopleura anomothyrsa es la única especie con fibrotraqueidas septadas, punteaduras intervasculares escalariformes y rafidios en la corteza y en la madera. Esta combinación de caracteres solo es distintiva entre las especies estudiadas, sino que incluso no se había descrito para otras Rubiaceae (Jansen et al., 1997; Jansen et al., 2001; Jansen et al., 2002).
Anatomía-ecológica
La mayoría de las especies que tienen madera tipo II son arbustos de 1-3 m o árboles de porte bajo < 4 m (H . xorullensis , P . flava , P. microdon y P . tetragona ), que se distribuyen, principalmente en el bosque mesófilo, bosque de pino-encino, selva alta perennifolia y selva mediana perennifolia, como elementos del sotobosque y, generalmente son especies perennifolias. En consecuencia, la mayoría exhibe porosidad difusa, probablemente debido a que no existe la estacionalidad y el fotoperiodo es poco variable en los sitios en los que se distribuyen, por lo que la distribución de los vasos no se afecta. La mayoría de las especies muestran maderas mesomórficas, porque los vasos tienen un índice de agrupamiento bajo, diámetro estrecho (< 30 µm) y una densidad elevada (> 110 vasos/mm2). En contraste, las especies del género Hamelia con distribución en ambientes más estacionales y con hojas deciduas tienen anillos de crecimiento marcados por diferencias en el grosor de la pared de las fibras y porosidad semianular (H . versicolor ), vasos con diámetros > 50 µm y una densidad < 60 vasos/mm2, como también es el caso de P. tetragona y P. simiarum . Syringantha coulteri es un árbol perennifolio que se desarrolla en matorral xerófilo que conserva las fibras libriformes y los vasos agrupados en hileras radiales de igual forma que las especies que se distribuyen en ambientes mésicos, pero a diferencia de estas tiene una densidad promedio de 71 vasos/mm2 y un diámetro de 37 µm. En esta especie la presión del ambiente tuvo efecto en el tamaño y textura de las hojas, siendo estas de lámina reducida y coriáceas (Martínez-Cabrera et al., 2010). Otros taxones que habitan en la selva alta perennifolia y el bosque mesófilo son arbustos (1-2.5 m) y/o árboles de porte pequeño (3-10 m), como Faramea , Hillia , Hoffmannia , Omiltemia , P. faxlucens , P. flava y P . microdon , también presentan de 50-90 vasos/mm2 con un diámetro de 20-42 µm. Estos resultados difieren de la relación registrada entre el tamaño de las especies y su densidad y diámetro de vasos para otros grupos taxonómicos (Olson y Rosel, 2013; Vázquez-Sánchez y Terrazas, 2011). En el grupo con madera tipo I, la mayoría de las especies se caracterizan por presentar hábito arbóreo > 6 m en Arachnothryx , Chione , Exostema y Hintonia o arbustivo-arbóreo < 5 m en Randia . Los 2 primeros taxones con distribución en selva alta perennifolia y los últimos en selva baja caducifolia; Exostema y Hintonia ocupando el dosel, mientras que las especies estudiadas de Randia forman parte del sotobosque y estrato medio, en este tipo de vegetación y con menos frecuencia en la selva alta perennifolia, sugiriendo que el hábito y las condiciones de sequía estacional favorecen la presencia de porosidad semianular marcada, generalmente por una o 2 hileras de vasos de mayor diámetro (31-45 µm) con vasos más estrechos en la madera tardía y densidades elevadas de vasos (> 200 vasos/mm2). El ritmo de crecimiento de la madera en este grupo de especies está asociado con su fenología, como consecuencia de las condiciones de sequía estacional, periodo que induce la pérdida de hojas, resultando en una disminución evidente del diámetro tanto de los vasos como de las fibrotraqueidas. Dickison (2000) refiere que las especies con distribución en ambientes secos o xéricos tienden a presentar elementos de vaso más cortos, con diámetro tangenciales estrechos y en mayores densidades, como es el caso de las especies de Rubiaceae. Los vasos con diámetros estrechos y numerosos, seguramente posibilitan la eficiencia en la conducción de agua y evita riesgos de embolismos. Para ambos tipos de madera en Rubiaceae, la asociación negativa entre densidad y diámetro de vasos fue significativa (p < 0.0001) para los taxa estudiados, semejante al escalamiento presente en otros grupos taxonómicos (Baas, 1986).
No en todos los taxones estudiados el diámetro de los vasos parece afectarse por la disponibilidad de agua, dado que, contra lo esperado de que las especies de ambientes mésicos tuvieran diámetros mayores, mientras que las especies de ambientes secos mostraran diámetros estrechos, este no fue el caso en las especies estudiadas de Rubiaceae. Aunque también podría pensarse que las características tuvieran un componente filogenético, es decir, que sin importar la talla de las especies o el ambiente donde se distribuyen, los diámetros se correlacionaran con los grupos taxonómicos y fueran estrechos (< 40 µm) con longitud tanto en elementos de vasos como fibras de medianas a largas (> 500 µm).
Por otra parte, es notable que B . longiflora y N . anomothyrsa , con forma de crecimiento subfrutescente, presentan madera tipo I, con radios uniseriados de tipo paedomórfico y elementos de vaso y fibrotraqueidas relativamente cortas (450 µm y < 700 µm). Estos resultados coinciden con lo encontrado por Lens, Groeninckx, Smets y Dessein (2009), en algunos taxones subfrutescentes de Spermacoceae-Knoxieae (por ejemplo Spermacoce , Otomeria , Pentas y Phyllopentas ). La presencia de radios también paedomórficos en Hoffmannia , Plocaniophyllon y Pinarophyllon , con madera tipo II, sugiere que este tipo de radios aparecieron en forma independiente en diferentes linajes de la familia, probablemente asociado al cambio en la forma de crecimiento.
Las fibras libriformes septadas en el grupo A, con madera tipo II, y las fibrotraqueidas septadas de N . anomothyrsa , con madera tipo I, se relacionan con la escasez de parénquima axial, por lo que estas fibras cumplen no solo con la función de proporcionar sostén, sino también de ser las que almacenan y movilizan almidones, principalmente. De igual forma, el escalamiento positivo de la longitud de los elementos de vaso y las fibras fue significativo para las especies de Rubiaceae estudiadas como en otras familias (Chattaway, 1936; Vázquez-Sánchez y Terrazas, 2011). Es de llamar la atención que la endodermis se mantenga en todos los miembros de Hamelieae, a pesar de alcanzar diámetros ≥ 5 cm, lo que sugiere que la endodermis continúa activa, teniendo divisiones anticlinales a medida que el diámetro del tallo se incrementa. No es así en otros taxones, como Psychotria , donde solo se conserva en especies con diámetros menores a 3 cm.
En este trabajo se reconoce que los 2 tipos de madera en Rubiaceae (I y II) están asociados a un tipo diferente de corteza. Además, la presencia de anillos de crecimiento se relaciona con el tipo de vegetación donde se distribuyen las especies, pero ni la densidad, ni el diámetro de los vasos o la longitud de fibras y elementos de vaso están asociados a la talla de los individuos.
Se reconoce que las características anatómicas de la madera y la corteza pueden tener importancia taxonómica en algunos casos y a diferente nivel jerárquico (por ejemplo, los integrantes de los géneros Deppea , Hamelia , Hoffmania y Omiltemia tienen características distintivas que permiten reconocerlos; los subgéneros de Bouvardia difieren entre sí), pero este no es siempre el caso (por ejemplo, los grupos I y II no se correlacionan con las subfamilias de Rubiaceae, pues Hamelieae y Hillieae son representantes ajenos a la subfamilia Rubioideae y también tienen madera tipo II).











 nova página do texto(beta)
nova página do texto(beta)