Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de biodiversidad
versión On-line ISSN 2007-8706versión impresa ISSN 1870-3453
Rev. Mex. Biodiv. vol.83 no.2 México jun. 2012
Ecología
Composición y abundancia del banco de semillas en una región semiárida del trópico mexicano: patrones de variación espacial y temporal
Composition and abundance of the seed bank in a semiaridregion in tropical Mexico: spatial and temporal patterns
Adriana Cano–Salgado1*, José Alejandro Zavala–Hurtado1, Alma Orozco–Segovia2, María Teresa Valverde–Valdés3 y Paulino Pérez–Rodríguez4
1 Departamento de Biología, Universidad Autónoma Metropolitana, Unidad Iztapalapa. Av. San Rafael Atlixco 186, Col. Vicentina 09340 México, D. F., México. *adycan@yahoo.com.
2 Laboratorio de Ecología Funcional del Instituto de Ecología, Universidad Nacional Autónoma de México. 70–275, Ciudad Universitaria 04510 México, D. F., México.
3 Departamento de Ecología y Recursos Naturales. Facultad de Ciencias, Universidad Nacional Autónoma de México. Circuito Exterior s/n, Ciudad Universitaria 04510 México D. F., México.
4 Programa de Estadística, Colegio de Postgraduados. Carretera México–Texcoco, Km 36.5. Montecillo 56230 Texcoco, Estado de México, México.
Recibido: 26 octubre 2010
Aceptado: 10 noviembre 2011
Resumen
Se estudió la estructura del banco de semillas en el valle semiárido de Zapotitlán, Puebla. El registro de la composición y abundancia del banco de semillas se realizó en 2 tipos de vegetación (tetechera y matorral espinoso) en los microhábitats (bajo arbustos, espacio abierto y basureros de la hormiga granívora Pogonomyrmex barbatus). Las semillas se recolectaron en las épocas de secas, lluvias y finales de lluvias durante 2 años. No se encontraron diferencias en la densidad de semillas entre las épocas y años, pero sí hubo diferencias entre los microhábitats evaluados. El microhábitat del hormiguero presentó la mayor abundancia de semillas, lo que resalta la importancia de las hormigas en la conformación espacial de la estructura de las comunidades en estos ecosistemas. Se registraron semillas de 38 especies de plantas. La densidad promedio varió de 23 800 a 28 000 semillas m–2, concordando con otros registros de regiones semiáridas y áridas. Las especies más frecuentes fueron las anuales Eragrostis mexicana, Bouteloua barbata, Kallstroemia rosei y Portulaca pilosa. Los resultados muestran que la heterogeneidad de sitios y de microhábitats en esta zona es alta. Es necesaria la realización de más estudios sobre patrones espacio–temporales en los bancos de semillas y su relación con la vegetación en pie en zonas áridas y semiáridas en México.
Palabras clave: dinámica de comunidades, ecosistemas áridos, microhábitat, lluvia de semillas.
Abstract
The seed bank structure in the semiarid valley of Zapotitlán, Puebla was studied. The record of the composition and abundance of the seed bank was conducted in 2 types of vegetation (tetechera and thorny scrub) in the microhabitats (under shrubs, open space and refuse– dumps of granivorous ants Pogonomyrmex barbatus). Seed collection was carried out in dry, rainy and late rainy seasons for 2 years. There were no differences in seed density between seasons and years, but there were differences between microhabitats evaluated. The microhabitat of the ant refuse–dumps had the highest abundance of seeds, which highlights the importance of ants in the spatial conformation of the structure of communities in these ecosystems. Seeds of 38 species of plants were recorded. The average density ranged from 23 800 to 28 000 seeds m–2, consistent with other reports for arid and semiarid regions. The most frequent species were the annual Eragrostis mexicana, Bouteloua barbata, Kallstroemia rosei and Portulaca pilosa. Results show that this area had a high heterogeneity at site and microhabitat level. It is necessary to conduct more studies on spatio–temporal patterns in seed banks and their relationship with the standing vegetation in arid and semiarid areas in Mexico.
Key words: dynamics of communities, arid ecosystems, microhabitat, seed rain.
Introducción
Un banco de semillas es una agregación de semillas que aún no germinan; potencialmente, son capaces de establecerse y formar parte de la vegetación en pie. Las semillas que lo constituyen forman una población con "memoria" de las condiciones selectivas que predominaron en el pasado así como las condiciones más recientes (Baker, 1989). Asimismo, este banco preserva la variabilidad genética y permite que las poblaciones de plantas resistan periodos adversos y persistan en el tiempo y en el espacio dependiendo del tamaño y duración de su banco de semillas (Harper, 1977; Templeton y Levin, 1979; Thompson y Grime, 1979), ya que la estructura del banco de semillas se verá favorecida por la presencia y producción de las especies de la comunidad vegetal anterior y presente, así como de la longevidad de las semillas en las condiciones locales (López–Mariño et al., 2000; Marone et al., 2000).
Se ha observado que la composición y abundancia de los bancos de semillas varían tanto espacial como temporalmente (Caballero et al., 2005) y están relacionadas con los diferentes microhábitats que se encuentran en un tipo de vegetación en particular. Así, la densidad de semillas varía marcadamente entre microhábitats, y el número de semillas que se encuentra en depresiones naturales del suelo, bajo árboles y arbustos altos es mayor que en áreas abiertas (Marone et al., 2004). Además, los efectos biológicos de los microhábitats, como aquellos derivados del transporte y acumulación selectiva en el suelo de ingenieros ecológicos, como las hormigas, pueden tener un significado clave en la regeneración de la vegetación y en la permanencia de las especies en las comunidades por largo tiempo (Shmida y Whittaker, 1981; Thompson, 1987; Warr et al., 1994; Bekker et al., 1997; Kalamees y Zobel, 2002; Devlaeminck et al., 2005). Estos efectos biológicos, aunados a variaciones estacionales y aleatorias (disturbios) de factores del medioambiente, estarían cercanamente relacionados con los patrones de variación temporal en los bancos de semillas registrados en diferentes estudios (Pablo, 2003). Aun así, los bancos de semillas desempeñan un papel crucial debido a que pueden conferir estabilidad y persistencia a largo plazo.
En México, más del 50% del territorio comprende zonas áridas y semiáridas, principalmente en el norte del país, aunque existen regiones semiáridas intertropicales cuya diversidad biológica es comparable a la que presentan algunas zonas del norte de México (Valiente, 1996). Dentro del trópico mexicano, el valle de Tehuacán, ubicado en la región árida intertropical de Tehuacán–Cuicatlán de los estados de Puebla y Oaxaca, se considera un ecosistema semiárido muy importante, entre otras razones, por ser un centro de evolución de la flora semiárida con alrededor de 22% de especies endémicas (Dávila et al., 1993).
A pesar de que algunos de los ecosistemas semiáridos del centro de México cuentan con regiones con altos niveles de endemismo, y aun sabiéndose que los bancos de semillas son importantes para entender la organización, dinámica y manejo de las comunidades vegetales naturales, los estudios para conocer la estructura de los bancos son muy pocos.
En el presente trabajo se presentan los resultados de una investigación cuyos objetivos principales fueron analizar la estructura espacial y temporal del banco de semillas (composición y abundancia) en 3 microhábitats diferentes en 2 tipos de vegetación del valle semiárido de Zapotitlán.
Relacionadas con estos objetivos están las siguientes preguntas: ¿Los bancos de semillas en los diferentes tipos de vegetación en el valle de Zapotitlán tienen estructura similar (composición de especies y densidad de semillas) en los diferentes microhábitats que se encuentran en esos tipos de vegetación? ¿La temporalidad en estos ecosistemas influye en la densidad del banco de semillas y en la permanencia de las especies? ¿Cuál es el papel de la heterogeneidad microambiental en la composición y abundancia del banco de semillas?
Materiales y métodos
El área de estudio se localiza en el valle de Zapotitlán que constituye una subcuenca ubicada en el límite suroeste del valle de Tehuacán (18°11'–18°25' N, 97°39'– 97°22' O) en el estado de Puebla, en la zona semiárida poblano–oaxaqueña situada en la sombra de lluvia de la sierra Madre Oriental (Vite et al., 1992). El valle forma parte de la cuenca alta del Papaloapan (Miranda, 1948) y se encuentra dentro de la Reserva de la Biosfera Tehuacán–Cuicatlán (INE–SEMARNAT– CONANP, 2002). El clima es cálido y semiárido, con lluvias en verano y presenta una canícula bien definida a mitad del periodo de lluvias (García, 1981). La precipitación promedio anual es de 380–400 mm y la temperatura promedio anual de 18–22 °C (Zavala–Hurtado et al., 1996). Existe una gran diversidad de afloramientos geológicos y tipos de suelo generalmente someros, pedregosos y halomórficos con diferentes niveles de alcalinidad y salinidad (Zavala–Hurtado, 1982; Osorio et al., 1996).
La vegetación corresponde al matorral xerófilo descrito por Rzedowski (1978) y presenta una gran variación, encontrándose diferentes unidades de vegetación, como son las tetecheras de Neobuxbaumia tetetzo (J.M.Coult) Backeb, los izotales de Yucca periculosa Baker o de Beaucarnea gracilis Lem, los cardonales de Cephalocereus columna–trajani (Karw. ex Pfeiff.) K. Schum, los cardonales de Stenocereus stellatus (Pfeiff.) Riccob., la selva baja espinosa perennifolia donde predomina Prosopis laevigata (Humb. et Bonpl. ex Willd.) M. C. Johnst, la selva baja caducifolia donde predominan las familias Caesalpiniaceae, Fabaceae y Mimosaceae y diversos tipos de matorrales espinosos, inermes o parvifolios–esclerófilos (Zavala–Hurtado, 1982; Villaseñor et al., 1990; Osorio et al., 1996).
Se seleccionaron 2 sitios de estudio con características contrastantes que podrían reflejarse en los patrones de sus respectivos bancos de semillas, cada uno con una unidad de vegetación reconocida para el valle de Zapotitlán (Zavala–Hurtado, 1982): 1), tetechera, definida por la predominancia de individuos de la cactácea columnar Neobuxbaumia tetetzo (J.M.Coult) Backeb., con un estrato arbustivo caracterizado por Aeschynomene compacta Rose, Mimosa luisana Brandegee, Cordia curassavica (Jacq.)Roem. et Schult., Mammillaria haageana Pfeiff., Ruellia sp y Eysenhardtia polystachya (Ortega) Sarg., entre otras y 2), matorral espinoso, caracterizado por Parkinsonia praecox (Ruiz et Pav. ex Hook) Hawkins, Prosopis laevigata (Humb. et Bonpl. ex Willd.) M. C. Johnst, Lantana sp, Agave marmorata Roezl, Gymnosperma glutinosum (Spreng.) Less., Cylindropuntia tunicata (Lehm.) F. M. Knuth y Myrtillocactus geometrizans (Mart. ex Pfeiff.) Console, entre otras. En cada sitio se eligieron 3 microhábitats: 1), espacio abierto desprovisto de vegetación; 2), bajo la copa de arbustos perennes, considerando arbustos mayores de 1 m de altura de las especies P. praecox y P. laevigata que presentan copas con estructura arquitectónica similar y 3), basureros de hormigueros de P. barbatus Smith que se encontraban lejos de los arbustos.
Para la obtención de las semillas se recolectaron 5 muestras de suelo en cada microhábitat en ambas unidades de vegetación (sitios), haciendo un total de 15 muestras por sitio. Cada una de las muestras de suelo consistió en 10 submuestras. La recolección de las submuestras se hizo considerando un punto central en cada microhábitat, a partir del cual se trazaron 10 radios de 50 cm cada uno. En el extremo distal de cada radio se tomó una submuestra de suelo con un nucleador de 4 cm de diámetro × 2 cm de profundidad que abarca el estrato donde se encuentra la mayoría de las semillas en el suelo de este tipo de ecosistemas (Guo et al., 1998).
Se pesaron 50 g de cada muestra de suelo recolectada, se secaron a la sombra y fueron procesadas utilizando la técnica del conteo directo de Simpson et al. (1989), que utiliza métodos de separación como flotación y tamizado, para determinar posteriormente el número total de semillas en el suelo, separadas por estos procedimientos.
Antes de tamizar las muestras se removieron los fragmentos de plantas y piedras. El tamizado se realizó usando 4 tamices (mallas de 1 mm, 0.850 mm, 0.425 mm, y 0.180 mm) que permitieran retener semillas de plantas anuales y perennes del banco. La fracción recolectada en cada uno de los diferentes tamices se observó en el microscopio estereoscópico y se separaron las semillas. La viabilidad de las semillas se determinó considerando lo propuesto por Moriuchi et al. (2000), que consiste en cortar las semillas por la mitad para observar si presentan un endospermo aceitoso o picarlas con unas pinzas para determinar la consistencia carnosa. Sólo las semillas viables fueron consideradas para determinar la densidad de semillas del banco. La identificación se llevó a cabo mediante el uso de un banco de semillas de referencia, el cual consistió en semillas recolectadas de especies previamente identificadas en cada uno de los sitios de estudio. Las muestras de suelo fueron tomadas en 3 épocas del año durante 2 años: a mitad de la época de secas (abril 2006, y abril 2007), a mitad de la época de lluvias (julio 2006, julio 2007) y en la etapa de finales de lluvias (octubre 2006 y octubre 2007).
Los datos de densidad de semillas (número de semillas m–2) fueron analizados utilizando modelos lineales generalizados (Nelder y Wedderburn, 1972). Se utilizó la distribución binomial negativa, que con frecuencia se emplea para modelar datos de conteos, como es éste el caso. Se consideraron como factores que afectan la densidad de semillas el año (variable categórica con 2 clases), la época (variable categórica con 3 clases), el sitio (unidades de vegetación, variable categórica con 2 clases) y el microhábitat (variable categórica con 3 clases), así como las interacciones entre éstos.
El modelo lineal generalizado consta de un componente aleatorio; en este caso se considera que la distribución de frecuencias de las densidades de semillas puede aproximarse por la distribución binomial negativa; un componente sistemático relacionado con un predictor lineal que, por ser de naturaleza nominal, incorpora el efecto de año, época, sitio y microhábitats al modelo mediante el uso de variables indicadoras (dummy), y una función enlace (en este caso una función logit) que relaciona el predictor lineal con la media del componente aleatorio. El modelo fue ajustado mediante el procedimiento GENMOD incluido en SAS/STAT versión 9.1.3 del paquete estadístico SAS para Windows. La bondad de ajuste de las distribuciones propuestas para modelar la densidad de semillas fue evaluada con la devianza del modelo (Nelder y Wedderburn, 1972; Dobson, 2002).
Para probar la existencia de diferencias significativas entre las densidades de semillas de los 2 sitios (tetechera y matorral espinoso) se usó la prueba no paramétrica de Kruskal–Wallis; también se hicieron gráficas de cajas y bigotes para explorar las diferencias en las distribuciones de las densidades de semillas. Los nombres y autores de las especies fueron validados en Tropicos.org.Missouri Botanical Garden (http://www.tropicos.org; 13.IX.2011).
Resultados
En el banco se encontraron semillas de plantas pertenecientes a 14 familias. La familia Poaceae presentó el mayor número de especies (51.6%), todas anuales, seguida de Cactaceae (21.6%), Fabaceae (14.7%), Asteraceae (13.1%), Zygophyllaceae (8.3%), Portulacaceae (8.3 %), Convolvulaceae (7.2%), Euphorbiaceae (1.6%), Mimosaceae (1.1%), Malphigiaceae (1.1%), Verbenaceae (1.1%), Malvaceae (0.5%) y Nyctiginaceae (0.5%). El 24.9% fueron especies que no pudieron identificarse y que aquí se reconocen como morfoespecies.
El banco de semillas se conformó por 33 especies propiamente identificadas, 1 que fue identificada a género y 4 que no pudieron identificarse y sólo se diferenciaron por su morfología (Cuadro 1), lo que hace un total de 38. De las especies anuales, las más frecuentes fueron Eragrostis mexicana, la cual representó el 40% del banco de semillas, Bouteloua barbata (11.66%), Kallstroemia rosei (8.3%) y Portulaca pilosa (8.3%). De las especies perennes las más frecuentes fueron: la morfoespecie 1 (15%), Myrtillocactus geometrizans (8.8 %) e Ipomoea arborescens (7.2%).
En el sitio dominado por la unidad de vegetación matorral, el microhábitat que presentó el mayor registro fue el hormiguero con 16 especies. En los otros 2 microhábitats la riqueza de especies fue menor, con 10 especies bajo la copa de arbustos y 8 en espacio abierto. Destaca la anual E. mexicana en los 3 microhábitats, bajo la copa de arbustos, hormiguero y espacio abierto, con frecuencias del 80, 50 y 40%, respectivamente.
En la unidad de vegetación de tetechera, el microhábitat hormiguero presentó el más alto número de especies (24); los microhábitats espacio abierto y bajo copa de arbustos presentaron 16 especies cada uno. La anual E. mexicana dominó en espacio abierto y 2 especies no identificadas, morfoespecie 1 y morfoespecie 3, con frecuencias de 50 y 30% respectivamente, dominaron en el microhábitat bajo copa de arbustos.
El total de la densidad registrada para los 2 años de evaluación fue de 52 026 semillas m–2; en el primer año se encontraron 28 050 semillas m–2 y en el segundo 23 976 semillas m–2. La densidad de semillas total para las 3 épocas durante los 2 años de evaluación fue de 19 349 semillas m–2 en la época de secas, 13 198 semillas m–2 en la de lluvias y 19 479 semillas m–2 en la de finales de lluvia. Estas cantidades se encuentran desglosadas por época, microhábitat y sitio en la figura 1, donde se observa claramente que hay diferencias entre los totales de semillas por microhábitats y que sus densidades cambian entre sitios y dentro de sitios.
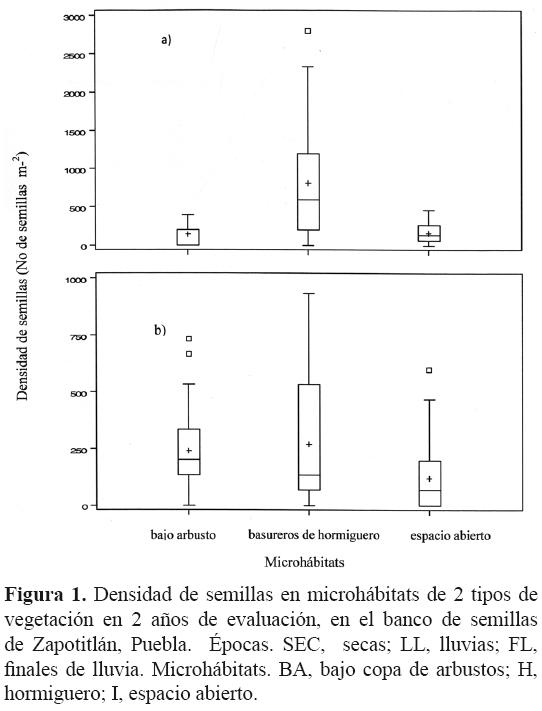
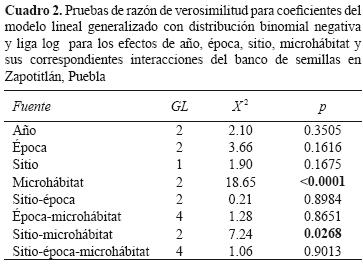
El resultado del ajuste del modelo binomial negativa para las densidades de semillas por muestra indicó que no hubo diferencias entre las 3 épocas del año y entre años (p = 0.1616 y p = 0.3505, respectivamente). Para el caso de los microhábitats, la densidad de semillas presentó diferencias significativas (p < 0.0001) y la interacción microhábitat–sitio también (p= 0.02); sin embargo, en las interacciones de microhábitats–época–sitio la densidad de semillas no varió significativamente (Cuadro 2).
La prueba no paramétrica de Kruskal–Wallis se utilizó para reforzar lo encontrado en relación con las diferencias entre los microhábitats de las 2 unidades de vegetación estudiadas, obteniéndose p< 0.0243 para matorral espinoso y p< 0.0001 para tetechera. La figura 2 muestra claramente estas diferencias usando un diagrama de caja y bigotes.
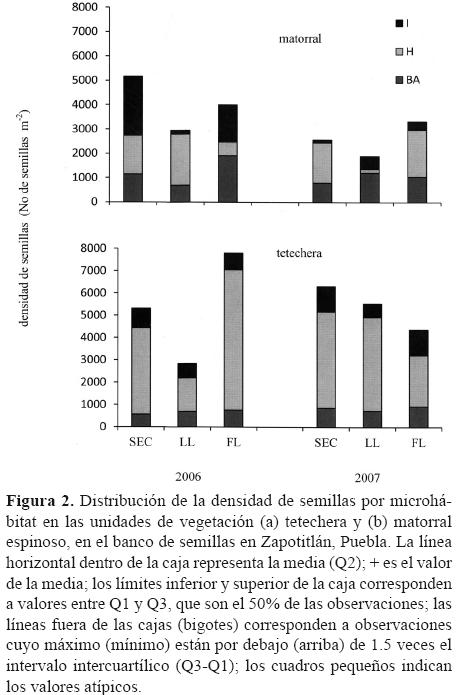
En la unidad de vegetación matorral, la densidad más alta la presentó el microhábitat hormiguero (268.06 ± 281.64 semillas m–2), seguido del microhábitat bajo copa de arbustos, cuya densidad fue de 238.36 ± 191.57 semillas m–2 y el microhábitat espacio abierto de 119.7 ± 165.31semillas m–2. Por otro lado, en tetechera, la más alta densidad media de semillas en el banco correspondió al microhábitat hormiguero con 816.06 ± 791.84 semillas m–2; para el microhábitat bajo arbusto fue de 141.40 ± 112.65 semillas m–2, mientras que en el microhábitat espacio abierto se registró una densidad media de 163.40 ± 119.24semillas m–2.
El aporte de las especies registradas al banco de semillas varió entre microhábitats y sitios. En el microhábitat hormiguero en tetechera, las especies perennes M. luisana, Senna pringlei, Cercidium praecox, I. arborescens y las morfoespecies 1 y 2 aportaron cerca del 80% de la densidad de semillas. En contraste, para el mismo microhábitat pero en el sitio matorral, las especies anuales E. mexicana y B. barbata fueron las que más contribuyeron al banco de semillas con un 57% de las semillas registradas, junto con un 19% de la especie perenne M. geometrizans. En el microhábitat bajo copa de arbustos del sitio matorral, una sola especie (la anual E. mexicana) contribuyó con el 80% del banco de semillas. Las morfoespecies 1 y 3 aportaron el 50% del total de semillas bajo copa de arbustos en tetechera. Para el espacio abierto en ambos sitios de estudio, las especies anuales aportaron la mayoría de semillas del banco; teniendo que E. mexicana contribuyó con el 78% en matorral, mientras que en tetechera, P. pilosa, E. mexicana y K. rosei aportaron el 48%.
Discusión
De las 38 especies presentes en el banco de semillas destacan por su prevalencia las anuales E. mexicana, B. barbata, K. rosei y P. pilosa, que en conjunto representaron el 75.8% de frecuencia .Esto concuerda con lo mencionado por Kemp (1989), quien anota que más del 40% de la flora de los ecosistemas desérticos la constituyen especies anuales (efímeras), además de que dominan los bancos de semillas en relación con su diversidad de especies, número y biomasa (Brown et al., 1979).
La mayoría de las muestras de vegetación incluyen un mosaico complejo de microhábitats que se forman de factores como variaciones edáficas, interacciones entre microtopografía y clima, depredación–selectiva, perturbación local del suelo y redistribución de nutrientes por animales (Zavala–Hurtado, 1982). Esta heterogeneidad se refleja en las diferencias encontradas entre sitios y microhábitats en este estudio.
Algunas de las especies que conformaron el banco de semillas sólo se presentaron en una de las 3 épocas del año. En su mayoría fueron perennes (7 de la familia Cactaceae, 2 Fabaceae, 1 Mimosaceae y 1 Euphorbiaceae) y sólo 1 especie anual. Las anuales, a excepción de Allionia incarnata, persistieron en las 3 épocas del año. Esta prevalencia temporal puede deberse a que las anuales se adaptan más fácilmente a las fluctuaciones temporales que se dan entre épocas en los diferentes microambientes a través de los años (Shmida y Whittaker, 1981).
Caballero et al. (2005) observaron que los cambios temporales en los bancos de semillas pueden afectarlos, sobre todo en su estructura espacial. Facelli et al. (2005) encontraron diferencias en la densidad de semillas entre épocas y años, como también lo anota Kemp (1989). En contraste, los resultados de este trabajo mostraron que la densidad de semillas entre las épocas de los años evaluados no varió significativamente, aunque en este caso los resultados en cuanto a microhábitats sí concuerdan con una alta variabilidad espacial. Los patrones que aquí se registran constituyen una primera aproximación al conocimiento de la estructura y dinámica de bancos de semillas de zonas semiáridas intertropicales en México, que requiere de estudios más amplios para abarcar un mayor ámbito de variabilidad espacial y temporal en la región.
Aunque se han realizado varios trabajos en desiertos extra tropicales, éste es el primero donde se registra una estimación de la densidad en el banco de semillas de una zona árida intertropical. En esos trabajos se ha encontrado una gran variabilidad en la densidad de semillas, que en el desierto de Sonora va desde 400 o 33 000 semillas m–2 (Kemp, 1989; Guo et al., 1999, respectivamente) hasta 106 000 semillas m–2 en el desierto de Mojave en California (Price y Joyner, 1997), en Norteamérica. En los desiertos de Sudamérica se tienen registros que van de 1150 a 42 000 semillas m–2 de los desiertos de Prepuna, Bolivia y el matorral espinoso chileno, respectivamente (Pablo, 2003; Gutiérrez et al., 1997). Asimismo, Kemp (1989) informó que en una región del desierto de New South Wales, Australia, las densidades de semillas fueron extremadamente altas (83 000 semillas m–2).
La densidad estimada del banco de semillas de la región semiárida de Zapotitlán, México que fue de 23 000 y 28 000 semillas m–2 para los años 2006 y 2007, respectivamente, estuvo dentro del intervalo de densidades de semillas en otros desiertos. Esta alta variabilidad parece depender, al menos parcialmente, de la época del año en que se realizaron las colectas (Pablo, 2003) y una muy alta heterogeneidad ambiental (Marone et al., 2004).
El método de conteo directo utilizado permitió una estimación total del banco de semillas (Gibson, 2002), no sesgada por la presencia de semillas latentes, sobre todo de especies anuales en el banco (Rivas–Arancibia et al., 2006) que no podrían haber sido cuantificadas con métodos basados en la germinación de semillas en muestras del suelo (Gross y Renner, 1989).
Las diferencias entre los microhábitats espacio abierto, bajo copa de arbustos y en basureros de hormigas granívoras, coinciden con estudios realizados en los desiertos de Sonora, Monte, Chihuahua y Chile Central (Marone y Horno, 1997; Guo, 1998; Pablo, 2003). Entonces, los patrones de composición y abundancia en los bancos de semillas se podrían explicar por una combinación de variabilidad espacial y temporal del medioambiente y las respuestas específicas de las especies a esta variabilidad (Guo, 1998).
La mayor concentración de semillas se registró en el microhábitat hormiguero, lo que claramente mostró que la depredación de semillas por hormigas de la especie P. barbatus aporta a éste una mayor cantidad de elementos en comparación con los microhábitats bajo arbusto y espacio abierto, por lo que esta hormiga puede considerarse como un ingeniero ecológico con un papel importante en la determinación de los patrones de distribución de las especies vegetales (Zavala–Hurtado et al., 2000).
Las hormigas tienen una capacidad de recolección de semillas muy eficiente, ya que pueden cosechar cerca de 25 kg en muy pocas horas, tan solo recogiendo las semillas de la superficie del suelo y no las enterradas (Gutterman, 1994). Se ha visto que las hormigas cosechadoras prefieren semillas de parches con densidades altas; además, a veces remueven semillas de la planta madre una vez que caen al suelo, tomando el papel de forrajeras de senderos de semillas, por lo que las tasas de descubrimiento y remoción pueden ser muy altas cerca de los senderos (MacMahon et al., 2000). En lo que se refiere a la densidad de semillas en el microhábitat hormiguero, otra observación fue la preferencia que los individuos de P. barbatus muestran por las semillas de algunas especies, ya que en este microhábitat se registró la mayor abundancia de semillas y también la mayor cantidad de especies en el banco. Se encontró que P. barbatus recoje preferentemente semillas pequeñas y abundantes de algunas especies anuales (como las de E. mexicana, K. rosei y P. pilosa) y de la familia Cactaceae (M. geometrizans y M. haageana, entre otras). Estos resultados concuerdan con los de otros estudios donde se muestra que las Pogonomyrmex spp. no sólo colectan semillas de una amplia variedad de especies (MacMahon et al, 2000), también pueden tener preferencias por especies anuales, como B. barbata (Whitford, 1978), probablemente en relación con cuestiones de costo–beneficio bajo diferentes condiciones medioambientales.
En el caso del microhábitat bajo arbustos en el matorral espinoso, se observó que sólo una especie (anual) fue la que aportó la mayor cantidad de semillas de las 38 especies identificadas en el banco de semillas. Estos resultados coinciden con los de Tielbörger y Kadmon (1997), quienes encontraron que solamente una especie fue consecuente en abundancia bajo arbustos. Sin embargo, en general las especies anuales conjuntamente aportaron la mayor densidad de semillas al banco en este microhábitat. Tielbörger y Kadmon (2000) registraron densidades promedio de plantas anuales que fueron significativamente más altas bajo arbustos que en espacios abiertos. Los arbustos constituyen trampas de semillas, interceptando aquellas dispersadas por viento, escurrimiento superficial o por animales que llegan a estas plantas con fines diferentes (protección, descanso, etc.). Las características de las semillas de estas plantas facilitan que sean enterradas por la misma hojarasca bajo la copa del arbusto, escapando de los depredadores y siendo protegidas por la sombra de viento del arbusto (Brown et al., 1979), incorporándose al banco de semillas y permaneciendo ahí hasta que las condiciones para su germinación sean favorables. Por otra parte, el que en el microhábitat bajo arbusto la abundancia de semillas sea menor que en el microhábitat hormiguero se podría deber a efectos negativos de los arbustos sobre la capacidad de establecimiento de plantas, principalmente debido a la densa capa superior del suelo y al dosel, lo cual ocasiona una disminución de la luz y la temperatura, provocando que algunas especies encontradas en el banco de semillas pierdan su viabilidad (Yuet al., 2008). En la tetechera ocurrió algo similar, sólo 2 especies, las cuales no pudieron ser identificadas, aportaron el 50% de la cantidad de semillas en el banco.
En relación con el microhábitat espacio abierto, la cantidad de semillas encontradas en el banco fue muy contrastante entre los sitios, ya que en tetechera la densidad registrada fue más alta que en matorral espinoso. Estas diferencias podrían explicarse por las características del suelo entre los sitios que habrían propiciado la permanencia o no de las semillas. El suelo en la tetechera, de textura migajón–arcilloso con superficie pedregosa y accidentada, permitiría que semillas de tamaño más pequeño, como las de plantas anuales, se acumulen en las depresiones en estos terrenos accidentados, también por la fracción de arcilla que presenta este suelo. Esta heterogeneidad microtopográfica sería decisiva para determinar la distribución espacial de las semillas (Reichman, 1984). En el matorral espinoso, el suelo es poco profundo y poco pedregoso, con textura de tipo migajón–limoso. Así, el suelo de este sitio estaría más expuesto a agentes como viento y agua, por lo que semillas de tamaño pequeño podrían tener más opciones de dispersión (transporte horizontal de semillas) o de acumulación en las depresiones formadas por los agentes mencionados anteriormente.
Al igual que otros ecosistemas de este tipo, la zona semiárida intertropical del valle de Zapotitlán, Salinas muestra una alta heterogeneidad en cuanto a sitio y microhábitat que se refleja en los patrones de las semillas en el banco. El microhábitat hormiguero fue el que más aportó al banco de semillas en cuanto a la densidad, pero no ocurrió así en lo que respecta a la composición de especies, debido a la preferencia de P. barbatus restringida a un solo tipo de especies. En los microhábitats bajo copa de arbustos y en lugar abierto, los resultados concordaron, en general, con otros estudios realizados en ecosistemas áridos, teniéndose mayores densidades de semillas bajo copa de arbustos que en lugares abiertos.
En cuanto a la composición de los bancos de semillas, se encontró que en su mayoría se componen de especies anuales; las perennes se encontraron en menor proporción.
El tamaño de los bancos de semillas en esta zona semiárida se encuentra dentro del ámbito de variación de otras regiones semiáridas y áridas del mundo, tanto a escala de hábitat como de microhábitat. Sin embargo, en relación con lo registrado en otras regiones, en Zapotitlán no se observó un efecto significativo de las épocas y de los años en el aumento o disminución de semillas.
Este primer trabajo sobre los patrones espaciales y temporales de la estructura de los bancos de semillas en una zona árida intertropical constituye una aproximación para entender la dinámica de comunidades y metacomunidades en estos ecosistemas. El estudio de los procesos que influyen en estos patrones debe basarse en el análisis comparativo y experimental de los diferentes niveles de resolución espacial y temporal en los ensambles dinámicos de bancos de semillas y su relación con la vegetación en pie.
Agradecimientos
El Consejo Nacional de Ciencia y Tecnología de México (CONACYT) otorgó una beca (número de registro 152622) a la primera autora para la realización de su tesis doctoral en el Programa de Doctorado en Ciencias Biológicas de la Universidad Autónoma Metropolitana, dentro del proyecto divisional de CBS de "Dinámica de comunidades de plantas anuales en una región semiárida del trópico mexicano". Agradecemos el apoyo proporcionado por la Dra. Sombra Rivas Arancibia, la M. en C. Monserrat Jiménez y el señor Pedro Miranda Pacheco, por su colaboración en la recolección de semillas para el banco de referencia; a la M. en C. Mariana Rojas Aréchiga, por su aportación de especies de cactáceas al banco de referencia; al Biól. Jerónimo Reyes Santiago y a la Biól. Reyna Cerón, quienes ayudaron en la identificación de algunas de las especies.
Literatura citada
Baker, H. 1989. Some aspects of the natural history of seed banks. In Ecology of soil seed banks, M. A. Leck, V. T. Parker y R. L. Simpson (eds.). Academic, New York. p. 257–282. [ Links ]
Bekker, R. M., G. L.Verweij, R. E. N. Smith, R. Reine, J. P. Bekkery y S. Schneider. 1997. Soil seed banks in European grasslands: does land use affect regeneration perspectives? Journal of Applied Ecology 34:1293–1310 [ Links ]
Brown, J. M., O. J. Reichman y D. W. Davidson. 1979. Granivory in desert ecosystems. Annual Review of Ecology and Systematics 10:201–27. [ Links ]
Caballero, I. J., M. Olano, A. L. Luzuriaga y A. Escudero.2005. Spatial coherence between seasonal seed banks in a semi–arid gypsum community: density changes but structure does not. Seed Science Research 15:153–160. [ Links ]
Dávila, P., J. L. Villaseñor, R. Medina, A. Ramírez, A. Salinas, G. Sánchez–Ken y J. P. Tenorio. 1993. Listados florísticos de México. X. Flora del valle de Tehuacán– Cuicatlán. Instituto de Biología, UNAM, México D. F. 195 p. [ Links ]
Devlaeminck, R., B. Bossuyt y M. Hermy. 2005. Inflow of seed through the forest Edge: evidence from seed bank and vegetation patterns. Plant Ecology 176:1–17. [ Links ]
Dobson, A. 2002.An introduction to generalized linear models, segunda edición. Chapman & Hall/ CRC, London. 240 p. [ Links ]
Facelli, J. M., P. Chesson y N. Barnes. 2005. Differences in seed biology of annual plants in arids lands: a key ingredient of the storage effect. Ecology 86:2998–3006. [ Links ]
García, E. 1981. Modificaciones al sistema climático de Köppen. Instituto de Geografía, UNAM, México, D.F. 71 p. [ Links ]
Gibson, D. J. 2002. Methods in comparative plant population ecology, Oxford University Press, New York. 344 p. [ Links ]
Gross, K. L. y K. A. Renner. 1989. A new method for estimating seed numbers in the soil. Weed Science 37:836–839. [ Links ]
Guo, Q. 1998. Microhabitat differentiation in Chihuahuan Desert plant communities. Plant Ecology 139:71–80. [ Links ]
Guo, Q., P. W. Rundel y D. W. Goodall. 1998. Horizontal and vertical distribution of desert seed banks: patterns, causes, and implications. Journal of Arid Environments 38:465–478. [ Links ]
Guo, Q., P. W. Rundel y D. W. Goodall. 1999. Structure of desert seed banks: comparisons across four North American deserts sites. Journal of Arid Environments 42:1–14. [ Links ]
Gutiérrez J. R., P. L. Meserve, S. Herrera, L. C. Contreras y F. M. Jaksic. 1997. Effects of small mammals and vertebrate predators on vegetation in the Chilean semiarid zone. Oecologia 109:398–406. [ Links ]
Gutterman, Y. 1994. Strategies of seed dispersal and germination in plants inhabiting deserts. The Botanical Review 60:374–378. [ Links ]
Harper, J. L. 1977. Population Biology of plants. Academic, London. 892p. [ Links ]
INE–SEMARNAT–CONANP (Instituto Nacional de Ecología, Secretaría del Medio Ambiente y Recursos Naturales, Comisión Nacional de Áreas Naturales Protegidas). 2002. Áreas naturales protegidas de México con decretos estatales, volumen 2. México, D.F. 400 p. [ Links ]
Kalamees, R. y M. Zobel. 2002. The role of the seed bank in gap regeneration in calcareous grassland community. Ecology 83:1017–1025. [ Links ]
Kemp, P. R. 1989. Seed banks and vegetation processes in deserts. In Ecology of soil seed banks, M. A. Leck, V. T. Parker y R. L. Simpson (eds.). Academic, New York. p. 257–282. [ Links ]
López–Mariño, A., L. E. Calabuig, F. Fillat y F. F. Bermúdez. 2000. Floristic composition of established vegetation and the soil seed bank in pasture communities under different traditional management regimes. Agriculture Ecosystems and Environment 78:273–282. [ Links ]
MacMahon, J. A., J. F. Mull y T. O. Crist. 2000. Harvester ants (Pogonomyrmex spp): Their community and ecosystems influences. Annual Review of Ecology and Systematics 31:265–91. [ Links ]
Marone, L. y M. E. Horno.1997. Seed reserves in the central Monte Desert, Argentina: implications for granivory. Journal of Arid Environments 1997:661–670. [ Links ]
Marone, L., M. E. Horno y R. González del Solar. 2000. Post–dispersal fate of seeds in the Monte desert of Argentina: patterns of germination in successive wet and dry years. Journal of Ecology 88:940–949. [ Links ]
Marone, L., V. R. Cueto, F. A. Milesi y J. López–de Casenave. 2004. Soil seed bank composition over desert microhabitats: patterns and plausible mechanisms. Canadian Journal of Botany 82:1809–1816. [ Links ]
Miranda, F. 1948. Datos sobre la vegetación de la Cuenca Alta del Papaloapan. Anales del Instituto de Biología, Universidad Nacional Autónoma de México 19:333–364. [ Links ]
Moriuchi, K. S., D. L. Venable, C. E. Pake y T. Lange. 2000. Direct measurement of the seed bank age structure of a Sonoran desert annual plant. Ecology 8:1133–1138 [ Links ]
Nelder, J. A. y R. W. M. Wedderburn. 1972. Generalized linear models. Journal of the Royal Statistical Society, series A 135:370–384. [ Links ]
Osorio, O., A. Valiente–Banuet, P. Dávila y R. Medina. 1996. Tipos de vegetación y diversidad B en el valle de Zapotitlán de las Salinas, Puebla, México. Boletín de la Sociedad Botánica de México 59:35–58. [ Links ]
Pablo, L, R. 2003. Soil seed banks in the semi–arid prepuna of Bolivia. Plant Ecology 168:85–92. [ Links ]
Price, M. V. y J. W. Joyner. 1997. What resources are available to desert granivores: seed rain or soil seed bank? Ecology 78:764–773. [ Links ]
Reichman, O. J. 1984. Spatial and temporal variation of seed distributions in Sonoran desert soils. Journal of Biogeography 11:1–11. [ Links ]
Rivas–Arancibia, S. P., C. Montaña , J. X. Velazco–Hernández y J. A. Zavala–Hurtado. 2006. Germination responses of annual plants to substrate type, rainfall, and temperature in a semi–arid inter–tropical region in Mexico. Journal of Arid Environments 67:416–427 [ Links ]
Rzedowski, J. 1978. Vegetación de México. Limusa, México, D. F. 432 p. [ Links ]
SAS Institute (Business Analytics software). 2004. SAS/STAT® 9.1 user's guide. SAS Institute, Cary, North Carolina. [ Links ]
Shmida, A. y R. H. Whittaker. 1981. Pattern and biological microsite effects in two shrub communities, southern California. Ecology 62:234–251. [ Links ]
Simpson, R. L., M. A. Leck y V. T. Parker. 1989. Seed banks: general concepts and methodological issues. In Ecology of soil seed banks. M. A. Leck, V. T. Parker y R. L. Simpson (eds.). Academic, New York, p. 3–8. [ Links ]
Templeton, A. R. y D. A. Levin. 1979. Evolutionary consequences of seed pools. American Naturalist 114:232–249. [ Links ]
Thompson, K. 1987. Seed and seed Banks. New Phytologist 106:23–34 [ Links ]
Thompson, K. y J. P. Grime. 1979. Seasonal variation in the seed banks of herbaceous species in ten contrasting habitats. Journal of Ecology 67:893–921. [ Links ]
Tielbörger, K. y R. Kadmon. 1997. Relationships between shrubs and annual communities in a sandy desert ecosystem: a three–year study. Plant Ecology 130:191–201. [ Links ]
Tielbörger, K. y R. Kadmon. 2000. Indirect effects in a desert plant community: is competition among annual more intense under shrub canopies. Plant Ecology 150:53–63. [ Links ]
Valiente, A. 1996. La conservación de los desiertos: un desafío. Ocelotl. Revista Mexicana de la Conservación 4:34–37. [ Links ]
Villaseñor, J. L., P. Dávila y F. Chiang. 1990. Fitogeografía del valle de Tehuacán–Cuicatlán. Boletín de la Sociedad Botánica de México 50:135–149. [ Links ]
Vite, F., J. A. Zavala–Hurtado, M. A. Armella y M. D. García. 1992. Regionalización y caracterización macroclimática del matorral xerófilo. Superficies de respuesta a variables climáticas de once géneros de plantas característicos de este tipo de vegetación. Carta escala 1:8 000 000. Atlas Nacional de México. Instituto de Geografía, UNAM, México, D. F. [ Links ]
Warr, J. S., M. Kent y K. Thompson.1994. Seed bank composition and variability in five woodlands in south–west England. Journal of Biogeography 21:151–168. [ Links ]
Whitford, W. G. 1978. Foraging in seed–harvester ants Pogonomyrmex spp. Ecology 59:185–189. [ Links ]
Yu, S., D. Bell, M. Sternberg y P. Kutiel. 2008. The effect of microhabitats on vegetation and its relationships with seedlings and soil seed bank in a Mediterranean coastal sand dune community. Journal of Arid Environments 72:2040–2053. [ Links ]
Zavala–Hurtado, J. A. 1982. Estudios ecológicos en el valle semiárido de Zapotitlán, Puebla. I. Clasificación numérica de la vegetación basada en atributos binarios de presencia o ausencia de las especies. Biotica 7:99–120. [ Links ]
Zavala–Hurtado, J. A., P. L. Valverde, A. Díaz–Solís, F. Vite y E. Portilla. 1996. Vegetation–environment relationships based on a life forms classification in a semiarid region of tropical Mexico. Revista de Biología Tropical 44:561–570. [ Links ]
Zavala–Hurtado, J. A., P. L. Valverde, M. C. Herrera–Fuentes y A. Díaz–Solís. 2000. Influence of leaf–cutting ants (Atta mexicana) on performance and dispersion patterns of perennial desert shrubs in an inter–tropical region of Central Mexico. Journal of Arid Environments 46:93–102. [ Links ]














