Introducción
Los blanqueamientos dentales a base de peróxido de hidrógeno son el tratamiento más utilizado para modificar la apariencia de las piezas dentales de una manera conservadora. Existen dos maneras básicas para aplicar este procedimiento, uno de ellos es el uso casero a baja concentración y prolongado con uso de fundas en lapsos de tiempo diario por varias semanas, y el otro es la aplicación de agente blanqueador a alta concentración en la oficina dental por varios minutos.1 La aplicación en la oficina se puede hacer en varias sesiones y puede o no utilizarse luz para activarlos, según lo indique el fabricante, y dicho procedimiento es solicitado por los pacientes que desean resultados inmediatamente visibles o que simplemente no deseen prolongar su tratamiento por mucho tiempo.2
Existen distintos estudios que comparan los blanqueamientos de casa y oficina, así como los efectos del tipo de activación sobre las características físicas de los dientes. Algunos investigadores reportan disminución en la microdureza dependiendo del tipo de fuente de luz,3 otros dicen que no hay cambios independientemente de la concentración y el tipo de luz usada para la activación.4,5
La rugosidad superficial del esmalte también ha sido estudiada, donde podemos observar que algunos autores reportan que no hay diferencia entre blanqueamientos de casa y oficina,5-7 mientras que otros reportan que los blanqueamientos de oficina causan alteraciones mayores en la topografía superficial adamantina.8
Otro grupo de estudios reporta los efectos a nivel molecular, como las variaciones en moléculas de fosfato y carbonato, con resultados contradictorios.9-15 Dichos estudios se apoyan en la espectroscopia Raman, cuyos beneficios y funcionamiento fueron descritos en una publicación anterior,16 sin embargo, pocos analizan sus espectros calculando el área bajo la curva y en vez de ello cuantifican la altura de los picos, lo cual no es recomendable ya que aporta resultados inconsistentes.
En el año 2015 se publicó un estudio16 que reportó que los peróxidos de hidrógeno y de carbamida aplicados todos los días por cuatro semanas (blanqueamiento casero) causan una disminución significativa de la molécula de fosfato, resultados coincidentes con otras publicaciones.9,12,14 Otro estudio de los mismos autores17 reportó que mientras que los blanqueamientos de oficina causaban una reducción en la molécula de carbonato, los blanqueamientos de oficina causaban un incremento de ésta.
El objetivo del presente estudio es describir el efecto de los blanqueamientos de oficina sobre la molécula de fosfato en el esmalte dental utilizando espectroscopia Raman.
Material y métodos
Este protocolo de investigación fue aprobado por la Comisión de Investigación de la Facultad de Odontología de la Universidad de Costa Rica y fue ampliamente descrito en dos publicaciones anteriores.16,17 De manera resumida, se seleccionaron 30 piezas dentales sanas extraídas por motivos ortodónticos o periodontales del banco de piezas dentales de la universidad. Las piezas fueron inspeccionadas y desinfectadas y se dividieron aleatoriamente en tres grupos experimentales de acuerdo al agente de blanqueamiento de oficina a utilizar (Cuadro I).
Para facilitar las lecturas repetitivas en el microscopio Raman, se marcó la porción más bulbosa de cada pieza dental. De esta manera se podían hacer los espectros siempre en la misma posición. Además, cada pieza recibió una codificación, de tal manera que posteriormente se pudieran realizar análisis estadísticos de medidas repetitivas y que cada pieza funcionara como su propio control. En los periodos en los que las piezas no eran blanqueadas, éstas se almacenaban en agua destilada a 32 oC.
El primer grupo experimental se trató con el agente Zoom! WhiteSpeed (Philips-EUA), el cual se fotoactivó por 15 minutos con una fuente de luz LED (420-480 nm), después de lo cual la pieza se lavó con agua destilada y se volvió a repetir el proceso. Los grupos 2 y 3 se trataron con el blanqueamiento Pola Office (SDI North América Inc.) por ocho minutos, con la diferencia de que solamente el grupo 2 se fotoactivó. Ambos grupos recibieron dos aplicaciones, al igual que el primer grupo.
Una semana después se realizó una segunda sesión de blanqueamiento, en donde únicamente se aplicó el blanqueamiento una vez.
Las lecturas con el microscopio Raman se realizaron previo a la aplicación de los blanqueamientos e inmediatamente posterior a la primera y segunda sesión de blanqueamiento. Las características del microscopio y la técnica de medición se pueden revisar en una publicación anterior.16 El operador encargado de realizar las lecturas Raman no estaba informado del tratamiento que recibió cada pieza dental.
En el procesamiento de los datos se calculó el área bajo la curva del pico de fosfato. Se realizó el test de Levene para analizar homogeneidad de varianzas y test de esfericidad de Mauchly para determinar si es posible realizar un análisis de varianza (ANOVA).
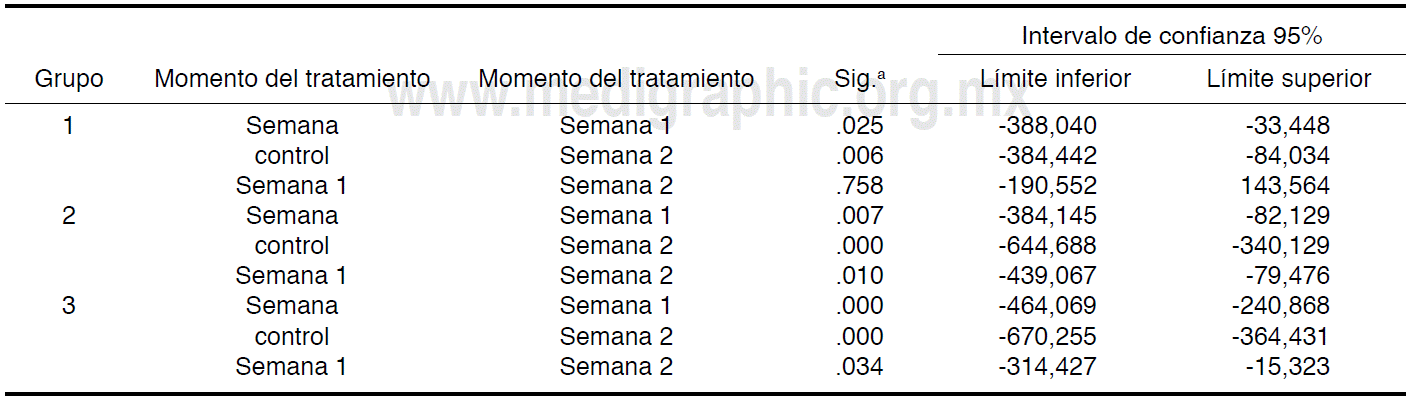
Posteriormente se realizó análisis de varianza de medidas repetitivas con el fin de analizar la variación en el contenido de fosfato a lo largo de las sesiones de blanqueamiento para cada grupo experimental. Se realizó prueba de Bonferroni para detectar diferencias estadísticamente significativas entre las sesiones.
Resultados
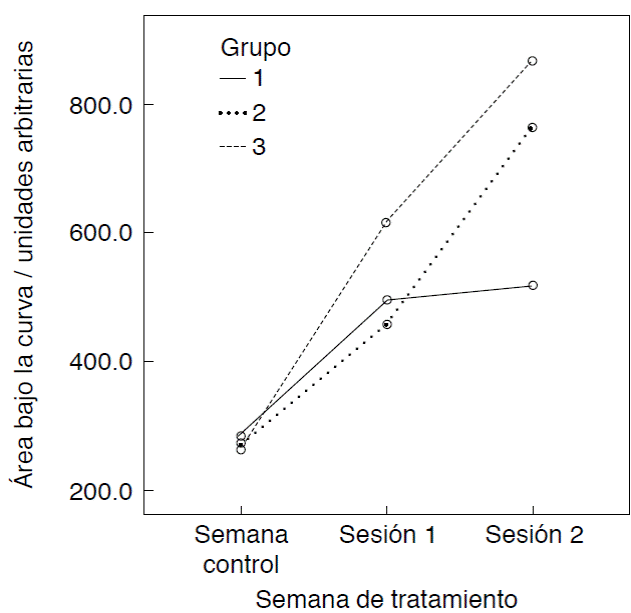
Las variaciones en la molécula de fosfato a lo largo de las sesiones de blanqueamiento se pueden observar en la Figura 1. Se puede encontrar un aumento en la molécula en los tres grupos experimentales respecto a la semana control. El aumento fue significativo (p ≤ 0.05) conforme progresaron las sesiones (Cuadro II). A la segunda sesión de blanqueamiento el aumento fue significativamente mayor para los grupos tratados con Pola Office respecto a la semana control (Cuadro III). El grupo tratado con Zoom! WhiteSpeed aumentó la concentración de fosfato significativamente luego de la primera sesión, pero no causó diferencia significativa para la segunda.
Discusión
El esmalte dental se compone en un 98% de hidroxiapatita, la cual a su vez se compone de moléculas de fosfato, hidroxilo e iones de calcio. Si el esmalte se diluye por causa de factores extrínsecos cambiará la composición de moléculas de fosfato, por lo tanto, analizar la presencia estas moléculas antes y después del tratamiento con agentes de superficie, nos ayuda a comprender el efecto químico de distintas sustancias en la integridad adamantina.
Este estudio complementa el publicado en el año 201516 en el que se observó que los blanqueamientos de uso casero, aplicados diariamente por varias semanas disminuyen la cantidad de molécula de fosfato en el esmalte dental. La presente investigación sugiere, que al contrario de los blanqueamientos caseros, los blanqueamientos de oficina que se utilizaron causan un aumento en la molécula de fosfato.
Estos resultados causan una interrogante acerca de los aditivos presentes en los geles de blanqueamiento. A pesar de que los fabricantes de ambos blanqueamientos utilizados en el presente estudio solamente reportan de manera clara como parte de su contenido agua y peróxido de hidrógeno, también se menciona que está presente algún agente desensibilizante. La composición de los agentes adicionales para reducir la sensibilidad no es clara y existe la duda de si este agente posee moléculas de fosfato que hayan podido incorporarse a la superficie estudiada.
En un estudio anterior17 se había reportado un comportamiento similar en la molécula de carbonato, donde los blanqueamientos de casa afectaban la concentración negativamente y los de oficina la aumentaban. Una posible explicación es que la aplicación de blanqueamientos por tiempo prolongado va en detrimento de la integridad adamantina si lo comparamos con blanqueamientos que se aplican en pocas sesiones y por menos tiempo, aunque tengan una mayor concentración del agente.
Además, los blanqueamientos utilizados en la presente investigación se comportaron de manera similar independientemente del uso de luz para la activación del proceso. En nuestro caso se utilizó Pola Office, indicado por el fabricante para uso con y sin lámpara LED, dando similares resultados desde el punto de vista de significancia estadística.
Los resultados de nuestro estudio no siempre son comparables con otras investigaciones revisadas, ello puede deberse a diferencias en los niveles de pH de algunos blanqueamientos, así como la composición de sus agentes desensibilizantes. Así mismo, no todos los estudios aplican los blanqueamientos de manera clínicamente relevante, ya que no todos siguen las indicaciones de los fabricantes.
Hay que recalcar que una de las limitaciones del presente estudio es la ausencia de saliva en los periodos fuera de las aplicaciones. La saliva está compuesta principalmente por agua y otros componentes como sodio, potasio, calcio, magnesio, bicarbonato, fosfatos, inmunoglobulinas, proteínas, enzimas, mucinas, urea y amonio. El pH de la saliva es aproximadamente de 6 o 7 y una de sus funciones es la de mantener el proceso de equilibrio desmineralización-remineralización.18 Attin y colaboradores discuten el impacto de utilizar saliva natural o artificial en los estudios acerca del efecto de blanqueamientos dentales sobre la microdureza del esmalte dental y concluye que los estudios que reprodujeron de mejor manera las condiciones orales presentaron resultados con menos detrimento adamantino.19
A pesar de lo anterior y debido a que la saliva natural y artificial también actuaría como una variable cuya composición exacta es desconocida, nuestro grupo de investigación decidió analizar únicamente el efecto del peróxido de hidrógeno de manera aislada.
Debido a que la composición de los blanqueamientos dentales varía entre las casas comerciales, los resultados del presente estudio solamente pueden limitarse a los agentes blanqueadores utilizados.
Dentro de las limitaciones del presente estudio in vitro se puede concluir que los blanqueamientos de oficina utilizados a base de peróxido de hidrógeno causaron un aumento significativo en la molécula de fosfato a lo largo de las sesiones de blanqueamiento. El tipo de activación utilizada (luz versus química) no causó un efecto significativo sobre el comportamiento de la molécula estudiada.











 texto en
texto en