Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias farmacéuticas
versión impresa ISSN 1870-0195
Rev. mex. cienc. farm vol.44 no.4 Ciudad de México oct./dic. 2013
Trabajo científico
Caracterización fitoquímica y la evaluación de la actividad antibacteriana in vitro de los extractos de hojas y tallos de Solanum nigrum L. que crece en Cuba
Phytochemical characterization and antibacterial activity evaluation in vitro of stems and leaves extracts of Solanum nigrum L. grown in Cuba
Lorenzo Chang H,1 América Garcia Lopez,3 Yeisa Rosabal C,2 Angel Espinosa R,1 Melquíades Ramos E,1 Harold Remon R1
1 Departamento de Ciencias Básicas, Facultad de Ciencias Técnicas, Universidad de Granma. Bayamo, Cuba
2 Empresa Nacional de Análisis y Servicios Técnicos ENAST, Laboratorios de Recursos Hidráulicos Bayamo, Granma
3 Departamento de Química Física, Facultad de Ciencias Naturales Universidad de Oriente
Correspondencia:
MSc. Lorenzo J. Chang Huerta.
Depto. de Ciencias Básicas, FCT
Universidad de Granma
Calle 3ra, entre Mártires y Bayamesa, Número 219,
Bayamo, Granma, Cuba
Teléfono. 053- 42-43-44
Correo electrónico. lchangh@udg.co.cu
Fecha de recepción: 04 de marzo de 2013.
Fecha de recepción de modificaciones: 06 de septiembre de 2013.
Fecha de aceptación: 26 de septiembre de 2013.
Resumen
La resistencia de las bacterias ha devenido problema de salud. Para verificar la acción antibacteriana de Solanum nigrum L., planta que crece en Cuba se le realizó la caracterización fitoquímico a los extractos de tallos y hojas, teniendo en cuenta la norma cubana establecida para la investigación en plantas medicinales. Se le determinó la actividad antibacteriana in vitro empleando el método de difusión en agar por diseminación superficial en disco. En la composición fitoquímica de los extractos obtenidos de las hojas y tallos de la planta de Solanum nigrum L. predominan: flavonoides, alcaloides, taninos, aminoácidos, saponinas y cumarinas. Los extractos secos de hojas y tallos, el clorofórmico de tallos y el obtenido de hojas y tallos en acetato de etilo mostraron actividad antibacteriana frente al Staphylococcus aureus (ATCC29737).
Palabras clave: Solanum nigrum L., tamizaje fitoquímico, Actividad antibacteriana, Extractos, Tinturas.
Abstract
The bacterial resistance is a health problem to every country. To verified the antibacterial activity of the Solanum nigrum L. plant that grow in our country was made the phytochemical characterization to the extracts of leaves and stems, taking into account the Cuban norm establish for the investigation in medicine plants. It was determined the antibacterial activity in vitro employing the diffusion method superficial dissemination in disc. In phytochemical composition of extracts obtained from leaves and stems of Solanum nigrum L. predominate: alkaloids, saponins, flavonoids, coumarins and tannins. The dry extracts of leaves and stems, the stems cloroformic and the obtained of leaves and stems in ethylacetate of Solanum nigrum L. showed antibacterial activity in front of Staphylococcus aureus (ATCC29737).
Key words: Tincture, Solanum nigrum L., extracts, antibacterial activity, phytochemical study.
Introducción
La resistencia de las bacterias a los antibióticos ha devenido en un grave problema de salud, tanto para los países del norte como para los del sur. Cuando se desarrollaron por primera vez, los antibióticos fueron vistos como "balas mágicas" que cambiarían radicalmente el tratamiento de la enfermedad infecciosa,1 sin embargo en la actualidad las bacterias han logrado desarrollar resistencia a los fármacos tradicionales, la producción de nuevas moléculas es lenta y ha disminuido notoriamente en los últimos años, aconteciendo casos contra los que no existe tratamiento eficaz.2
En respuesta a la necesidad de conseguir alternativas eficaces para el control de las infecciones bacterianas, se ha recurrido a la fitoquímica y fitofarmacología.3 La gran cantidad de metabolitos secundarios en las plantas ofrece una gigantesca posibilidad de hallar moléculas bioactivas con actividad biológica. Así, se acepta que sin menospreciar el avance alcanzado por la síntesis química, las plantas son consideradas la fuente principal de sustancias activas con propiedades antibacterianas, apoyado en que ellas producen cientos de miles de metabolitos secundarios y muchos pueden ser antibacterianos.4
La flora cubana posee un gran número de familias de plantas, que poseen propiedades medicinales reconocidas.5 Entre estas especies se encuentra Solanum nigrum L, conocida como hierba mora, perteneciente a la familia de las solanáceas. Puede encontrarse en todos los continentes, aunque la mayor riqueza de especies se halla en América Central y América del Sur. En Cuba se encuentra distribuida en todas las regiones del país. A esta planta se le atribuyen una serie de propiedades curativas entre las cuales sobresalen: curar los eczemas, salpullidos, pústulas de origen variado, la sarna, la tiña y otras erupciones cutáneas, en la cura de tumores inflamados y erisipelas. Se utiliza también para el dolor de oídos y de muelas, como tónico estomacal, aperitivo, febrífugo, digestivo amargo, afrodisíaco, estimulante suave, reconstituyente, sedante y expectorante.6
Investigación etnobotánica
La hierba mora sirve para curar los eczemas, salpullidos, pústulas de origen variado, la sarna, la tiña y otras erupciones cutáneas. Lo utilizan para el dolor de muelas, en gargarismo. También se utiliza como: tónico estomacal, digestivo amargo, afrodisíaco, reconstituyente, sedante y expectorante.6
En los tumores inflamados se ponen cataplasmas de las hojas con migajas de pan y miel, en las erisipelas, el zumo de las mismas con aceite violado (preparación específica que lleva en su composición la esencia de las violetas). Para el dolor de oídos, se añade en los mismos el zumo de las hojas con un aplicador.
Las hojas también son usadas como emplastos para el reumatismo y para calmar el dolor de cabeza, se aplican cataplasmas sobre la frente y sienes.6
Aplicaciones
Estudios previos realizados con esta especie le atribuyen a la misma una serie de propiedades medicinales y terapéuticas. En estudios realizados por Wang H.C.7 y col. en el 2011, concluyeron que el extracto polifenólico del S. nigrum L. es un potente agente para el tratamiento del carcinoma hepatocelular, un tipo de cáncer de rápida progresión con pobre pronóstico. En el 2010, Jeong J.B.8 y col. reportaron el efecto protector de la lunasina purificada obtenida a partir del S. nigrum L. contra el daño oxidativo del ADN. La lunasina protege ADN del daño oxidativo inducido por Fe2+ y el radical hidroxilo.
Un estudio realizado del S. nigrum L. por Gopalan H.K.9 y col. en el 2006, evaluaron los efectos antiinflamatorios, antipiréticos y antinociceptico de la planta, demostrando que el extracto soluble en lípidos posee tales propiedades, confirmando con ello lo referido por la medicina tradicional. En 2010, una investigación realizada por Parijhar S.K.10 y col. comprobaron propiedades antihistamínicas y anti-inflamatorias del extracto etanólico de hojas de la planta empleando como modelo biológico piel de pollo.
En el 2010, Rawani A.11 y col. estudiaron la actividad larvicida frente al mosquito Culex quinquefasciatus del material crudo y extractos con seis solventes de las hojas de S. nigrum L. obteniendo resultados positivos.
Teniendo en cuenta estos elementos, la especie S. nigrum L. fue sometida a un estudio dirigido a evaluar la composición fitoquímica y actividad antibacteriana de los extractos de tallos y hojas, en condiciones in vitro.
Material y métodos
El material vegetal fue recolectado el 15 mayo de 2011 a las 8:00 am en el poblado de Julia, municipio Bayamo, provincia de Granma, Cuba; incluyó hojas y tallos de S. nigrum L. Posteriormente fue clasificado con el objetivo de eliminar las partes que no reunían las condiciones para el estudio según Norma Ramal de Salud Pública (NRSP) 309 del Ministerio de Salud Pública (MINSAP).12 La planta se identificó en el departamento de Biología de la Facultad de Ciencias Agrícolas de la Universidad de Granma. Luego, fue sometida a un proceso de desinfección que consistió en lavar con agua potable y luego en una disolución de hipoclorito de sodio al 2%, asegurando de este modo la calidad del principio activo desde el punto de vista higiénico sanitario, según los parámetros establecidos por la OMS.5 El material, separado en tallos y hojas, fue secado al aire durante una semana y después a una temperatura de 60° C durante tres días en una estufa con circulación de aire marca WSU 400 de fabricación alemana. Finalmente se pulverizó el material seco utilizando un molinillo eléctrico fabricado en la Unión Soviética.
Tinturas al 20%
Las tinturas al 20% fueron obtenidas a partir de los polvos (tamaño de partícula menor de 2 mm de diámetro), utilizando una solución etanólica al 70% (v/v) en agua destilada. Se utilizaron 50 g de la materia vegetal para obtener 250 mL de tintura al 20%. El método de extracción empleado para la obtención de las tinturas fue la maceración de la materia vegetal pulverizada en zaranda según la Guía Metodológica para Investigaciones Fitoquímicas en Plantas Medicinales por el MINSAP.13 Después de realizada la extracción se filtró a presión reducida para lograr la homogeneidad y transparencia total de cada producto. El filtrado (tintura al 20%) se almacenó en frascos de color ámbar y se dejó en reposo durante 72 horas a temperaturas entre 4 y 8° C. 14
Extracto crudo etanólicos
Los extractos crudo etanólicos de las partes estudiadas de la planta fueron obtenidos a partir de las tinturas al 20% por rotoevaporación del solvente a 50° C utilizando un (Rotoevaporador IKA, RV05 Basic, Alemania), conectado a un baño con termostato (IKA, HB4, Werke, Alemania), recirculador de agua para condensación (MLW, Alemania) y una bomba de vacío (VEM KMR 53 K4 FTH, Alemania) y fueron secados en estufa con recirculación de aire a 40° C, hasta obtener masas consistentes que posteriormente fueron preservadas en frascos de color ámbar.
Extracciones con solventes de polaridad creciente
Se utilizaron los extractos secos, disolviéndolos en etanol al 70%. Posteriormente se realizaron extracciones sucesivas con solventes de polaridad creciente: (n-hexano, cloroformo, acetato de etilo)(Merck) con el objetivo de separar los metabolitos presentes en los mismos. En cada caso fueron añadidos 20 mL del solvente empleado a un volumen igual de cada solución etanólica obtenida, se agito bien, se dejó reposar hasta que se separaran las dos capas y luego se separaron. Este procedimiento fue repetido hasta la total separación de los metabolitos extraídos.
A cada tintura y extracto obtenido se le determinó la presencia de compuestos orgánicos que, según su solubilidad, pudieran ser extraídos en los solventes empleados, aplicando ensayos de tamizaje fitoquímico simples, rápidos y selectivos dirigidos a la detección cualitativa de grupos o familias de metabolitos secundarios, reportadas en la Norma Ramal de Salud Publica 309 del Ministerio de Salud Pública (MINSAP).12
Tamizaje fitoquímico
El tamizaje fitoquímico se realizó en el Laboratorio de Productos Naturales de la Universidad de Granma por la metodología reportada en Guía Metodológica para Investigaciones Fitoquímicas en Plantas Medicinales por el MINSAP.13
Los extractos secos fueron utilizados en la preparación de diluciones en dimetilsulfóxido (DMSO) destinadas a la evaluación de la actividad antibacteriana.
Evaluación de la actividad antibacteriana
La actividad antibacteriana in vitro de los extractos obtenidos de hojas y tallos de la planta investigada fue evaluada utilizando el método de difusión en agar por diseminación superficial en disco (Kirby-Bauer)15 para una concentración de 200 µg/disco. Se determinaron los halos de inhibición del crecimiento bacteriano para los extractos secos de las hojas y tallos y a las fracciones colectadas en separaciones sucesivas con solventes de polaridad creciente (n-hexano, cloroformo, acetato de etilo). Se utilizó una batería compuesta por bacterias del tipo Gram (+) y Gram (-) seleccionadas del cepario de la Universidad de Granma, entre las que se encontraron: B. subtilis (ATCC 6633), S. aureus (ATCC 29737), P. aeruginosa (ATCC 27853) y E. coli (ATCC113 - 3).
Se utilizaron cinco controles negativos (DMSO, etanol al 70 %, acetato de etilo, n-hexano y cloroformo) para descartar que los solventes utilizados en las extracciones fueran los responsables de la actividad biológica. Como control positivo se utilizó el antibiótico comercial penicilina.
Resultados y discusión
El tamizaje fitoquímico realizado a las tinturas al 20% y extractos secos, de las diferentes partes de la planta en estudio (tabla 1) muestra una gran diversidad de metabolitos secundarios, destacándose en las tinturas al 20% la presencia abundante de cumarinas en tallos y hojas y de flavonoides en tallos; también están presentes taninos, saponinas, alcaloides, triterpenos y/o esteroides y aminoácidos libres.
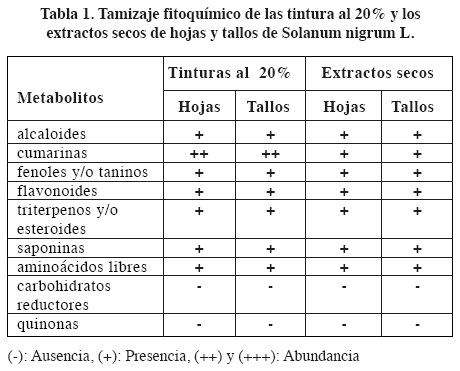
En los extractos secos la composición fitoquímica es similar a la determinada para las tinturas al 20%. Se determinó la presencia de metabolitos secundarios como: alcaloides, taninos, cumarinas, triterpenos y/o esteroides, aminoácidos libres, saponinas y flavonoides de los cuales hay reportes como responsables de la actividad antibacteriana en las plantas. En los extractos secos, se destaca una disminución en la abundancia de las cumarinas, en relación con las tinturas al 20%, el resto de los metabolitos se comportaron de manera semejante a las tinturas, por lo que se puede afirmar que son estables a 50° C.
Los resultados obtenidos en el tamizaje coinciden con los reportados por Huang H.C16 y col. en el 2010 en un estudio realizado en China y con los resultados de Zhao Y.17 y col. en el 2010.
En análisis previo de la actividad biológica de las tinturas al 20% de las hojas y tallos de S. nigrum L, estas no manifestaron actividad frente a las cepas bacterianas evaluadas (datos no mostrados). Estos resultados indican que estos preparados no son apropiados para el tratamiento de infecciones generadas por los agentes patógenos evaluados.
No se observó actividad antimicrobiana de los extractos secos de tallos y hojas, a la concentración evaluada, frente las cepas de E. coli y P. aeruginosa (Tabla 2). Se debe señalar que ambas son bacterias Gram (-), por tanto, es probable que de modo general las formulaciones obtenidas de las hojas y los tallos de la especie estudiada no presenten actividad frente a las bacterias de este grupo, coincidiendo con estudios anteriores que señalan la inactividad de un elevado número de especies vegetales contra microorganismos Gram (-).18
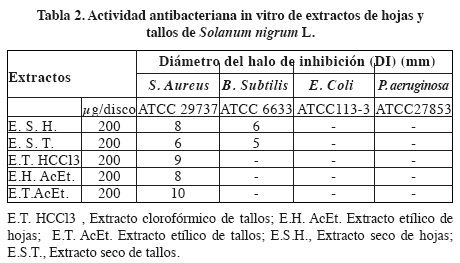
Sin embargo, los extractos secos, tanto de hojas como de tallos, mostraron actividad frente a las cepas de B. subtilis y S. aureus. El mayor halo de inhibición se observó en el extracto seco obtenido de las hojas, frente a S. aureus con un diámetro de 8 mm, valor por encima de los reportados como efectivos por Ávila.19 En relación con B. subtilis, los halos de inhibición fueron de 6 y 5 mm para los extractos secos de hojas y tallos, respectivamente.
Los extractos hexánicos de hojas y tallos y el extracto clorofórmico de hoja, no mostraron actividad antimicrobiana frente a los microorganismos evaluados (datos no mostrados). Los extractos clorofórmico y de acetato de etilo de tallos mostraron actividad frente a las cepas de S. aureus, al igual que los extractos de hojas en acetato de etilo. La mayor actividad biológica fue manifestada por el extracto obtenido con acetato de etilo a partir de los tallos, con diámetro del halo de inhibición de 10 mm, seguidos por los extractos clorofórmicos de esta parte de la planta con 9 mm de halo de inhibición, valores que se pueden considerarse como moderados o medios con respecto a los reportados por Ávila.19 Los extractos obtenidos con acetato de etilo para las hojas mostraron valores de 8 mm de diámetro de los halos de inhibición, el cual se encuentra en los límites de exclusión reportados por este autor.
Abiy20 plantea haber encontrado actividad biológica en la planta Erythrina burti contra las bacterias Gram (+) y Gram (-). Sin embargo, Avila19 obtuvo importantes niveles de actividad biológica con Diplostephium tolimense frente a S. aureus (ATCC 25923) lo que se adjudica a la presencia de terpenos y flavonoides.
Los resultados obtenidos confirman los hallazgos de Llop21, Mandigan22 y otros investigadores23,24 con relación a que la mayoría de los productos naturales con propiedades antibióticas tienen mayor acción biológica sobre las bacterias Gram (+).
El tamizaje fitoquímico a los extractos de hojas y tallos en acetato de etilo y clorofórmico de tallos se muestra en la tabla 3. Como se puede apreciar en el extracto clorofórmico de tallos se destaca la presencia de abundantes cumarinas y flavonoides y la presencia de otras cuatro familias de metabolitos secundarios: triterpenos y/o esteroides, saponinas, aminoácidos libres y alcaloides. Mostró resultado negativo para antocianidinas, taninos y/o fenoles simples. En el extracto de hojas en acetato de etilo se detectó la presencia de: cumarinas, flavonoides, antocianidinas, triterpenos y/o esteroides, saponinas, aminoácidos libres, taninos y alcaloides.
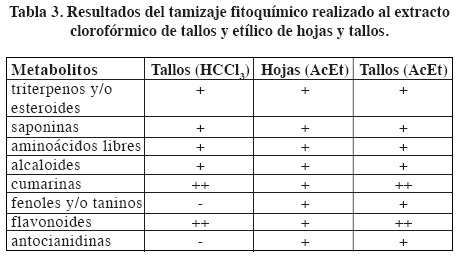
En el extracto de tallos en acetato de etilo se comprobó la presencia de abundantes: cumarinas, flavonoides y además, antocianidinas, triterpenos y/o esteroides, saponinas, aminoácidos libres, taninos y alcaloides.
En la composición fitoquímica de cada uno de los extractos que presentaron actividad antibacteriana, destacan metabolitos como los flavonoides, cumarinas, alcaloides y saponinas, de los cuales se ha demostrada su actividad antibacteriana.
Conclusiones
1.- En la composición fitoquímica de los extractos obtenidos de las hojas y tallos de la planta de S.nigrum L. predominan: flavonoides, alcaloides, taninos, aminoácidos, saponinas y cumarinas.
2.- Los extractos secos de hojas y tallos de S.nigrum L mostraron actividad biológica frente a cepas de S. aureus (ATCC 29737) y B. subtilis (ATCC 6633).
3.- Se demostró actividad antibacteriana in vitro de los extractos de hojas y tallos en acetato de etilo y el extracto clorofórmico de tallos de S. nigrum L frente a las cepas de S. aureus (ATCC 29737).
4.- El extracto de los tallos en acetato de etilo mostró el mayor halo de inhibición (10 mm) frente a cepas de S. aureus (ATCC 29737).
Referencias
1. Livermore DM. Bacterial resistance: origins, epidemiology and impact. Clin Infect Dis. 2003; 36(1):511-523. [ Links ]
2. Soto L. Resistencia bacteriana. Rev Cubana Med Milit. 2003; (1):44-48. [ Links ]
3. Domingo D, López M. Plantas con acción antimicrobiana. Rev Española Quimioterapia. 2003; (4):385-393. [ Links ]
4. Jawetz y col. Microbiología Médica; XVII Edición, Ed. Manual Moderno. 2002; 163-172. [ Links ]
5. Menendez RA. Acerca de las pautas de la OMS en la investigación para la evaluación de la seguridad y eficacia de los medicamentos herbarios. Rev Cubana Plant Med. 2000; (1):5-5p. [ Links ]
6. Mohamed TS, Madhusudhana CC, Ramkanth S, Alagusundaram M, Gnanaprakash K, Thiruvengada VS, Angalaparameswari S. Solanum nigrum Linn.- A recopilación. 2009; (6):342-345.
7. Wang HC, Chung PJ, Wu CH, Lan KP, Yang MY, Wang CJ. Solanum nigrum L. polyphenolic extract inhibits hepatocarcinoma cell growth by inducing G2/M phase arrest and apoptosis. J Sci Food Agric. 2011 Jan 15; 91(1):178-185p. [ Links ]
8. Jeong JB, De Lumen BO, Jeong HJ. Lunasin peptide purified from Solanum nigrum L. protects DNA from oxidative damage by suppressing the generation of hydroxyl radical via blocking fenton reaction. Cancer Lett. 2010; 293(1):58-64. [ Links ]
9. Gopalan HK, Zainal H, Mohd Pojan NH, Morsid NA, Aris A, Sulaiman MR. Antinociceptive, anti-inflammatory and antipyretic effects of Solanum nigrum chloroform extract in animal models. Yakugaku Zasshi. 2006; 126(11):1171-1178. [ Links ]
10. Parihar SK, Jain NK, Katiyar AK. Effect of Solanum nigrum and Ricinus communis extracts on histamine and carrageenan-induced inflammation in the chicken skin. Cell Mol Biol (Noisy-le-grand). 2010; (9):56-63. [ Links ]
11. Rawani A, Ghosh A, Chandra G. Mosquito larvicidal activities of Solanum nigrum L. leaf extract against Culex quinquefasciatus Say. Parasitol Res. 2010, 107(5):1235-1240. [ Links ]
12. Cuba. Ministerio de Salud Pública. NRSP No. 309. Medicamentos de origen vegetal: droga cruda. Métodos de ensayos. La Habana. MINSAP. 1992. [ Links ]
13. Ministerio de Salud Pública (MINSAP). Guía metodológica para la investigación en plantas medicinales. La Habana: Editorial Pueblo y Educación; 1997. [ Links ]
14. Abreu G. et al. "Estrategias en la selección de las plantas medicinales". Rev Cubana Plant Med. 2008; 13(3). http://scielo.sld.cu/scielo.php. [ Links ]
15. Clinical and Laboratory Standards Institute: M100-S17 (M2). 2007. Disk Diffusion Supplemental Tables, CLSI, Wayne Pa. [ Links ]
16. Huang HC, Syu KY, Lin JK. Chemical Composition of Solanum nigrum Linn Extract and Induction of Autophagy by Leaf Water Extract and Its Major Flavonoids in AU565 Breast Cancer Cells. J Agric Food Chem. 2010; 58:8699-8708. [ Links ]
17. Zhao Y, Liu F, Lou HX. Studies on the chemical constituents of Solanum nigrum. Zhong Yao Cai. 2010; 33(4):555-556. [ Links ]
18. Gilbert P. Potential impact of increased use of biocides in consumer products on prevalence of antibiotic resistance. Clin Microbiol Rev. 2003; (16):190-191. [ Links ]
19. Ávila L, Baquero E, Viña A, Murrillo E. Actividad antibacteriana de Diplostephium tolimense Cuatrec. (Asteraceae) frente a Staphylococcus aureus. Vitae. 2006; 3(1):55-60. [ Links ]
20. Abiy Y, Solomon D. Antimicrobial flavonoids from the stem of Erythrina burtii. Fitoterapia. 2005, (96):496-499. [ Links ]
21. Llop A.H. Microbiología y Parasitología Médicas. Ed. Ciencias Médicas. La Habana. Cuba. 2001, Tomo I, secc. 3, Cap. 29, p303-309. [ Links ]
22. Madigan MT, Martinko JM, Parker J. Biología de los microorganismos. 10a Ed. Pearson Educación. 2009, p696-700. [ Links ]
23. Ogundare AO, Olorunfemi OB. Antimicrobial efficacy of the leaves of Dioclea reflexa, Mucunapruriens, Ficus asperifolia and Tragia spathulata. Res J Microbiol. 2007; (2):392-396. [ Links ]
24. Kaur GJ, Arora DS. Antibacterial and phytochemical screening of Anethum graveolens, Foeniculum vulgare and Trachyspermum ammi. BMC Complementary and Alternative Medicine. 2009; (9):30. [ Links ]














