Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias farmacéuticas
versión impresa ISSN 1870-0195
Rev. mex. cienc. farm vol.43 no.3 Ciudad de México jul./sep. 2012
Trabajo científico
Evaluación de la actividad antimicrobiana del extracto etanólico
Evaluation of antimicrobial activity of ethanol extract of Cestrum buxifolium Kunth
Diana C. Corzo Barragán
Jardín Botánico José Celestino Mutis.
Correspondencia:
Diana Carolina Corzo Barragán
Jardín Botánico José Celestino Mutis. Av. calle 63 n° 68-95
Bogotá- Colombia.
Calle 72a n° 87-75 Int 5 Apto 301
Tel.: (57) 3114466699
e-mail: dianacorbarral@gmail.com
Fecha de recepción: 21 de abril de 2012.
Fecha de recepción de modificaciones: 18 de julio de 2012.
Fecha de aceptación: 25 de julio de 2012.
Resumen
Se evaluó la actividad antimicrobiana de los diferentes órganos de la especie Cestrum buxifolium Kunt, frente a Escherichia coli, Pseudomelia aeruginosa, Staphylococcus aureus, por la técnica de difusión en disco; el extracto etanólico de los frutos y hojas de C. buxifolium inhiben el crecimiento de E. coli en concentraciones de 30 mg/ml, los extractos etanólicos de frutos y tallos inhiben el crecimiento frente a Pseudomona aeruginosa, en la misma concentración, con respecto al control positivo; ninguno de los extractos evaluados presentó inhibición frente Sthaphylococcus aureus.
Palabras clave: Actividad antimicrobiana, Cestrum buxifolium, extracto etanólico.
Abstract
We evaluated the antimicrobial activity of different plant organs of the species Cestrum buxifolium Kunt, for Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus, through the disk diffusion method, the ethanol extract of the fruits and leaves of C. buxifolium inhibitthe growth of E. coli at a concentration of 30 mg/ml, the ethanol extracts of fruits and stems inhibit the growth front of Pseudomonas aeruginosa in the same concentration with respect to the positive control, none of the extracts were evaluated for inhibition versus Staphylococcus aureus.
Keywords: antimicrobial activity, Cestrum buxifolium, ethanol extract.
Introducción
La proliferación de enfermedades causada por microorganismos patógenos es una preocupación generalizada, que constituye un factor de riesgo para la salud pública, es por esto que se buscan fuentes naturales que inhiban el crecimiento bacteriano; descubriendo en las plantas compuestos bioactivos para tal fin.
El hombre a través del tiempo ha encontrado en los recursos naturales la solución a diferentes problemáticas, empleando las plantas a nivel alimenticio. Industrial y medicinal, convirtiéndose de esta manera, en materias primas de vital importancia para el avance de la humanidad.
Es así como los productos naturales han desempeñado un papel importante en el desarrollo de fármacos, los cuales han sido la base de las primeras medicinas permitiendo el descubrimiento de diferentes productos, entre ellos los anti-bacterianos.1 en los últimos años mas de la mitad de los productos farmacéuticos usados son derivados de fuentes naturales.2
Por lo anterior se puede afirmar que los productos naturales se han convertido en fuente de hallazgos de numerosas drogas desde el siglo XIX hasta la actualidad, como es el caso de la morfina a partir de opio. Identificándola como el compuesto responsable de la acción de dicha planta.
Actualmente existen alcaloides muy conocidos, como la cafeína, la codeína. la atropina y la papaverina, otros ejemplos de fármacos extraídos de la naturaleza son la gramicina, primer antibiótico obtenido de bacterias del suelo; la insulina, purificada de extractos pancreáticos animales; y el ácido salicílico, analgésico extraído por primera vez de la corteza del sauce, y antecesor de la aspirina (ácido acetilsalicílico).3
Los productos naturales han hecho enormes contribuciones a la salud humana a través de la utilización de compuestos como los mencionados anteriormente; sin embargo se evidencia la necesidad de seguir encontrando nuevos compuestos que permitan dar solución a diferentes enfermedades. Colombia posee un territorio con una alta riqueza en recursos vegetales. A nivel mundial, se encuentra clasificado dentro de los países megadiversos del mundo.4
En la región andina encontramos especies nativas con diversas potencialidades de uso, las cuales han sido poco estudiadas, por éste motivo el Jardín Botánico de Bogotá (JBB): adelanta estudios e Investigaciones sobre el aprovechamiento integral y sostenible de especies presentes en el ecosistema alto andino y de páramo.
Una de estas especies es el tinto o también llamado uvito morado Cestrum buxifolium Kunt. (Figura 1).

Especie perteneciente a la familia Solanaceae, que se distribuye a una altitud entre los 2750 y 3800 m:; en el Distrito Capital crece de manera silvestre.
Estos arbustos se caracterizan por ser altamente tóxicos; todas las partes de la planta causan gastroenteritis severa por ingestión.6
Los frutos son una baya Jugosa y carnosa;7 a escala industrial son empleados comúnmente para teñir telas de color morado. Análisis fitoquímicos preliminares evidenciaron la presencia de alcaloides, saponinas, esteroides, triterpenos.8
Esta investigación permite validar información etnobotánica reportada por las comunidades locales, o proponer alternativas de uso de las especie vegetales presentes en nuestro ecosistema; trabajos anteriores sobre está especie han reportado su uso en medicina popular, donde se informa sobre el uso de los tallos y las hojas en decocción, como desinfectantes en las úlceras y otras enfermedades epidérmicas; así mismo se emplea esta para lavados rectales en casos de fiebres Infecciosas.9
Estudios etnobotánicos realizados en zona rural de la localidad de Ciudad Bolívar en el Distrito Capital colombiano reportaron que la especie es conocida por tener aplicaciones mágico-religiosas, por el potencial tintóreo de sus frutos y como planta medicinal.10
De igual manera Habballah et al, mencionan los potenciales efectos farmacológicos del género, como anticonvulsivante, antitumoral, antiinflamatoria, analgésica y actividad contra Leishmania.11 Investigaciones realizadas con el extracto acuoso de C. buxífolíum demuestran que posee un importante efecto analgésico y antiinflamatorio.12
Además otras especies del género Cestrum, poseen actividad antiinflamatoria e inhibidora de la agregación plaquetaria.13 Del mismo modo especies como C. nocturnum son reconocidas por su potencial antibacteriano frente a Staphylococcus aureus, Listeria monocytogenes, Basilius subtills, Pseudomonas aeruginosa, Escherichia coll,u de igual manera el aceite esencial de la especie del Oestrum dlurnum (L.) presentó una fuerte actividad in vitro frente a Pseudomonas aeruginosa y Staphylococcus aureus.15
El objetivo del presente trabajo fue evaluar la actividad antibacteriana de los extractos etanólicos de los frutos, tallos y hojas de la especie vegetal C. buxifolium Kunt. frente a microorganismos patógenos y determinar la concentración mínima inhibitoria (CMI) de los extractos que presentaron inhibición. De esta manera realizar aportes en cuanto a las potencialidades de uso de la especie como agente antibacteriano.
Material y método
Recolección de material vegetal y obtención de extractos
Se recolectaron hojas, tallos y frutos sanos de C. buxifolium Kunt. en el Páramo de Cruz verde, zona rural de la ciudad de Bogotá, Colombia; un espécimen reposa en el Herbario del Jardín Botánico de Bogotá José Celestino Mutis. Posteriormente se seco a temperatura ambiente por 8 días, para reducir el tamaño de forma mecánica hasta obtener partículas finas y someter a maceración en frío usando etanol al 96% en recipientes ámbar por 3 días, seguidamente se filtró y el extracto etanólico resultante se concentro sucesivamente a presión reducida, en roto evaporador (marca Heidolp), hasta eliminar el etanol.16 El extracto se almaceno hasta su uso en cabina de extracción de gases LEX C-4. Se pesaron 0.03 g del extracto crudo y se solubilizo con 1 mL de Dimetilsulfóxido (DMSO) de grado analítico para lograr una concentración de 30 mg/mL.17
Evaluación de actividad antimicrobiana
Se probaron los extractos etanólicos frente a bacterias Gram negativas y Gram positivas Escherlcha coli, Pseudomona aeruginosa, Sthaphylococcus aureus procedentes de cepas de referencia, las cepas se mantuvieron en medio líquido a temperatura de refrigeración.
Se empleó el método de difusión en discos basada en el trabajo de Kirby y Bauer para la determinación preliminar de la actividad antibacteriana y así evidenciar la inhibición del extracto. Para la activación de los microorganismos se aislaron las bacterias en agar nutritivo marca Difco™, preparado según especificaciones de la casa matriz y esterilizados en autoclave a 121 °C y 1 atmosfera durante 20 min. El procedimiento se realizó por la técnica de agotamiento de la muestra por estría, en cajas de Petri servidas con un espesor de agar de 25 a 30 mL18 e incubadas por un tiempo de 18-24 h. a 37°C. Después del tiempo de incubación, con ayuda de un escobillón estéril se tomaron 2 a 5 colonias morfológicamente similares y se suspendieron las bacterias en solución salina NaCl al 0.85 % hasta alcanzar la turbidez comparable con el patrón 0.5 de Mcfarland, de manera cualitativa; para el ensayo de actividad antibacterial se empleo agar Muller- Hilton marca Scharlau preparado según especificaciones de la casa matriz y esterilizado en autoclave a 121 °C y 1 atmosfera durante 20 min. servido en cajas de petri con un espesor de agar de 25 a 30 mL, las cuales fueron impregnadas con 100 μl/caja con la suspensión ajustada de cada bacteria indicadora, se emplearon discos estériles de 6 mm de diámetro los cuales fueron impregnados con 10 μl de extracto diluido, como control positivo se uso cloranfenicol en concentración de 100 μg/ml(10 μl/disco) y como control negativo se empleo DMSO en proporción de 10 μl. Seguidamente las cajas de petri se incubaron a 36°C por 24 horas;19 los ensayos se realizaron por triplicado.
El porcentaje de inhibición se cálculo mediante la fórmula 1,20 teniendo como referencia la medición del diámetro de la zona de inhibición del control positivo y la medición del halo de los extractos testeados.

Determinación de la concentración mínima inhibitoria (CMI)
La concentración mínima inhibitoria se evaluó solo a los extractos que evidenciaron inhibición frente a las bacterias de referencia. Se realizó por el método de dilución en agar, en donde se incorporó el producto a evaluar en el medio con agar, el producto fue añadido cuando el medio estaba aún estaba líquido,21 la técnica fue realizada en microplacas de fondo plano de 24 pozos, en las cuales se dispusieron diferentes volúmenes de solución de los extractos en cada pozo y se realizaron diluciones con el medio de cultivo. Las concentraciones probadas fueron 30μl/mL, 15μl/mL, 7,5μl/mL, 3,75μl/mL, 1,875 μl/mL y 0,9375 μl/mL. En cada pozo se sembraron 2 μl μ de solución bacteriana (P. aeruginosa y E. coli) a una concentración de 1.5x106 UFC/mL, comprables al tubo 0,5 en la escala de turbidez de Macfarland. Se empleo como control negativo DMSO y como control positivo cloranfenicol en concentración de 100 μg/mL. Después de 24 horas de incubación a 36°C las microplacas, se examinaron visualmente.
El punto final (Concentración Mínima Inhibitoria) se considera la menor concentración de compuesto frente a la cual el microorganismo ensayado no presenta desarrollo visible.22
Resultados y discusión
Evaluación de la actividad antibacteriana
En la tabla 1, se evidencia con positivo (+) la inhibición de los extracto frente a las bacterias seleccionadas, mientras que las que no presentaron actividad se marcaron como negativo (-).

Los frutos y hojas de C. buxifolium Kunth presentaron inhibición frente a E. coli, los tallos y frutos presentaron inhibición frente a P. aeruginosa; ninguno de los extractos evaluados inhibió el crecimiento de S. aureus. En la figura 2 y 3 se muestra de manera porcentual la inhibición de los tallos y frutos frente a P. aeruginosa y E. coli, respectivamente calculado de acuerdo al halo de inhibición, teniendo como referencia el control positivo.
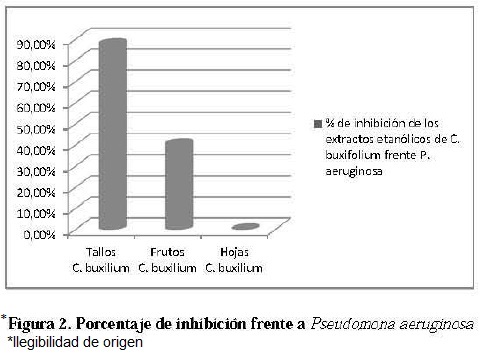
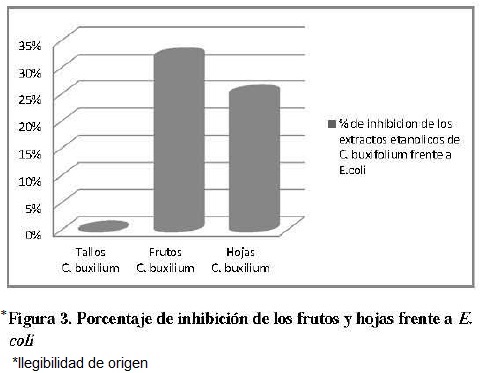
El porcentaje de inhibición se cálculo con la fórmula 1, el mejor resultado de la pmeba in vitro se logro con el extracto etanólico de los tallos de C. buxifolium frente a P. aeruginosa los cuales inhibieron en un 87,63%, mientras que los frutos lo hicieron en un 40.32% frente a la misma bacteria; en cuanto a E. coli el extracto etanólico de las hojas y frutos presentaron un porcentaje de inhibición del 25% y 32% respectivamente.
Lo anterior sugiere que la especie tiene potencial anti microbiano; la presencia de algunos metabolitos secundarios como los alcaloides, saponinas, esteroides, triterpenos puede ser las responsables de este efecto.
De acuerdo con lo reportado por Al-Reza et al,23 y Bhattacharjee I et al;15 respectivamente especies del mismo género como C. nocturnum L y Cestrum diurnum L. presenta actividad antibacteriana frente a Staphylococcus aureus, esto puede deberse a que los estudios se realizaron a los aceites esenciales y no al extracto etanólico como en la presente investigación.
Según lo reportado por Tavares 2000,24 existen mecanismos de resistencia por parte de S. aureus que están relacionados con la activación de una síntesis de la pared celular, con hiperpreducción de proteínas ligadoras de penicilina.
Este puede ser uno de los factores que influye en la no inhibición de los extractos frente a este microorganismo.
De otro modo Lizcano y Vergara 2007, reportaron que los mecanismos de resistencia de E. coli pueden presentarse como alteración del blanco antimicrobiano o disminución de la permeabilidad de la pared por poseer una pequeña capa de peptidoglicano, la cual es más sensible,25 por lo que se puede pensar que el extracto etanólico de los frutos y hojas de Cestrum buxifolium presenta algún metabólito secundario con la capacidad de contrarrestar los mecanismos de resistencia de la bacteria.
Por otro lado, especies de la familia solanaceae, tales como Solanum americanum Mili., reporta actividad antibacteriana frente a C. albicans.26
Por lo anterior se puede deducir que varias especies de la familia tienen efecto antibacteriano.
Determinación de la CMI
El crecimiento bacteriano fue interrumpido en un lapso de 24 horas, correspondiente al tiempo de observación, donde se determino que para todos los casos la CMI fue de 30 mg/mL. En la figura 4, se observa que la mínima concentración de los tallos y frutos frente a P. aeruginosa.

Conclusiones
Actualmente, no se reportan estudios antimicrobianos realizados a la especie Cestrum buxifolium Kunt, convirtiéndose esté en el primer reporte de actividad antibacterial para la especie.
El resultado de esta investigación contribuye con la determinación de las potencialidades de uso para la industria farmacéutica.
Se sugiere realizar un ensayo biodirigido, realizando una serie de fraccionamientos con diferentes solventes para así determinar cuál es el compuesto responsable de la actividad antimicrobiana.
Es importante obtener extractos de todas las partes de la planta para realizar la evaluación antibacteriana, puesto que como se evidencio en este estudio algunas partes inhiben.
Agradecimientos
A la Microbióloga Andrea Martínez, por su ayuda en el montaje de los ensayos, al Jardín Botánico José Celestino Mutis por brindar el apoyo económico para llevar a cabo la investigación.
Referencias
1. Butler, M S. Natural products to drugs: natural product derived compounds in clinical trials. Natural Product Reports. 2005; 22: 162-195. [ Links ]
2. Newman DJ, Cragg GM. Natural products as sources of new drugs over the last 25 years. J Nat Prod. 2007;70:461-77. [ Links ]
3. Ravaschino E. Diseño racional de drogas: en busca de la droga ideal. Revista Química Viva- Número 3, año 6, diciembre 2007. Buenos Aires. [ Links ]
4. Mittermeier RA, y Goettsch, C. Mega diversidad. Los países biológicamente más ricos del mundo. 1997. Cemex, Ciudad de México. [ Links ]
5. Mora F. y Rozo C. Lista preliminar de las especies de Cestrum L (Solanaceae) para Colombia. Revista Biota colombiana. Junio 2002 Vol. 3 numero 001. Instituto de investigaciones de recursos biológicos Alexander Von Humboldt. Bogotá Colombia, p. 131-140. [ Links ]
6. Instituto nacional de biodiversidad. Accesible en: http://www.inbio.aca/bims. Consultado el 1 sept. 2010.
7. Orozco, CI; Mora, F. Lista preliminar de las especies de Cestrum (Solanaceae) para Colombia. Biota Colombiana. 2002; 3(1): 131-140. [ Links ]
8. Plazas EA. Análisis fitoquímicos de dos especies priorizadas dentro del proyecto 318. 2010. Subdirección científica Jardín Botánico José Celestino Mutis. Informe técnico inédito. [ Links ]
9. Universidad Inca de Colombia. Familia Solanaceae. [online]. Accesible en: http://www.unincca.edu.co/tesis/FTWeb/Solanaceae.html. (Consultado el 6 mayo de 2010). [ Links ]
10. Pineda FM. Usos potenciales de dos especies de plantas andinas en la cuenca del río Tunjuelo, Bogotá, Colombia. Revista Pérez Arbelaezia. 2011, 20: 126-141. [ Links ]
11. Habballah K, Tarantino R, Ciangherotti C, Buitrago D, Salazar M.Evaluacion del efecto citotoxico y antiproliferativo del extracto acuoso de Cestrum buxifolium Kunth sobre células epiteliales renales y células de cancer de mama. Abstractbook of XIX° SILAE Congress "Fernando Cabieses Molina" Villasimius, 2010, Cagliari- ITALY. [ Links ]
12. Gómez J, Ciangherotti C, Matos M, Pastorello M, Buitrago D Israel AY Salazar M. Efecto analgésico y antiinflamatorio del extracto acuoso de Cestrum buxifolium Kunth. Revista Facultad de Farmacia Universidad Central de Venezuela. 2008; 71(1); 12-47. [ Links ]
13. Darakhshanda, S., Faiza, H., Fehmida, T. and Viqar, U. Effect of the Crude Extract of Cestrum parquion Carrageen in-induced Rat Paw Oedema and Aggregation of Human Blood Platelets. Phytother. 1999; 13:445-447. [ Links ]
14. Sharif M. Al-Reza, Atiqur Rahman & Sun Chul Kang. Chemical composition and inhibitory effect of essential oil and organic extracts of Cestrum nocturnum L. on food-borne pathogens. Int J Food SciTech. 2009; 44: 1176-1182. [ Links ]
15. Bhattacharjee, I.; Ghosh, A.; Chandra, G. Antimicrobial activity of the essential oil of Cestrum diurnum (L.) Solanales: Solanaceae. African Journal of Biotechnology -ONLINE (2005), 4(4), 371-374. [ Links ]
16. Markman B.J. Evaluación de la actividad antimicrobiana del Psidium guajava. Rev Cubana Plant Med. 1997:12-48. [ Links ]
17. Atep, D.;Erdoúrul, Z. Antimicrobial Activities of Various Medicinal and Commercial Plant Extracts. Turk J. Biol. 2003; 27: 157-162. [ Links ]
18. Cavalieri, S, Harbeck R, Mc Carter Y, Ortez J, Rankin I, Soutter R, Sharp S & Spiegel C. Manual de pruebas de susceptibilidad antimicrobiana. American Society for Microbiology. 2005. [ Links ]
19. Chitnis, R.; Abichandani, M.; Nigam, P.; Nahar, 1.; Sarker, S. Actividad antibacteriana y antioxidante de los extractos de Piper cubeba (Piperaceae). ArsPharm. 2007; 48(4): 343-350. [ Links ]
20. Ramírez, L.; Diaz, H. Actividad antibacteriana de extractos y fracciones del ruibarbo (Rumex conglomeratus). Scientia et Technica. 2007; 33: 0122-1701. [ Links ]
21. Shiva RC. Estudio de la actividad antimicrobiana de extractos naturales y ácidos orgánicos; posible alternativa los antibióticos promotores de crecimiento. Departament de sanitat id" anatomía animals. Facultad de Veterinaria. Universitat Autónoma de Barcelona. 2007. Pág. 26. [ Links ]
22. Koneman W. E. "Diagnóstico Microbiológico" 3ra. Ed. Panamericana, 1992. [ Links ]
23. Al-Reza, M. Sharif; Rahman, Atiqur; Kang, Sun Chul. Chemical composition and inhibitory effect of essential oil and organic extracts of Cestrum nocturnum L. on food-borne pathogens. Desde International Journal of Food Science and Technology (2009), 44 (6): 1176-1182. [ Links ]
24. Tavares W. Bacteriasgram positiva: resistencia do estafilococu, do enterococu antimicrobianos. Revista da sociedades Brasilera de medicina tropical Rio de Janeiro, Brasil. 2000. [ Links ]
25. Lizcano, A. & Vergara, J. Evaluación de la actividad antimicrobiana de los extractos etanólicos o aceites esenciales de las especies vegetales Valeriana pilosa, Hesperomeles ferruginea, Myrcianthes rhopaloides y Passíñora manicata frente a microorganismos patógenos y fitopatógenos. 2007. Facultad de Ciencias Básicas. Pontificia Universidad Javeriana. Trabajo de grado. Bogotá, D.C. [ Links ]
26. Martínez J, López B, Morejón Z, Boucourt E, García A. Actividad antimicrobiana e irritabilidad vaginal y dérmica de extractos acuosos de hojas secas de Solanum americanum Mili. Revista Cubana Plant Med 2009; 14 N°(1). [online]. Disponible en: http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S1028 47962009000100003&lng=es&nnn=iso>. ISSN 1028-4796. [ Links ]














