Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ciencias farmacéuticas
versión impresa ISSN 1870-0195
Rev. mex. cienc. farm vol.42 no.1 Ciudad de México ene./mar. 2011
Revisiones bibliográficas
Los excipientes y su funcionalidad en productos farmacéuticos sólidos
The excipients and their functionality in pharmaceutical solid products
Leopoldo Villafuerte Robles
Escuela Nacional de Ciencias Biológicas, Instituto Politécnico Nacional de México.
Correspondencia:
Dr. Leopoldo Villafuerte Robles,
Escuela Nacional de Ciencias Biológicas, IPN,
Av. Wilfrido Massieu S/N, Unidad Profesional Adolfo López Mateos,
Col. Industrial Vallejo, C. P. 07738, D. F. México
e-mail: lvillaro@encb.ipn.mx; lvillarolvillaro@hotmail.com
Fecha de recepción: 13 de octubre de 2010.
Fecha de recepción de modificaciones: 18 de febrero de 2011.
Fecha de aceptación: 1 de marzo de 2011.
Resumen
El propósito de este trabajo es una breve revisión y evaluación de la información relativa a los conceptos de funcionalidad de los excipientes usados en productos farmacéuticos sólidos. La determinación de las características de funcionalidad de los excipientes como partículas, como polvos y como una mezcla de polvos en una formulación, permite la reducción de las propiedades de los polvos a números tangibles. Los valores específicos de sus propiedades físicas, químicas y tecnológicas, que identifican la funcionalidad de un material, permiten establecer parámetros estadísticos y límites de corte para utilizarlos, para controlar la calidad y la consistencia entre los diferentes lotes del material y para predecir y comparar la funcionalidad de los materiales obtenidos con diferente marca comercial. La determinación de la funcionalidad de los materiales reduciría el costo de una experimentación muy amplia, debido al conocimiento de lo que se puede esperar de un material con cierta funcionalidad.
Palabras clave: excipientes, genéricos, funcionalidad, características físicas, características tecnológicas.
Abstract
The purpose of the work is a brief review and evaluation of information related to functionality concepts of excipients used in solid pharmaceutical products. The assessment of the excipients characteristics that determine their functionality allows the reduction of the powder properties to concrete numbers. This is possible at the level of individual particles, as a powder or in a mixture of powders in a formulation. The specific values of their physical, chemical and technological properties, that identify the functionality of a material, allow the establishment of statistical parameters and cut-off limits to use it, with the aim to control their lot to lot quality and consistency in the material manufacturing and to predict and compare the functionality of materials obtained from different trade name. The assessment of the materials functionality would reduce the costs of a wide experimentation, due to the knowledge of what can be expected of every excipient with certain functionality.
Key words: excipients, generics, functionality, physical characteristics, technological characteristics.
Introducción
Muchas empresas farmacéuticas se encuentran actualmente en la búsqueda de nuevas formulaciones para el suministro de fármacos, con el fin de superar las presiones de la reducción de precios derivadas de la venta de genéricos de los productos de marca y de una competencia global muy fuerte, aún entre los fabricantes de productos genéricos. Además, las compañías que fabrican genéricos desarrollan también alternativas para poder patentar sus formulaciones. Los fabricantes y distribuidores de materias primas ofrecen continuamente nuevos excipientes que permiten el desarrollo de nuevas formas de dosificación, que mejoran la eficiencia y que reducen el costo de los medicamentos. Los excipientes pueden agregar funcionalidad a los productos farmacéuticos. Actualmente, se reconoce el valor de los excipientes más que nunca antes.1
El mercado mundial de los excipientes se considera que se desarrolla en dos partes, por un lado los mercados con un desarrollo moderado en los Estados Unidos y en Europa y un fuerte potencial de crecimiento en los mercados emergentes. Por otro lado, considerando los productos, los fabricantes de excipientes se concentran en el desarrollo de productos con un mejor desempeño y en materiales con multifuncionalidad. Ambos tipos de mercados de los excipientes son diferentes, con desafíos particulares para los proveedores. Cada mercado tiene diferentes expectativas y se encontraría en un punto diferente de su ciclo de vida. Los mercados de Estados Unidos y Europa son los más maduros mientras que los otros mercados están emergiendo. Como consecuencia, la mezcla de productos, las bases de suministro y los métodos de producción en estas regiones presentan diferencias. Sin embargo, un factor en común es que sus dinámicas de crecimiento están creando oportunidades para los proveedores de excipientes.2,3
Un resultado satisfactorio en la manufactura de un producto farmacéutico depende de que se apliquen sistemas de control robustos en todos los aspectos en que se base el producto; en el analítico, en la ingeniería de fabricación y en los materiales. Regularmente, muchos de los aspectos de la manufactura de un medicamento se pueden controlar satisfactoriamente. Sin embargo, es común que los fármacos y excipientes sean los que puedan provocar variaciones en la calidad del producto terminado.4
El conocimiento de las propiedades y el desempeño de los materiales farmacéuticos es crítico para el diseño de formas farmacéuticas seguras y efectivas. El desempeño que se desea en los productos farmacéuticos se considera dividido en niveles de importancia. En un primer nivel de importancia se encontrarían propiedades de los materiales y productos como la solubilidad, la velocidad de disolución y la biodisponibilidad, en segundo término parámetros como la estabilidad y en un tercer nivel de importancia estarían, por ejemplo, las propiedades mecánicas de las formas farmacéuticas.
Las propiedades de los materiales se podrían situar en el nivel de las partículas individuales, en el nivel del conjunto de ellas o polvos y en la forma de dosificación. Las propiedades de los excipientes y de los principios activos se evalúan en cada uno de estos diferentes niveles. En el nivel de partículas individuales se evaluaría, entre otros, la solubilidad, la velocidad de disolución, el polimorfismo y la cristalinidad. En el nivel del polvo se evaluaría entre otros, el flujo del polvo y la capacidad del polvo para procesarse en forma de una tableta. En el nivel de forma farmacéutica los materiales se evaluarían en sus efectos sobre el desempeño de la forma farmacéutica. Por ejemplo, los efectos de las características de cristalinidad de los excipientes sobre la disolución y la resistencia a la ruptura de las tabletas.5
Aunque el tamaño y morfología de las partículas individuales, entre otras de sus propiedades, serían un indicativo de la funcionalidad física de los polvos, se considera que sea sólo el efecto integrado de las partículas el que defina realmente el procesamiento y manipulación del polvo. Se sugiere que las propiedades del conjunto de las partículas es esencial para definir su funcionalidad física. Las propiedades de los polvos se expresan a través de diferentes índices y se considera que estos índices se correlacionen con las propiedades de las formas farmacéuticas.6
Entre los diferentes índices se encuentran:
a. Dureza de las tabletas, muestra las posibilidades de que una tableta pueda soportar sin daño las diferentes manipulaciones de que es objeto
b. Compresibilidad, mide la tendencia de compresión de los polvos y podría relacionarse con la variación de peso de tabletas y cápsulas
c. Índice de adhesión, mide la tendencia de los polvos para adherirse a las paredes con las que colisiona y podría relacionarse con la variación de peso y la dificultad para mantener limpias las matrices
d. Velocidad de flujo, mide el flujo de un polvo a través de un recipiente y se podría relacionar con la tendencia de las tabletas a laminarse y a variar de peso.
La tendencia a formar un arco o cúpula en la salida de una zapata, la tendencia de los polvos que fluyen en una tolva para permanecer sobre las paredes, la densidad de un polvo en una salida, la densidad de un polvo en un recipiente, el ángulo necesario para generar flujo en una tolva cónica son otros índices que se reportan en la literatura y que podrían relacionarse con el desempeño de los materiales durante su procesamiento.6
Muchos de los índices antes mencionados se utilizan básicamente para medir las propiedades de flujo de los polvos. Sin embargo, podrían también predecir el éxito o fracaso de una formulación en una tableteadora, en otros equipos de procesamiento de polvos y en equipos de manejo de los mismos. Otros parámetros que se utilizan son relativos a las propiedades reológicas de los polvos. Entre ellos se cuentan la resistencia al flujo, la densidad aparente, la resistencia al flujo del aire o permeabilidad y adhesividad a las superficies. Estos parámetros son función de la composición química, de la distribución del tamaño y la forma de las partículas, aunque también son dependientes de la presión de compactación a la que se someten las muestras durante su manejo y evaluación. Por esta razón los resultados que se obtienen no son fáciles de interpretar.7
Entre tales índices se incluyen no sólo los tradicionales sino que se incluyen mediciones que se podrían hacer con nuevas tecnologías y nuevas propiedades de los excipientes como la dispersión de rayos X. Estudios con los que se puede correlacionar la fuerza de compactación, la densidad relativa de los compactos y los cambios que ocurren en las formas del patrón de dispersión de los rayos X. Esta técnica permite la investigación de los mecanismos de compactación de diferentes excipientes en diferentes condiciones de compactación.8 La difracción de rayos X de los polvos ha servido tradicionalmente para identificar estructuras cristalinas. Sin embargo, se considera que actualmente tiene varios usos, por ejemplo, la inferencia de la influencia de la presión de compactación sobre las propiedades de las tabletas terminadas. Se considera que con esta técnica se podría determinar el intervalo de presión de compactación asociado a los parámetros estructurales estables de las tabletas. Tomando como referencia estos parámetros sería posible la selección de la presión de compactación óptima asociada a una cierta velocidad de disolución.9
Las pruebas de conductividad eléctrica de las formulaciones serían otra metodología que se utilizaría para inferir el flujo de los polvos. Se ha observado una fuerte correlación entre la impedancia y el flujo de los polvos. Esto nos indicaría que el comportamiento cohesivo de los polvos dependería de sus propiedades eléctricas.10
La formulación de una tableta, como ejemplo de un producto farmacéutico sólido, involucra la combinación de un ingrediente activo con los que teóricamente serían ingredientes inactivos conocidos como excipientes. Sin embargo, es de notarse que el desarrollo de la nanotecnología, dentro del desarrollo de las formas farmacéuticas, hace cada vez más difícil el separar lo que es el principio activo y los adyuvantes inactivos, ya que sin ellos el fármaco no tendría la misma eficacia y la misma eficiencia. De cualquier manera, los excipientes son, hoy en día, elementos que dan funcionalidad y un desempeño apropiados a las formas farmacéuticas.
El principal interés en las propiedades de los materiales farmacéuticos radica en hacer que el producto terminado cumpla con los objetivos terapéuticos deseados. Para una forma farmacéutica sólida, por ejemplo, se encontrarían las características de estabilidad y las propiedades mecánicas de los productos.
En el desarrollo de los productos farmacéuticos, una vez que se conocen las características de los principios activos estas deben ajustarse a las características deseadas en la forma farmacéutica terminada. Para este fin se adicionan los excipientes, los cuales le darían al principio activo las características o funcionalidades terapéuticas, de estabilidad y de reproducibilidad o fabricación deseadas. Se considera que los problemas que se presentan en estos tópicos serían trazables hasta problemas de falta de comprensión o de conocimiento de las propiedades o características de los materiales farmacéuticos y de las metodologías de procesamiento. Estas circunstancias nos muestran la necesidad de mejorar nuestro conocimiento de las características de la funcionalidad de los excipientes, como materiales que conforman una forma farmacéutica.
Recientemente se ha reconocido la importancia de la ciencia de los materiales en la industria farmacéutica. Aunque la ciencia de los materiales ha formado parte de la investigación de los productos farmacéuticos desde los 1950s su importancia ha aumentado recientemente. La parte más importante de su aplicación se orienta al estudio del impacto de las propiedades fisicoquímicas de los componentes de una formulación sobre el desempeño de la forma de dosificación terminada o sobre el uso de técnicas de análisis avanzadas en la caracterización de los materiales o los sistemas de suministro de fármacos. El interés farmacéutico en la ciencia de los materiales incluye el diseño de materiales con características físicas y químicas específicas, el uso de modelos que permitan predecir el desempeño de las formas de dosificación y el desarrollo de nuevas técnicas de caracterización de los materiales.11
Las técnicas de análisis como las de rayos X y las de conductividad eléctrica de las formulaciones ejemplifican las nuevas técnicas de caracterización de los materiales. El diseño de materiales se ejemplifica con la obtención de partículas con diferentes tamaños, morfologías y estructuras de los cristales. El concepto de modelos predictivos se ejemplifica con el establecimiento de relaciones matemáticas entre el desempeño in vitro de las formas farmacéuticas y su absorción in vivo. El interés en los modelos predictivos radica en la posible reducción de costos de los estudios in vivo.
Los excipientes
La farmacopea y el formulario nacional de los Estados Unidos de América12 define a los excipientes como: Cualquier componente que se agrega intencionalmente a la formulación de una forma farmacéutica, que es diferente del principio activo. La comisión internacional de los excipientes13 los define como: Sustancias, aparte del principio activo, que se encuentran en una forma de dosificación, las cuales se han evaluado de manera apropiada en su seguridad y que se incluyen en un sistema de suministro de fármacos para ayudar en su procesamiento o manufactura, para proteger, apoyar y mejorar la estabilidad, la biodisponibilidad o la aceptabilidad por el paciente, para apoyar en la identificación del producto, para mejorar cualesquier otros atributos de seguridad y efectividad de la forma de dosificación, durante su almacenamiento y durante su uso.
La definición anterior incluye a los solventes utilizados durante la producción a pesar de que no se conserven en el producto terminado. Como se puede ver, los excipientes ayudan en la fabricación y en el desempeño de las formas de dosificación, sirviendo a diferentes propósitos. Tomando como ejemplo a los productos farmacéuticos sólidos, los propósitos serían como los de diluyente, aglutinante, desintegrante, lubricante, etc. Los excipientes son considerados como componentes funcionales de una formulación.
En contraste con los excipientes utilizados antes de la nanotecnología, la funcionalidad de los excipientes emergentes es de mucho mayor repercusión sobre la conducción del fármaco hacia una meta específica y sobre su actividad sobre tejidos o células específicas. Esto es, la actividad terapéutica de los fármacos se ve influida en mayor medida por los excipientes. Varios de los excipientes nuevos son entidades muy complejas, comparadas con los excipientes tradicionales. Entre ellos se encuentran los dendrímeros, las nanopartículas, los nanotubos de carbono, los cocleatos, las huellas o sondas cuánticas y las estructuras biomiméticas.
Los dendrímeros, se han utilizado como transportadores en sistemas de suministro de fármacos. Los dendrímeros son polímeros con una estructura en forma de árbol y casi esféricos, con diámetros entre 2 y 10 nm, que se utilizan como tales y como bloques para la construcción de sistemas supramoleculares. Entre los usos actuales y futuros de los dendrímeros se encuentran14:
• Suministro de ácidos nucléicos, fármacos encapsulados y fármacos enlazados covalentemente
• Formación de películas para liberación controlada
• Lubricantes para procesos farmacéuticos
• Transportadores para sistemas de suministro de fármacos
• Reactivos de diagnóstico, serodiagnosis y sistemas biosensores
• Vacunas contra bacterias, virus y parásitos
• Modificadores de las interacciones célula-célula y en la expresión de genes
Un ejemplo de la utilización de los dendrímeros es con fármacos que actúan contra células cancerigenas. En algunas variedades de células cancerigenas se encuentran sobre expresados los receptores de folato. Los dendrimeros modificados con folato utilizan esa circunstancia para orientarse hacia esas células a través del reconocimiento ligando-receptor. Los dendrimeros modificados se conjugan covalentemente con el fármaco metotrexato para matar específicamente las células que expresen este receptor. Esto ocurre después que el complejo dendrimero-metotrexato, atrapado por las células por endocitosis mediada por el receptor, libera el fármaco intracelularmente. El complejo con el dendrimero permite dar dirección, capacidad para formar imágenes y una liberación intracelular del fármaco. Este complejo muestra una toxicidad 100 veces menor que el metotrexato libre.15
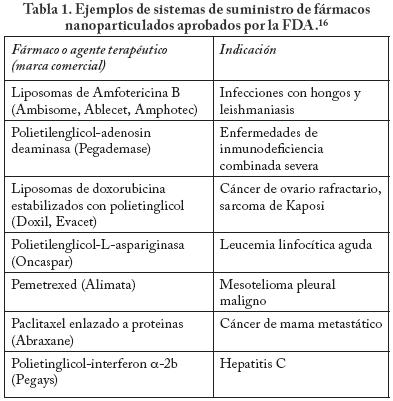
Las nanopartículas son partículas coloidales sólidas de polímeros biodegradables o materiales lipídicos de un tamaño de 10 a 1000 nm. Las nanopartículas funcionan como excipientes para transportar fármacos adsorbidos sobre su superficie, dispersos en el interior del polímero o lípido o disueltos en la matriz de la partícula. La Tabla 1 ejemplifica algunos de los sistemas de suministro de fármacos en que se han usado las nanopartículas, incluyendo entre ellas a los liposomas, y que están aprobados por la FDA.16
Los nanotubos de carbono son estructuras ordenadas de nanomateriales grafíticos huecos. Conceptualmente los nanotubos de carbono son hojas de grafeno simples o múltiples que se han enrollado para dar nanotubos de una sola pared o de paredes múltiples. Los de una pared muestran un diámetro es de 0.4-2 nm y un largo que va de algunos cientos de nanómetros hasta varios micrómetros. Los de paredes múltiples coaxiales presentan diámetros de 2-100 nm.
Los nanotubos de carbono son materiales con potencial para usarlos como excipientes farmacéuticos debido a su estructura flexible y a la posibilidad de funcionalizarlos químicamente. La aplicación en sistemas biológicos depende de su compatibilidad con medios hidrofílicos. Particularmente depende de su solubilización en solventes farmacéuticos y de sus propiedades químicas, fisicoquímicas y farmacéuticas.
Los nanotubos de carbono se han utilizado para orientar o dirigir sustancias activas hacia órganos específicos. Un ejemplo de ello es su aplicación para dirigir péptidos con actividad biológica hacia el sistema inmune. Un epítope se unió covalentemente a un grupo amino en un nanotubo de carbono, utilizando un elemento de unión bifuncional. Los nanotubos modificados con el péptido mimetizan la estructura secundaria que sirve para el reconocimiento de anticuerpos monoclonales o policlonales. La inmunización de ratones muestra que los conjugados de los nanotubos con el péptido tienen una mayor respuesta de anticuerpo in vivo que el péptido libre.17
Las estructuras supramoleculares antes mencionadas son llamadas dispositivos nanobiotecnológicos, dispositivos nanobiológicos o nanodispositivos semisintéticos (biosintéticos). Un ejemplo de su utilización farmacéutica es la orientación de los fármacos hacia ciertos tejidos seleccionados. Los métodos para lograrlo incluyen las preferencias celulares para atrapar las estructuras supramoleculares de cierto tamaño y química superficial, una partición o reparto preferente de los nanomateriales debido a su grado de opsonización, la extravasación diferencial del sistema vascular de varios tejidos o la afinidad de moléculas biológicas integradas a los nanodispositivos con receptores en las células o tejidos de interés.
El disparo seguro y efectivo de la acción terapéutica podría ser también función de los nanodispositivos. El disparo de la acción terapéutica podría incluir eventos como la liberación de un fármaco desde un depósito o el procesamiento físico o químico de los materiales farmacéuticos para transformarlos de un estado inerte a uno activo. En este último caso el material inerte se activa a un tiempo y en un lugar específico. Las estrategias más comúnmente utilizadas para iniciar la acción terapéutica son un estímulo externo, un sistema de disparo intrínseco y una señalización secundaria. Estos sistemas requieren de una activación predecible para controlar los nanodispositivos o de un evento de disparo intrínseco definido espacial y temporalmente, mediado por alguna condición particular. El evento de activación podría ser la ruptura o separación de un inhibidor para liberar los efectores. Otro modo de activación podría ser un cambio químico o un cambio en la conformación del efector, como respuesta a una condición del medio ambiente.18
Aún no se ha establecido claramente si las estructuras obtenidas de la nanotecnología se puedan clasificar como excipientes, como fármacos o como ambos. En términos generales, las estructuras farmacéuticas obtenidas en la nanotecnología se denominan como sistemas de suministro de fármacos. El argumento de que un excipiente debe ser una molécula que se encuentre totalmente separada y no unida covalentemente al principio activo excluiría a la mayoría de los productos obtenidos en la nanotecnología. Sin embargo, existen antecedentes en que se ha considerado como excipientes a componentes unidos covalentemente a los principios activos, por ejemplo, el polietilenglicol en proteínas pegiladas y la albúmina en productos conjugados como el complejo albúmina-doxorubicina.19
Una interpretación literal de la definición de excipiente incluiría también diversas moléculas o sustituyentes tales como virus incompetentes para su replicación (vectores adenovirales o retrovirales), componentes de proteínas bacterianas, anticuerpos monoclonales, bacteriófagos, proteínas fusionadas y quimeras moleculares. Un ejemplo de su uso sería él de un profármaco con una enzima de direccionamiento hacia un gene. Esto es, una quimera que contiene una secuencia de DNA que regula la transcripción capaz de ser activada selectivamente en las células de mamífero y que fue unida a una secuencia que decodifica una enzima β-lactamasa y la libera a las células seleccionadas. La enzima expresada en las células escogidas cataliza la conversión de un profármaco, que se administra posteriormente, a un agente tóxico. Un efecto similar se lograría utilizando un anticuerpo conjugado a una enzima, que es capaz de catalizar in vivo la transformación de una sustancia no-citotóxica a una que si es citotóxica. En estos ejemplos la quimera o enzima unida al anticuerpo se consideraría como un excipiente.20
La evolución de la funcionalidad de los excipientes derivados de la nanotecnología hace difícil el discriminar la diferencia entre los excipientes y los fármacos; debido al papel tan importante que juegan los excipientes en la respuesta clínica de los fármacos. Se debe crear una nueva perspectiva acerca de que son los excipientes y acerca de su contribución en la nueva generación de los sistemas derivados de la nanotecnología, la biotecnología y de los medicamentos genéticos.
Actualmente, muchas compañías farmacéuticas tratan de disminuir sus costos de desarrollo sin comprometer la calidad de sus productos. Para este fin se ha planteado la utilización de excipientes, como un elemento de bajo costo, para aumentar la funcionalidad de los medicamentos, esto sin afectar de manera importante los costos básicos de la empresa. Los excipientes permiten mejorar la efectividad de los fármacos de diferentes maneras. Un ejemplo de ello sería el control de la absorción de los fármacos, la mejora de la seguridad y de la estabilidad de los medicamentos. Esta circunstancia nos enfatiza el aumento de la importancia de los excipientes en la fabricación de formas farmacéuticas sólidas y su participación en la innovación de las formulaciones.21
Los excipientes en el diseño de un producto
En muchos casos, los excipientes se podrían considerar como un "mal necesario" en las formulaciones farmacéuticas. Los excipientes son necesarios para suministrar los principios activos pero el número de excipientes que requiere una formulación y sus posibles interacciones pueden complicar el trabajo de diseño para la fabricación comercial. Indudablemente la función económica también es de considerarse en cada decisión que se toma en la empresa farmacéutica, llevándonos a un análisis de costo-beneficio y de oferta y demanda en la selección de excipientes.22
En un ejemplo de una forma farmacéutica sólida como lo es una tableta, las características deseables que podrían constituirla incluirían:
• Fácil de fabricar a diferentes escalas de producción
• Estable física y químicamente, aún en condiciones de almacenamiento adversas
• Aceptable globalmente para los pacientes y los proveedores de servicios de salud
• Suministra el principio activo al sitio de acción a una velocidad óptima
• Se fabrica de manera económica y reproducible, utilizando equipo de manufactura común
• Contiene pocos excipientes y estos están registrados en las farmacopeas y los venden diferentes proveedores
• Los excipientes sólo se incluyen para un propósito específico
El principio de diseño de tal forma farmacéutica inicia con el desarrollo de un perfil del producto que se desea fabricar. Después de ello, es de vital importancia la comprensión de diferentes paquetes de información que son necesarios para la siguiente toma de decisiones. Los paquetes de información son:
• Propiedades físicas y químicas de los ingredientes activos
• Propiedades físicas y químicas de los excipientes que se podrían utilizar
• Principios de operación del equipo de fabricación que esté disponible en el mercado y en la empresa
Las propiedades del principio activo son la principal limitante para la formulación y definen como es que este principio activo responde a las condiciones de estrés que ocurren durante la fabricación y el uso por el paciente. Una vez conocidas las propiedades del principio activo, se pueden escoger los excipientes y el método de fabricación que permitan superar las deficiencias aparentes del fármaco para transformarse en un medicamento. Esto enfatiza la importancia de la funcionalidad de cada excipiente así como los beneficios de cada operación de fabricación.23
La selección de excipientes durante el desarrollo de un producto farmacéutico se enfoca sobre las características que se desean o se buscan en el excipiente, por ejemplo, funcionalidad, consistencia del material, aceptación por autoridades sanitarias, el costo, su disponibilidad y su origen. Una selección sin prudencia tanto de excipientes así como de los proveedores puede crear problemas que podrían conducir al fracaso del desarrollo del producto. La aplicación de los conceptos de la calidad a través del diseño (quality by design) enfatiza la necesidad de caracterizar las propiedades de los materiales, por ejemplo, sus propiedades de tamaño y distribución del mismo, sus propiedades térmicas, químicas, reológicas y mecánicas.24 Sin embargo, es necesario también caracterizar su comportamiento tecnológico como materia prima y hacer explicito su desempeño en la formulación y en el proceso de manufactura.
La funcionalidad de los excipientes
La selección de los excipientes requiere un balance entre la eficiencia en tiempo, en costo y en el desempeño esperado en el producto. La razón para buscar la multifuncionalidad en los excipientes es la disminución de su número en una formulación así como la disminución de las etapas de procesamiento. Los excipientes se utilizan para convertir un fármaco en una forma farmacéutica que el paciente puede utilizar para tener un beneficio terapéutico. Los excipientes se incluyen en una formulación por poseer propiedades que en conjunto con un proceso permiten fabricar un medicamento con las especificaciones requeridas. Las propiedades deseadas de un excipiente se refieren a su desempeño funcional o funcionalidad.25,26
La funcionalidad es la propiedad que es deseable en un excipiente para ayudar en la fabricación y que mejora las condiciones de la manufactura, la calidad o el desempeño del medicamento.
Obviamente todos los excipientes cumplen una función o un propósito, si no fuera así no se incluirían en las formulaciones. Sin embargo, la funcionalidad de un excipiente se refiere a su contribución en la elaboración, la liberación, identidad y en la forma de dosificación. La funcionalidad no sólo dependería de las propiedades intrínsecas del excipiente, sino también de la aplicación a una fórmula y a un proceso específico; la funcionalidad va más allá del excipiente. Esto quiere decir que no se podría garantizar totalmente la funcionalidad del excipiente de forma aislada.25
Cada formulación o producto tiene sus propios requisitos o exigencias para la funcionalidad de un excipiente. Por esta razón, la funcionalidad sólo puede determinarse en un lote y un producto específico.26
Lo que podría considerarse una funcionalidad para un producto podría ser la disfuncionalidad para otro. Sin embargo, ciertas propiedades de los excipientes podrían relacionarse a la funcionalidad de una manera más general y servir como medio de control de los excipientes. Estas características relacionadas con la funcionalidad serían subrogadas o representantes de la funcionalidad, pudiendo medirse y establecer límites sobre ellas. Tomando en consideración el paradigma de las tecnologías analíticas de los procesos (PAT) de que los productos pueden ser mejor controlados cuando hay un mayor control del proceso, se puede decir que si hay un mejor control y comprensión de las características de los excipientes y de las características que afectan su desempeño en la formulación y en el proceso, los productos serían mejor controlados en sus características de producto terminado.27
Actualmente se considera que la funcionalidad de los excipientes podría determinarse a través de pruebas defuncionalidad subrogadas, esto es, a través de pruebas físicas que tengan alguna relación con la funcionalidad requerida o con las pruebas de desempeño.
En el sentido antes expresado, se buscan pruebas que nos permitan predecir si es que un lote particular de un excipiente cumple los requisitos de funcionalidad para fabricar un producto que cumple con las especificaciones establecidas, en todos sus aspectos. Las características relevantes diferirán para cada aplicación del excipiente. Para cada aplicación del excipiente se podrían identificar los parámetros que sean críticos para la función específica del excipiente en esa aplicación en particular.28
Las características relacionadas con la funcionalidad serían características físicas y/o fisicoquímicas que son críticas para los usos típicos de un excipiente. Sin embargo, también se podrían utilizar como pruebas subrogadas aquellas que demuestran el desempeño tecnológico de los excipientes puros sin una formulación o aplicación a un fármaco y producto específico. Estas pruebas podrían incluirse en las especificaciones del excipiente. Entre las pruebas subrogadas de funcionalidad referentes al desempeño tecnológico se incluyen las curvas de compactabilidad, de presión de expulsión y las propiedades de desintegración de los excipientes individuales, en su forma de tabletas.
Otras definiciones de la funcionalidad de un excipiente incluyen el término de excipientes con funcionalidad añadida o aumentada. Esto se refiere al procesamiento de los excipientes originales los cuales se han procesado o coprocesado para mejorar o aumentar propiedades ya existentes o para dar nuevas funcionalidades a excipientes que no las tenían. En comparación con los excipientes originales, se considera que las propiedades que se mejoran incluyen las propiedades físicas, mecánicas y/o químicas de estos excipientes que ayudan a resolver problemas de la formulación como la fluidez de los polvos, compresibilidad y compactabilidad, higroscopicidad, palatabilidad, disolución, desintegración, adhesión y generación de polvo.
Un ejemplo de funcionalidad añadida es el manitol compresible directamente, el cual permite la preparación de tabletas robustas que no sufran daño durante su procesamiento y transporte.
Para este fin se han desarrollado un manitol texturizado, uno de compresión directa, otro secado por aspersión y uno granulado. El procesamiento de estos excipientes en condiciones definidas de fabricación les da una estructura exterior muy porosa y friable. Durante la compresión la estructura se fragmenta en partículas pequeñas, las cuales ocupan los espacios intersticiales entre las partículas porosas grandes.29 Galen IQMR es también un excipiente que se ha procesado para obtener diferentes funcionalidades. Este excipiente cumple con todas las especificaciones de la isomaltosa registradas en diferentes farmacopeas (BP, Ph. Eur., USP 29-NF 24) y se ha procesado para obtener diferentes tipos, los cuales se utilizan en formas farmacéuticas sólidas. Entre ellos, el tipo 720 (solubilidad de 25 g/ 100 g) se usa para compresión directa de fármacos en dosis altas o bajas, para tabletas de disolución lenta. El tipo 721 que es un aglomerado esférico al igual que el grado 720 (solubilidad de 45 g/100 g) se usa también para compresión directa pero de tabletas que desintegran y disuelven muy rápido. Otros tipos de Galen IQMR son presentaciones pulverizadas de diferente tamaño de partícula y que son utilizadas para granulación húmeda.30
Otros ejemplos de funcionalidad se mencionan en el subtítulo de vías para mejorar o aumentar la funcionalidad de los excipientes.
El término excipiente de funcionalidad elevada (high functionality excipients - HFE) también se ha utilizado para designar la funcionalidad de los excipientes. Particularmente se refiere a excipientes que son multifuncionales, que desempeñan las funciones de varios excipientes tradicionales, sin la necesidad de un procesamiento complejo. Los excipientes de funcionalidad elevada se consideran particularmente relevantes para responder a los desafíos cada vez más complejos en el desarrollo de productos nuevos para los que se requieren perfiles de suministro de los fármacos también complejos. Ejemplos de excipientes con una elevada funcionalidad son la celulosa microcristalina silicificada, el estearil fumarato de sodio y el copolimero de alcohol polivinílico-polietilenglicol.22 Otros ejemplos de funcionalidad se mencionan en el subtítulo de vías para mejorar o aumentar la funcionalidad de los excipientes.
Algunos autores consideran otra denominación de excipientes, relativa a su funcionalidad, en el término de excipientes con grado de especialidad. Este término corresponde a excipientes que mejoran alguna característica de funcionalidad, a menudo se considera que a expensas de otra u otras funciones. Un ejemplo sería la celulosa microcristalina con un mayor tamaño de partícula a la que tradicionalmente se ha suministrado. Este mayor tamaño de partícula promueve un mayor flujo del polvo, sin embargo y al mismo tiempo, el mayor tamaño de partícula disminuye la compactabilidad. Esta circunstancia podría obligar a agregar otros componentes a la formulación para compensar esta deficiencia.22
NeusilinMR es otro ejemplo de un excipiente de especialidad derivado de silicato de aluminio y magnesio sintético que se utiliza en formas farmacéuticas sólidas y se encuentra disponible en varios grados. Los grados difieren en su densidad aparente, contenido de humedad tamaño de partícula y pH. NeusilinMR se utiliza en la compresión directa así como en la granulación húmeda. Se encuentra disponible en forma de gránulos esféricos y en forma de aglomerados. Se utiliza como diluente, aglutinante y para aumentar la fluidez de los polvos.31
Los excipientes críticos serían otra denominación relativa a la funcionalidad de los excipientes. Estos excipientes se definirían como materiales inertes que pueden afectar las características, la calidad, la estabilidad o el desempeño de los medicamentos. Un ejemplo de ellos serían los agentes solubilizantes y los agentes que modifican la disolución tales como los tensoactivos, los agentes mojantes para fármacos hidrofóbicos, los conservadores para inyectables, etc.32
Como se puede observar existen varios términos para definir la funcionalidad de los excipientes, sin embargo, algunos autores consideran que estos términos como el de funcionalidad elevada son sólo utilizados con fines de mercadeo y no tienen mayor significado. No se ha encontrado un consenso acerca del significado de excipiente de elevada funcionalidad y se considera que acaba significando lo mismo que la simple funcionalidad. El hecho es que ningún formulador utilizaría excipientes de baja funcionalidad. Aunque se podría argumentar que un excipiente tiene elevada funcionalidad en una formulación ya que sin él la formulación no funciona.
Otros términos como el de los excipientes críticos, el cual se ha utilizado en la literatura, sería también un término confuso. Igual que en el caso anterior, se podría argumentar que un excipiente o una combinación de los mismos podría ser crítico para el funcionamiento adecuado de una formulación de liberación controlada. Sin embargo, lo mismo se podría decir de los demás excipientes.28
Por otro lado, el desempeño funcional de los excipientes puede ser múltiple y esta multiplicidad sería benéfica en el diseño de una formulación. Los excipientes multifuncionales incluyen excipientes pre-procesados y co-procesados que proveen mayores funcionalidades a las formulaciones. Funcionalidades como fluidez, compresibilidad, distribución del tamaño de partícula, forma, porosidad, etcétera. El término multifuncionalidad se aplica también a productos que cumplen varios objetivos en una formulación.33
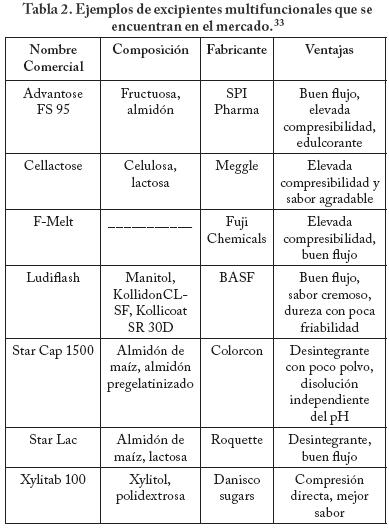
Entre los excipientes multifuncionales se cuenta al LudipressMR, un producto que es coprocesado de lactosa, KollidonMR y Kollidon CLMR y que cumple funciones de diluente de compresión directa, aglutinante y desintegrante. De la misma manera la celulosa microcristalina que podría utilizarse como diluente y auxiliar en la fabricación de tabletas, cumpliendo funciones de aumento de la compresibilidad, compactabilidad y de mejora en la desintegración; la hidroxipropilcelulosa con un bajo grado de sustitución que facilita la desintegración y previene la laminación. El aceite vegetal hidrogenado (LubritabMR, SerotexMR), el monoestearato de glicerilo destilado (Myvaplex 600PMR), el behenato de glicerilo (Compritol 888 ATOMR) y el palmitato estearato de glicerilo (Precirol ATO5MR) se anuncian como lubricantes para tabletas y cápsulas y como agentes para prolongar la liberación. Los almidones pregelatinizados que son insolubles y que se hinchan fuertemente se anuncian como vehículo para fármacos higroscópicos, como estabilizador de fármacos sensibles a la humedad y como desintegrantes.24 Algunos ejemplos de excipientes multifuncionales que se encuentran en el mercado se describen en la Tabla 2.
En la mayoría de las formulaciones los excipientes conforman la mayor parte de una formulación, tanto en número así como en proporción. Esta circunstancia, por si sola, justifica la atención que estos materiales merecen para asegurar la calidad, eficacia y reproducibilidad de las formas farmacéuticas. En este sentido, las especificaciones de las características químicas de los excipientes se describen en las farmacopeas. Sin embargo, hasta hoy las características físicas y de funcionalidad no se han considerado suficientemente. Existe la necesidad de establecer pruebas objetivas que comparen el desempeño tecnológico de los excipientes y su inclusión en los medicamentos.34
El control de la funcionalidad de los excipientes es tan importante como el control de su identidad y de su pureza. Entre las razones para su control estaría el hecho de que muchos excipientes tienen múltiples funciones y de que no hay ninguna advertencia o manifestación de un desempeño diferente en los excipientes obtenidos de diferentes proveedores. Consecuentemente se requiere controlar la funcionalidad de los excipientes para asegurar una producción sin contratiempos.
Establecimiento de las especificaciones de la funcionalidad de los excipientes
Las pruebas o ensayos de funcionalidad de los excipientes son una tendencia de la industria farmacéutica. Muchas materias primas requieren de algún tipo de pruebas de funcionalidad para determinar su desempeño en el producto farmacéutico terminado. Las pruebas de funcionalidad comprenden un ensayo físico o tecnológico para determinar que se logrará un efecto deseado en la formulación. A menudo es difícil la obtención de la funcionalidad deseada con una consistencia entre un lote y otro. Particularmente cuando los proveedores sólo certifican que los excipientes cumplen con las exigencias farmacopéicas.
Las GMPs puntualizan que cada componente debe cumplir con todas las especificaciones escritas que aseguran que el producto terminado cumple con las exigencias de pureza, potencia y calidad. Como respuesta a estas necesidades de los fabricantes farmacéuticos, los proveedores de excipientes han escrito especificaciones de sus productos que se sustentan en un muestreo y análisis por una unidad de control de calidad. Sólo se puede exigir que los proveedores de excipientes aseguren que los procedimientos se siguen y que se producen excipientes de una calidad consistente.35
Debido a esta circunstancia debe estudiarse la función de los excipientes, y su consistencia entre un lote y otro, su participación en el desempeño de los medicamentos, su papel en la capacidad del producto para ser procesado sin contratiempos y en su papel en la calidad de los productos.
Se ha recomendado que se realicen pruebas de funcionalidad o procesabilidad que vayan más allá de los ensayos de las monografías farmacopéicas. Esta estrategia sería consistente con las iniciativas para el siglo 21 de la FDA-QbD and CGMP. Se ha considerado una proposición de incluir en la USP-NF un apoyo o guía para las pruebas de funcionalidad que debieran presentarse en un capítulo general, con referencias a las pruebas que serían adecuadas a la funcionalidad deseada.36
El desempeño de los excipientes debe optimizarse para asegurar que desarrollan consistentemente la función deseada y asegurar también que el proveedor y la manera en que él controla la calidad del material se encuentran definidos.37
La selección de las pruebas se hace en función de su significación o importancia, la cual se refiere a:
• Pruebas que nos den el conocimiento y una mejor comprensión del impacto del excipiente sobre la fórmula, el proceso y el producto
• Especificaciones que tengan un significado
• Que permitan reconocer y aceptar la variabilidad normal entre un lote y otro
• Que permitan comprender cual es la variabilidad normal y su posible impacto sobre el proceso
• Que el formulador comprenda que necesita trabajar con esta variabilidad y no contra ella
La guía para las prácticas correctas de manufactura de los excipientes de la IPEC-PQG define las especificaciones como:
Lista de pruebas, referencias a procedimientos analíticos y a criterios de aceptación adecuados que son límites numéricos, intervalos u otros criterios para las pruebas descritas para un material.38
Comúnmente son las especificaciones de una monografía en una farmacopea. Sin embargo, estas especificaciones generalmente no están actualizadas y fueron establecidas a propósito con límites muy amplios. Estos límites fueron establecidos con productos con cierta variabilidad la cual sólo es permisible gracias a dicha amplitud. Las especificaciones más importantes son, sin embargo, las del cliente que compra los excipientes. El problema es que no todos los clientes saben lo que desean de las características de funcionalidad, en términos numéricos. A veces, toman las mismas citadas por los proveedores, con la esperanza de que los excipientes se desempeñen de manera consistente. Por otro lado, algunos clientes exageran en las especificaciones, considerando que si son más cerradas disminuirán la variabilidad en los productos. En algunos casos las formulaciones se diseñan de manera robusta, de forma tal que "absorben" la variabilidad de los excipientes y principios activos. En otras circunstancias la variabilidad de los excipientes puede conducir a fallas inexplicables y a desviaciones atribuibles a los excipientes. Generalmente, el problema se resuelve con un compromiso entre el cliente y el proveedor de los excipientes, estableciendo especificaciones de excipientes que se pueden trabajar. Los excipientes se fabrican con un cierto grado de variabilidad que no siempre es controlable por el fabricante de excipientes. Antes de incluir una especificación para un excipiente debemos asegurarnos que el proveedor es capaz de cumplirla, además de permitir que podamos confiar en que el excipiente se desempeñará satisfactoriamente durante la fabricación, el almacenamiento y el uso del producto farmacéutico terminado.39
En términos más coloquiales las especificaciones se han descrito como: "Una promesa, y justo como cualquier otra promesa, deberíamos ser sinceros cuando la hacemos y ser capaces de cumplirla. Una falla en mantener la promesa genera decepción, las fallas continuas nos conducen a la desconfianza y la ruptura conciente de una promesa no es menos que deshonestidad". Cuando todo falla, lo razonable es disminuir la severidad de nuestros estándares, hasta un nivel que sea posible cumplirlos.40
Una de las propiedades que se podrían considerar subrogadas o sustitutas de la funcionalidad de los excipientes en forma de polvos es el tamaño de partícula. La distribución del tamaño de las partículas de los polvos pudiera tener efectos importantes sobre las características de calidad de los productos farmacéuticos terminados.
Propiedades tales como:
• Disolución, solubilidad, biodisponibilidad
• Procesabilidad de la forma farmacéutica
• Estabilidad de la forma farmacéutica
• Uniformidad del contenido de la forma farmacéutica
• Apariencia del producto
Estas propiedades del producto se considera que están influenciadas por el tamaño de las partículas, no sólo del fármaco sino también de los excipientes. En este sentido, la distribución del tamaño de las partículas de los polvos debe controlarse utilizando métodos analíticos y especificaciones apropiadas.
El establecimiento de las especificaciones toma en cuenta la variabilidad de los lotes fabricados, la variabilidad de los métodos de análisis así como la repercusión que las variaciones tengan sobre las propiedades del producto.
La Tabla 3 muestra los parámetros que se han utilizado para describir la distribución del tamaño de partícula de un material.41
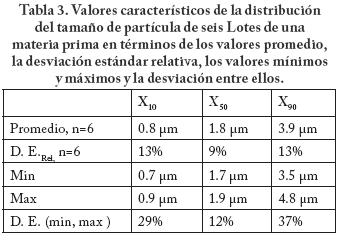
Suponiendo que el objetivo para el valor de X90 corresponda con un valor promedio de los datos de X90 = 3.9 μm, se desearía entonces establecer el criterio de aceptación para el límite superior de X90. Si se toman los resultados de la Tabla 3 para determinar el criterio de aceptación, entonces se podría considerar que el valor máximo registrado sería un límite superior razonable. En los resultados de la Tabla 3 se considera que estos incluyen la variabilidad analítica y la variabilidad de la fabricación ya que corresponden con los valores obtenidos durante un periodo de 3 años.
Si se toma el valor de X90 ≤ 4.8μm como criterio de aceptación entonces entre el límite superior y el valor medio habría un intervalo de trabajo de 0.9 μm, equivalente a 23% en relación al valor medio.
Esto nos daría la especificación en su valor promedio y el intervalo de variación permitido, para ese material. Partiendo de la circunstancia de que con todos los lotes estudiados se obtuvieron productos aceptables o que cumplen con sus especificaciones como producto terminado.
El caso anterior es un ejemplo de cómo se pueden establecer las especificaciones. Un procedimiento similar se puede seguir para otros parámetros.
Vías para mejorar o aumentar la funcionalidad de los excipientes
Una mejor funcionalidad de los excipientes se puede lograr a través del desarrollo de nuevas entidades químicas de los excipientes, de nuevos grados de los materiales existentes y de nuevas combinaciones de los materiales existentes. El desarrollo de nuevas entidades químicas para utilizarlas como excipientes requiere de varias etapas de la regulación sanitaria acerca de la seguridad y toxicidad del producto, lo cual involucra mucho tiempo y dinero. Esto equivale a proyectos con mucho riesgo, elevadas inversiones y pocas probabilidades de ganancias. El desarrollo de nuevos grados de excipientes ya existentes (diferentes propiedades físicas y fisicoquímicas) se ha mostrado como la mejor estrategia para el desarrollo de excipientes con un mejor desempeño. Ejemplos de ello serían el almidón pregelatinizado, la CroscarmelosaMR y la Crospovidona. Sin embargo, la funcionalidad sólo puede mejorarse hasta cierto límite. Actualmente la estrategia más interesante para mejorar la funcionalidad de los excipientes podría ser la combinación de los excipientes existentes, debido a que todas las formulaciones contienen múltiples excipientes y a que se pueden probar todas las posibles combinaciones para lograr las características de desempeño deseadas. Sin embargo, el desarrollo de tales combinaciones es un proceso complejo, debido a que un excipiente puede interferir con la funcionalidad previa de otro excipiente.42
La funcionalidad que se desea en un excipiente, por ejemplo para compresión directa, incluiría parámetros tales como un flujo libre, compactabilidad, capacidad para diluirse, capacidad para poderse reprocesar, estabilidad y con un tamaño de partícula controlado, entre otros. Como ya se ha mencionado, los excipientes se han mejorado en su funcionalidad básicamente a través de dos métodos. El primero de ellos sería la modificación de sustancias individuales y el segundo sería el coprocesamiento de dos o más sustancias para obtener un excipiente con partículas de características homogéneas y distintas a las originales. La Tabla 4 resume los principales rasgos de ejemplos del primer método, señalando sus ventajas y limitaciones así como una lista de productos que les ejemplifican.41,43
Un ejemplo de la transformación física de un excipiente ya conocido es el de la lactosa. La lactosa secada por aspersión se introdujo en el mercado farmacéutico en la década de 1960 y es un excipiente utilizado para compresión directa. Este producto se obtiene secando por aspersión una suspensión de cristales de monohidrato de α-lactosa, como partículas primarias, en una solución saturada de lactosa. El producto obtenido son partículas esféricas que se tamizan para obtener una distribución estrecha del tamaño de las partículas (Figura 1), la cual mejora las propiedades de flujo. Aunque los cristales de la α-lactosa son suficientemente grandes para fluir razonablemente, no es particularmente buena para formar tabletas. Las propiedades de compactación de la lactosa secada por aspersión dependen del tamaño de los cristales primarios.44

El coprocesamiento es un método utilizable sin la necesidad de pruebas toxicológicas rigurosas como la de los excipientes completamente nuevos. Puede definirse como la combinación de dos o más excipientes ya existentes a través de un procesamiento adecuado. El coprocesamiento supone llegar a obtener propiedades de los excipientes que sean superiores a las de una mezcla física simple; supone la obtención de un producto con valor agregado en su relación de funcionalidad contra el precio.
El proceso de desarrollo de excipientes coprocesados involucra:
• La identificación de los excipientes que se desea coprocesar, a través del estudio de sus características y de la funcionalidad que se desea tener.
• La selección de las proporciones de los varios excipientes.
• La determinación del tamaño de partícula requerido para coprocesar. Particularmente importante cuando uno de los componentes se procesa en una fase dispersa ya que el posterior procesamiento del tamaño de partícula de este excipiente depende del tamaño de partícula que tenía inicialmente.
• Selección de un proceso de secado adecuado, p. e. secado por aspersión (spray-dry) o secado instantáneo (flash-dry).
• Optimización del proceso para evitar variaciones entre un lote y otro en la funcionalidad del excipiente que se pretende obtener.
De acuerdo al comité de expertos de monografías de excipientes 2 de la USP, Los excipientes coprocesados son una combinación de dos o más excipientes que poseen ventajas en su desempeño que no se pueden obtener usando una mezcla física simple de la misma combinación de excipientes. Una característica que deben poseer estos excipientes coprocesados es que deben diferenciarse en al menos una propiedad, no referida al desempeño, de la mezcla obtenida por mezclado físico simple. Un excipiente coprocesado es aquel que típicamente se obtiene por algún método de fabricación especializado como la dispersión de elevado corte, granulación, secado por aspersión o extrusión de un material fundido.
La característica física o química en la que difiere el excipiente coprocesado de la mezcla física simple puede ser la causa o puede correlacionarse con las mejoras en el desempeño del excipiente. Sin embargo, tal característica debe ser inherente, demostrable analíticamente y cuantitativamente diferente en el excipiente coprocesado, antes de su incorporación en el producto farmacéutico terminado.47
Un objetivo particular de los excipientes coprocesados es la compresión directa de los productos farmacéuticos sólidos. Esto requiere de excipientes con características físicas que aumenten la compresibilidad y la fluidez de las mezclas para compresión.
Además de los fármacos, las mezclas para compresión comúnmente contienen un diluente, un aglutinante, un desintegrante, deslizantes, etcétera. Las propiedades físicas de estas mezclas no son fáciles de predecir y pueden presentar problemas de uniformidad en su mezclado o de segregación. Por estas razones, los nuevos excipientes se desarrollan para poseer las propiedades de los componentes clave de una mezcla para tabletear en un solo excipiente. Este debe ser un material granulado que es muy fluido y compresible. Una mezcla de este tipo de excipientes con los fármacos y quizá con un lubricante podría comprimirse directamente y con buenos resultados en una tableteadora de alta velocidad.48
La Tabla 5 muestra ejemplos de materiales coprocesados que se encuentran en el mercado. En la Figura 2 se muestran las transformaciones de los excipientes que conforman al excipiente PanExcea™ MHC300G. Estas microfotografías ejemplifican los cambios que ocurren durante el procesamiento y que dan una mayor funcionalidad de los excipientes.
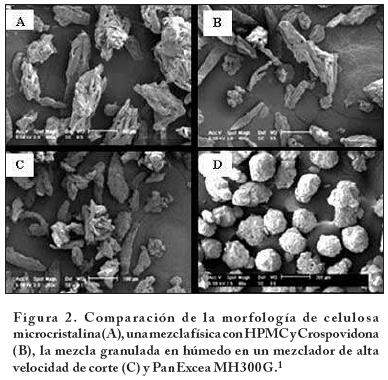
El excipiente PanExcea MH300G es un nuevo excipiente basado en la tecnología de la ingeniería de las partículas. Es un producto compuesto de celulosa microcristalina (diluente), hidroxipropilmetilcelulosa (aglutinante) y Crospovidona (desintegrante). Este excipiente se desarrolló específicamente para tabletas de liberación rápida y para su obtención por compresión directa en tableteadoras de alta velocidad. La ingeniería utilizada permite obtener partículas esféricas, porosas y con una actividad superficial que permite mejorar el flujo del polvo, la compresibilidad, la capacidad de carga de fármacos y con una desintegración consistente.
El Prosolv EasytabMR se considera un excipiente multifuncional que tiene propiedades de aglutinante, diluente, lubricante, deslizante y superdesintegrante, todas en un solo material (Figura 3). Las características de este excipiente se considera que favorecen un proceso de tableteo eficiente, impartiendo un balance de propiedades de flujo del polvo, lubricación, desintegración y uniformidad de contenido de formulaciones de liberación inmediata. Es un excipiente compuesto, de reciente creación, que es adecuado para formulaciones con contenidos de fármacos de hasta 65%.

Prosolv EasytabMR se considera particularmente útil para formulaciones difíciles de procesar por compresión directa y para fármacos abrasivos que fluyen pobremente o de muy baja densidad. Una de sus mayores ventajas es la uniformidad de contenido en formulaciones con fármacos de baja dosificación, debido a su baja tendencia a la segregación. Este hecho se puso de manifiesto al fabricar tabletas de paracetamol con el excipiente coprocesado y con la mezcla física. Utilizando como límite máximo de la uniformidad de contenido una desviación estándar relativa de 2.5%, el coprocesado se pudo tabletear a 240 000 tabletas por hora mientras que la mezcla física sólo se pudo tabletear a 80 000 tabletas por hora. Este excipiente se presenta con un tamaño de partícula de 100-110 μm, una superficie específica de 6.4 cm2/g y una densidad aparente de 0.45 g/cm3 a 0.65 g/cm3. Este tipo de excipiente se ha designado como "all-round", esto es, considerados como los que cubren todos los aspectos.49, 50
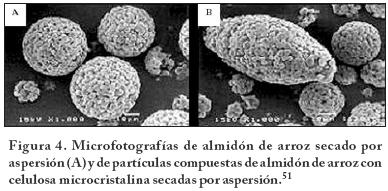
Un ejemplo de productos coprocesados y las pruebas que demuestran su funcionalidad como un excipiente de compresión directa es el almidón de arroz con celulosa microcristalina (7:3). Las tabletas fabricadas con este producto; con buena velocidad de flujo del polvo; muestran una elevada compresibilidad y una desintegración sin necesidad de un desintegrante. Las pruebas de funcionalidad subrogadas que se utilizaron fueron las características físicas de tamaño y morfología de las partículas y las pruebas de desempeño tecnológico de propiedades de flujo del polvo y características de tableteo y de las tabletas obtenidas. Las pruebas realizadas comparan la funcionalidad del material coprocesado con respecto a los excipientes de origen y del producto coprocesado con respecto a otros excipientes en el mercado.51
Los resultados del tamaño y morfología de las partículas tienen sólo valor de referencia, para observar la constancia del proceso de fabricación del producto coprocesado y con ello de una expectativa de que el producto mantenga una cierta funcionalidad en las formulaciones y procesos en los que sea utilizado.
En las pruebas de desempeño tecnológico se observa que el almidón de arroz mejora su compactabilidad (131 N) cuando se coprocesa (189 N), sin embargo, la celulosa la disminuye (desde valores demasiado altos no medibles). Se observa también que el procesamiento del almidón por secado por aspersión no tiene efecto sobre su compactabilidad (128 N). En comparación con otros productos del mercado el coprocesado tiene una compactabilidad similar al Eratab (132 N) pero mayor que Cellactose (72 N).
Los tiempos de desintegración de las tabletas están todos en un intervalo de 2-3 minutos, con excepción de la celulosa que tarda más de 30 minutos en desintegrar, lo que corresponde con una dureza muy superior a todos los demás. El índice de flujo es el parámetro que aunque mejora con el coprocesamiento (72.3), en comparación con el almidón (1.3) y la celulosa (45.2), no parece ser resultado del mismo coprocesamiento sino del secado por aspersión (Figura 4). El procesamiento del almidón sólo, por secado por aspersión, permite alcanzar resultados similares (67). En conclusión, las pruebas subrogadas de funcionalidad no permiten observar grandes ventajas atribuibles al coprocesamiento. Sin embargo, el solo procesamiento del almidón, por secado por aspersión, beneficia las características de flujo del almidón de manera muy importante.
El coprocesado de manitol con celulosa microcristalina, obtenido por secado por aspersión, forma un excipiente granulado con propiedades superiores a las de una mezcla física o los componentes individuales. Este excipiente se considera un ejemplo de la teoría de que un coprocesado funciona bien si tiene una gran cantidad de un excipiente quebradizo y una pequeña cantidad de uno plástico.52
Varias técnicas analíticas mostraron que ocurre una cierta amorfización durante el secado por aspersión, atribuible a una pérdida de cristalinidad del manitol. No se observaron cambios importantes en el grosor y friabilidad de las tabletas obtenidas con coprocesados de diferentes proporciones de los componentes. El aumento de la celulosa microcristalina aumenta la compresibilidad pero disminuye la fluidez del coprocesado. En comparación con las tabletas de la mezcla física de manitol y celulosa microcristalina las tabletas del coprocesado mostraron una liberación más rápida de un fármaco usado como referencia (glipizide).
En este estudio se utilizaron pruebas de funcionalidad subrogada de los componentes individuales, pruebas de funcionalidad subrogada en formulaciones sin principio activo y pruebas de funcionalidad en una formulación de un fármaco específico. Si bien el manitol mejora de manera importante sus características para formar tabletas, lo hace a expensas de la celulosa que pierde parte de sus propiedades superiores. Sin embargo, el coprocesado mostró un mejor flujo que cualquiera de los componentes individuales. El coprocesado mostró también mejores características sensoriales en la boca para la desintegración y el sabor.
Un caso similar al anterior es el coprocesado de crospovidona con almidón glicolato de sodio con funciones de superdesintegrante, el cual presenta un buen flujo y buenas propiedades de compresión. En su evaluación se utilizaron pruebas de funcionalidad subrogadas con el producto coprocesado y con los componentes individuales y pruebas de funcionalidad con tabletas de cefixima e ibuprofen. Las tabletas de los fármacos con el superdesintegrante coprocesado mostraron una rápida desintegración y una mejor disolución.5
Excipientes derivados de celulosa y su funcionalidad -estudio de un caso
Evaluación de la funcionalidad subrogada de algunos derivados de celulosa
Las características relacionadas con la funcionalidad pueden ser consideradas como sustitutos de la misma y permiten, de esa manera, su medición y el establecimiento de límites en su variación.54
Un ejemplo de ello es el estudio de la funcionalidad subrogada de diferentes tipos de celulosa microcristalina de las marcas comerciales, AvicelMR y AlfacelMR y de carboximetilcelulosas sódicas enlazadas transversalmente de diferente marca comercial, CarmacelMR y Croscarmelosa.MR 55
En este estudio la distribución del tamaño de las partículas caracterizado con la distribución de Weibull aplicada por RRSB56 muestra que el tamaño de las partículas de las celulosas tipo 102 es mayor que las del tipo 101 aunque no tanto como se ha reportado en la literatura.57 El tamaño de partícula de las celulosas tipo 102 es sólo 15-30% mayor que el de las tipo 101. El tamaño de las partículas del genérico AlfacelMR es mayor en ambos casos (d50% = 57 y 76 μm), Tipos 101 y 102, que el del innovador AvicelMR (d50% = 46 y 54 μm). El tamaño de las partículas de las carboximetilcelulosas enlazadas transversalmente es similar para ambos casos, CroscarmelosaMR (d50%=62 μm)y CarmacelMR (d50% = 58 μm).
Los datos de funcionalidad subrogada muestran el estado actual del tamaño de las partículas y de su distribución en los excipientes. Sin embargo, no se puede hacer un juicio de valor tecnológico farmacéutico de los diferentes derivados de celulosa ni de las marcas comerciales aunque se dice que partículas de menores tamaños y esféricas mostrarían una mayor compactabilidad.58
La compactabilidad, como prueba subrogada de la funcionalidad, mostró que la marca AvicelMR tiene una compactabilidad 26% mayor que la marca AlfacelMR y que el innovador CroscarmelosaMR tiene una compactabilidad 50% mayor que el genérico Carmacel.MR Es clara una mayor funcionalidad de las celulosas innovadoras que las correspondientes celulosas genéricas.
El tiempo de desintegración, como prueba subrogada de la funcionalidad, mostró que el innovador AvicelMR tiene una clara superioridad en su capacidad de desintegrante, en comparación con el genérico AlfacelMR. El innovador CroscarmelosaMR muestra mayores tiempos de desintegración que el genérico Carmacel.MR En este último caso el excipiente genérico muestra una mayor funcionalidad como desintegrante que el innovador.
La presión de expulsión, como prueba subrogada de funcionalidad, no mostró diferencias apreciables entre los diferentes derivados de la celulosa, genéricos e innovadores.
En general, las pruebas subrogadas de funcionalidad muestran que los productos innovadores tienen una mejor funcionalidad que los genéricos.
Funcionalidad en formulaciones de liberación rápida y liberación prolongada de metronidazol
Las pruebas subrogadas de la funcionalidad del excipiente CarmacelMR muestran mejores propiedades de desintegrante que las de CroscarmelosaMR y la CroscarmelosaMR mejores propiedades de compactación que el Carmacel.MR Sin embargo, en formulaciones de metronidazol de liberación inmediata y de liberación prolongada no se pudo confirmar plenamente las ventajas de un excipiente sobre el otro.
Las formulaciones con CroscarmelosaMR muestran en promedio una resistencia a la ruptura de sus tabletas mayor que las que contienen Carmacel.MR Aunque esto confirma una mayor compactabilidad de la CroscarmelosaMR en formulaciones de liberación rápida de metronidazol, la diferencia entre las mismas es de tan sólo 5%, mucho menor que la diferencia original de un 50%.59
La prueba de disolución del metronidazol en las formulaciones de liberación inmediata, como parámetro de comparación con la prueba subrogada de desintegración, no mostró ninguna diferencia entre las varias formulaciones debido a que ocurre demasiado rápido en todos los casos.
En el caso de gránulos de liberación prolongada, utilizando tres diferentes concentraciones de los desintegrantes, tampoco se observó ninguna tendencia de mejor funcionalidad de un desintegrante sobre el otro. Formulaciones con 5 partes del desintegrante muestran que el CarmacelMR produce mayores velocidades de disolución, con 10 partes la CroscarmelosaMR fue mejor y con 15 los perfiles de disolución fueron similares. La mayor funcionalidad del CarmacelMR como desintegrante para tabletas mostrada con pruebas subrogadas desaparece en las formulaciones de gránulos flotantes de metronidazol de liberación prolongada.
En el caso de las tabletas de liberación prolongada de metronidazol los perfiles de disolución si muestran una tendencia hacia una mejor funcionalidad de la CroscarmelosaMR. Sin embargo, dicha mejor funcionalidad de la CroscarmelosaMR disminuye conforme la proporción del desintegrante en la formulación también disminuye. Las formulaciones conteniendo CroscarmelosaMR en proporciones de 10-15% muestran mayores velocidades de disolución que las de CarmacelMR. Sin embargo, a bajas proporciones del desintegrante (5%) las formulaciones conteniendo CarmacelMR o CroscarmelosaMR muestran perfiles de disolución similares.
En el caso de las celulosas microcristalinas las tabletas de liberación rápida de metronidazol con AlfacelMR muestran una mayor resistencia a la ruptura (169 kPa) que las de AvicelMR (141 kPa). Estos resultados son contradictorios con la funcionalidad subrogada donde el AvicelMR mostró una mayor compactabilidad.
Considerando los resultados obtenidos se puede concluir que las diferencias observadas entre excipientes genéricos e innovadores tienden a desaparecer conforme los excipientes se diluyen en una formulación.
Funcionalidad de los desintegrantes en formulaciones de captopril con diferentes diluentes
En general, en estas formulaciones se observó que la funcionalidad de compactabilidad del innovador CroscarmelosaMR es mayor que la del genérico CarmacelMR mientras que el CarmacelMR fue mejor en su funcionalidad para mejorar la disolución. Estos resultados coinciden con los observados en las pruebas de funcionalidad subrogada. En este sentido se puede decir que las pruebas de funcionalidad subrogadas serían indicativas del desempeño de los materiales en las formulaciones de tabletas de captopril. Aunque las pruebas subrogadas de funcionalidad no predicen de manera definitiva la funcionalidad de los desintegrantes en las tabletas de captopril, tampoco son contradictorias al desempeño de los desintegrantes en las mismas. Manteniendo la funcionalidad observada en las pruebas subrogadas los desintegrantes despliegan su funcionalidad en una magnitud variable en las diferentes formulaciones de captopril.60
Conclusión
La determinación de las características de funcionalidad de los excipientes, en cualquiera de sus niveles: como partícula, como conjunto de partículas y como parte de una mezcla de partículas en una formulación, permite a los formuladores reducir las propiedades de los polvos a números tangibles. Los valores específicos de sus propiedades físicas, químicas y fisicoquímicas así como tecnológicas, que identifican la funcionalidad de un material, permiten establecer parámetros estadísticos y límites de corte para utilizarlos en un cierto proceso. Esto con el fin de controlar la calidad y la consistencia entre los diferentes lotes del material que se fabrican. Además de permitir una comparación inicial de la funcionalidad de los materiales obtenidos de diferente proveedor o con diferente marca comercial. La determinación de la funcionalidad de los materiales, en cualquiera de sus niveles, reduciría el costo de una experimentación muy amplia, debido a que el formulador conoce lo que puede esperar de cada material, dada su funcionalidad.
La funcionalidad de los excipientes y su utilidad puede dividirse en tres partes, la primera de ellas es la determinación de sus propiedades para controlar la calidad y consistencia de los materiales; la segunda es la predicibilidad del desempeño del material en una formulación, a partir de las pruebas de funcionalidad subrogadas y de pruebas con formulaciones diferentes a la actual y la tercera, la comparación de la funcionalidad de un mismo tipo de materiales o excipientes de diferentes proveedores o marcas comerciales (innovadores y genéricos) así como la comparación del desempeño de materiales de diferente composición física o química.
Aunque ni las pruebas de funcionalidad subrogada ni la funcionalidad conocida en otras formulaciones reflejan exactamente el desempeño de los excipientes en una nueva formulación, estas pruebas se pueden considerar como indicativas de su funcionamiento, particularmente cuando los excipientes se utilizan en proporciones elevadas. Cuando los excipientes se usan en proporciones bajas, debe considerarse que conforme más se diluyan en una formulación la influencia que ejercerían sobre su desempeño sería menor, y con esto, la predecibilidad de su desempeño se volvería incierta. Por efecto de la misma dilución de los excipientes en una formulación, las diferencias en el desempeño entre excipientes innovadores y genéricos tienden a desaparecer, igualándose la influencia que ejercen sobre el desempeño de la misma. Se puede decir que la funcionalidad observada en pruebas subrogadas se mantiene o se refleja en el desempeño de la formulación que le contiene. Sin embargo, los excipientes despliegan esa funcionalidad en una magnitud variable en diferentes formulaciones.
Referencias
1. Miinea L., Farina J., Kallam M., Deorkar N. A New World of Excipients for Oral Solid Dosage Formulation. Am. Pharm. Rev. White paper, Disponible en: http://www.americanpharmaceuticalreview.com/images/MBI_A_New_World_of_Excipients.pdf. Consultado el 7 de mayo de 2010.
2. Van Arnum P. 2007. Expanding Opportunities for Specialty Excipients. Pharm. Tech., abril. Consultado el 3 de septiembre de 2010. Disponible en: http://pharmtech.findpharma.com/pharmtech/Pharma+Ingredients/Expanding-Opportunities-for-Specialty-Excipients/ArticleStandard/Article/detail/415103.
3. Morris G. S., Huang J. 2006. China Emerges as the Next Frontier For Specialty Excipients. Pharm. Tech., octubre. Consultado el 3 de septiembre de 2010. Disponible en: http://pharmtech.findpharma.com/pharmtech/Formulation+Article/China-Emerges-as-the-Next-Frontier-For-Specialty-E/ArticleStandard/Article/detail/385861.
4. Edge S., Mueller S., Price R., Shur J. 2008. Factors affecting defining the quality and functionality of excipients used in the manufacture of dry powder inhaler products. Drug Dev. Ind. Pharm., 34(9):966-973. [ Links ]
5. Hamad, M. L., Bowman K., Smith N., Sheng X., Morris K. R. Multi-scale pharmaceutical process understanding: From particle to powder to dosage form. Chem. Eng. Sci. En prensa, pruebas corregidas, Disponible en línea el 10 de febrero de 2010, doi:10.1016/j.ces.2010.01.037.
6. Johanson J. R. Defining the physical functionality of excipients, bulk drugs and formulations. Disponible en: http://www.indicizer.com/files/DefiningExipients.pdf. Consultado el 10 de septiembre de 2010. [ Links ]
7. Johanson, J. 1995. Flow indices in the prediction of powder behaviour. Pharm. Manuf. Int., a través de Diamondback Technology, Inc. CA 93422, USA. E-mail: info@ diamondbacktechnology.com).
8. Laity, R. R., Cameron, R. E. 2009. A small-angle X-ray scattering study of local variations within powder compacts. Pow. Tech., 192 (3):287-297. [ Links ]
9. XRPD comes of age. 2009. Manuf. Chem., 7 de abril. Consultado el 6 de octubre de 2010. Disponible en: http://www.manufacturingchemist.com/technical/article_page/XRPD_comes_of_age/41967.
10. Pingali K. C., Shinbrot T., Hammond S. V., Muzzio F. J. 2009. An observed correlation between flow and electrical properties of pharmaceutical blends. Pow. Tech., 192(2):157-165. [ Links ]
11. Material masters of r & d. 2008. Manuf. Chem., 3 de septiembre. Consultado el 6 de octubre de 2010. Disponible en: http://www.manufacturingchemist.com/technical/article_page/Material_masters_of_r_and_d/41230.
12. USP NF2002, United States Pharmacopoeial convention Inc. 12601 Twinbrook Parkway, Rockville, Maryland 20852, USA, pp. 2148. [ Links ]
13. The Joint IPEC - PQG Good Manufacturing Practices Guide for pharmaceutical excipients, 2006. The International Pharmaceutical Excipients Council and Pharmaceutical Quality Group, pp. 3. Consultado el 31 de enero de 2011, disponible en: http://www.ipec-europe.org/UPLOADS/IPEC_PQG_GMP_Guide_2006(1).pdf. [ Links ]
14. Florence, A., Sakthivel, T. 2003. Dendrimers & Dendrons: Facets of Pharmaceutical Nanotechnology. Drug Deliv. Tech. , 3(5) julio/agosto, publicado en línea el 28 de marzo. Disponible en: http://www.drugdeliverytech.com/ME2/dirmod.asp?sid&nm=&type=Publishing&mod=Publications%3A%3AArticle&mid=8F3A7027421841978F18BE895F87F791&tier=4&id=9B9BA1DAA5BE455A85A81D97382FE885. [ Links ]
15. Bharali, D. J., Khalil, M., Gurbuz, M., Simone, T. M., Mousa, S. A. 2009. Nanoparticles and cancer therapy: A concise review with emphasis on dendrimers. Int. J. Nanomed. 4:1-7. [ Links ]
16. Kingsley, J. D., Dou, H., Morehead, J., Rabinow, B., Gendelman, H. E., Destache, C. J. 2006. Nanotechnology: A Focus on Nanoparticles as a Drug Delivery System. J. Neuroimmune Pharmacol. 1:340-350. [ Links ]
17. Yang, W., Thordarson, P., Gooding, J. J., Ringer, S. P., Braet, F. 2007. Carbon nanotubes for biological and biomedical applications. Nanotechnology 18, I.D. del artículo: 412001 (12 páginas). [ Links ]
18. Smith, B. R., Ruegsegger, M., Barnes, P. A., Ferrari, M., Lee, S. C. 2006. Nanodevices in biomedical applications, capítulo 13, pp. 363-398. En: Ferrari, M., Lee, A. P., Lee, L. J. (Eds) BioMEMS and Biomedical Nanotechnology, Volumen I Biological and Biomedical Nanotechnology, Springer science and business media, LLC. NY, USA. DOI: 10.1007/978-0-387-25842-3_13. [ Links ]
19. Villafuerte Robles, L. 2007. El diseño de medicamentos al inicio del siglo 21. Los diferentes tipos de medicamentos VI. Nanotecnología Farmacéutica. Informacéutico, 14(1):15-32. [ Links ]
20. Shireesh P.A., Ugwu S. O. 2003. A Review and Classification of Emerging Excipients in Parenteral Medications. Pharm. Tech., marzo, 46-60.
21. Taylor J. 2006. Current Trends and Challenges in the Excipients Market. Pharm. Tech. Octubre 1. Consultado el 30 de julio de 2009. Disponible en: http://pharmtech.findpharma.com/pharmtech/Excipients/Current-Trends-and-Challenges-in-the-Excipients-Ma/ArticleStandard/Article/detail/378396.
22. Seufert, K., Zeleznik, K. 2009. The attractive economics of high-functionality excipients. Tabs. Caps., 7(5):10-15. [ Links ]
23. Hancock, B. C. 2009. Achieving a Perfect Tablet Formulation: Evolution, or Intelligent Design? Am. Pharm. Rev. - Marzo. Consultado el 31 de julio de 2009. Disponible en http://americanpharmaceuticalreview.com/ViewArticle.aspx?ContentID=3969.
24. Chang D., Chang R. K. 2007. Review of Current Issues in Pharmaceutical Excipients. Pharm. Tech., Mayo 2. Disponible en: http://pharmtech.findpharma.com/pharmtech/Excipients/Review-of-Current-Issues-in-Pharmaceutical-Excipie/ArticleStandard/Article/detail/423551. Consultado el 25 de marzo de 2010.
25. Viscasillas A. 2008. Aportación al diseño de un nuevo excipiente tipo "coprocessed product" para compresión directa. Tesis de doctorado de la Universidad de Barcelona, España. [ Links ]
26. Moreton. R. Ch. 2006. Functionality and Performance of Excipients. Pharm. Tech. Octubre 1. Consultado el 25 de marzo de 2010. Disponible en: http://pharmtech.findpharma.com/pharmtech/Excipients/Functionality-and-Performance-of-Excipients/ArticleStandard/Article/detail/378395.
27. Moreton, R. Ch. 2004. Excipient Functionality. Pharm. Tech., mayo 5, 98-119. Consultado el 3 de mayo de 2010. Disponible en: http://pharmtech.findpharma.com/pharmtech/data/articlestandard/pharmtech/192004/94554/article.pdf.
28. Moreton, Ch. 2009. Functionality and Performance of Excipients in a Quality-by-Design World: Part 1. Formulations. Am. Pharm. Rev., Enero-febrero. Consultado el 31 de julio de 2009. Disponible en: http://americanpharmaceuticalreview.com/ViewArticle.aspx?ContentID=3885.
29. Joshi A. A., Duriez X. 2004. Added Functionality Excipients: An Answer to Challenging Formulations. Pharm. Tech., junio 9, 12-19. Disponible en: http://pharmtech.findpharma.com/pharmtech/data/articlestandard/pharmtech/242004/98156/article.pdf. Consultado el 04 de mayo de 2010.
30. GalenIQMR , BENEO-Palatinit, Alemania. Disponible en: http://www.beneo-palatinit.com/en/Pharma_Excipients/galenIQ/, Consultado el 03 de febrero de 2011. [ Links ]
31. Neusilin. Fuji Chemical Industry Co. Ltd. Technical Library. Disponible en: http://www.neusilin.com/product/pharmaceutical_application.php. Consultado el 04 de febrero de 2011. [ Links ]
32. Rios, M. 2009. Debating Excipient Functionality. Pharm. Tech., septiembre. Consultado el 25 de marzo de 2010. Disponible en: http://pharmtech.findpharma.com/pharmtech/article/articleDetail.jsp?id=371132&sk=&date=&pageID=4.
33. Patel, A. 2009. Multifunctional excipients creating new possibilities. Contrac Pharma, noviembre/diciembre. Disponible en: http://www.contractpharma.com/articles/2009/11/multifunctional-excipients. Consultado el 26 de abril de 2010.
34. Viana, M., Ribet, J., Rodriguez, F., Chulia, D. 2005. Powder Functionality Test: A Methodology for Rheological and Mechanical Characterization. Pharm. Dev. Tech. 10(2):327-338. [ Links ]
35. Silverstein, I., Falk, A., Carter, D., Guazzaroni-Jacobs, M., Schoneker, D. 2008. Excipient-Control Strategies. Pharm. Tech., octubre. Consultado el 30 de septiembre de 2010. Disponible en: http://pharmtech.findpharma.com/pharmtech/article/articleDetail.jsp?id=556262&sk=&date=&pageID=3.
36. Joint Position Paper on Pharmaceutical Excipient Testing and Control Strategies. 2007. Pharm. Tech., septiembre. Consultado el 30 de septiembre de 2010. Disponible en: http://pharmtech.findpharma.com/pharmtech/Article/Joint-Position-Paper-on-Pharmaceutical-Excipient-T/ArticleStandard/Article/detail/452937.
37. Lerke S. A. 2004. Excipient Sourcing Challenges in Pharmaceutical Research & Development. Am. Pharm. Rev. Noviembre/Diciembre, 7(6):58-61. [ Links ]
38. The Joint IPEC - PQG Good Manufacturing Practices Guide for pharmaceutical excipients, 2006, pp 33. Consultado el 31 de enero de 2011, disponible en: http://www.ipec-europe.org/UPLOADS/IPEC_PQG_GMP_Guide_2006(1).pdf. [ Links ]
39. Moreton, Ch. 2010. Functionality and Performance of Excipients in Quality-by-Design World, Part VIII: Excipient Specifications. Am. Pharm. Rev. Abril-Marzo, 46-50.
40. The QA Pharm. 2010. When All Else Fails, Lower Your Standards. Octubre 16. Consultado el 22 de octubre de 2010. Disponible en: http://theqapharm.blogspot.com/. [ Links ]
41. John, E. 2009. How to Set Specifications for the Particle Size distribution of a Drug Substance? Am. Pharm. Rev. Abril. Consultado el 31 de Julio de 2009. Disponible en: http://americanpharmaceuticalreview.com/ViewArticle.aspx?ContentID=4045.
42. Nachaegari, S. K., Bansal, A. K. 2004. Coprocessed excipients for solid dosage forms. Pharm. Tech., enero, 52-64.
43. Gohel, M. C., Jogani, P. D. 2005. A review of co-processed directly compressible excipients. J. Pharm. Pharmaceut. Sci. (www.cspscanada.org), 8(1):76-93. Disponible en: http://www.ualberta.ca/~csps/JPPS8(1)/P.Jogani/excipients.htm. Consultado el 04 de febrero de 2011. [ Links ]
44. Bolhuis, G., Kussendrager, K., Langridge, J. 2004. New Developments in Spray-Dried Lactose. Pharm. Tech., EXCIPIENTS & SOLID DOSAGE FORMS 2004, pp. 26-31. Consultado el 9 de mayo de 2010. Disponible en http://pharmtech.findpharma.com/pharmtech/data/articlestandard//pharmtech/242004/98160/article.pdf.
45. Electron microscopic view of spray-dried lactose. Disponible en: http://www.lactose.com/basic/lactose_in_solid_form.html. Consultado el 21 de octubre de 2010. [ Links ]
46. FlowLac 90. Giusto Faravelli S.p.A. Disponible en: http://www.faravelli.it/upload/news/allegati/Spray%20Dried%20Lactose%20FlowLac90.pdf. Consultado el 21 de octubre de 2010. [ Links ]
47. Block, L. H., Moreton, R. C., Apte, S. P., Wendt, R. H., Munson, E. J., Creekmore, J. R., Persaud, I. V., Sheehan, C., Wang, H. 2009. Co-processed Excipients. Pharmacopoeial Forum, 35(4):1026-1028. [ Links ]
48. Miinea, L., Farina, J., Kallam, M., Deorkar, N. 2009. A New World of Excipients for Oral Solid Dosage Formulation. PharmPro, lunes 2 de febrero. Disponible en: http://www.pharmpro.com/Articles/2009/03/A-New-World-of-Excipients-for-Oral-Solid-Dosage-Formulation/. Consultado el 26 de abril de 2010.
49. Prosolv Easytab. 2010. Prosolv Family of high functionality excipients. Wall chart. JRS Pharma GmbH+Co. KG. 73494 Rosenberg (Germany), www.jrspharma.de. [ Links ]
50. Vollmer, R., Stoyanov, E. 2010. An all-round excipient for direct compression. Pharm. Tech. Eur., Oct 1, 22(10). Consultado el 18 de febrero de 2011. Disponible en: http://pharmtech.findpharma.com/pharmtech/article/articleDetail.jsp?id=688414&pageID=1&sk=&date=). [ Links ]
51. Limwong, V., Sutanthavibul, N., Kulvanich, P. 2004. Spherical Composite Particles of Rice Starch and Microcrystalline Cellulose: A New Coprocessed Excipient for Direct Compression. AAPS PharmSciTech. 5(2) Artículo 30 (http://www.aapspharmscitech.org). [ Links ]
52. Jacob, S., Shirwaikar, A. A., Joseph, A., Srinivasan, K. K. 2007. Novel co-processed excipients of mannitol and microcrystalline cellulose for preparing fast dissolving tablets of glipizide. Ind. J. Pharm. Sci. 69(5):633-639. [ Links ]
53. Gohel, M., Parikh, R. K., Brahmbhatt, B. K., Shah, A. R. 2007. Preparation and assessment of novel coprocessed superdisintegrant consisting of crospovidone and sodium starch glycolate: A technical note. AAPS PharmSciTech; 8(1), Artículo 9, disponible en: http://www.aapspharmscitech.org. [ Links ]
54. Moreton, Ch. 2009. Functionality and Performance of Excipients in a Quality-by-Design World Part 2: Excipient Variability, QbD and Robust Formulations. Excipients. Am. Pharm. Rev. [On line]. Disponible en: http://americanpharmaceuticalreview.com/ViewArticle.aspx?ContentID=3966. Consultado el 31 de julio, 2009.
55. Díaz Ramírez C. C., Villafuerte Robles L. 2010. Surrogate functionality of celluloses as tablet excipients. Drug Dev. Ind. Pharm. 36(12):1422-1435. [ Links ]
56. Sucker, H., Sucker, H. 1991. Theoretische Grundlagen der verfahrenstechnischen Grundoperationen. En: Sucker, H. Fuchs, P., Speiser, P. Pharmazeutische Technologie. Segunda edición, Georg Thieme Verlag, Stuttgart, pp. 16-17. [ Links ]
57. Kibbe, A. H. Editor, 2000. Handbook of pharmaceutical excipients, tercera edición, American Pharmaceutical Association, Washington D.C. pp. 103. [ Links ]
58. Kaerger J. S., Edge S., Price R. 2004. Influence of particle size and shape on flowability and compactibility of binary mixtures of paracetamol and microcrystalline cellulose. Eur. J. Pharm. Sci., 22(2-3):173-179. [ Links ]
59. Díaz Ramírez C. C., Villafuerte Robles, L. Functionality of innovator and generic celluloses in metronidazole formulations. Aceptado para su publicación en el Braz. J. Pharm. Sci.
60. Díaz Ramírez C. C., Villafuerte Robles L. Comparative functionality of Croscarmellose and Carmacel as tablet excipients. Aceptado para publicación en Lat. Am. J. Pharm














