Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de ingeniería química
versão impressa ISSN 1665-2738
Rev. Mex. Ing. Quím vol.11 no.3 Ciudad de México Dez. 2012
Catálisis, cinética y reactores
Desulfuración oxidativa de dibenzotiofenos con VOx/ZrO2-Al2O3
Oxidative desulfurization of dibenzothiophenes using VOx/ZrO2-Al2O3
M.A. Alvarez-Amparán y L. Cedeño-Caero*
UNICAT, Dpto. de Ingeniería Química, Fac. de Química, UNAM. 04510 México D.F. * Autor para la correspondencia. E-mail: caero@unam.mx Tel. (5255)-5622-5369, Fax 56-22-53-66.
Recibido 20 de Enero 2012
Aceptado 31 de Octubre 2012
Resumen
Catalizadores de óxido de vanadio para la desulfuración oxidativa (ODS) de compuestos dibenzotiofénicos se prepararon por impregnación incipiente de metavanadato de amonio, sobre un óxido mixto de zirconia y alúmina con diferentes contenidos de vanadio (8, 10 y 15?% de V) y catalizadores de óxidos de vanadio parcialmente reducidos se obtuvieron del catalizador con 15% de V. El grado de oxidación y reducibilidad del vanadio en los catalizadores se estudió por medio de reducción a temperatura programada (TPR). Los catalizadores se caracterizaron por microscopía electrónica de barrido (SEM-EDX) y difracción de rayos-X (XRD). Se utilzó H2O2 o tertbutil hidroperóxido como agente oxidante para evaluar la actividad catalítica y ésta se discutió en términos de las especies de vanadio presentes en el catalizador, las cuales incrementan la reactividad de los compuestos refractarios en HDS (DBT, 4-MDBT, 4,6-DMDBT).
Palabras clave: desulfuración oxidativa, ZrO2-Al2O3, óxido de vanadio, dibenzotiofenos.
Abstract
Vanadium oxide catalysts were nrepared by incipient wetness impregnation of ammonium metavanadate on a zirconia-alumina mixed oxide with different vanadium loading (8, 10 and 15 wt.% of V), in order to increase the performance in oxidative desulfurization (ODS) of dibenzothiophene compounds, using H2O2 or tert-butyl hydroperoxide as oxidant. In addition, the catalyst with 15% of V was modified creating vanadium oxides partially reduced. The oxidation states and reducibility of vanadium catalysts were studied by temperature-pcogzammed reduztion (TPR). The cataSysts were characterized by scanning electron microscopy (SEM-EDX) and X-ray diffraction (XRD). Catalytic performance was discussed in terms of vanadium species prevailing on the catalysts, which increase the reactivity of refractory HDS compounds present in diesel fuel (DBT, 4-MDBT, and 4,6-DMDBT).
Keywords: oxidative desulfurization, ZrO2-Al2O3, vanadium oxide, dibenzothiophenes.
1 Introducción
El azufre presente en los combustibles para, transporte es la mayor fuente de contaminación ambiental debido a la emisión de SOx, lo cual ha generado normas más estrictas respecto al contenido de azufre en los combustibles. El pro ceso convencional de remoción de azufre es la hidrodesulfuración (HDS), pero este difícilmente alcanza ultra bajos niveles de S. Asimismo los niveles de azufre presente en los combustibles líquidos, particularmente diesel y gasolina, son suficientemente altos para disminuir la actividad y tiempo de vida de los catalizadores utilizados para su obtención. Por lo que recientemente se han realizado estudios para obtener catalizadores más activos para los procesos de HDS; por ejemplo, catalizadores de Mo modificados con fosfatos (Montesinos-Castellanos y col., 2012) o catalizadores nanoestructurados de CoMoW (Huirache y col. 2010).
El dibenzotiofeno (DBT) y principalmente sus alquilsustituidos en las posiciones 4 y 6 (por ejemplo; 4-MDBT y 4,6-DMDBT) son muy difíciles de convertir en los procesos de HDS, debido al impedimento estérico de los grupos alquilo alrededor del átomo de S (Babich y col., 2003; Song y col., 2003). Lo que ha llevado a la búsqueda de nuevas tecnologías para la desulfuración que muestren una alternativa a los procesos de HDS. Destaca entre estas el proceso de oxidación extracción (O/E), también llamado oxidesulfuración o desulfuración oxidativa (ODS). La ODS se considera como un tratamiento posterior a la HDS convencional para llegar a una desulfuración profunda, debido a que los compuestos refractarios en HDS son altamente reactivos en la ODS. Las condiciones de proceso son menos severas que en la HDS, temperatura menor de 100°C y presión atmosférica, lográndose niveles de azufre en diesel menores a 10 ppm. El fundamento de este proceso se basa en la oxidación de compuestos organoazufrados para producir sulfóxidos y posteriormente sulfonas, las cuales pueden separarse por medio de extracción con un disolvente (Ismagilov y col., 2011; Stanislaus y col., 2010).
Catalizadores conteniendo óxidos de V han sido utilizados en la ODS y los resultados indican que su desempeño depende del tipo de soporte catalítico utilizado, así como del método de preparación y la dispersión de la fase activa sobre soportes como alúmina, titania, sílice, niobia y mezclas de estos óxidos (Ito y col., 2006; Qian, 2008; Cedeño y col., 2008). Resultados previos con catalizadores de V2O5 sobre zirconia muestran un buen desempeño en la ODS, utilizando H2O2 como agente oxidante (Fabián-Mijangos y col., 2011), donde la actividad se favorece debido a la alta dispersión de las especies de (óxido de vanadio. Sin embargo, los estudios de la zirconia como soporte catalítico de V2O5 son aún incipientes.
En este estudio, se utilizó un soporte mixto de ZrO2 y Al2O3 con la intención de aumentar la dispersión de las especies de V y se estudió la actividad de estos catalizadores en presencia H2O2 o TBHP como agente oxidante. Los catalizadores se prepararon con el propósito de estudiar el efecto del soporte, identificar las especies más activas de V sobre este soporte mixto y evaluar su comportamiento con los diferentes oxidantes.
2 Materiales
Dibenzotiofeno y sus alquil derivados (DBTs), los cuales representan las especies de azufre en el diesel, fueron las especies seleccionadas para evaluar la actividad en ODS. Acetonitrilo (99.9%) se usó como disolvente de los compuestos modelo: dibenzotiofeno (DBT 98%), 4-metildibenzotiofeno (4-MDBT 96%) y 4,6-dimetildibenzotiofeno (4,6-DMDBT 97%); con 609 ppm de azufre: 217 de DBT, 206 de 4-MDBT y 186 de 4,6-DMDBT. Peróxido de hidrogeno (H2O2, 30% en peso) y tertbutil hidroperóxido (TBHP, 70% en peso) se usaron como agentes oxidantes.
2.1 Preparación de catalizadores y caracterización
Se prepararon catalizadores con un contenido de 8 (V8%), 10 (V10%) y 15% en peso (V15%) de V sobre un soporte mixto de zirconia-alúmina (marca Condea con 23 % en peso de ZrO2, en forma de esferas de 1.8 mm de diámetro y 210 m2/g) por el método de impregnación por exceso de volumen de metavanadato de amonio. Las muestras impregnadas se secaron a 100°C y calcinaron en atmosfera de aire a 500°C por 6 horas. Además, el catalizador V15% fue tratado en un equipo convencional de TPR para obtener oxidaciones parciales del V, equivalentes al 0, 64, 95 y 100% y estos catalizadores fueron denominados como VOx0, VOx64, VOx95 y VOx100, respectivamente.
En el TPR se hizo pasar por el reactor un flujo de 25 mL/minuto de una mezcla de H2 (70%) en Ar, a una velocidad de calentamiento de 10°C/min hasta 550°C para obtener V2O3 y el catalizador se designio como VOx0 (0% de oxidación). Las oxidaciones parciales se realizaron haciendo cortes a la temperatura apropiada y cambiando en ese momento el flujo de H2/Ar por Ar y dejando enfriar lentamente el reactor, de acuerdo al procedimiento descrito por González-García y col. (2010). VOx64 se obtuvo a una temperatura de corte de 280°C y VOx95 corresponde al catalizador fresco V15%, dado que en las condiciones de preparación este no fue oxidado totalmente. Para el caso de VOx100, se realizó un TPO (oxidación a temperatura programada) del catalizador V15% hasta una temperatura de 500°C y se mantuvo esta temperatura durante 2 horas, para garantizar que no existan especies de V en estado reducido. El área bajo la curva del TPR de VOx100 corresponde a la cantidad total de especies reducibles de V2O5 y el área del TPR de V15% corresponde a un 95% del área de VOx100, por lo que se tiene un catalizador con 95% de especies reducibles y se le denomino como VOx95. Así como el área bajo la curva del TPR de VOx64 corresponde al 64% del área de V0x100.
Se preparo como referencia un catalizador de V205 soportado en gamma-alúmina de 188 m2/g (VAI) con 15% de V, por el mismo método descrito para V15%. Se sintetizo ZrV207 con una mezcla equimolar de V205 y Zr02, la cual fue calentada en atmosfera de aire a 650°C por 5 días, seguido de una calcinación final a 710°C por 2 días; el V205 en exceso fue removido por lixiviación con una solución amoniacal (29%, en peso) caliente en un recipiente cerrado con agitación por 24 horas, de acuerdo al procedimiento descrito por Gazzoli y col. (2009).
Los catalizadores se caracterizaron por difracción de rayos X (XRD) usando un difractometro de polvos Siemens D500 con radiación Cu Kα. La composición elemental se determinó por microscopía electrónica de barrido (SEM) en un microscopio Jeol JSM-5900 LV equipado con un sistema de análisis elemental de energía dispersiva de rayos-X (EDX).
2.2 Pruebas de actividad catalítica
Para llevar a cabo la reacción de oxidación, se uso un reactor intermitente (250 mL) equipado con un agitador mecánico, un termopar, una chaqueta conteniendo agua a temperatura constante (60°C), un puerto de muestreo y un sistema de reflujo para condensar vapores y mantener la presión constante. En una corrida típica la mezcla reactiva de DBTs (50 mL) se introdujo al reactor, entonces H202 o TBHP (0/S = 6, mol/mol) y el catalizador (100 mg en polvo) fueron añadidos al reactor con una agitación vigorosa de 750 rpm, para garantizar un régimen cinético. Todos los catalizadores que recibieron un tratamiento térmico, inmediatamente después de éste, fueron transferidos al reactor para las pruebas de actividad catalítica. Las pruebas de 0DS se llevaron a cabo con una relación de 2 gramos de catalizador por litro de mezcla reactiva.
Para seguir el avance de reacción, se tomaron pequeñas muestras del reactor a 15, 30, 60, 90, 120 min y fueron analizadas en un cromatográfo de gases (GC-FID) HP5890 Series II provisto con un sistema de inyección automática de muestras HP7673 y con una columna P0NA de 50 m. Los productos de reacción y reactivos se identificaron por su tiempo de retención y se confirmaron en un GC con detector PFPD (Varian CP-3800) y con un espectrómetro de masas (GC-MS, HP G/800B). La cantidad de agente oxidante presente en el sistema de reacción se determinó por yodometría para H202 y permanganometría para TBHP.
3 Resultados y discusión
Primero se presentan los resultados de la caracterización de los catalizadores y después se discuten los resultados de actividad en 0DS.
3.1 Caracterización de catalizadores
La Fig. 1 muestra la micrografía de SEM-EDX para el catalizador V15%, donde se puede observar una adecuada distribución de vanadio sobre la superficie del soporte mixto de Zr02-Al203. Para todos los catalizadores preparados, las micrografías (no mostradas) presentan una buena distribución elemental. Esto puede ser atribuido a que la temperatura de calcinación (500°C por 6 horas) es mayor a la temperatura Tamman del V205 de 370°C y esto provoca que las especies de V sean muy móviles, lo cual lleva a una alta dispersión de (óxido de vanadio sobre la superficie del soporte (Weckhuysen y col., 2003).

El análisis elemental cuantitativo muestra que los contenidos nominales (8, 10 y 15%) son similares a los obtenidos por EDX (8.3, 10.0 y 14.7%, respectivamente). Por lo que todos estos resultados indican una correcta preparación de los catalizadores, sin segregación y buena distribución de las especies de V sobre el soporte.
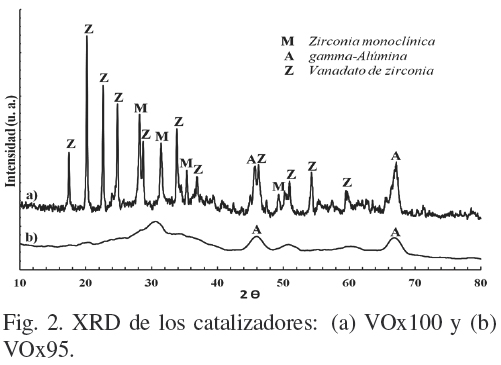
En la Fig. 2 se muestran los difractogramas de los catalizadores con mayor grado de oxidación (V0x100 y V0x95). Se observa que V0x100 presenta picos de difracción de rayos X en los ángulos 2θ = 17, 20, 23, 25, 29, 34, 37, 46, 51, 54 y 60º (JCPDS 16422) debido a la presencia de cristales de vanadato de zirconia (ZrV207), la formación de este complejo puede ser atribuida a la migración de zirconia dentro de los cristales de V205 (Gazzoli y col., 2009). Además presenta picos de difracción en los ángulos 2θ = 28.5, 31, 35 y 50º (JCPDS 36-420) que indican la presencia de Zr02 monoclínica y en los ángulos 2θ = 46 y 67º de gamma-Al203 (JCPDS 10-425). Los picos de difracción principales de V205 (Shcherbinaite) se presentan en 2θ = 15, 20, 21.6, 26 y 31º (JCPDS 9387), en el intervalo de 20 a 26º son similares a las difracciones de ZrV207 y acorde con los otros picos característicos no se observa la presencia de V205. Los difractogramas de V0x0, V0x64 y V0x95 son similares entre sí, por lo que solo se presenta el de V0x95, donde vínicamente se observa la presencia de zirconia y alumina. Estos resultados pueden ser atribuidos a una buena dispersión de los óxidos de vanadio, dado que no se presentan cristalitos mayores a 40 Å que puedan ser observados por XRD.
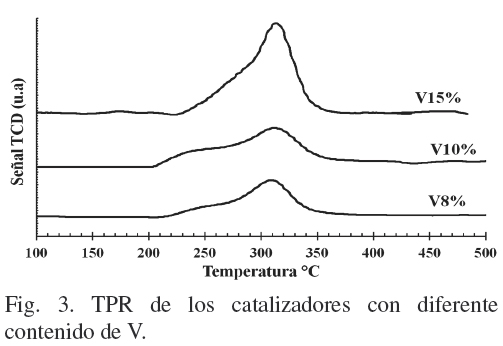
La reducción a temperatura programada (TPR) se llevó a cabo para investigar la reducibilidad de las diferentes especies de óxido de vanadio en el soporte y para obtener diferentes estados de oxidación del V. La Fig. 3 muestra los TPR de V8%, V10% y V15%. Estos exhiben un pico asimétrico que inicia entre 205 y 220ºC, con una Temperatura máxima de reducción (Tmax) alrededor de 310ºC. Se observa que conforme la carga de V se incrementa: a) el área del pico de reducción aumenta, debido a una mayor cantidad de especies reducibles de V y b) la presencia de un hombro entre 220 y 280ºC, atribuible a especies con mayor dispersión y/o interacción con el soporte.
La Fig. 4 presenta los perfiles de TPR de V205 (RA), VAl y V0x100. La Tmax de V205 es 422ºC y corresponde a la reducción de las especies de V5+ a V3+ (Wachs y col., 2003). Este termograma corresponde al material de referencia para TPR y muestra la reducción de especies de V205 sin interacción con un soporte catalítico.
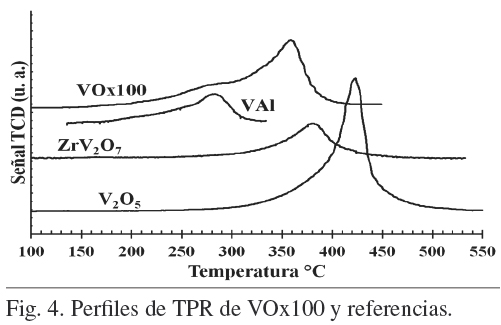
El perfil de TPR de VAl, muestra un pico de reducción asimétrico con una Tmax en 280ºC y muestra un amplio hombro entre 180 y 260ºC, que indica la presencia de especies de V altamente dispersas. Mientras que la reducción de especies alrededor de la Tmax son atribuidas a especies de vanadio que tienen poca interacción con el soporte de alumina.
V0x100 muestra un pico de reducción asimétrico que tiene una Tmax de 358ºC y un hombro entre 230 y 310ºC. Este hombro es atribuible a especies facilmente reducibles de V. Los resultados de XRD muestran que este catalizador contiene ZrV207, lo que indica que la zona donde esta la Tmax (358º C) corresponde a especies de V que interactúan fuertemente con el soporte. Esto de acuerdo con el TPR de ZrV207 puro (Fig. 4), que presenta el pico de reducción simetrico a una Tmax de 382ºC y esta temperatura es cercana a la Tmax de V0x100. Por lo que, cuando el V205 es soportado en alúmina (VAl), la Tmax es menor que cuando el soporte es un óxido mixto Zr-Al y esto indica que la interaccioín de las especies de V es diferente con cada tipo de soporte debido principalmente a la formación de ZrV207.
Para formulaciones de catalizadores de óxidos de V, una monocapa teórica de V205 sobre diferentes soportes se obtiene con un contenido de 0.1% en peso de V205 por m2 de soporte (Cedeno y col., 2008), que equivale a 0.056% de V por m2. Para la alúmina con 188 m2/g, la monocapa teórica corresponde a 10.5% de V, por lo que en el TPR de VAl (Fig. 4) se observa la presencia de especies de V altamente dispersas y la ausencia de especies poliméricas de vanadio. Resultados sobre zirconia con 74 m2/g (Fabián-Mijangos y col., 2011) sugieren que la monocapa de especies de V se encuentra a contenidos mayores de 9 % y menores a 23 % de V, dado que sobre este último se observa la presencia de las especies poliméricas de vanadio. Para el soporte mixto Zr-Al (210 m2/g) la monocapa teórica correspondería a 12% de V, pero los resultados de XRD (Fig. 2) para el catalizador con mayor contenido de V (V15%) no muestran la presencia de cristales de V205, los resultados de SEM-EDX muestran una buena distribución de las especies de V y los de TPR no muestran presencia de especies poliméricas de vanadio. Por lo tanto, de estos resultados se puede inferir que se tiene una buena dispersión de las especies de V sobre el soporte mixto Zr-Al y que atan en el catalizador V15%, no se alcanza a cubrir con una monocapa la superficie del soporte.
3.2 Desulfuración oxidativa
Un sistema típico de ODS consiste de dos fases líquidas (fase diesel y fase disolvente) y un catalizador solido, donde los DBTs son convertidos a sus correspondientes sulfonas, debido a que la oxidación tiene lugar en la superficie catalítica (Torres y col., 2011). En estas condiciones (Cedefio y col., 2008; Ramírez-Verduzco y col., 2008) y debido a la polaridad de las sulfonas, estas son obtenidas predominantemente en la fase disolvente. En un sistema reactivo adecuado, donde se logra una alta dispersión de las dos fases inmiscibles, la extracción de DBTs del diesel al disolvente ocurre rápidamente y el paso determinante es la oxidación (Gomez y col., 2005), por lo que la oxidación en la fase disolvente es la base del proceso ODS. Por esta razón, en este caso, la reacción ODS se llevó a cabo empleando DBTs en acetonitrilo como la mezcla reactiva (sistema LS), para evaluar solo la reacción de oxidación y sin limitaciones por transferencia de masa entre las fases.
En primera instancia se realizaron pruebas de referencia en ausencia del catalizador, obteniéndose conversiones despreciables de sulfonas y mostrándose que la reacción no catalítica no contribuye al sistema reaccionante. Resultados similares obtuvieron Ramírez-Verduzco y col. (2008), donde después de 3 horas de reacción solo obtuvieron una conversión de 3.6 % del DBT. En todas las pruebas de actividad con los catalizadores, solo se obtuvieron las sulfonas de los DBTs como producto tánico de la reacción de ODS.
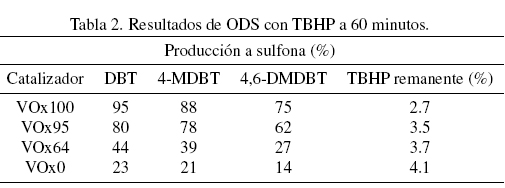
En la Tabla 1 y 2 se muestran los resultados a 60 minutos de la producción a sulfona y la cantidad de agente oxidante remanente en el sistema de reacción.
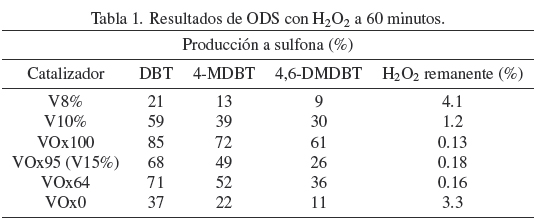
La Tabla 1 muestra los resultados con H2O2, donde la mayor producción a sulfonas se obtiene con VOx100, con una producción de 85, 72 y 61% de DBT, 4-MDBT y 4,6-DMDBT sulfonas (respectivamente) y con la menor cantidad remanente de H2O2 (0.13%).
Resultados similares se obtuvieron con TBHP como agente oxidante (Tabla 2), donde la mayor producción a sulfonas se obtiene también con VOx100. En general, para ambos oxidantes, los resultados indican que la actividad disminuye a medida que el estado de oxidación del V es reducido (de VOx100 a VOx95, VOx64 y VOx0) y aumenta con el contenido de V (al cambiar de V8% a V10% y V15%).
Se observa para todos los catalizadores que existe una relación entre la producción a sulfonas y la cantidad de oxidante remanente en el sistema de reacción. Conforme aumenta la producción a sulfonas, la cantidad de oxidante remanente en el sistema de reacción es menor, debido a que, se logra una mayor descomposición selectiva del oxidante.
Comparando los resultados con los diferentes agentes oxidantes, en general se obtiene que para V0x100 y V0x95 la actividad es mayor con TBHP que cuando se usa H202 y que para V0x64 y V0x0 la actividad es mayor con H2O2. Esto indica que las especies oxidadas de V son más reactivas con TBHP y las especies reducidas son más reactivas con H2O2.
En este contexto, González y col. (2010) obtuvieron que las especies oxidadas de vanadio son más reactivas con H202 que con TBHP, para catalizadores de óxido de vanadio sobre alumina. Por otro lado, Fabian-Mijangos y col. (2011) afirman que el ZrV2O7 de alta pureza es un compuesto que presenta muy baja actividad catalítica en 0DS. Como se menciono anteriormente, V0x100 presenta una mayor actividad con TBHP que con H202. Este resultado puede ser explicado debido a la presencia de ZrV2O7 y a las especies oxidadas de V, posiblemente esta combinación es la responsable del alto grado de actividad. Para el catalizador V0x95 también se presenta una actividad mayor cuando se usa TBHP que con H2O2, debido posiblemente a que también puede existir presencia de ZrV207 pero en una forma altamente dispersa (ya que XRD no muestra su presencia) en la superficie del catalizador.
Los catalizadores con oxidaciones parciales, presentan especies de V en diferentes proporciones de acuerdo a su grado de oxidación (V3+/ V4+/ V5+). Debido a la distribución de especies, los catalizadores oxidados muestran diferentes actividades; por ejemplo V0x95 presenta en su composición mayoritariamente especies V5+ con un bajo contenido de especies V3+, mientras que V0x64 presenta una mayor composición de especies reducidas. Por lo que es posible que la combinación de las especies de vanadio en las diferentes proporciones modifique la actividad catalítica.
De acuerdo a los resultados presentados, podemos observar que, las especies reducidas de V son más reactivas con H2O2 y que las especies oxidadas V son más reactivas con TBHP. Posiblemente esto es debido a que las diferentes especies de V tienen diferente capacidad de descomponer el agente oxidante y debido a ello se puede favorecer la actividad catalítica.
Finalmente, los resultados anteriores indican que la reactividad de DBTs decrece en el siguiente orden: DBT > 4-MDBT > 4,6-DMDBT, lo cual es consistente con los resultados previos para catalizadores solidos (Cedeño y col., 2008; Ismagilov y col., 2011). De acuerdo con estos resultados, Ishihara y col. (2005) afirman que el orden de reactividad es inverso en la presencia de un catalizador solido respecto a peracidos líquidos, sugiriendo que cuando un catalizador solido es usado, el principal parámetro que gobierna la reactividad no es la gran densidad electrónica de los átomos de azufre (Qian, 2008). La reactividad en HDS de DBTs decrece en el siguiente orden: DBT > 4-MDBT > 4,6-DMDBT, mientras que para la oxidación con peróxido de hidrogeno y acido formico es opuesta a la de HDS (Ito y col., 2006; Qian, 2008). De hecho para DBT, 4-MDBT y 4,6-DMDBT la diferencia de densidad electrónica en el átomo de azufre es muy pequeña (5.739, 5.758 y 5.760 respectivamente) y debería ser el impedimento esterico de grupos metilos lo que gobierna la reactividad, dado que estos grupos vienen a ser un obstáculo para la aproximación del átomo de azufre a la fase activa catalítica (en un sistema heterogeneo). Un resultado similar fue obtenido en el presente estudio, resaltando que la rapidez de reacción es controlada también por el impedimento estérico, inducido por los sustituyentes en los DBTs y no por la densidad electrónica del átomo de azufre.
Conclusiones
Una serie de catalizadores de óxido de vanadio sobre un soporte mixto de ZrO2 y Al2O3 fueron preparados por el método de impregnación por exceso de volumen. Para los catalizadores calcinados (V8%, V10% y V15%) la mayor actividad se presenta cuando se tiene un contenido de óxido de vanadio cercano a la monocapa (15%), donde se debe presentar la mayor dispersión de las especies de vanadio.
La actividad de los catalizadores con oxidaciones parciales muestra que las especies reducidas de V son más reactivas con H2O2 y las especies oxidadas de V son más reactivas con TBHP. Esto debido a la capacidad de descomposición del agente oxidante por estas especies. Por lo que la actividad catalítica en la 0DS muestra una dependencia con la presencia de las diferentes especies de vanadio.
La combinación de ZrV207 con especies oxidadas de vanadio muestra una alta actividad. Lo que sugiere que ZrV2O7 pudiera actuar como un promotor de las especies de V en el soporte, mejorando posiblemente la dispersión de las especies, evitando el aglomeramiento de las mismas y promoviendo así la actividad catalítica.
Agradecimientos
M. A. Alvarez Amparan agradece al C0NACyT por la beca recibida. Los autores agradecen a la DGAPA-UNAM (IN-116611) por el apoyo económico y a C. Salcedo (XRD) e I. Puente (SEM-EDX) por la asistencia técnica.
Referencias
Babich, I.V. y Moulijn, J.A. (2003). Science and technology of novel processes for deep desulfurization of oil refinery streams: A review. Fuel 82, 607-631. [ Links ]
Cedeño-Caero, L., Gómez-Bernal, H., Fraustro-Cuevas A., Guerra-Gómez H.D. y Cuevas-García, R. (2008). Oxidative desulfurization of synthetic diesel using supported catalysts Part III. Support effect on vanadium-based catalysts. Catalysis Today 133-135, 244-254. [ Links ]
Fabian-Mijangos, L. y Cedeño-Caero, L. (2011). V Loading Effect on V2O5/ZrO2 Catalysts for Oxidative Desulfurization. Industrial and Engineering Chemistry Research 50, 2659-2664. [ Links ]
Gazzoli, D., Rossi, S., Ferraris, G., Mattei, G., Spinicci, R. y Valigi, M. (2009). Bulk and surface structures of V2O5/ZrO2 catalysts forn-butane oxidative dehydrogenation. Journal of Molecular Catalysis A: Chemical 310, 17-23. [ Links ]
Gómez, B.H. y Cedeño, C.L. (2005). Solvent effects during oxidation/extraction desulfurization process of aromatic sulfur compounds from fuels. International Journal of Chemical Reactor Engineering 3, A28. www.bepress.com/ijcre/vol3/A28. [ Links ]
González-García, O. y Cedeño-Caero, L. (2010). V-Mo based catalysts for oxidative desulfurization of diesel fuel. Part II. Catalytic performance and stability after redox cycles. Catalysis Today 150, 237-243. [ Links ]
Huirache-Acufia, R., Sanchez-Bautista, M.G., Lemus-Ruiz, J., Ornelas, C., Paraguay-Delgado F. y Rivera-Muñoz, E.M. (2010). Synthesis and characterization of partially sulfided CoMoW oxides nanostructures and their application in the HDS of DBT. Revista Mexicana de Ingeniería Química 9, 209-218. [ Links ]
Ishihara, A., Wang, D., Dumeignil, F., Amano, H., Qian, E. y Kabe, T. (2005). Oxidative desulfurization and denitrogenation of a light gas oil using an oxidation/adsorption continuous flow process. Applied Catalysis A: General 279, 279-287. [ Links ]
Ismagilov, Z., Yashnik, S., Kerzhentsev, M., Parmon, V., Bourane, A., Al-Shahrani, F. M., Hajji, A. A. y Koseoglu, O. R. (2011): Oxidative Desulfurization of Hydrocarbon Fuels. Catalysis Reviews 53, 199-255. [ Links ]
Ito, E. y Rob van Veen, J. (2006). On novel processes for removing sulphur from refinery streams. Catalysis Today 116, 446-460. [ Links ]
Montesinos-Castellanos, A., Lima, E., Vázquez-Zavala, A., De los Reyes, J. A. y Vera, M. A. (2012). Industrial alumina as a support of MoP: catalytic activity in the hydrodesulphurization of dibenzothiophene. Revista Mexicana de Ingeniería Química 11, 105-120. [ Links ]
Qian, E. (2008). Development of novel nonhydrogenation desulfurization process: Oxidative desulfurization of distillate. Journal of The Japan Petroleum Institute 51, 14-31. [ Links ]
Ramírez-Verduzco, L.F., De los Reyes, J.A., Torres-García, E. (2008). Solvent effect in homogeneous and heterogeneous reactions to remove dibenzothiophene by an oxidationextraction scheme. Industrial and Engineering Chemistry Research 47, 5353-5361. [ Links ]
Song, C. y Ma, X. (2003). New design approaches to ultra-clean diesel fuels by deep desulfurization and deep dearomatization. Applied Catalysis B: Environmental 41, 207-238. [ Links ]
Stanislaus, A., Marafi, A. y Rana, M.S. (2010). Recent advances in the science and technology of ultra low sulfur diesel (ULSD) production. Catalysis Today 153, 1-68. [ Links ]
Torres-García, E., Galano, A., Rodríguez-Gattorno, G. (2011). Oxidative desulfurization (ODS) of organosulfur compounds catalyzed by peroxo-metallate complexes of WOx-ZrO2: Thermochemical, structural and reactivity indexes analyses. Journal of Catalysis 282, 201-208. [ Links ]
Wachs, I., Chen, Y., Jehng, J., Briand, L. y Tanaka, T. (2003). Molecular structure and reactivity of the group V metal oxides. Catalysis Today 78, 13-24. [ Links ]
Weckhuysen, B.M. y Keller D.E. (2003). Chemistry, spectroscopy and the role of supported vanadium oxides in heterogeneous catalysis. Catalysis Today 78, 25-46. [ Links ]














