Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ingeniería química
versión impresa ISSN 1665-2738
Rev. Mex. Ing. Quím vol.11 no.3 Ciudad de México dic. 2012
Biotecnología
Técnicas cromatográficas y su aplicación a estudios de cambios conformacionales, estabilidad y replegamiento de proteínas
Chromatographic techniques and their application to studies of conformational changes, stability and refolding of proteins
K. Mayolo-Deloisa1, L.M. Martínez2 y M. Rito-Palomares1*
1 Centro de Biotecnología-FEMSA, Tecnológico de Monterrey, Campus Monterrey. * Autor para la correspondencia. E-mail: mrito@itesm.mx
2 Departamento de Química, Tecnológico de Monterrey, Campus Monterrey. Ave. Eugenio Garza Sada 2501 Sur, Monterrey, NL 64849, México.
Recibido 17 de Agosto 2012
Aceptado 30 de Octubre 2012
Resumen
El constante incremento en las aplicaciones de proteínas en diversos campos como la medicina, el medio ambiente y la industria alimentaria; va generado un interés especial en el desarrollo de procesos para el análisis y purificación de proteínas. La cromatografía de líquidos ha sido ampliamente explotada para llevar a cabo dichos análisis debido a su versatilidad. La resolución de mezclas de proteínas por cromatografía de líquidos se basa en que bajo un conjunto de condiciones específicas, los solutos disueltos en una fase móvil interactúan con una fase estacionaria. Dependiendo de la naturaleza química de la fase y del tipo de estas interacciones, existen diferentes tipos de técnicas cromatográficas. En esta revisión se incluyen los principios básicos y las características principales de los métodos cromatográficos más utilizadas en el análisis de proteínas, como lo son: exclusion, intercambio tónico, interacción hidrofóbica y fase rever's. Además, se muestran las aplicaciones de dichas técnicas para el estudio de cambios conformacionales, estabilidad y replegamiento de proteínas; áreas que han despertado gran interés de la comunidad científica en la última década.
Palabras clave: técnicas cromatográficas, cromatografía de líquidos, cambios conformacionales, estabilidad de proteínas, bioseparaciones.
Abstract
The increase in protein applications in various fields; such as medicine, environmental protection and food industry; has generated a special intaresa in the development of processes eor the analyses and purification of proteins. Liquid chromatography has been widely exploited to carry out such analyses because of its versatility. The resolution of protein mixtures by liquid chromatography is based upon specific conditions, in which solutes dissolved in a mobile phase interact with a stationary phase. Depending upon the chemical nature of the type; of interactions, there are different chromatographic techniques. This review paper includes the basic principles and main characteristic. of the liquid chromatographies used in the analysis of proteins, such as: size exclusion, ion exchange, hydrophobic interaction and reverse phase. Moreover, it shows the applications of such techniques in the study of conformational changes, stability and refolding of proteins. Such research fields have raised attention from research groups in the last decade.
Keywords: chromatographic techniques, liquid chromatography, conformational changes, stability of proteins, bioseparations.
1 Introducción
Los procesos de separación de proteínas están dominados principalmente por la cromatografía de líquidos (CL). La resolución de mezclas proteícas por CL se basa en el principio de que bajo un conjunto dado de condiciones, los solutos disueltos en una fase móvil interactúan en grado diferente con la fase estacionaria contenida en la columna. El tipo de interacción depende de las propiedades físicas y químicas de la fase estacionaria. De esta manera, la CL explota las diferencias inherentes entre las proteínas (e.g., tamaño, hidrofobicidad, especificidad de unión y de carga) con el fin de lograr su separación (Cummins y col., 2011). En base a lo anterior, las técnicas de cromatografía de líquidos pueden estar clasificadas en cromatografía de: exclusión (Size Exclusión Cromatography, SEC) o filtración en gel, intercambio iónico (Ion Exchange Chromatography, IEC), interacción hidrofóbica (Hydrophobic Interaction Chromatography, HIC) y fase reversa (Reverse Phase Chromatography, RPC).
En SEC la separación se lleva a cabo por la inclusión o exclusión de las proteínas en una fase estacionaria porosa (con cavidades de tamaño y distribución definidas), tradicionalmente se dice que dicha separación es debida al tamaño o peso molecular de la molécula (Irvine 1997). Cuando la separación es en base a la carga de las proteínas, se utiliza IEC (Cummins y col., 2011); mientras que las separaciones que se llevan a cabo mediante interacciones hidrofóbicas entre la fase estacionaria, la fase móvil y las proteínas se realizan utilizando HIC y/o RPC.
Las técnicas cromatográficas han sido utilizadas en el análisis y purificación de proteínas; sin embargo, se han realizado diversos estudios en donde son usadas para detectar cambios conformacionales en las proteínas, ya sea por el proceso cromatográfico en sí o por la naturaleza de la muestra. Debido a esto también es posible determinar la estabilidad de una proteína. Por otro lado, como consecuencia de la expresión de proteínas como cuerpos de inclusión en microorganismos recombinantes, el replegamiento de proteínas a través de técnicas cromatográficas ha cobrado relevancia en la última decada, y actualmente se están desarrollando nuevos procesos con este proposito (Antonio-Pérez y col., 2012; Hwang y col., 2010; Wang y Geng 2012).
En México, la investigación en el aáea de bioingeniería se ha centrado principalmente en el desarrollo de procesos de fermentación (upstream) para la producción de diversos productos biológicos. Como consecuencia el número de grupos que enfocan sus investigaciones en el desarrollo de procesos de bioseparación (downstream) son reducidos. Si bien esta situación no es exclusiva de México, resulta más acentuada a nivel nacional. Esto representa un área de oportunidad relevante debido a que esta línea de investigación resulta clave para la implementación de bioprocesos a nivel comercial.
Es un hecho que la cromatografía no es una técnica nueva; sin embargo, es una de las técnicas más explotadas para la elucidación de mezclas de proteínas. De ahí la importancia y el impacto de esta técnica en los procesos de separación, por lo que se debe seguir en la búsqueda de nuevas fases estacionarias que permitan aun más la aplicación de la CL en el análisis de proteínas.
Con base en lo anterior, el objetivo de este artículo de revisión es recopilar los principios fundamentales de las técnicas cromatográficas utilizadas en la purificación de proteínas, así como el estado del arte de su aplicación en el análisis conformacional, estabilidad y replegamiento de las mismas.
2 Técnicas cromatográficas utilizadas en la separación dé proteínas
2.1 Cromatografía de exclusión molecular
La cromatografía de exclusión molecular (Size Exclusión Chromatography, SEC) es el nombre general para los procesos de separación de biomoléculas de acuerdo a su tamaño cuando una solución fluye a través de una cama empacada con un medio poroso (Irvine 1997; Kostanski y col., 2004).
Para la separación en SEC, se utilizan las propiedades de tamiz molecular de una variedad de materiales porosos. El proceso de separación depende del tamaño y el volumen hidrodinámico (volumen que ocupa una molécula en solución), el cual define la capacidad de la molécula de penetrar o no en los poros de la fase estacionaria. De tal forma que, las moléculas de alto peso molecular son excluidas de los poros debido a un efecto estérico y pasan rápidamente a través de la matriz (ver Fig. 1). En el caso de biomoléculas pequeñas, estas tienen diferente accesibilidad en las cavidades de la matriz porosa.

En la Fig. 1 se observa que las moléculas que son completamente excluidas eluyen primero en el volumen vacío, V0 (Irvine 1997). El volumen de elución de las moléculas que pueden entrar en los poros libremente es designado como volumen total, Vt. El volumen de elución de una proteína que esta entre V0 y Vt es designado como Ve (Cutler 2008).
Fase estacionaria o matriz. Un amplio rango de matrices preparativas y analíticas esta disponible comercialmente, en la Tabla 1 se muestran algunas de las matrices preparativas más utilizadas en la separación de proteínas. Las matrices preparativas más usadas son frecuentemente de polímero naturales como agarosa o dextrano, pero también pueden estar compuestas por poliacrilamida (Cutler, 2008; Hagel, 2011).
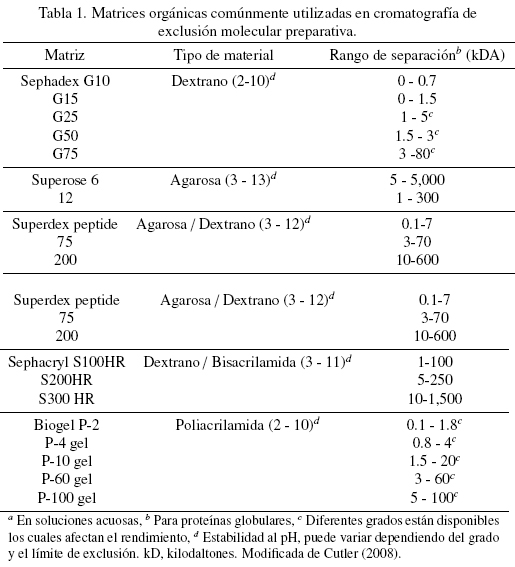
Las columnas de SEC de alto rendimiento son usadas analíticamente para estudiar la pureza de las proteínas, su plegamiento, las interacciones proteína-proteína, etc. (Irvine 2003). Por otro lado, las separaciones preparativas se realizan utilizando matrices de SEC de baja presión y sirven para separar mezclas de proteínas con diferentes pesos moleculares, proteínas de otras macromoléculas biológicas y para la separación de proteínas agregadas de monomeros. La cromatografía de exclusión molecular es frecuentemente utilizada como un paso de pulimiento final del producto (Cutler, 2008).
Fase móvil . En contraste con otros tipos de cromatografía, la selectividad de una matriz de SEC no se puede ajustar cambiando la composición de la fase móvil . Las matrices de SEC tienden a ser compatibles con muchos buffers acuosos; incluso en la presencia de surfactantes, agentes reductores o agentes desnaturalizantes. Dado que las moléculas no son adsorbidas en la matriz, las proteínas se eluyen de modo isocrático para lo cual se requiere de un solo buffer. Idealmente, todos los buffers usados en SEC y en todos los tipos de cromatografía deben de ser filtrados con una membrana de 0.2 jum y desgasificados (Cutler, 2008).
2.2 Cromatografía de intercambio iónico
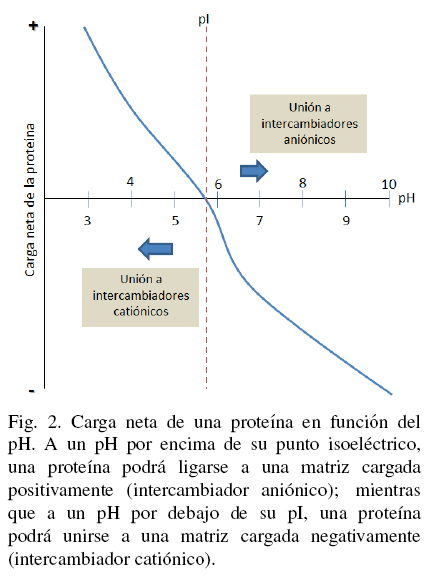
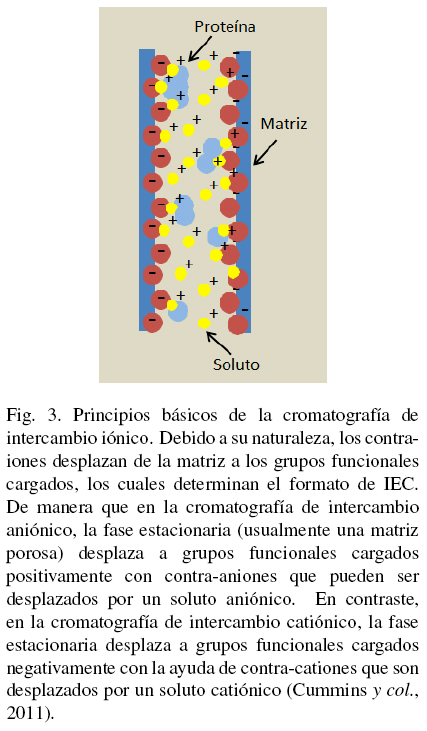
La cromatografía de intercambio iónico (Ion Exchange Chromatography, IEC) separa las moléculas en base a su carga ionica neta. La separación se lleva a cabo por la competencia entre proteínas con diferente carga superficial por grupos cargados opuestamente sobre un adsorbente o una matriz de intercambio icónico. Actualmente, IEC es una de las técnicas de purificación de proteínas más usadas. En una separación utilizando IEC, las interacciones hidrofóbicas reversibles entre los solutos son controladas con el objetivo de favorecer la unión o elución de moléculas específicas logrando su separación. Una proteína que no tiene carga neta a un pH equivalente a su punto isoeléctrico (pl) no podrá interactuar con la matriz o fase estacionaria cargada (ver Fig. 2). Sin embargo, a un pH por encima de su punto isoeléctrico una proteína podrá ligarse a una matriz cargada positivamente o intercambiador aniónico mientras que a un pH por debajo de su pl, una proteína podrá unirse a una matriz cargada negativamente o intercambiador catiónico (Handbook GEa 2004; Cummins y col., 2011). Dichos intercambiadores existen en estado de equilibrio entre la fase móvil y la fase estacionaria, dando lugar a dos tipos de IEC, llamados aniónico y cationico, tal y como se muestra en la Fig. 3. La matriz intercambiadora puede incluir protones (H+), grupos hidroxilo (OH-), iones monoatómicos cargados (Na+, K+, Cl-), iones monoatómicos doblemente cargados (Ca2+, Mg2+) e iones poliatómicos inorgánicos (SO24-, PO34-), además de bases orgánicas (NR3H+) y ácidos (R-COO-) (Cummins y col., 2011).
Fase estacionaria o matriz. La elección de una matriz de intercambio iónico adecuada es probablemente uno de los aspectos más importantes y debe estar basada en diversos factores, que incluyen los siguientes: 1) la fuerza del intercambiador de iones, 2) el flujo y/o volumen de muestra y 3) las propiedades de la muestra. Como se mencionó anteriormente y como se muestra en la Tabla 2, los grupos funcionales de intercambio iónico pueden caer dentro de dos categorías. Los grupos funcionales cargados positivamente como dietilaminoetil (DEAE) y amonio cuartenario (Q), por ejemplo, son empleados rutinariamente en cromatografía de intercambio anionico, mientras que grupos cargados negativamente como carboximetil (CM), sulfometil (S) y sulfopropil (SP) son utilizados como intercambiadores cationicos. Ambos tipos de intercambiadores pueden ser categorizados como fuertes o débiles. Los nombres se refieren a los valores de pKa de los grupos cargados. Los intercambiadores iónicos fuertes están totalmente ionizados sobre un amplio rango de pH. Consecuentemente, con intercambiadores fuertes las proteínas pueden adsorberse a varios sitios, necesitando condiciones de elución severas para su desorción (de hasta 1.0 M de NaCl) que puede comprometer la estabilidad de la muestra y la resolución. Los intercambiadores fuertes son por lo tanto utilizados en la optimización de los protocolos de purificación (y para ligar proteínas con valores de pl hacia el extremo final de la escala de pH). En contraste, los intercambiadores ionicos débiles son más flexibles en terminos de selectividad, son comúnmente elegidos para la separación de proteínas que retienen su funcionalidad sobre un rango de pH de 6 a 9, así también como para purificar proteínas labiles que requieren condiciones de elución débiles. El tamaño, la porosidad y la capacidad de unión de las partículas son también importantes cuando se selecciona una matriz de intercambio iónico (Cummins y col., 2011).
Fase móvil . Varios factores son importantes en la selección de la fase móvil , que pueden incluir: 1) la carga del buffer, 2) la fuerza ionica del buffer y 3) el pH. El buffer de tris es utilizado con intercambiadores DEAE, mientras que los buffers de fosfatos y acetatos son frecuentemente utilizados con intercambiadores CM. Por otra parte, la fuerza iconica mínima del buffer recomendado para intercambio iónico es de aproximadamente 10 mM. El pH de la fase móvil puede ser alterado para favorecer la adsorción o elución de las proteínas. En general el valor del pH es elegido de manera que permita la unión reversible de la proteína de interés a la matriz o fase estacionaria. Esto es usualmente alrededor de 1 unidad arriba o abajo del pi de la proteína.
2.3 Cromatografía de interacción hidrofóbica
La cromatografía de interacción hidrofóbica (Hydrophobic Interaction Chromatography, HIC) es uno de los métodos de purificación de macromoléculas biológicas más utilizado, especialmente para proteínas terapeúticas (Lienqueo y col., 2007; Mahn y col., 2005). Los mecanismos de adsorción en el cual están basados las interacciones hidrofóbicas de las moleículas con la fase estacionaria fueron primeramente demostradas por Tiselius en 1940 (Porath 1987).
La HIC explota la interacción reversible entre la superficie hidrofóbica de una proteína y una matriz cromatográfica con un ligando hidrofóbico a moderadamente altas concentraciones de sal, como el sulfato de amonio. Este tipo de sales tiene alta polaridad y se unen fuertemente al agua, lo cual induce la exclusión del agua sobre la proteína y la superficie del ligando lo que promueve las interacciones hidrofóbicas y la precipitación de la proteína (salting-out) (Lienqueo y col., 2007; Xia y col., 2004).
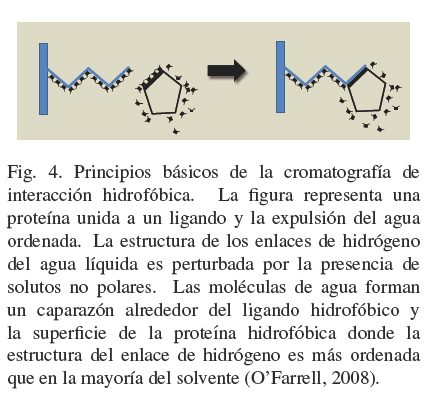
Las interacciones hidrofóbicas son las fuerzas no covalentes más importantes que pueden estar relacionadas con diferentes procesos, como la estabilización de la estructura de las proteínas, la unión de enzimas a un sustrato y el replegamiento de proteínas. Este tipo de interacción aparece cuando compuestos no polares son colocados dentro de un ambiente acuoso (ver Fig. 4) (Lienqueo y col., 2007; Queiroz y col., 2001).
Fase estacionaria o matriz. La fase estacionaria en HIC presenta pequeños grupos no-polares unidos a estructuras de polímeros hidrofílicos. Por lo tanto, existen varios tipos de fases estacionarias en HIC que pueden diferir en la naturaleza química del ligando, las superficie o concentración del ligando sobre el soporte y la naturaleza química y el tamaño de partícula del soporte base (Lienqueo y col., 2007; Queiroz y col., 2001). En la Tabla 3 se muestran algunas de las matrices comerciales disponibles (OTanell 2008).
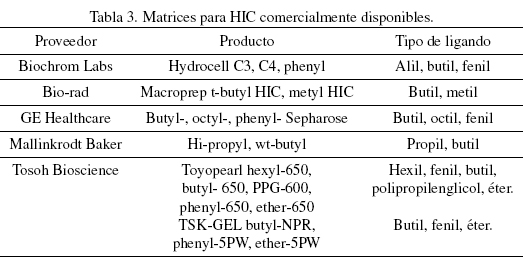
El soporte por sí mismo debe ser inerte y no debe tener grupos funcionales capaces de ligarse a la proteína. Los ligandos más ampliamente usados son alcanos de cadena lineal (como butil y octil) y algunos grupos aromáticos (e.g. fenil). Un incremento en la longitud de la cadena de un ligando alquilo aumenta la fuerza de la interacción hidrofóbica entre la proteína y la resina. Por otro lado, un incremento en el grado de sustitución de la resina lleva a un aumento en la capacidad de unión de la fase estacionaria, debido a la alta probabilidad de que se formen múltiples puntos de unión y en ocasiones esto puede hacer difícil la elución de la proteína ligada sin desnaturalizarla (Lienqueo y col., 2007). La elección del ligando es esencialmente empírica, pero se puede hacer uso del conocimiento básico que se tenga sobre la proteína de interés. Una proteína hidrofóbica débil puede requerir de un ligando hidrofóbico fuerte para asegurar la unión. Con una proteína muy hidrofobica, es preferible un ligando hidrofóbico débil para evitar la desnaturalización (O'Farrell 2008).
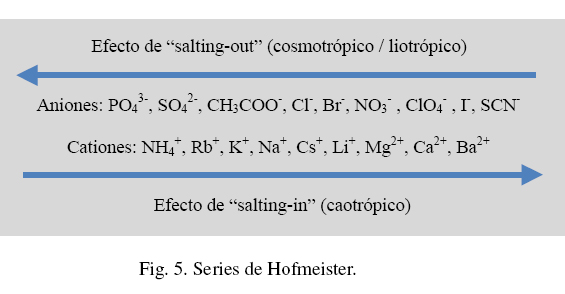
Fase móvil. La unión y/o la elución en HIC son logradas por la adición o remoción de sales u otros solutos. La estructura formada por las sales aumenta la fuerza de las interacciones hidrofobicas. Las series de Hofmeister (o liotropicas), presentadas en la Fig. 5, organiza a los iones desde los que promueven las interacciones hidrofóbicas hasta los que las disminuyen. Esto se refiere tanto a la capacidad de las sales para hacer que una proteína se precipite (salting-out), así como a sus interacciones en HIC (O'Farrell 2008; Xia y col., 2004). Cualquier sal liotrófica puede ser utilizada en HIC, sin embargo el sulfato de amonio es usado a menudo debido a su alta solubilidad y buenas propiedades liotropicas (O'Farrell 2008; Roettger y Ladisch 1989). En la mayoría de las aplicaciones, la unión se logra mediante la carga a la columna de una alta concentración de sal. La elución se lleva a cabo mediante la reducción de la concentración de sal, ya sea a través de un gradiente o en forma escalonada. A pesar de que con la elución en gradiente se puede lograr una mejor separación, en ocasiones los picos pueden ser amplios debido a la agregación de las proteínas y la lenta asociación/disociación. Esto puede resultar en una baja resolución. En tales circunstancias, se recomienda utilizar un método de elución por pasos. También se ha reportado que se pueden lograr picos más nítidos mediante la inclusión de una pequeña cantidad de solvente (e.g. etanol 0.1-5%) en el buffer de elución (O'Farrell 2008).
2.4 Cromatografía de fase reversa
La cromatografía de fase reversa (Reversed Phase Chromatography, RPC) describe un tipo de cromatografía en la cual la fase estacionaria es menos polar que la fase móvil . La RPC es una técnica de purificación capaz de separar componentes con características muy similares, como proteínas que difieren en solo un aminoacido e isomeros conformacionales de péptidos (de Collongue-Poyet y col., 1995; McNay y Fernandez 2001). Sin embargo, el valor de la RPC puede estar limitado por diversos factores, como el uso de solventes y su disposición final así como a los bajos porcentajes de recuperación debidos a los cambios conformacionales ocasionados por las interacciones envueltas en el proceso (McNay y Fernandez 2001; Sokol y col., 2003).
La asociación de una molécula con la fase estacionaria puede ocurrir tanto por partición como por adsorción. Los mecanismos de adsorción están basados en la teoría de Melander y Horvath (Horvath y Melander 1977), que establece que la retención en RPC surge de la unión de las moléculas en la fase estacionaria y se debe principalmente al resultado de las interacciones hidrofóbicas entre el soluto y la fase móvil .
Fase estacionaria. Hay dos tipos principales de medios para RPC, uno basado en una matriz hidrofílica de perlas de sílice cubierta con una fase hidrofóbica unidos por cadenas de carbono (hidrocarburos normalmente n-alquilo o aromáticos), y otro basado en una matriz de polímero hidrofobico. Las matrices de alta porosidad proporcionan una superficie interna de alta capacidad de unión.
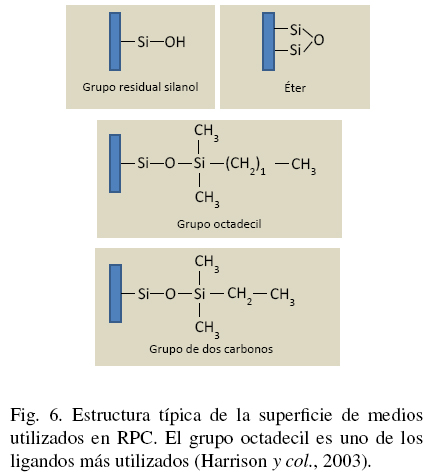
La sílica fue el primer polímero utilizado como fase estacionaria para RPC. La sílica es producida como una cama porosa que es químicamente estable a pH bajos y solventes organicos. Los ligandos que están típicamente unidos a soportes de sílica son: octil (C8), octadecil (C18), fenil o metil (C2) (Harrison y col., 2003). La Fig. 6 muestra la superficie de la sílica unida a diferentes ligandos hidrofóbicos.
Los polímeros orgánicos sintéticos, como el poliestireno, también son utilizados como matrices cromatográficas en RPC. La gran ventaja del poliestireno es su excelente estabilidad química, principalmente sobre condiciones de pH fuertes. A diferencia de la sílica, el poliestireno es estable en un rango de pH de 1-12 y su superficie es fuertemente hidrofóbica.
La porosidad de la fase estacionaria es un factor crucial y determinante en la adsorción. Las matrices con tamaño de poro de aproximadamente 100 Á son utilizadas predominantemente para purificar pequeñas moléculas orgánicas y péptidos. Mientras que las matrices con poros de 300 Å o mayores pueden ser usadas en la purificación de proteínas y péptidos recombinantes (Handbook GEb 2006).
Fase móvil . La retención hidrofóbica del soluto en la fase estacionaria puede disminuirse añadiendo un disolvente organico a la fase móvil acuosa. Al disminuir la polaridad de la fase móvil, la distribución de los solutos cambia hacia la fase móvil . Los dos solventes más utilizados son el acetonitrilo y el metanol, siendo el acetonitrilo la opción más popular. El isopropanol (2-propanol) puede ser empleado por sus propiedades de elución, pero su uso esta limitado por su alta viscosidad, lo que se traduce en una menor eficiencia de la columna.
El pH y la composición de la fase móvil son dos parámetros relevantes que pueden ser optimizados: el pH para variar la medida de la disociación de los silanoles residuales en el soporte de sílica y la composición de la fase móvil para compensar la disminución de la retención cuando aumenta la ionización del soluto. La influencia de estos dos parametros en el proceso de retención es algo muy complejo ya que la variación de la composición de la fase móvil (tipo de modificador organico, tipo de buffer y fuerza ionica) induce a una variación del grado de ionización de las moléculas (Heinisch y Rocca 2004).
3 Aplicación de técnicas cromatográficas a estudios de cambios conformacionales, estabilidad y replegamiento de proteínas
Desde la aprobación del uso terapeutico de la insulina humana recombinante en el año 1982, que marcó el comienzo de la era de los productos biofarmacéuticos, muchos productos proteicos han demostrado ser eficaces y seguros para el tratamiento de numerosas enfermedades (Gaberc-Porekár y col., 2008; Javsevar y col., 2010). Sin embargo, este tipo de fármacos tienen serios problemas de estabilidad. Mientras que su actividad biológica reside en parte en la estructura primaria de la proteína, en la mayoría de los casos el estado funcional (nativo) es debido a su configuración tridimensional específica. Actualmente existen diferentes métodos analíticos para detectar y cuantificar cambios en la estructura terciaria de proteínas por espectroscopia o fluorescencia. Estos cambios de la estructura terciaria pueden ser conformacionales y/o de desnaturalización y pueden conducir a la perdida de la actividad biológica. Además de las técnicas espectroscopias, la cromatografía de líquidos también puede ser utilizada para estos fines ya que permite detectar cambios conformacionales y de estabilidad en una proteína (Withka y col., 1987).
Otra de las aplicaciones de la cromatografía en los ultimos años es el replegamiento de proteínas recombinantes (Gu y col., 2001). Las proteínas recombinantes son frecuentemente expresadas en cuerpos de inclusión que no tienen la actividad biológica deseada, por lo que tienen que ser replegados para recuperar su actividad. Las ventajas del replegamiento cromatográfico son que: 1) existen diferentes modos de operación dependiendo de la técnica cromatográfica utilizada; 2) el replegamiento simultaneo y la purificación de las proteínas correctamente plegadas de las que no lo estan, puede eliminar el proceso de purificación adicional despues del replegamiento; 3) las proteínas ligadas a la fase estacionaria reducen la posibilidad de que choquen entre sí durante el repliegue, lo que se traduce en la disminución de la formación de agregados y 4) debido a que los sistemas cromatografías están ampliamente caracterizados es más fácil instalarlos, automatizarlos y escalarlos (Hwang y col., 2010).
En la Tabla 4 se resumen algunos de los trabajos en donde se reporta el uso de una técnica cromatográfica (SEC, IEC, RPC o HIC) para estudiar cambios conformacionales, estabilidad y replegamiento de proteínas.
Uno de los estudios más completos sobre la aplicación de cromatografía para detectar cambios conformacionales de proteínas fue realizado por Withka y sus colaboradores (Withka y col., 1987), para ello utilizaron tres proteínas modelo: BSA (albumina de suero bovino), tripsina y lisozima y las analizaron por SEC, HIC e IEC. En la Tabla 4 se resumen las condiciones experimentales con las que trabajaron. En el caso de BSA detectaron cambios conformacionales en SEC debido al uso de urea. Bajo las condiciones mencionadas, observaron una disminución en la altura del pico de la proteína nativa a la vez que se observo un incremento en la altura del pico de un intermediario, el cambio en la altura de ambos picos fue completamente dependiente de la concentración de urea. Los cambios conformacionales en BSA están correlacionados con su comportamiento cromatográfico durante SEC. Cuando se utilizó IEC e HIC sólo se pudo detectar y cuantificar la forma nativa de BSA. En cuanto a los estudios con IEC, los tiempos de retención para especies cargadas positivamente, como el caso de tripsina, disminuyeron cuando se incrementaba la concentración de urea. Mientras que tanto la tripsina como la lisozima poseen una carga neta positiva bajo las condiciones empleadas, tripsina muestra un incremento en el tiempo de retención; lo que sugiere que el efecto sobre el proceso cromatográfico puede ser independiente de cualquier modificación de la fase estacionaria por la urea. De manera general, en este estudio concluyeron que las alteraciones conformacionales detectadas cromatográficamente pueden ser correlacionadas directamente con los cambios detectados por fluorescencia y la medición de actividad enzimática.
Hou y col., (2010) utilizaron 5 proteínas modelos para examinar los efectos de la cromatografía sobre los cambios conformacionales inducidos por urea en cromatografía de intercambio iónico (ver Tabla 4). Además evaluaron la estructura secundaria y terciaria con dicroismo circular y fluorescencia. Los resultados que obtuvieron indicaron que los tiempos de retención de las proteínas fueron más sensibles a la estructura terciaria que a la secundaria. El tamaño de HSA (albumina de suero humano) incremento cuando se utilizo una concentración 7.0 M de urea, sin embargo se observo una disminución en su carga. En contraste, para BLA (α-lactoalbumina), el tamaño de la proteína no cambia demasiado a una concentración de urea de 7.0 M. Para proteínas como glucosa oxidasa e invertasa, las estructuras fueron relativamente estables a 3.0 M de urea mientras que a 7.0 M se observaron algunos cambios menores en el tiempo de retención. Con esto se pudo observar que los cambios estructurales inducidos por urea sobre el comportamiento cromatográfico en IEC pueden ser muy complicados y específicos para cada proteína (Hou y col., 2010).
La IEC también puede ser empleada para llevar a cabo el replegamiento de proteínas. En este proceso la proteína desplegada o desnaturalizada es primeramente ligada a una columna de IEC y replegada por intercambio de buffer a su forma nativa. Subsecuentemente, la proteína replegada correctamente es eluida y separada del resto de los contaminantes. En este contexto, Yamamoto y col., (2007) investigaron dos sistemas: proteínas desplegadas o desnaturalizadas (lisozima y BSA) con urea y ditriotreitol (DTT) y proteínas PEGiladas (lisozima ligada a polietilen glicol (PEG) 5000). Además desarrollaron un modelo matemático que predice el volumen de elución en un gradiente lineal de sal y que aplicaron para obtener información sobre el número de sitios ligados. Las muestras de proteínas desnaturalizadas fueron preparadas incubaindolas en un buffer que contenía 4.0 - 8.0 M de urea y 0.01 M de DTT. Las condiciones experimentales se muestran en la Tabla 4. Con esto, observaron que las proteínas desnaturalizadas con urea y DTT mostraron una retención más débil y valores más grandes de sitios de unión comparados con los valores obtenidos para la proteína nativa. En cuanto a las proteínas PEGiladas, debido al efecto protector de la carga, se observo una retención más débil y los valores de los sitios de unión disminuyeron con un decremento del volumen de retención.
La HIC es usada potencialmente para el replegamiento de proteínas debido a que las interacciones hidrofóbicas son las fuerzas dominantes en el plegamiento y estabilización de la estructura. Las proteínas purificadas por HIC usualmente retienen su conformación nativa y su actividad biológica porque las interacciones proteína-ligando suelen ser débiles (Hwang y col., 2010).
Deitcher y col. (2009) utilizaron técnicas de 'marcado' con deuterio además de un modelo matemático (two-conformation four-state model) que describe el equilibrio termodinámico de la adsorción de proteínas y desnaturalización en HIC, utilizando a-lactoalbumina como modelo experimental (Xiao y col., 2006; Xiao y col., 2007). Ellos investigaron la dependencia de la sal sobre la adsorción tanto de la proteína nativa como de la desnaturalizada. Con estos experimentos determinaron que la adsorción de proteínas desnaturalizadas en superficies hidrofóbicas a bajas concentraciones de sulfato de amonio (no mayores a 1.2 M) puede ser reversible, y los modelos apropiados deben tener en cuenta el replegamiento sobre la superficie. En el caso de BLA ligada a calcio, se comprobo que la tasa de replegamiento sobre la superficie es más grande que la tasa de desnaturalización (Deitcher y col., 2009).
Hwang y sus colaboradores investigaron el efecto de la concentración de la sal en la fase móvil , el tipo de elución, y la hidrofobicidad de la fase estacionaria sobre el replegamiento de lisozima en HIC; bajo las condiciones descritas en la Tabla 4 (Hwang y col., 2010). De manera que observaron que con la débil unión entre la lisozima y la resina menos hidrofóbica (butyl sepharose) a una concentración 1.0 M de sulfato de amonio se puede obtener el mejor rendimiento de replegamiento. Las condiciones optimas de elución se pudieron obtener con un incremento lineal de hasta 4.0 M de urea. El rendimiento de replegamiento fue mejorado de 1.6 a 4.8 veces comparando la dilución en batch convencional con el metodo de HIC, respectivamente. Con esto pudieron concluir que para obtener rendimientos óptimos de replegamiento es necesario considerar el tipo de resina, la fuerza iónica y la concentración del desnaturalizante con respecto a las características hidrofóbicas de la proteína. Las características hidrofóbicas de una proteína son una combinación del efecto de la superficie hidrofobica, la carga superficial, la cantidad de residuos aromáticos y el número de enlaces disulfuro (Hwang y col., 2010).
La RPC también ha sido utilizada para estudiar la desnaturalización de proteínas. Ejemplo de ello es el trabajo reportado por McNay y col., (2001), en donde mostraron como el tipo de sal y la fuerza iconica afectan la conformación del inhibidor de tripsina pancreatica de bovino (BPTI).
Como puede notarse en las investigaciones anteriormente discutidas, el compuesto más utilizado para el estudio de los cambios conformacionales de proteínas es la urea, que es bien conocido como un agente desnaturalizante. En este tipo de estudios, se han propuesto dos modelos principales. Uno es llamado el modelo de interacción directa, en el cual la urea interactúa con las cadenas laterales polares vía puentes de hidrogeno y otras interacciones electrostáticas, así como a través de fuerzas de van der Waals. El otro es el modelo indirecto, donde la urea afecta los puentes de hidrógeno del agua, alterando el entorno de la solución por interacciones hidrofobicas, en consecuencia cambia la solvatación de las proteínas. Mientras que teorías recientes soportan el modelo de interacción directa, otras argumentan que ambos mecanismos son igualmente relevantes (Hou y col., 2010).
Debido al auge de la producción de proteínas a través de microorganismos recombinantes, se preve un aumento en la aplicación de las técnicas cromatográficas en el replegamiento de proteínas especialmente utilizando SEC e HIC. Como ya se mencionó, una de las grandes ventajas es que se puede llevar a cabo el replegamiento y el proceso de purificación en un mismo paso; lo que puede reducir el costo del proceso, especialmente cuando se trabaja con proteínas de interés farmacéutico.
Las condiciones en las cuales se llevan a cabo los estudios de cambios conformacionales y estabilidad de proteínas son diversas y al parecer dependen de las características de cada proteína. Esto puede verse como una desventaja de la aplicación de los métodos cromatograficos puesto que es difícil generar métodos universales; sin embargo, esto es parte de la versatilidad de las técnicas cromatográficas.
En los procesos reportados en la Tabla 4 se utiliza tanto cromatografía a escala analítica (HPLC) como a escala preparativa (FPLC, Äkta explorer system) (Wang y Geng, 2012). En la mayoría de los casos los sistemas son fácilmente escalables; sin embargo, existen áreas de oportunidad, ejemplos de ello son los problemas de escalamiento de sistemas de replegamiento asistido por chaperoninas y foldasas debido a la cantidades estequiométricas que deben utilizarse (Antonio-Pérez y col., 2012).
Detectar cambios conformacionales en las proteínas al mismo tiempo en que se separan o purifican resulta sumamente práctico y da una ventaja al proceso, puesto que permite definir fácilmente cuales son las condiciones adecuadas bajo las cuales las proteínas conservan o no su estabilidad. En muchas ocasiones se pueden formar mezclas de isoformas, que no pueden ser detectadas fácilmente con los análisis convencionales (e.g. electroforesis, técnicas de cuantificación de proteínas como Bradford o Lowry), pero si por técnicas como IEC, HIC o RPC.
Conclusiones
Es evidente que la cromatografía es un poderoso metodo de separación y análisis de proteínas. Las técnicas cromatográficas pueden llevarse a cabo por diferentes mecanismos como son: absorción continua, adsorción, partición e intercambio ionico. Son claras sus ventajas en la purificación de proteínas, particularmente las de interés farmacéutico. La cromatografía ha sido utilizada con éxito para determinar cambios conformacionales y estabilidad en proteínas, que además pueden ser correlacionados con los métodos tradicionales; como fluorescencia. Una de las aplicaciones que ha cobrado relevancia en la última década es el replegamiento de proteínas, en donde se ha demostrado que el proceso puede ser mucho más efectivo que cuando se utilizan otros métodos (e.g. diálisis y dilucion). Ademas, es posible realizar el replegamiento y el proceso de purificación de manera simultanea. Sin embargo, es importante considerar que la versatilidad de las técnicas cromatográficas genera un sinnúmero de condiciones experimentales, que pueden depender de las características de cada proteína. Es por ello que se identifica como un área de oportunidad la posibilidad de establecer procesos generales para el análisis de los cambios conformacionales y estabilidad de proteínas.
Agradecimientos
Los autores agradecen el apoyo financiero del Tecnológico de Monterrey a través de la Cátedra de Bioprocesos (CAT-161). Karla Mayolo-Deloisa agradece a CONACyT por la beca No. 27470 para realizar estudios de posgrado.
Referencias
Antonio-Pérez, A., Ramón-Luing, L.A. y Ortega-López, J. (2012). Chromatographic refolding of rhodanese and lysozyme assisted by the GroEL apical domain, DsbA and DsbC immobilized on cellulose. Journal of Chromatography A 1248,122-129. [ Links ]
Corbett, R.J.T. y Roche, R.S. (1984). Use of high-speed size-exclusión chromatography for the study of protein folding and stability. Biochemistry 23,1888-1894. [ Links ]
Cummins, P.M., Dowling, O. y O'Connor, B.F. (2011). Ion-Exchange Chromatography: Basic Principles and Application to the Partial Purification of Soluble Mammalian Prolyl Oligopeptidase Protein Chromatography. In: Walls D, Loughran ST, editors: Humana Press. p 215-228. [ Links ]
Cutler, P. (2008). Size-Exclusión Chromatography Molecular Biomethods Handbook. In: Walker JM, Rapley R, editors: Humana Press. p 719729. [ Links ]
de Collongue-Poyet, B., Vidal-Madjar, C., Sebille, B. y Unger, K.K. (1995). Study of conformational effects of recombinant interferon y adsorbed on a non-porous reversed-phase silica support. Journal of Chromatography B: Biomedical Sciences and Applications 664, 155-161. [ Links ]
Deitcher, R.W., Xiao, Y., O'Connell, J.P. y Fernández, E.J. (2009). Protein instability during HIC: Evidence of unfolding reversibility, and apparent adsorption strength of disulfide bond-reduced α-lactalbumin variants. Biotechnology and Bioengineering 102, 14161427. [ Links ]
Fogle, J.L., O'Connell, J.P. y Fernandez, E.J. (2006). Loading, stationary phase, and salt effects during hydrophobic interaction chromatography: α-Lactalbumin is stabilized at high loadings. Journal of Chromatography A 1121, 209-218. [ Links ]
Gaberc-Porekar, V., Zore, I., Podobnik, B. y Menart, V. (2008). Obstacles and pitfalls in the PEGylation of therapeutic proteins. Current Opinion in Drug Discovery & Development 11, 242-250. [ Links ]
Gospodarek, A.M., Smatlak, M,E., O'Connell, J.P. y Fernandez, E.J. (2010). Protein Stability and Structure in HIC: Hydrogen Exchange Experiments and COREX Calculations. Langmuir 27, 286-295. [ Links ]
Gu, Z., Su, Z. y Janson, J-C. (2001). Urea gradient size-exclusión chromatography enhanced the yield of lysozyme refolding. Journal of Chromatography A 918, 311-318. [ Links ]
Handbook GEa. (2004). Ion Exchage Chromatography & Chromatofocusing: Principles and Methods. GE Healthcare. Uppsala Sweden. [ Links ]
Handbook GEb. (2006). Hydrophobic Interaction and Reversed Phase Chromatography: Principles and Methods. GE Healthcare. Uppsala Sweden. [ Links ]
Hagel, L. (2011). Gel Filtration: Size Exclusión Chromatography. Protein Purification. John Wiley & Sons, Inc. p 51-91. [ Links ]
Harrison, R.G., Todd, P., Rudge, S.R. y Petrides, D.P. (2003). Liquid Chromatography and Adsorption in Bioseparations Science and Engineering. New York: Oxford University Press. [ Links ]
Heinisch, S. y Rocca, J.L. (2004). Effect of mobile phase composition, pH and buffer type on the retention of ionizable compounds in reversed-phase liquid chromatography: application to method development. Journal of Chromatography A 1048, 183-193. [ Links ]
Horvath, C. y Melander, W. (1977). Liquid chromatography with hydrocarbonaceous bonded phases; theory and practice of reversed phase chromatography. Journal of Chromatographic Science 15, 393-404. [ Links ]
Hou, Y., Hansen, T.B., Staby, A. y Cramer, S.M. (2010). Effects of urea induced protein conformational changes on ion exchange chromatographic behavior. Journal of Chromatography A 1217, 7393-7400. [ Links ]
Hwang, S-M., Kang, H-J., Bae, S-W., Chang, W-J. y Koo, Y-M. (2010). Refolding of lysozyme in hydrophobic interaction chromatography: Effects of hydrophobicity of adsorbent and salt concentration in mobile phase. Biotechnology and Bioprocess Engineering 15, 213-219. [ Links ]
Irvine, G.B. (1997). Size-exclusión highperformance liquid chromatography of peptides: a review. Analytica Chimica Acta 352, 387-397. [ Links ]
Irvine, G.B. (2003). High-performance size-exclusión of peptides. Journal of Biochemical and Biophysical Methods 56, 233-242. [ Links ]
Jevsevar, S., Kunstelj, M. y Gaberc-Porekar, V. (2010). PEGylation of therapeutic proteins. Biotechnology Journal 5, 113-128. [ Links ]
Kostanski, L.K., Keller, D.M. y Hamielec, A.E. (2004) . Size-exclusión chromatography-a review of calibration methodologies. Journal of Biochemical and Biophysical Methods 58, 159-186. [ Links ]
Lienqueo, M.E., Mahn, A., Salgado, J.C. y Asenjo, J.A. (2007). Current insights on protein behaviour in hydrophobic interaction chromatography. Journal of Chromatography B-Analytical Technologies in the Biomedical and Life Sciences 849, 53-68. [ Links ]
Mahn, A., Zapata-Torres, G. y Asenjo, J.A. (2005). A theory of protein-resin interaction in hydrophobic interaction chromatography. Journal of Chromatography A 1066, 81-88. [ Links ]
McNay, J.L.M. y Fernandez, E.J. (2001). Protein unfolding during reversed-phase chromatography: I. Effect of surface properties and duration of adsorption. Biotechnology and Bioengineering 76, 224-232. [ Links ]
McNay, J.L.M., O'Connell, J.P. y Fernández, E.J. (2001). Protein unfolding during reversed-phase chromatography: II. Role of salt type and ionic strength. Biotechnology and Bioengineering 76, 233-240. [ Links ]
O'Farrell, P.A. (2008). Hydrophobic Interaction Chromatography Molecular Biomethods Handbook. In: Walker JM, Rapley R, editors: Humana Press. p 731-739. [ Links ]
Porath, J. (1987). Metal ion-hydrophobic, thiophilic and II-electron governed interactions and their application to salt-promoted protein adsorption chromatography. Biotechnology Progress 3, 1421. [ Links ]
Queiroz, J.A., Tomaz, C.T. y Cabral, J.M.S. (2001). Hydrophobic interaction chromatography of proteins. Journal of Biotechnology 87, 143-159. [ Links ]
Roettger, B.F. y Ladisch, M.R. (1989). Hydrophobic interaction chromatography. Biotechnology Advances 7, 15-29. [ Links ]
Sokol, J.M., Holmes, B.W., O'Connell, J.P. y Fernández E.J. (2003). Aprotinin conformational distributions during reversed-phase liquid chromatography: Analysis by hydrogen-exchange mass spectrometry. Journal of Chromatography A 1007, 55-66. [ Links ]
Wang, C. y Geng X. (2012). Refolding and purification of recombinant human granulocyte colony-stimulating factor using hydrophobic interaction chromatography at a large scale. Process Biochemistry. In Press. [ Links ]
Wang, S.S.S., Chang, C-K. y Liu, H-S. (2007). Effect of sample loop dimensión on lysozyme refolding in size-exclusión chromatography. Journal of Chromatography A 1161, 56-63. [ Links ]
Withka, J., Moncuse, P., Baziotis, A. y Maskiewicz, R. (1987). Use of highperformance size-exclusion, ion-exchange, and hydrophobic interaction chromatography for the measurement of protein conformational change and stability. Journal of Chromatography 398, 175-202. [ Links ]
Xia, F., Nagrath, D., Garde, S. y Cramer, S.M. (2004). Evaluation of selectivity changes in HIC systems using a preferential interaction based analysis. Biotechnology and Bioengineering 87, 354-363. [ Links ]
Xiao, Y., Freed, A.S., Jones, T.T., Makrodimitris, K., O'Connell, J.P. y Fernández, E.J. (2006). Protein instability during HIC: Describing the effects of mobile phase conditions on instability and chromatographic retention. Biotechnology and Bioengineering 93, 1177-1189. [ Links ]
Xiao, Y., Jones, T.T., Laurent, A.H., O'Connell, J.P., Przybycien, T.M. y Fernandez, E.J. (2007). Protein instability during HIC: Hydrogen exchange labeling analysis and a framework for describing mobile and stationary phase effects. Biotechnology and Bioengineering 96, 80-93. [ Links ]
Yamamoto, S., Fujii, S., Yoshimoto, N. y Akbarzadehlaleh, P. (2007). Effects of protein conformational changes on separation performance in electrostatic interaction chromatography: Unfolded proteins and PEGylated proteins. Journal of Biotechnology 132, 196-201. [ Links ]














