Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista mexicana de ingeniería química
versão impressa ISSN 1665-2738
Rev. Mex. Ing. Quím vol.10 no.3 Ciudad de México Dez. 2011
Ingeniería de procesos
Sorgo como un cultivo multifacético para la producción de bioetanol en México: Tecnologías, avances y áreas de oportunidad
Sorghum as a multifunctional crop for bioethanol production in Mexico: Tecnologies, advances and improvement opportunities
C. Chuck–Hernández, E. Pérez–Carrillo, E. Heredia–Olea y S.O. Serna–Saldívar*
Departamento de Biotecnología e Ingeniería de Alimentos. Centro de Biotecnología. Tecnológico de Monterrey. Av. Eugenio Garza Sada 2501 Sur. CP 64849. Monterrey, N.L. México. *Autor para la correspondencia. E–mail: sserna@itesm.mx
Recibido 30 de Julio 2011.
Aceptado 9 de Septiembre 2011.
Resumen
Para el 2012 en México se proyecta sustituir 880 millones de litros de oxigenantes de gasolina por etanol. Esto representa la bioconversión de 2.2 o 16 millones de toneladas de maíz o caña de azúcar (10 y 33% de la producción nacional), cultivos más utilizados en el mundo para producir etanol. El uso de maíz en México resulta poco factible debido a restricciones sociales y legales, mientras que el alto precio de la caña de azúcar limita también su uso. El sorgo en cambio representa una buena opción por ser un cultivo resistente a sequía y condiciones agronómicas adversas. Es un cultivo multifacético ya que existen genotipos de sorgo granífero, dulce y de alta–biomasa que pueden ser biotransformados. La conversión del grano almidonoso con tecnologías similares a las del maíz permiten producir 360 a 400 L de bioetanol/ton. La conversión de sorgo dulce permiten obtener jugo y material lignocelulósico con excelentes rendimientos (8,000 L bioetanol/Ha/corte considerando una producción de 120 ton de sorgo dulce/Ha). Las nuevas variedades de sorgo de alta biomasa pueden ser convertidas en etanol con tecnologías de lignocelulosa y con un potencial productivo de hasta 14,800 L de bioetanol/Ha. Este cultivo, sin embargo, supone desafíos tecnológicos como desarrollo de maquinaria de molienda, modificación o ingeniería genética de cultivos y de microorganismos fermentadores, asi como métodos de pretratamiento de grano y bagazo. En esta revisión se describen tecnologías viables especialmente en el contexto mexicano para transformar sorgo granírero, dulce y su biomasa en etanol.
Palabras clave: bagazo, bioetanol, material lignocelulósico, sorgo dulce, sorgo grano.
Abstract
By year 2012, Mexico plans to substitute 880 million liters of gasoline oxygenase with ethanol. This represente the bioconversion of 2.2 or 16 million tons of maize and sugar cane (10 or 33% of the national production). maize and sugarcane are the most common crops utilized to produce ethanol worldwide. The use of maize in Mexico is not feasible due to social and legal restrictions whereas the high price of domestic sugar cane also limits its use. Instead, sorghum is a good option because is a drought resistant crop that yields under adverse agronomic conditions on rain fed areas. The main advantage of sorghum is that is a multifaceted crop because it has commercial grain, sweet and high biomass genotypes that can be efficiently bioconverted into ethanol. The conversion of the starchy sorghum grain with similar technologies employed for maize allows the production of 360 to 400 L/ton. Procetsing sweet sorghums into sweet juice and spent bagasse or ligno–cellulose have the potential to yield 8,000 L bioethanol/Ha. The new high biomass varieties can be transformed into bioethanol with ligno–cellulose technologies. These have the potential to yield up to 14,800 L/Ha. However, the sorghum crop still has to overcome technological challenges such as milling equipment, crop genetic engineering or modification, development of new fermenting microorganisms and pretreatment methods for grain and bagasse. This review describes viable technologies of transformation of grain, sweet and high biomass sorghums into ethanol especially considering the Mexican context.
Keywords: bagasse, bioethanol, lignocellulosic material, grain and sweet sorghum.
1 Introducción
El etanol producido a partir de cereales y frutas es quizás el producto más antiguo obtenido por la biotecnología tradicional, ya que el consumo y producción de bebidas alcohólicas data de hace más de 8 mil años (Serna–Saldívar, 2010).
El reciente interés e incremento en la producción de etanol ha sido principalmente provocado por su uso como combustible automotriz. En el 2008 se obtuvieron 65,000 millones de litros de etanol en el mundo, 32% más que en el 2007, mientras que en el 2009 y con datos estimados para el 2010 se destilaron 73,900 y 85,900 millones de litros respectivamente, lo que representa un crecimiento anual sostenido por encima del 12% (GRFA, 2010). El etanol anhidro puede ser además usado como sustituto del Metil Terbutil Eter (MTBE), oxigenante de gasolina altamente tóxico y tan soluble en agua que representa en la actualidad una de las fuentes más peligrosas de contaminación de mantos acuíferos.
La ventaja del etanol con respecto a los combustibles fósiles es que se obtiene de fuentes renovables y representa una oportunidad interesante para el desarrollo agrícola. La desventaja más obvia es que su producción puede competir por el uso de recursos alimenticios, además de su menor densidad calorífica comparado con la gasolina (63% de su contraparte fósil). Por esta razón una de las líneas de investigación más relevantes se encuentra en la búsqueda y modificación de materias primas, para interferir lo menos posible en la producción de alimentos y utilizar de forma más eficiente la energía de proceso.
1.1 Etanol y petróleo
México es el sexto productor de crudo en el mundo (USEIA, 2011), sin embargo a partir del 2004, cuando se alcanzó el punto máximo de extracción, la producción petrolera ha declinado. Las reservas de nuestro país al 2010 sólo cubren una década más de explotación (PEMEX, 2010).
Además del problema de extracción, se tiene un déficit de producción de derivados que pone también en riesgo la seguridad energética. El caso de la gasolina es quizás uno de los más representativos, ya que el 42% de este combustible es importado o adquirido en el exterior. Sin embargo, de acuerdo al Plan Energético, hacia el 2017 se espera importar menos del 10% de la gasolina demandada. En el caso de aditivos como el MTBE, la producción nacional cubre sólo el 50% de la demanda. Estos casos exacerban aún más la dependencia energética mexicana.
1.2 Legislación para la producción de etanol en México
La inseguridad energética es un tema que se encuentra en la agenda de la mayoría de los países en el mundo y ha promovido tanto el desarrollo de alternativas energéticas como el crecimiento en la producción de etanol en el mundo. El ejemplo más ambicioso es quizas el de la "Renewable Fuel Standard" (RFS) en Estados Unidos de Norteamérica, en donde se establece el objetivo de producir 36,000 millones de galones para el año 2022 (136,000 millones de litros), cantidad que casi triplica el volumen alcanzado en el 2010.
El equivalente a la RFS en México es la "Ley de Promoción y Desarrollo de los Bioenergéticos" (LPDB) publicada en el Diario Oficial de la Federación en febrero del 2008 y que fue impulsada en la administración del presidente Felipe Calderón. En la LPDB se establece una comisión intersecretarial encargada de establecer instrumentos para la coordinación de actividades enfocadas al desarrollo de los Bioenergéticos en México.
En el reglamento de esta ley se establecen responsabilidades específicas entre las que destacan las de SAGARPA, encargada de autorizar el uso de los excedentes de maíz a las empresas interesadas en producir etanol. Esta secretaría será también la responsable de llevar un registro, a través de los "avisos de siembra", de todos los cultivos reservados para la producción de biocombustibles. La Secretaría de Energía (SENER), por otra parte será quien otorgue los permisos para la producción, almacenamiento, transporte y distribución de biocombustibles.
Los dos programas que se encuentran actualmente en operación y que están alineados con esta Ley son: 1) "Programa de producción Sustentable de Insumos para Bioenergéticos y de Desarrollo Científico y tecnológico", cuyo principal objetivo es generar paquetes tecnológicos que les permitan a los agricultores optar por la siembra de cultivos bioenergéticos (principalmente caña de azúcar, sorgo dulce y remolacha azucarera para producir etanol) y 2) el "Programa de Introducción de Bioenergéticos" encabezado por la SENER, en el cual se fomenta la integración de las actividades agropecuarias con las energéticas introduciendo el etanol mezclado como oxigenante en las gasolinas de las principales zonas metropolitanas de nuestro país, a partir del 2011.
A pesar de las fechas de introducción planteadas en los programas gubernamentales, aun no se tienen registros de producción de etanol para combustible. La única planta productora en nuestro país es la inaugurada a principios del 2011 en Atoyac, Veracruz. En estas instalaciones se planeaba inicialmente usar caña de azúcar como materia prima y la inversión ascendió a 500 millones de pesos. En los comunicados de la propia empresa (Alcoholera de Zapopan) no se detalla la producción esperada ni los planes futuros de crecimiento.
1.3 Necesidades energéticas en México
En México, la demanda diaria de gasolina asciende a 140 millones de litros y la primera etapa de sustitución con etanol está enfocada en 6% de este volumen. La siguiente etapa, que ha sido realizada en países como Brasil y Estados Unidos, es la mezcla de 10% de etanol con 90% de gasolina (E10) o 15% de etanol con 85% de gasolina (E15). Ambas mezclas pueden ser usadas sin necesidad de modificar a los motores de combustión interna.
Si se toman como base los supuestos de producir etanol como oxigenante y como sustituto del 15% de la gasolina, requeriría la fermentación y destilación de entre 8.5 y 17 millones de litros diarios para los cuales (en teoría) demandarían entre 8 a 14 millones de toneladas de maíz, más de la mitad de las 20 millones de toneladas de maíz cosechadas en el país. Si esta producción supuesta se cubre con caña de azúcar, el monto requerido sería de entre 44 a 78 millones de toneladas, volumen que sobrepasa la producción cañera nacional del 2008 que fue de 51 millones (FAOSTAT, 2011). Bajo estos escenarios en México se tendrían que construir entre 20 a 54 biorefinerías con una producción anual de 100 millones de litros (la producción promedio en las biorefinerías estadounidenses actualmente es de 250 millones de litros anuales), lo cual representaría una inversión en construcción y equipos de aproximadamente 2,000 a 3,750 millones de dólares.
Es claro que la disponibilidad de biomasa es limitada. La decisión de utilizar una u otra opción deberá recaer en un conjunto de factores como: disponibilidad, rendimiento, tecnología, flexibilidad, conveniencia económica y ambiental, así como la presión que ejerza sobre las fuentes de alimentación humana y recursos hídricos.
2 Tecnologías y materias primas para la producción de etanol en el mundo
Al día de hoy, las tecnologías usadas para la producción de etanol se clasifican de acuerdo a la materia prima a utilizar. Los materiales ricos en azucares simples como caña y sorgo dulce y los abundantes en almidón como papa, camote y cereales usan una tecnología madura o de "primera generación" basada en el uso de agua, enzimas y microorganismos fermentadores. En estos casos el costo de la materia prima representa hasta el 80% de costo final del combustible.
El etanol de "segunda generación" es el que se obtiene a partir de residuos agrícolas, pasto y en general de materiales fibrosos que estan compuestos principalmente por lignina, celulosa y hemicelulosa. En este proceso se requieren etapas químicas, enzimáticas y térmicas para liberar a los azúcares sencillos (en su mayoría glucosa, xilosa y arabinosa), para luego fermentar el material resultante con microorganismos modificados y lograr asi la mejor productividad posible a partir de estos caldos complejos.
En términos económicos, los costos más representativos son los tratamientos previos a la fermentación. Las enzimas o cocteles enzimáticos para desdoblar los polisacáridos, son los que tienen el mayor impacto en el costo unitario. Otra diferencia importante de las tecnologías de segunda generación con respecto a sus predecesoras son los microorganismos utilizados. Generalmente son levaduras o bacterias con mutaciones o modificaciones genéticas, que las hacen aptas para fermentar azucares de cinco carbonos tales como xilosa, que en promedio representan alrededor del 20% de todos los carbohidratos fermentables. Estas ligeras diferencias con respecto a los procesos de primera generación hacen que el etanol de lignocelulosa no sea aún económicamente competitivo. Sin embargo, de acuerdo al Laboratorio Nacional de Energía Renovable de los Estados Unidos (NREL por sus siglas en ingles), se espera que ya para el 2012 el costo del etanol de segunda generación se acerque a 1.07 dólares por galón (0.28 centavos por litro) (Clixoo, sin fecha).
Existen tecnologías descritas como de "tercera generación", basadas en el uso algas. Con estos organismos se puede obtener principalmente biodiesel y mediante un proceso (Direct to Ethanol®), patentado por la empresa Algenol, se puede producir etanol y agua dulce usando CO2, agua salada y luz solar como materias primas. Los costos operativos son menores a un dólar por galón, a los cuales se debe agregar el costo de capital que anualmente asciende en promedio a 5 dólares por galón (Algenol, 2011). Uno de los objetivos de esta empresa es reducir el costo unitario a menos de 90 centavos de dólar por galón con una productividad de 6 mil galones por acre (56,700 litros/Ha) anuales, 14 veces más lo obtenido con maíz (alrededor de 4,000 litros de etanol/Ha).
Actualmente en los Estados Unidos, el 95% del etanol es obtenido a partir del maíz y de acuerdo a la RFA (2011) se utilizaron alrededor de 76.2 millones de toneladas de grano, es decir, el 23% de la producción nacional estadounidense de maíz en el 2010 se destinó a las biorefinerías. Solo para poner en el contexto nacional, este volumen es 3.8 veces la producción mexicana de maíz en el 2009 (FAOSTAT, 2011).
En el caso de México, el uso de maíz como fuente de combustible, aún cuando la tecnología para su producción es accesible, sería prácticamente imposible debido a que este cereal es la base de la alimentación directa de la población e importante en la alimentación de animales domésticos. De acuerdo a la FAO en el 2007 un mexicano en promedio utilizó 123 kg/maíz/ano. Además, la producción nacional de este cereal es tan limitada que lleva a adquirir en el exterior hasta el 32% de las aproximadamente 37 millones de toneladas demandadas anualmente (datos estimados para el 2011, SAGARPA, 2009).
Otra materia prima de gran interés para el desarrollo de la bioenergía en México es la caña de azúcar, cultivo que ha permitido el desarrollo de Brasil como potencia bioenergética. En el estudio "Potenciales y Viabilidad del Uso de Bioetanol y Biodiesel para el Transporte en México", publicado en el 2006, la caña de azúcar resulte) el cultivo con mayor potencial de uso inmediato para producir bioenergéticos a partir de su jugo y bagazo. Sin embargo, la alta volatilidad de los precios y los problemas en la producción cañera nacional, han demostrado que no es del todo rentable como materia prima. Esto lo confirma el anuncio realizado a mediados del 2011 por los inversionistas de la planta de Atoyac Veracruz, quienes dejaron ver la posibilidad de usar sorgo dulce como alternativa o complemento a la caña de azúcar, debido a que el precio de esta última estaba rondando los 500 pesos por tonelada (arriba de lo previsto en la destiladora) (García, 2011).
3 Sorgo: características agronómicas, físicas y químicas
El sorgo (Sorghum bicolor L. Moench) es uno de los cultivos más antiguos y actualmente uno de los cereales de mayor importancia en el mundo (Serna–Saldívar, 2010). Es muy eficiente en ambientes cálidos y con intensidad luminosa alta, como los prevalecientes en regiones semiáridas (Rooney y Serna–Saldívar, 2000). De acuerdo a Taylor y col. (2006), es el mejor cereal en términos de resistencia a la sequía. Pertenece a las plantas C4, las cuales forman compuestos de cuatro carbonos, haciéndola más eficiente en el uso del agua, bioxido de carbono y nutrientes. De acuerdo a Serna–Saldívar (2010) estas podrían ser las "plantas del futuro" debido a la cada vez más escasa agua disponible para irrigación y al más alto el nivel de CO2 presente en el ambiente. En regiones con clima óptimo es posible obtener varias cosechas de sorgo por año ya sea directamente de semilla o de retoños (Saballos, 2008; Turhollow y col., 2010).
Existe un gran número de variedades, las cuales pueden ser clasificadas en tres grandes grupos: sorgo grano, forrajero y dulce. Recientemente se creó una nueva categoría de sorgo denominado de alta biomasa. Este sorgo, a diferencia del sorgo dulce y forrajero, está conceptualizado para producir altos rendimientos de biomasa fibrosa y ser principalmente canalizado a la producción de bioetanol de segunda generación (Tabla 1). Son híbridos de floración tardía con una etapa vegetativa prolongada, lo cual permite el retraso en el desarrollo de estructuras reproductivas para alcanzar, en condiciones favorables, hasta 6 metros de altura (Blade, 2010).

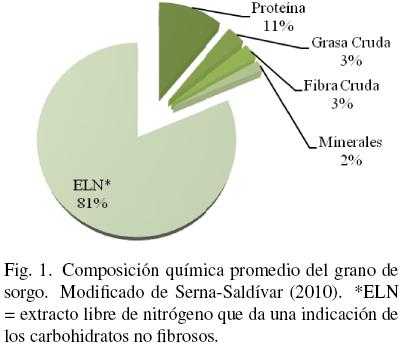
Cada uno de los grupos de sorgo se pueden a su vez dividir por características aún más especificas. Por ejemplo, el grano o cariopside puede ser clasificada de acuerdo al color y grosor de su pericarpio (blanco, rojo y café; grueso o delgado), a la presencia o no de testa pigmentada (con o sin taninos), color de endospermo (blanco, amarillo heterogéneo o amarillo) o el tipo de endospermo (normal, ceroso o heteroceroso). Todas estas características se encuentran controladas genéticamente y forman parte de la enorme diversidad de genotipos resguardados en la Colección Internacional de Sorgo en la India (World Sorghum Collection) con 37,904 accesiones de 91 diferentes países, la cual se estima que representa alrededor del 80% de variabilidad presente en el sorgo (ICRISAT, 2011). La composición química general del grano de sorgo se muestra en la Fig. 1.
En el caso de las variedades de sorgo dulce, los tallos maduros contienen alrededor de 73% de humedad y los sólidos se pueden dividir en carbohidratos estructurales y no estructurales. El jugo que se obtiene de los tallos está compuesto básicamente por sacarosa, glucosa y fructosa, en proporciones que dependen de la variedad, temporada de cosecha, etapa de madurez, entre otros factores (Mamma y col., 1996; Phowcliinda y col, 1997). En la Fig. 2 se muestran los porcentajes de sacarosa, glucosa y fructosa determinados en un conjunto de sorgos dulces cosechados en el sur de Estados Unidos y en el Noreste de México.
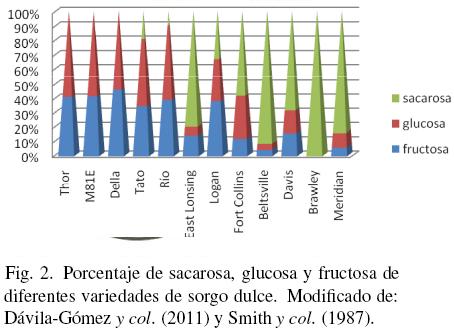
Si se compara la composición química del jugo de sorgo dulce con el jugo de caña de azúcar, el contenido de azúcares totales puede llegar a ser semejante, sin embargo en la caña, el porcentaje de sacarosa en relación a glucosa y fructosa es generalmente más alto (90, 4 y 6% respectivamente). De acuerdo a Gnansounou y col. (2005), los azúcares simples en el jugo de sorgo dulce representan 53–85, 9–33 y 6–21% para sacarosa, glucosa y fructosa, respectivamente. La cantidad de azúcar producida por hectárea cosechada de las variedades Keller, Wray y H173 es en promedio 7, 10 y 4 toneladas respectivamente (Woods, 2000). Davila–Gomez y col. (2011), con variedades sembradas en Hualahuises Nuevo León, obtuvo 1.85 a 2.03 toneladas de azúcar por hectárea, mientras que Smith y col. (1987) en un extenso estudio en Estados Unidos y Hawaii, reportaron 4.5 a 10.6 toneladas/Ha. Zhang y col. (2010) obtuvieron 18 toneladas de azúcar por hectárea en China, ligeramente más que las 17 toneladas típicamente reportadas para caña de azúcar (Woods, 2000).
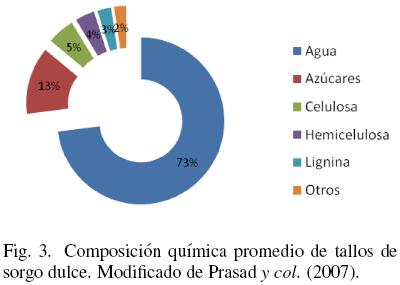
En el caso de los carbohidratos estructurales, el sorgo está compuesto principalmente por celulosa y hemicelulosa, los cuales a su vez pueden ser hidrolizados y usados como sustrato para la producción de etanol (Sipos y col., 2009). Como se ha mencionado en varias ocasiones, la composición química varía dependiendo de diversos factores, entre los que destacan el tipo y variedad de sorgo así como la madurez del cultivo y las condiciones climatológicas. En la Fig. 3 se muestra la composición promedio de los tallos de sorgo dulce. La hemicelulosa, celulosa y lignina representan el 12% del peso total del tallo. De acuerdo a Woods (2000), puede decirse que en promedio un 15% del peso del tallo corresponde a la porción fibrosa en un rango que va desde el 12 hasta el 17%.
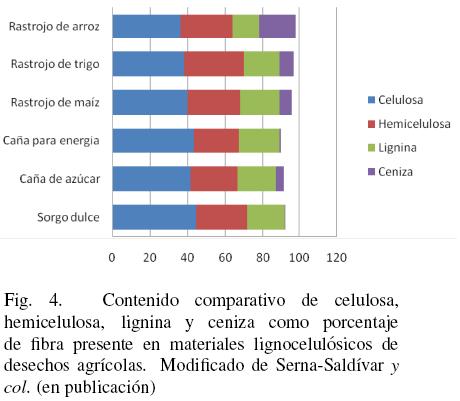
Si se analiza el bagazo de sorgo dulce, o el residuo que se obtiene después de extraer el jugo azucarado, se tiene que los rangos de celulosa, hemicelulosa y lignina van de 34–44%, 25–27% y 1820%, respectivamente (Ballesteros y col., 2003; Kim y Day, 2010; Sipos y col., 2009). En la Fig. 4 se muestra la composición química del bagazo y rastrojo de sorgo dulce comparado con los residuos de caña de azúcar, rastrojo de maíz, trigo y arroz.
4 Producción mundial de sorgo
De todos los cereales, el sorgo es el quinto más producido en el mundo con 56 millones de toneladas métricas en el 2009 (FAOSTAT, 2011), siendo Estados Unidos, India, México y Nigeria los principales países productores (Tabla 2). Estos países juntos aportan aproximadamente la mitad de la producción mundial.
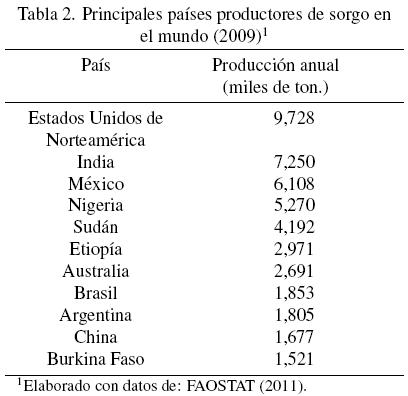
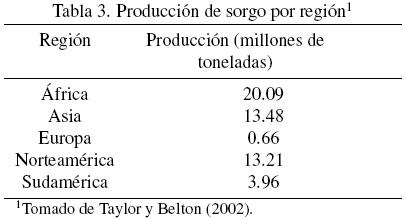
El cultivo del sorgo se encuentra muy concentrado en áreas geográficas específicas (Tabla 3). África destaca con el 39% de la producción mundial, seguido por el continente asiático y americano (parte norte) con el 26% cada uno (Taylor y Belton, 2002). Esta tendencia indica los lugares en los que el sorgo tiene un mayor impacto económico y nutrimental.
En el mundo, el país que dedica más superficie fértil para el sorgo es la India con 7.7 millones de hectáreas, área que por cierto representa 4.5 veces más tierra que la destinada en México al mismo cultivo (35% de las 22 millones de hectáreas agrícolas en nuestro país). A pesar de que India es el país con mayor superficie sembrada de sorgo, los mayores rendimientos por hectárea se concentran en tres lugares: Jordania, Argelia e Israel con 13, 9 y 6 ton/Ha respectivamente (FAOSTAT, 2011).
En México, la producción en el 2009 fue de 6.1 millones de toneladas y para el periodo 2011–2012 se esperan cosechar 6.9 millones, con una productividad de 3.6 toneladas por hectárea (FAOSTAT, 2011; USDA, 2011).
La producción de sorgo en Estados Unidos de Norteamérica, ha mostrado una tendencia a la baja en los últimos años, mientras que el maíz ha incrementado su porcentaje de producción durante el mismo periodo. Este comportamiento ha sido en gran medida producto del crecimiento de la industria del etanol que a su vez propició un fuerte incremento en el precio del grano. En México los pronósticos para el siguiente periodo agrícola (2011–2012) ubican al sorgo con un ligero decremento respecto a lo originalmente publicado por la USDA. Este ajuste, al igual que en Estados Unidos, se debe al probable cambio de superficie cultivada de sorgo por maíz, pero también a las perdidas en la producción nacional por las heladas de febrero del 2011 y al incremento de los precios internacionales de este cereal. De acuerdo a la USDA otro factor que puede afectar a la superficie sembrada de sorgo en el periodo del 2011 al 2012 (en México) es la implementación de programas de apoyo tecnico por parte del gobierno, en el cual se está mejorando la productividad por hectárea. La producción de sorgo en México se concentra en los estados de Guanajuato, Michoacán, Sinaloa, Jalisco y Tamaulipas, con el 75% del total. El estado de Tamaulipas es el máximo productor con 1.9 millones de toneladas en el 2011.
En México el 99% del sorgo se usa para alimentar el hato ganadero y en el 2011 se espera una demanda de 10.1 millones de toneladas. Para satisfacer este consumo se debe adquirir en el exterior el 35% de este volumen principalmente para la producción de alimentos balanceados para ganado.
Es necesario también aclarar que las estadísticas de producción de la FAO y USDA corresponden al sorgo grano, que es la porción comúnmente más usada en el mundo para alimentación animal y humana, así como la variedad más intensivamente cosechada. En contraste, poca información existe al momento sobre la producción de las variedades dulce y forrajera, debido a que son cosechadas de forma muy local en países como India y China. En estos lugares, el sorgo es usado para obtener productos tradicionales, como jarabe, papel y materiales de construcción o como fuente de calor por combustión directa (Fig. 5).
5 Procesos para producir etanol a partir de sorgo
5.1 Sorgo dulce
El estudio del sorgo como fuente de etanol involucra tecnologías de primera y segunda generación. Todas las variedades de sorgo pueden ser usadas, pero el reto más importante se encuentra en aprovechar al máximo cada una de las porciones de la planta.
Para la obtención del jugo de sorgo dulce a partir de los tallos, generalmente se usan rodillos prensadores continuos de los que se obtienen dos fracciones: el jugo que pasa directamente a fermentación (Fig. 6) y el residuo o bagazo que debe pasar por tratamientos previos antes de poder ser inoculado con levadura para la producción de etanol (Fig. (7) 8).
Tradicionalmente se usan también otro tipo de extractores, pero la eficiencia de esta etapa depende en gran medida de la tecnología utilizada. Wu y col. (2010b) reportan una eficiencia de extracción del 50% con prensas tipo lote, muy por debajo del 70% descrito por algunos otros autores con los sistemas de rodillos. De acuerdo a Gnansounou y col. (2005), los porcentajes de extracción para las variedades Kelley, Wray, Río y Tianza van desde el 59 hasta el 65%, en tanto que Kundiyana (1996) observo que los porcentajes de extracción variaban desde el 47 hasta el 58% en relación al peso inicial de los tallos de sorgo dulce, resultados más cercanos a los obtenidos en variedades evaluadas en el centro de México.
Una vez extraído el jugo, este puede pasar por una etapa de pasteurización para reducir la carga microbiológica, principalmente bacterias del género Lactobacillus y Leuconostoc. Con jugos almacenados y pasteurizados correctamente se alcanzan de forma típica rendimientos de fermentación mayores al 85% con levaduras comunes (Saccharomyces cerevisiae).
A pesar de que el jugo es la forma más simple de obtener etanol, su uso supone una serie de retos, entre los que destacan: la rápida tasa de deterioro de los azucares debido a su alta disponibilidad así como la baja concentración de compuestos nitrogenados necesarios para el desarrollo de S. cerevisiae. El desempeño del jugo de sorgo durante la fermentación puede además ser afectado por parámetros de proceso y la configuración de los reactores. Por ejemplo Nuanpeng y col. (2011) observaron en un estudio de lotes repetidos que fermentaciones con alta concentración de azúcar (o de alta gravedad) pueden ser una buena alternativa de proceso sobre todo cuando: 1) la tasa de inoculación es adecuada; 2) los compuestos nitrogenados son suficientes para evitar fermentaciones lentas o truncas y 3) cuando la oxigenación durante las primeras etapas es adecuada (para más detalle ver sección 5.2).
Laopaiboon y col. (2007) reportaron mejores resultados de fermentación en reactores operados bajo condiciones fed–batch comparados con la fermentación por lote. Estas diferencias fueron reportadas en términos de concentración de etanol y rendimiento final. La productividad sin embargo, no fue significativamente diferente (gramos de etanol por litro por cada hora de proceso).
Estos resultados indican que existen parámetros a optimizar dentro del proceso, tales como la tasa de alimentación y de remoción de sustrato, así como del volumen del reactor. En el caso del jugo de sorgo dulce, el microorganismo que se usa para fermentar es un factor en el cual se tienen también áreas de oportunidad para mejorar la eficiencia. Resultados con diferentes cepas han sido reportados y entre ellas la productividad cambia de forma significativa, aunque la mayoría con eficiencias mayores al 90% (Wu y col., 2010b). El arreglo de la levadura en los reactores o su inmovilización es también una variante tecnológica que vale la pena explorar. Liu y Shen (2008) reportaron condiciones óptimas de proceso derivados de un diseño de experimentos ortogonal en una fermentación con levadura inmovilizada a 37°C a un pH de 5.0 en matraces y en reactores de 5L.
5.2 Sorgo grano
El proceso de producción de etanol a partir de grano es el típico usado en materiales almidonosos y consiste en cinco pasos: molienda, licuefacción, sacarificación, fermentación y destilación/deshidratación (Fig. 7). El material molido es mezclado con agua para ser sometido a un proceso térmico que tiene como objetivo gelatinizar el almidón.
Durante esta etapa (maceración), el primer tipo de enzima es agregado (alfa amilasa), la cual tiene como objetivo producir dextrinas. Esta enzima, obtenida de bacterias del genero Bacillus, es termoestable y por lo tanto usada durante la etapa de calentamiento cuyo objetivo primario es el desordenamiento de las moleculas de almidón. Posteriormente, el material es enfriado y en ocasiones se ajusta el pH antes de agregar la segunda mezcla comercial de enzimas, con actividad amiloglucolítica y obtenidas de Aspergillus niger. El objetivo de esta etapa es incrementar los equivalentes de dextrosa del mosto.
A diferencia del maíz, en el sorgo el contenido de almidón no es precisamente el mejor indicador de rendimiento de fermentación, ya que la disponibilidad o susceptibilidad de hidrólisis es diferente y en ella intervienen de forma importante las proteínas de almacenamiento localizadas en el endospermo.
La digestibilidad de los diferentes componentes del sorgo (almidón y proteína específicamente) es significativamente más baja comparada con la de otros cereales como el maíz, sobre todo cuando el sorgo ha sido sometido a cocimiento húmedo. Este fenómeno ha sido extensamente estudiado y en general se puede decir que es causado por el entrecruzamiento de las prolaminas, proteínas ricas en cisteína que en el sorgo son denominadas kafirinas y que se encuentran en forma de corpúsculos dentro del endospermo. Estos cuerpos de proteína están formados por diferentes capas y destaca el centro rico en alfa kafirina rodeado de cadenas de beta y gamma. Estas últimas son generalmente las menos digeribles y las que tienen mayor tendencia al entrecruzamiento durante el cocimiento en húmedo.
La diferencia entre las fracciones alfa, beta y gamma corresponde al perfil de las mismas en geles de poliacrilamida (SDS–PAGE, sodium dodecyl sulphate–polyacrilamide gel electrophoresis). En condiciones reductoras, existen dos porciones de alfa kafirina, que se encuentran en el rango de 24 a 28 kDa y en 22 kDa, la beta se encuentra en 19kDa y la gamma en 27 kDa (Taylor y Belton, 2002).
En el sorgo es ya bien conocido que el rendimiento de etanol se ve afectado cuando el contenido de proteína se incrementa. Sin embargo, aún con la misma cantidad de proteína, la eficiencia de fermentación puede variar hasta 8% indicando que existen otros factores que influyen en la tasa de conversión de almidón. Wang y col. (2008) estudiaron en nueve genotipos de sorgo el efecto de la disponibilidad o digestibilidad de proteína en la eficiencia de fermentación, encontrando que este factor es un buen indicador para predecir el rendimiento de etanol.
En la Fig. 7 se muestra el procedimiento típico de producción de etanol a partir de grano de sorgo. La producción promedio por tonelada de grano basado en 14% de humedad es de 390 L. En algunos trabajos se han reportado hasta 400 L/ton con eficiencias de fermentación de más de 90% (Chuck–Hernández y col., 2009; Pérez–Carrillo y Serna–Saldívar, 2007). En la Fig. 7 se muestra también el residuo obtenido después de la destilación (Granos Gastados de Destilería con Solubles, DDGS por sus siglas en ingles). Este subproducto es muy importante dentro de la industria ya que contribuye de forma decisiva en la salud financiera de las biorefinerías, además de una excelente opción para alimentar ganado por su alto contenido de proteína (39% en promedio).
Se han reportado diversos tratamientos enfocados a mejorar el rendimiento del proceso mostrado en la Fig. 7. Debido a que las eficiencias de fermentación dependen en gran medida del genotipo y composición química del sorgo, se han hecho esfuerzos de investigación importantes para determinar los rasgos genéticos que fomentan o reducen los rendimientos.
El almidón y la proteína, principales componentes involucrados en la fermentación, además de estar relacionados con factores genéticos, se encuentran ligados a factores ambientales así como a la temporada y lugar de siembra (Wu y col., 2008). La composición del almidón, específicamente la relación amilosa: amilopectina es también uno de los rasgos más estudiados del sorgo. De acuerdo a Wu y col. (2006), los materiales con menos amilosa exhiben una mejor eficiencia durante la fermentación. Esto se podría inferir a partir de trabajos como los de Rooney y Pflugfelder (1986) que previamente habían asociado una mayor digestibilidad del almidón en variedades de sorgo ceroso. Esta diferencia, de acuerdo a lo reportado por Wu y col. (2006), puede estar relacionada con la formación de complejos amilosa–lípido, que favorecen la conservación de fracciones intactas de almidón después de procesos de hidrólisis.
En relación a la proteína, Wu y col. (2010a) reportaron el desarrollo de líneas de sorgo con alto nivel de lisina y alta digestibilidad proteica. Estos genotipos tienen rasgos promisorios para su uso en biorefinerías: el almidón tiene una temperatura de gelatinización más baja, las proteínas están más disponibles para la digestión de animales monogástricos y contienen 60% más aminoácidos esenciales comparados con los sorgos regulares. De acuerdo a los mismos autores, estas características estan relacionadas con una modificación en la apariencia de los cuerpos proteicos, que en las variedades de alta digestibilidad tienen invaginaciones "atípicas", lo cual facilita a las enzimas el acceso al centro rico en álfá kafirina que regularmente es más digestible que el resto de las prolaminas.
Además de los cambios de la materia prima, el uso de enzimas, específicamente de proteasas, ha sido reportado durante las etapas de preparación de sorgo antes de la fermentación. Estas proteasas afectan la matriz que rodea al almidón, incrementando con esto los azucares liberados y el nitrógeno disponible para el microorganismo fermentador (Pérez–Carrillo y Serna–Saldívar, 2007). Estos mismos autores describen también el uso del decorticado (o remoción de las capas externas de sorgo), para mejorar el perfil de carbohidratos fermentables al reducir la fibra localizada en su mayor parte en el pericarpio. Con la decorticación se reduce también la concentración de fenó licos totales, localizados principalmente en el pericarpio y la testa o envoltura de la semilla. Estos compuestos afectan el desempeño de enzimas, razon por la cual su remoción puede favorecer la fermentación (Pérez–Carrillo y Serna–Saldívar, 2007).
Los granos decorticados tienen un mejor desempeño durante la licuefacción y producen más etanol durante la fermentación. Los autores obtuvieron 44% más etanol comparado con el sorgo entero (Tabla 4). Otra ventaja de la decorticación es que con esta se obtiene el salvado seco, antes de todas las etapas indicadas en la Fig. 7, lo cual reduce la fracción de granos gastados separados al final del proceso y con ello la energía requerida para el secado, sin comprometer la calidad proteica del residuo. Otro proceso simple que tiene un efecto positivo en la eficiencia de fermentación es la geminación, sobre todo cuando es realizada en sorgos altos en taninos o tipo III. Yan y col. (2009 y 2010) reportaron reducción en el tiempo de fermentación así como rendimientos más altos cuando procesaron sorgo ya germinado, atribuyendo este resultado al efecto de las enzimas intrínsecas sobre almidón, proteína y pared celular, por lo que el uso de sorgo malteado o germinado en campo puede ser considerado por la industria como ventajoso en términos de uso de agua, energía y tiempo de proceso al igual que los granos decorticados.
Con el uso de grano de sorgo, así como de jugo de las variedades dulces, se han reportado varios trabajos con mostos de alta concentración, el cual puede ser definido como caldos que contienen más de 23°Brix y a partir de los cuales se pueden obtener concentraciones de etanol de más del 10% (v/v) y que en promedio rondan del 15 al 18%. Este tipo de proceso permite incrementar la productividad, reducir costos de capital, el agua requerida durante el proceso así como la energía invertida durante la deshidratación final. Esto produce ahorros considerables, que pueden alcanzar hasta el 30% del costo total (Pradeep y col., 2010; Wang y col., 2007).
Sin embargo, cuando se utilizan caldos concentrados, algunos retos tecnológicos deben ser superados, sobre todo lo relacionado con la osmotolerancia de la levadura o del organismo fermentador, así como su desempeño y estabilidad con el aumento de etanol en el medio. De acuerdo a Casey e Ingledew (1986) la tolerancia de la levadura a la presión osmótica está relacionada con condiciones genéticas, temperatura de fermentación, el tipo y cantidad de carbohidratos, así como composición del medio, sobre todo el tipo y cantidad de aminoácidos y péptidos. Usando la misma levadura y las mismas condiciones de fermentación, la cantidad de compuestos nitrogenados en el medio se encuentra directamente relacionada con el rendimiento y eficiencia de fermentación. En relación a la temperatura, se puede decir que en general este parámetro está inversamente relacionado con el tiempo de fermentación. Algunos autores han reportado incrementos en la eficiencia cuando los sólidos aumentan desde 14.0 hasta 36.5 gramos por cada 100 mL y también observaron que el uso de urea acelera la tasa de fermentación y reduce el tiempo para completar el proceso (Jones e Ingledew, 1994).
En general, las levaduras presentan inhibición osmotica en soluciones con 15% (p/v) de azúcar y este fenómeno depende en gran medida del tipo de carbohidratos presentes en el medio. Por ejemplo, la glucosa tiene un efecto negativo más pronunciado en el microorganismo que la sacarosa y maltosa. Algunos autores como Sumari y col. (2010) indican que pocas levaduras pueden manejar concentraciones mayores a 40% de azúcares, pero también reportan que se han aislado de alimentos fermentados en el continente Africano algunas cepas que tienen un buen desempeño a mayores concentraciones y el análisis filogénetico de estos microorganismos hace suponer que existen organismos pertenecientes a esos clusters aun por descubrir.
Dentro de los cambios de proceso que afectan directamente al grano de sorgo, se pueden mencionar: reducción de tamaño de partícula, decorticación mecánica y rolado al vapor. Mediante estos tratamientos se busca reducir barreras físicas para permitir un acceso más rápido y eficiente de las enzimas generando con ello más azúcares fermentables en menor tiempo de proceso.
El tamaño de partícula o granulometría del grano molido, como en todas las reacciones químicas y enzimáticas, juega un papel muy importante en el proceso de conversión. Algunos autores como Wang y col. (2008) han observado que las eficiencias de fermentación en muestras molidas finamente son 5% más altas que los tratamientos hechos con muestras de molido grueso. Este resultado se debe a diferencias básicas en la temperatura de gelatinización (5 a 10° C menos en las partículas finas) y en la facilidad de acceso enzimatico. La reducción de tamaño de partícula puede llevar también a inconvenientes energéticos como una mayor viscosidad de los caldos que elevan la necesidad de energía para el movimiento de los macerados a lo largo del proceso.
La decorticación consiste en eliminar mecánicamente las capas externas del sorgo tales como el pericarpio, la testa, la aleurona y el endospermo periférico que de acuerdo a autores como Rooney y Serna–Saldívar (2000) están a su vez relacionadas con la baja digestibilidad del sorgo. Los molinos que generalmente se usan para esta operación son de tipo lote y contienen discos de material abrasivo con los que mediante fricción se remueven gradualmente las partes externas del grano hasta alcanzar de forma óptima una reducción del 10 al 30% del peso original. De acuerdo a Serna–Saldívar (2010), el producto resultante es una mezcla de salvado molturado y granos decorticados o perlados que pueden ser eficientemente separados con tamices y aspiración. Una vez obtenido el grano perlado, se moltura generalmente en molinos de cuchillas o martillos. El producto así obtenido, tiene mayor concentración de almidón, así como menos grasa, fibra y compuestos fenólicos.
Otro proceso físico que ha sido utilizado como pre–tratamiento del sorgo en la producción de etanol es el rolado al vapor (Chuck–Hernández y col., 2009). Esta tecnología es ya ampliamente utilizada en engorda de ganado, ya que incrementa el valor nutritivo del sorgo al someterlo a vapor directo (de 15 a 30 minutos) y un posterior rolado o formación de hojuelas con un par de rodillos estriados. Antes del tratamiento hidrotérmico generalmente los granos son acondicionados para alcanzar cierto nivel de humedad (alrededor del 21%). En esta etapa usualmente se agregan también acondicionadores y en ocasiones conservadores, de modo que se reduzcan las pérdidas por rompimiento o separación de fracciones finas y por contaminación microbiológica después del rolado.
El almidón así pregelatinizado tiene un mejor desempeño durante la licuefacción y produce más etanol comparado con el sorgo entero control. Chuck–Hernández y col. (2009) reportaron 40% más etanol con los granos rolados al vapor y el tratamiento fue significativamente más eficiente en sorgo que en maíz. Esto sin duda está relacionado con los cambios en la naturaleza de la matriz de proteína. De acuerdo a los autores del estudio, este tratamiento incrementa en solo 6% el costo de la materia prima.
Otro tratamiento físico muy interesante y novedoso es el uso de extrusión con fluidos supercríticos. La extrusion, muy utilizada en industria de cereales, es una operación continua con la que se pueden ahorrar etapas y energía en el proceso. Durante la extrusión el material se somete a incrementos de temperatura, mezclado y esfuerzo lo cual favorece cambios físicos y químicos.
Algunas de las ventajas de este proceso son: mejora de la digestibilidad del almidón, reducción de su peso molecular, producción de azúcares libres y dextrinas, cambios en la estructura nativa tanto de los gránulos de almidón como de las proteínas y la reducción de la viscosidad de los caldos obtenidos. La versión de extrusión con fluidos supercríticos ha sido patentada por investigadores de la Universidad de Cornell y en esta se reemplaza el agua como agente para expansión con la inyección de un fluido en estado supercrítico (generalmente CO2). Esta sustitución permite el rompimiento de enlaces entre almidón y proteínas resultando en una mejor disponibilidad del almidón (Zhan y col., 2006). Estos mismos autores explican que la digestibilidad de la proteína también se incrementa (en aproximadamente 8%) y que el rendimiento final de etanol es 5% más alto que los controles.
En la Tabla 4 se muestra un resumen de las diferentes eficiencias de fermentación, así como los rendimientos reportados en literatura con diferentes variedades de sorgo grano o con diversas tecnologías o modificaciones en proceso.
5.3 Bagazo y rastrojo de sorgo
Se puede decir que el bagazo de sorgo dulce es el residuo lignocelulósico que se obtiene después de la extracción del jugo, en tanto el rastrojo son los restos vegetales dejados en campo después de la cosecha. En ambos casos la composición del material es muy ventajosa para ser usada como fuente de etanol debido a su moderado contenido de lignina. La composición química de estos materiales se ha indicado ya previamente (Figs. 3 y 4).
En la Fig. 8 se indican de forma general las etapas involucradas en la obtención de etanol a partir del bagazo de sorgo dulce. De acuerdo a Herrera y col. (2003), el residuo puede ser picado, molido y secado a temperaturas que oscilan entre los 50 y 60°C para obtener así un material estable durante el almacenamiento.
Para el proceso de molienda se pueden utilizar molinos de martillos o de tipo rotario y puede realizarse sobre el material seco o húmedo. Posterior a esta etapa se debe hacer un pretratamiento con el objetivo de separar o liberar la porción de celulosa y hemicelulosa que se encuentra unida a la lignina en el material original. La etapa de obtención de azucares a partir de la fibra representa la más retadora de acuerdo a Mizuno y col. (2009) ya que requiere una inversión considerable de energía sobre todo si se desean obtener altas concentraciones de azucares fermentables.
Una etapa de hidrólisis previa libera tanto las fracciones de hemicelulosa como de celulosa y este proceso generalmente se realiza con ácidos diluidos o con cocteles enzimáticos comerciales. La hidrólisis ácida generalmente antecede a la enzimática para optimizar la producción de azucares de 6 y 5 carbonos (Mamma y col.,1996; Sipos y col., 2009).
En la Fig. 8 se resume un proceso en donde se usa pretratamiento ácido diluido (ácido sulfúrico, 0.5 a 1.0% v/v), el más común y relativamente económico (Gnansounou y col., 2005). Los pretratamientos ácido diluido consisten en la adición de una solución acida (desde 0.1 hasta 1.0% p/v) al material lignocelulósico previamente molido. Los ácidos generalmente utilizados son: sulfúrico, clorhídrico, fluorhídrico y acetico (Herrera y col., 2003). Una vez empapado todo el material con esta solución es sometido a un proceso térmico, preferentemente con incremento de presión, tal como las condiciones que se pueden alcanzar en una autoclave o reactor presurizado. Después de este proceso se obtienen dos fracciones, una solida, rica en celulosa y lignina y una líquida en donde se encuentran una parte de los azúcares que previamente estaban en forma de polisacáridos. El desecho sólido después de ser ajustado en pH puede ser tratado con enzimas en una segunda etapa (Fig. 8) para mejorar la extracción de azúcares fermentables. Durante la etapa de hidrólisis previa, la lignina cede el paso de forma parcial a las enzimas las cuales a su vez deberán actuar sobre la celulosa y hemicelulosa.
Con el uso de ácido sulfúrico algunos autores tales como Kurian y col. (2010) han logrado extractos de 92 g/L de azúcares totales a concentraciones de 5 g de acido sulfúrico por kilogramo y tratado a 140°C por 30 minutos. Ban y col. (2008), con bagazo de sorgo y 80 g de acido fosfórico por litro a 120°C por 80 minutos obtuvieron 302 g de azúcares reductores por cada kilogramo con materia prima diluida a una tasa de 10% de sólidos.
Otros pretratamientos recomiendan el uso de materiales alcalinos y vapor. El uso de agua caliente ha sido también estudiado de forma intensiva por ser más amigable con el ambiente. En el caso de pretratamientos alcalinos, su objetivo principal es deslignificar la biomasa al romper enlaces ester de la lignina entrecruzada y xilanos para obtener fracciones ricas en celulosa y hemicelulosa. De acuerdo a McIntosh y Vancov (2010) la ventaja de este tipo de pretratamiento es que utiliza condiciones de temperatura y presión más bajas así como tiempos reducidos comparado con otras tecnologías. Los principales álcalis usados para este proceso son hidróxido de sodio, amoniaco y cal debido a su relativo bajo costo y a la posibilidad de reuso. Generalmente se utilizan dos condiciones de temperatura: media (a 60°C)yalta(121°C).
Por otra parte, el pretratamiento con explosión de vapor consiste en rehidratar el material con vapor a presión atmosférica e impregnarlo con pequeñas cantidades de dióxido de azufre en bolsas de plástico por periodos de 20 a 30 minutos. Este material se coloca en reactores donde la temperatura es mantenida por inyección de vapor saturado con temperaturas que van desde 170 hasta 210°C (Sipos y col., 2009; Stenberg y col., 1998). Después de cierto tiempo de tratamiento (2 a 10 minutos) se abre el reactor y el hidrolizado se libera de forma súbita a un ciclón. Sipos y col. (2009) reportan con este método una extracción del 89 al 92% de celulosa, hasta 18 g de glucosa, 23 g de xilosa y 5.5 g de arabinosa por litro de hidrolizado. Ballesteros y col. (2003) también usaron este tratamiento pero sin el dióxido de azufre y obtuvieron una recuperación del 50% de sólidos y la solubilización de solo el 20% de la celulosa.
Siguiendo las etapas de proceso indicadas en la Fig. 8, después del pretratamiento, los azúcares ya liberados y las porciones ya susceptibles al pretratamiento enzimático son sometidas a una etapa denominada Sacarificación–Fermentación Simultanea (SFS), en la cual se agregan enzimas y el organismo fermentador. Aunque estos pasos se pueden hacer por separado, generalmente se hacen simultáneamente para optimizar recursos al favorecer el uso inmediato por parte de la levadura de los azúcares liberados de forma paulatina por las enzimas celulolíticas.
Existe una gran variedad de enzimas para convertir la celulosa y hemicelulosa en azúcares solubles. Las enzimas comerciales son generalmente mezclas de pectinasas, celulasas y hemicelulasas (Reddy y Yang, 2005). La celulosa puede ser hidrolizada mediante una acción conjunta de endo y exoglucanasas y generalmente se emplean cocteles enzimáticos que actúan de forma sinérgica. Esta mezcla es agregada antes o después de tratamientos químicos o mecánicos (Reddy y Yang, 2005). De acuerdo a Gnansounou y col. (2005), las enzimas se encuentran entre los mejores prospectos para mejorar el proceso, sobre todo cuando se busca reducir costos.
De acuerdo a empresas como Novozymes, con la nueva generación de celulasas para la producción de etanol a partir de material lignocelulósico, se reduce el costo de las enzimas a 0.50 dólares por galón producido. Las enzimas comercializadas por esta compañía para la producción de etanol son descritas como celulo y hemicelulíticas con alto nivel de betá glucosidasas.
Una variante interesante de la etapa de hidrólisis enzimática es la reportada por autores como Gnansounou y col. (2005) y Mamma y col. (1996) quienes utilizan una porción del material lignocelulósico pretratado, para inocular organismos productores de celulasas tales como Trichoderma reesei, Neurospora crassa y Fusarium oxysporum. Este material ya inoculado es reincorporado al proceso en la etapa de SFS donde en conjunto o no con el organismo fermentador (depende de la naturaleza fermentativa del organismo productor de enzimas) inicia la producción de etanol (Mamma y col., 1996).
El producto obtenido es rico en hexosas y pentosas (Kurian y col., 2010). La producción de etanol a partir de estos caldos puede ser posible cuando se usan levaduras o bacterias que puedan utilizar de forma adecuada azúcares de cinco carbonos tales como xilosa.
Se han desarrollado y descubierto una gran cantidad de organismos con capacidad de fermentar caldos híbridos en condiciones industriales, sin embargo aun existen áreas de oportunidad interesantes sobre todo en lo relacionado a la estabilidad ante inhibidores, altas temperaturas, estrés osmótico y por supuesto en lo relativo a la fermentación simultanea de C5 y C6.
En el caso de bacterias se han reportado modificaciones en Escherichá coli, para el uso de xilosa, pero aún con baja estabilidad ante el incremento de etanol en el medio. De acuerdo a Balat y col. (2008) y a Lee (1997), en la fermentación de caldos híbridos se ha reportado el uso de: Clostridium acetobutilicum, Clostridium thermocellum, Klebsiella oxytoca, Klebsiella planticola ATCC 33531, Lactobacillus pentoaceticus, Lactobacillus casei, Lactobacillus xylosus, Lactobacillus pentosus, Lactobacillus plantarum, Pachysolen tannophilus, Saccharomyces cerevisiae ATCC 24860, Pichia stipits NRRL Y–7124, Y–11 544, Y–11 545, Pichia stipits NRLL Y–7124, Saccharomyces cerevisiae CBS 1200, Candida shehatae ATCC 24860, entre otras. Estos microorganismos se han evaluado por separado o en conjunto, obteniéndose resultados alentadores.
En un trabajo reportado por Ballesteros y col. (2003) se obtuvieron 16.2 g de etanol por litro cuando se utilizaron hidrolizados obtenidos de bagazo de sorgo dulce fermentados con Kluyveromyces marxianus. Esta es una levadura muy tolerante a temperaturas elevadas que puede ser modificada genéticamente de forma relativamente sencilla con una estabilidad adecuada a la transformación. Se tiene conocimiento de que en México algunas instituciones como el Tecnológico de Monterrey han hecho esfuerzos para obtener cepas modificadas que fermenten de forma más eficiente los caldos de materiales lignocelulósicos.
Kurian y col. (2010) trabajando con Pichia stipitis, obtuvieron 38.7 g de etanol por litro con una conversión teórica del 82.5%. En la Fig. 8 se muestra el rendimiento promedio reportado por Almodares y Hadi (2009) así como por Gnansounou y col. (2005) para bagazo de sorgo dulce. Ellos estiman una producción de 158 litros de etanol por cada tonelada de bagazo procesado. Se considera que este material tiene un 5.4% de azúcares fermentables, 17% de celulosa, 12% de hemicelulosa y el resto agua y azucares no fermentables, por lo que la eficiencia que reportan estos autores se encuentra alrededor del 75% del etanol teórico. En la siguiente sección se comentarán más detalles de los rendimientos que se pueden obtener con el bagazo de sorgo dulce.
Una etapa muy importante que no se menciona en la Fig. 8 es la detoxificación que se realiza antes de la SFS. Esta operación se hace necesaria debido a que en el proceso de hidrólisis de fibra se produce un gran numero de productos derivados de la degradación de los azucares. Estas especies químicas inhiben a los microorganismos de fermentación (Ban y col., 2008). Entre los productos de inhibición más importantes se encuentran: furfural, 5–hidroximetilfurfural y el ácido acético.
El proceso de detoxificación tiene un doble objetivo: precipitar los inhibidores en forma de sales insolubles al agregar productos alcalinos como cal o hidróxido de calcio, lo cual además incrementa el pH para poder así mejorar las condiciones de fermentación (Kurian y col., 2010). La formación de compuestos inhibidores se reduce de forma considerable cuando las condiciones de pretratamiento son moderadas (temperatura, presión y acidez).
Se puede decir sin duda que cada una de las etapas mostradas en la Fig. 8 presenta oportunidades de mejora, sin embargo, el pretratamiento, las enzimas usadas en sacarificación, así como los microorganismos de fermentación consisten en las mayores áreas de oportunidad detectadas por los investigadores.
6 Rendimiento de etanol a partir de sorgo
De acuerdo a lo descrito en la Fig. 8, Almodares y Hadi (2009) así como Gnansounou y col. (2005) indican que se puede obtener un rendimiento en base húmeda de 158 litros de etanol por cada tonelada de bagazo ingresada al proceso, obteniendo además 110 kilogramos de lignina y no fermentables. Este resultado indica un rendimiento de fermentación del 75% contabilizando el total de azúcares presentes en la materia prima y con posibilidad de ser hidrolizados y posteriormente fermentados.
En el caso del proceso descrito por Mamma y col. (1996), en el cual se utilizan enzimas aportadas por hongos desarrollados in situ, se pueden obtener 5.2 a 8.4 gramos de etanol por cada 100 gramos de sorgo húmedo introducido al sistema de producción.
El rendimiento de etanol en las variedades de sorgo es relativamente diferente, sin embargo el mejor desempeño se da obviamente cuando se usan cada una de las porciones obtenidas de la planta, sobre todo el material lignocelulítico, jugo e incluso el grano. En muchas ocasiones esta última fracción no se puede obtener de forma completa, debido a que la cosecha se hace antes de la madurez completa del grano.
En el noreste de México se encontró que la epoca en la cual se alcanza el máximo de grados Brix en el tallo es en la tercera, incluso hasta la quinta semana de floración en el caso de variedades de sorgo tardías (Davila–Gomez y col., 2011), posterior a esto los cambios en grados Brix no fueron significativos. Este resultado es muy semejante a lo observado por Nan y col. (1994), quienes en la cuarta semana post antesis observaron la mejor producción de azúcar.
En términos generales se puede decir que el rendimiento de etanol por cada tonelada de sorgo grano podría compararse (aunque no es igual) con la del maíz. El rendimiento por cada hectárea sería menor también por el menor rendimiento del sorgo en campo comparado con otros cereales. El sorgo dulce en cambio, puede tener un rendimiento mucho más competitivo comparado con otros cereales o con otros cultivos como la caña de azúcar. De una hectárea de sorgo dulce se pueden obtener desde 42 hasta incluso 85 toneladas de tallos (Fig. 9) (Praj, sin fecha).
Almodares y Hadi (2009) así como Prasad y col. (2007), reportan un rango de producción aún mayor, que va desde los 50 hasta las 120 toneladas de tallo. Este material tiene alrededor de 73% de humedad y de él se obtiene de 50 hasta 70% de jugo. De acuerdo a lo observado en el campo mexicano, se podrían llegar a extraer 42.5 toneladas de jugo por hectárea (Fig. 9).
Si se considera un promedio de 15°Brix, se producirían 6.4 toneladas de azúcares fermentables por hectárea, aunque Praj (sin fecha) establece un rango de 3.6 hasta 6.2 toneladas. Este material serviría para obtener 4,132 litros de etanol cansiderando una fermentación perfecta y alrededor de a,600 litros con una eficiencia promedio. Kim y Day (2010) reportan una producción por hectárea de 3,296 litros, mientras que con una eficiencia de fermentación del 95%, Almodares y Hadi (2009) reportan 3,000 litros por cada hectárea cuando se procesa jugo extraído de variedades productoras de 39 hasta 128 toneladas de tallos por hectárea. Wu y col. (2010b), a pesar de no reportar rendimientos de etanol por hectárea, expresan el rendimiento de azúcares fermentables, con las cuales (y considerando una eficiencia del 95%) se pueden obtener de entre 4,750 hasta 5,220 litros por hectárea. Esto equivale a la conversión de 12 a 13 toneladas de maíz, cuando la productividad media de este cereal en México y Estados Unidos es de 3.2 y 10.3 toneladas por hectárea, respectivamente.
Lo anterior fue con respecto al jugo. Ahora, si el bagazo es también procesado se tendría un potencial obviamente más promisorio (Fig. 9). Si se considera que el 50% del peso inicial de tallos obtenidos por hectárea se convierten en bagazo y que el 50% es fibra fermentable, se tiene un potencial de 6,000 litros de combustible por hectárea.
En pruebas realizadas en el Instituto Tecnológico de Monterrey con Issatchenkia orientalis durante la fermentación y con caldos obtenidos con pretratamientos ácidos se lograron generar 3,865 litros por cada hectárea, 60% del etanol esperado de forma teórica, indicando el espacio de mejora que aún queda en el tratamiento de este tipo de materiales.
En fermentaciones típicas con maíz, el rendimiento de etanol por tonelada de grano es de más de 360 litros cuando contiene alrededor del 60% de almidón, lo cual indica una eficiencia de conversión del 85%. Si en campo se considera una productividad de 9 a 10 toneladas por hectárea, esto representaría 3,240 a 3,600 litros por año. Otros autores más optimistas mencionan incluso una producción de hasta 4,000 litros por cada hectárea cosechada. Kim y Day (2010) indican que el rendimiento teórico por hectárea de maíz cosechada es de hasta 5,100 L/Ha (con una producción de casi 13 toneladas de maíz por hectárea) y que esta se puede elevar hasta 8,625 L/Ha cuando toda la planta (incluyendo el rastrojo) es bioconvertida.
En el caso del sorgo grano, la producción esperada puede considerarse ligeramente a la baja, pero si en conjunto se procesa el jugo y el rastrojo de sorgo la mejora es sustancial. Es interesante también hacer notar que la producción indicada en la Fig. 9 es para un solo corte de los dos posibles por año en el sorgo dulce, por lo que fácilmente los resultados pueden duplicarse.
La producción de biomasa de sorgo por hectárea es quizás el factor que más influye en el rendimiento de etanol, así como la energía requerida en el proceso. En los estudios de factibilidad economica es entonces importante considerar aspectos agrícolas (rendimiento, necesidad de fertilizante, agua y otros insumos), energéticos y tecnológicos.
7 Tendencias para el uso de sorgo como fuente de etanol
A lo largo del artículo se han descrito las áreas de oportunidad más interesantes en el estudio del sorgo como fuente de combustible líquido. Se han indicado los factores que más influyen en la productividad de etanol a partir del grano de sorgo, así como las etapas de mayor trascendencia energética durante el desdoblamiento de la celulosa y lignocelulosa en azucares sencillos y su posterior fermentación. Las etapas posibles de modificación son múltiples y van desde el desarrollo de nuevas variedades haciendo uso de técnicas tradicionales o modernas de mejora agrícola, hasta las modificaciones en proceso que permitan acelerar e incrementar la producción de bioetanol.
El desarrollo de nuevas variedades es sin duda una de las áreas de investigación más prometedoras. En el caso de sorgo para combustible, existen ya avances importantes en el fitomejoramiento de variedades de alto rendimiento de biomasa, grano y jugo, sin embargo sigue siendo una de las áreas con mayor potencial. Además porque estas nuevas variedades deben también adaptarse a las nuevas condiciones agronómicas en el mundo: temperaturas más elevadas, lluvias escasas, deterioro acelerado de tierras así como al surgimiento de plagas y organismos fitopatogenos más agresivos.
La transformación genética de sorgo ha resultado sin embargo una tarea ardua comparada con otros cereales. Los rasgos que tienen relevancia en las biorefinerías, tales como la altura de la planta, cantidad de sólidos solubles, producción de jugo, proporción de celulosa/hemicelulosa/lignina, son no "aditivos". De acuerdo a algunos autores tales como Turhollow y col. (2010), el mapeo genético comparado con su relativamente rápida hibridación y rapidez para desarrollarse en campo, podría por otra parte reducir las dificultades previamente mencionadas.
Otra área de oportunidad, es el desarrollo de maquinaria exclusiva para la cosecha de sorgo dulce y forrajero, debido a que actualmente se usa equipo adoptado de otras industrias como la cañera, lo cual reduce rendimientos y eficiencias. Además, dentro de los aspectos netamente operativos se encuentra la oportunidad de desarrollar sistemas o paquetes tecnológicos que incluyan la cosecha y entrega de material "just in time" o justo a tiempo para evitar deterioro de los materiales susceptibles a contaminación.
El desarrollo de microorganismos con capacidad de metabolizar eficientemente sustratos C5 y C6 es también una línea que se requiere explorar. Estos organismos deben ser también más resistentes a cambios en temperatura, pH y presión para permitir el desarrollo de procesos flexibles y rápidos que favorezcan la producción de etanol y la productividad de las biorefinerías.
El desarrollo de pretratamientos más amigables con el medio ambiente y energéticamente más eficientes, en los cuales se utilice de forma conjunta enzimas de nueva generación, microorganismos productores de enzimas y productos químicos más baratos y menos contaminantes, constituyen también una tendencia futura.
En México se encuentran ya cada vez más establecidas las condiciones legislativas, energéticas y de mercado que alienten la construcción de biorefinerías. El uso de sorgo como materia prima para la producción de alternativas a la gasolina resulta sin duda una de las áreas más promisorias en el campo y la industria nacional.
Agradecimientos
Los autores agradecen el soporte financiero y apoyo provisto por Fondos Mixtos N.L.–CONACyT NL–2006–C09–33363 "Creación del centro de investigación y desarrollo de biocombustibles del Estado de Nuevo León" y de la Cátedra de Investigación del Tecnológico de Monterrey.
Referencias
Algenol. (2011). Harnessing the sun to fuel the world. Disponible en: http://www.algenolbiofuels.com/. Accesado: 19 julio 2011. [ Links ]
Almodares, A. y Hadi, M.R. (2009). Production of bioethanol from sweet sorghum: A review. African Journal of Agricultural Research 4, 772–780. [ Links ]
Balat M., Balat H. y Öz C. (2008). Progress in bioethanol processing. Progress in Energy and combustion Science 34, 551–573. [ Links ]
Ballesteros, M., Oliva, J.M., Negro, M.J., Manzanares, P. y Ballesteros, I. (2003). Ethanol from lignocellulosic materials by a simultaneous saccharification and fermentation process (SFS) with Kluyveromyces marxianus CECT 10875. Process Biochemistry 39, 1843–1848. [ Links ]
Ban, J., Yu, J., Zhang, X. y Tan, T. (2008). Ethanol production from sweet sorghum residual. Frontiers of Chemicál Engineering in China 2, 452–455. [ Links ]
Blade. Energy Crops. (2010). Managing High–Biomass Sorghum as a Dedicated Energy Crop. Disponible en: http://www.bladeenergy.com/Bladepdf/Blade_SorghumMgmtGuide2010.pdf. Accesado: 27 julio 2011. [ Links ]
Casey, G.P. e Ingledew, W.M. (1986). Ethanol tolerance in yeasts. Critical Reviews of Microbiology 13, 219–280. [ Links ]
Chuck–Hernández, C., Pérez–Carrillo, E. y Serna–Saldívar, S.O. (2009). Production of bioethanol from steam–flaked sorghum and maize. Journal of Cereal Science 50, 131–137. [ Links ]
Clixoo. (sin fecha). Future Predictions of Cellulosic Ethanol Production Costs. Disponible en: http://www.clixoo.com/includes/pdf/Prediction_of_Cellulosic_Ethanol_Production_Cost_in_Future.pdf. Accesado: 27 julio 2011. [ Links ]
Corredor, D. Y., Bean, S. R., Schober, T. y Wang, D. (2006). Effect of decorticating sorghum on ethanol production and composition of DDGS. Cereal Chemistry 83, 17–21. [ Links ]
Dávila–Gomez, F. J., Chuck–Hernández, C., Pérez–Carrillo, E., Rooney, W. L. y Serna–Saldívar, S.O. (2011). Evaluation of bioethanol production from five different varieties of sweet and forage sorghums (Sorghum bicolor (L) Moench). Industrial Crops and Products 33, 611–616. [ Links ]
FAOSTAT (2011). Disponible en: http://faostat.fao.org/. Accesado: 19 julio 2011. [ Links ]
García, L. (2011). Proyectan el sorgo para producir etanol. Disponible en: http://elmundodecordoba.com/elmundo/index.php?option=com_content&view=article&id=1047372%3ACR4N2SORGO&catid=200%3Aotras–poblaciones&Itemid=76. Accesado: 19 julio 2011. [ Links ]
Gnansounou, E., Dauriat, A. y Wyman, C. E. (2005). Refining sweet sorghum to ethanol and sugar: economic trade–offs in the context of North China. Bioresource Technology 96, 985–1002. [ Links ]
GRFA. (2010). Global ethanol production to reach 85.9 bn litres in 2010. Disponible en: http://www.commodities–now.com/news/environmental–markets/2099–global–ethanol–production–to–reach–859–bn–litres–in–2010.html. Accesado: 19 julio 2011. [ Links ]
Herrera, A., Téllez–Luis, S.J., Ramírez, J.A. y Vazquez, M. (2003). Production of xylose from sorghum straw using hydrochloric acid. Journal of Cereal Science 37, 267–274. [ Links ]
ICRISAT. (2011). Sorghum [Sorghum bicolor (L.) Moench]. Disponible en: http://www.icrisat.org/crop–sorghum–genebank.htm. Accesado: 19 julio 2011. [ Links ]
Jones, A.M. e Ingledew, W.M. (1994). Fuel alcohol production: optimization of temperature for efficient Very–High–Gravity fermentation. Applied and Environmental Microbiology 60, 1048–1051. [ Links ]
Kim, M. y Day, D. (2010). Composition of sugar cane, energy cane, and sweet sorghum suitable for ethanol production at Louisiana sugar mills. Journal of Industrial Microbiology & Biotechnology. Volumen no disponible, 1–5. [ Links ]
Kundiyana, D.K. (1996). Sorganol: In–field production of ethanol from sweet sorghum. Disponible en: http://digital.library.okstate.edu/etd/umi–okstate–1974.pdf. Accesado: 19 julio 2011. [ Links ]
Kurian, J.K., Minu, A.K., Banerji, A. y Kishore, V.V.N. (2010). Bioconversion of hemicellulose hidrolysate of sweet sorghum bagasse to ethanol by using Pichia stipitis NCIM 3497 and Debaryomyces hansenii sp. Bioresources 5, 2404–2416. [ Links ]
Laopaiboon, L., Thanonkeo, P., Jaisil P. y Laopiboon, P. (2007). Ethanol production from sweet sorghum juice in batch and fed–batch fermentations by Saccharomyces cerevisiae. World Journal of Microbiology and Biotechnology 23, 1497–1501. [ Links ]
Lee, J. (1997). Biological conversion of lignocellulosic biomass to ethanol. Journal of Biotechnology 56, 1–24. [ Links ]
Liu, R. y Shen, F. (2008). Impacts of main factors on bioethanol fermentation from stalk juice of sweet sorghum by immobilized Saccharomyces cerevisiae (CICC 1308). Bioresource Technology 99, 847–854. [ Links ]
Mamma, D., Koullas, D., Fountoukidis, G., Kekos, D., Macris, B.J. y Koukios, E. (1996). Bioethanol from sweet sorghum: simultaneous saccharification and fermentation of carbohydrates by a mixed microbial culture. Process Biochemistry 31, 377–381. [ Links ]
McIntosh, S. y Vancov, T. (2010). Enhanced enzyme saccharification of Sorghum bicolor straw using dilute alkali pretreatment. Bioresource Technology 101, 6718–6727. [ Links ]
Mizuno, R., Ichinose, H., Honda, M., Takabatake, K., Sotome, I., Takai, T., Maehara, T., Okadome, H., Isobe, S., Gau, M. y Kaneki, S. (2009). Use of whole crop sorghums as a raw material in consolidated bioprocessing bioethanol production using Flammulina velutipes. Bioscience, Biotechnology, and Biochemistry 73, 1671–1673. [ Links ]
Nan, L., Best, G. y De Carvalho–Neto, C.C. (1994). Integrated energy systems in China – The cold Northeastern region experience. Disponible en: http://www.fao.org/docrep/T4470E/t4470e00.htm#Contents. Accesado: 19 julio 2011. [ Links ]
Nuanpeng, S., Laopaiboon, L., Srinophakun, P., Klanrit, P., Jaisil, P. y Laopaiboon, P. (2011). Ethanol production from sweet sorghum juice under very high gravity conditions: batch, repeated–batch and scale up fermentation. Electronic Journal of Biotechnology 14, 112. http://dx.doi.org/10.2225/vol14–issue1–fulltext–2. Accesado: 19 julio 2011. [ Links ]
PEMEX. (2010). Queda petróleo para 10 años: Pemex. Disponible en: http://www.jornada.unam.mx/2010/03/20/index.php?section=economia&article=024n1eco. Accesado: 5 julio 2011. [ Links ]
Pérez–Carrillo, E. y Serna–Saldívar, S.O. (2007). Effect of protease treatment before hydrolysis with álphá–amylase on the rate of starch and protein hydrolysis of maize, whole sorghum and decorticated sorghum. Cereal Chemistry 84, 607–613. [ Links ]
Pérez–Carrillo, E., Serna–Saldívar, S.O., Alvarez, M.M. y Cortes–Callejas, M.L. (2008). Effect of sorghum decortication and use of protease before liquefaction with thermoresistant álphá–amylase on efficiency of bioethanol production. Cereal Chemistry 85, 792–798. [ Links ]
Phowchinda, O., Delia–Dupuy, M.L. y Strehaiano, P. (1997). Alcoholic fermentation from sweet sorghum: some operating problems. Disponible en: http://www.energy–based.nrct.go.th/Article/Ts–3%20alcoholic%20fermentation%20from%20sweet%20sorghum%20some%20operating%20problems.pdf. Accesado 19 julio 2011. [ Links ]
Pradeep, P., Goud, G.K. y Reddy, O. V. S. (2010). Optimization of very high gravity (VHG) finger millet (ragi) medium for ethanolic fermentation by yeast. Chiang Mai Journal of Science 37, 116–123. [ Links ]
Praj. (Sin fecha). Sweet sorghum to etanol. Technology, plant & machinery. Disponible en: http://www.praj.net/media/sweetsorghum.pdf. Accesado: 19 julio 2011. [ Links ]
Prasad, S., Singh, A., Jain, N. y Joshi, H.C. (2007). Ethanol production from sweet sorghum syrup for utilization as automotive fuel in India. Energy & Fuels 21, 2415–2420. [ Links ]
Reddy, N. y Yang, Y. (2005). Biofibers from agricultural by products for industrial applications. TRENDS in Biotechnology 23, 22–27. [ Links ]
RFA. Renewable Fuels Association. (2011). The Industry–Statistics. Disponible en: http://www.ethanolrfa.org. Accesado: 19 julio 2011. [ Links ]
Rooney, L. W. y Pflugfelder, R.L. (1986) Factors affecting starch digestibility with special emphasis on sorghum and corn. Journal of Animal Science 63, 1607–1623. [ Links ]
Rooney, L. y Serna–Saldívar, S. (2000). Sorghum. En: Handbook of Cereal Science and Technology, (Kulp, K., Ponte, J., eds.). Marcel Dekker, New York, USA. [ Links ]
Saballos, A. (2008) Development and Utilization of Sorghum as a Bioenergy Crop. En: Genetic Improvement of Bioenergy Crops, (Vermerris, W., ed.), Pp 211–248. Springer. USA. [ Links ]
SAGARPA (2009). Proyecciones para el sector agropecuario de México. Disponible en: http://www.sagarpa.gob.mx/agronegocios/Documents/EBespañol300909.pdf. Accesado: 19 julio 2011. [ Links ]
Serna–Saldívar, S. (2010). Cereal Grains: Properties, Processing, and Nutritional Attributes. CRC Press. Boca Raton, FL. [ Links ]
Sipos, B., Réczey, J., Somorai, Z., Kádár, Z., Dienes, D. y Réczey, K. (2009). Sweet sorghum as feedstock for ethanol production: enzymatic hydrolysis ofsteam–pretreated bagasse. Applied Biochemistryand Biotechnology 153, 151–162. [ Links ]
Smith, G. A., Bagby, M. O., Lewellan, R. T., Doney, D. L., Moore, P. H., Hills, F. J., Campbell, L. G., Hogaboam, G. J., Coe, G. E. y Freeman, K. (1987). Evaluation of sweet sorghum for fermentable sugar production potential. Crop Science 27, 788–793. [ Links ]
Stenberg, K., Tengborg, C., Galbe, M. y Zacchi, G. (1998). Optimisation of steam pretreatment of SO2–impregnated mixed softwoods for ethanol production. Journal of Chemical Technology & Biotechnology 71, 299–308. [ Links ]
Sumari, D., Hosea, K. M. M. y Magingo, F. S. S. (2010). Genetic characterization of osmotolerant fermentative Sáccháromyces yeasts from Tanzania suitable for industrial very high gravity fermentation. African Journal of Microbiology Research 4, 1064–1070. [ Links ]
Suresh, K., Kiransree, N. y Rao, L.V. (1999). Utilization of damaged sorghum and rice grains for ethanol production by simultaneous saccharification and fermentation. Bioresource Technology 68, 301–304. [ Links ]
Taylor, J.R.N. y Belton, P.S. (2002). Sorghum. En: Pseudocereals and less common cereals, (P. Belton y J. Taylor, eds.), Pp. 25–91. Springer, Germany. [ Links ]
Taylor, J.R.N., Schober T.J. y Bean S.R. (2006). Novel food and non food uses for sorghum and millets. Journal of Cereal Science 44, 252–271. [ Links ]
Turhollow, A.F., Webb. E.G. y Downing, M.E. (2010). Review of Sorghum Production Practices: Applications for Bioenergy. Oak Ridge National Laboratory. Department of Energy. Disponible en: http://info.ornl.gov/sites/publications/files/Pub22854.pdf. Accesado 19 julio 2011. [ Links ]
USDA (2011). Mexico. Grain and Feed Annual. Gain report number: MX1017. Disponible en: http://gain.fas.usda.gov/Recent%20GAIN%20Publications/Grain%20and%20Feed%20Annual_Mexico%20City_Mexico_3–14–2011.pdf. Accesado: 19 julio 2011. [ Links ]
USEIA. (2011). Country analysis: Mexico. U.S. Energy Information Administration. Disponible en: http://www.eia.doe.gov/countries/country–data.cfm?fips=MX. Accesado: 19 julio 2011. [ Links ]
Wang, D., Bean, S., McLaren, J., Seib, P., Madl, R., Tuinstra, M., Shi, Y., Lenz, M., Wu, X. Y Zhao, R. (2008). Grains sorghum is a viable feedstock for ethanol production. Journal of Industrial Microbiology and Biotechnology 35, 313–320. [ Links ]
Wang, F.Q., Gao, C.J., Yang, C.Y. y Xu P. (2007). Optimization of an ethanol production medium in very high gravity fermentation. Biotechnology Letters 29, 233–236. [ Links ]
Woods, J. (2000). Integrating sweet sorghum and sugarcane for bioenergy: modelling the potential for electricity and ethanol production in SE Zimbabwe. Tesis de Doctorado en Filosofía, King's College London, University of London, Gran Bretaña. [ Links ]
Wu, X., Jampala, B., Robbins, A., Hays, D., Yan, S., Xu, F., Rooney, W., Peterson, G., Shi, Y. y Wang, D. (2010a). Ethanol fermentation performance of grain sorghum (Sorghum bicolor) with modified endosperm matrices. Journal of Agricultural and Food Chemistry 58, 9556–9562. [ Links ]
Wu, X., Staggenborg, S., Propheter, J.L., Rooney, W.L., Yu, J. y Wang, D. (2010b). Features of sweet sorghum juice and their performance in ethanol fermentation. Industrial Crops and Products 31, 164–170. [ Links ]
Wu, X., Zhao, R., Bean, S.R., Seib, P.A., McLaren, J.S., Madl, R.L., Tuinstra, M., Lenz, M.C. y Wang, D. (2007). Factors impacting ethanol production from grain sorghum in the dry–grind process. Cereal Chemistry 84, 130–136. [ Links ]
Wu, X., Zhao, R., Liu, L., Bean, S., Seib, P.A., McLaren, J., Madl, R., Tuinstra, M., Lenz, M. y Wang, D. (2008). Effects of growing location and irrigation on attributes and ethanol yields of selected grain sorghums. Cereal Chemistry 85, 495–501. [ Links ]
Wu, X., Zhao, R., Wang, D., Bean, S.R., Seib, P.A., Tuinstra, M.R., Campbell, M. y O'Brien, A. (2006). Effects of amylose, corn protein, and corn fiber contents on production of ethanol from starch–rich media. Cereal Chemistry 83, 569–575. [ Links ]
Yan, S., Wu, X., Dahlberg, J., Bean, S.R., MacRitchie, F., Wilson, J.D. y Wang, D. (2010). Properties of field–sprouted sorghum and its performance in ethanol production. Journal of Cereal Science 51, 374–380. [ Links ]
Yan, S., Wu, X., MacRitchie, F. y Wang, D. (2009). Germination–improved ethanol fermentation performance of high–tannin sorghum in a laboratory dry–grind process. Cereal Chemisty 86, 597–600. [ Links ]
Zhan, X., Wang, D., Bean, S.R., Mo, X., Sun, X.S. y Boyle D. (2006). Ethanol production from supercritical–fluid–extrusion cooked sorghum. Industrial Crops Products 23, 304–310. [ Links ]
Zhang, C., Xie, G., Li, S., Ge, L. y He, T. (2010). The productive potentials of sweet sorghum ethanol in China. Applied Energy 87, 2360–2368. [ Links ]














