Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista mexicana de ingeniería química
versión impresa ISSN 1665-2738
Rev. Mex. Ing. Quím vol.9 no.1 Ciudad de México abr. 2010
Biotecnología
Proteínas PEGiladas: producción, purificación y aplicaciones
PEGylated proteins: production, purification, and applications
K. P. Mayolo-Deloisa y M. Rito-Palomares*
Departamento de Biotecnología e Ingeniería de Alimentos, Centro de Biotecnología-FEMSA, Tecnológico de Monterrey. Campus Monterrey, Ave. Eugenio Garza Sada 2501 Sur, Monterrey, NL 64849, México. *Corresponding author. E-mail: mrito@itesm.mx Tel: (52) 81 8328-4132, Fax: (52) 81 8328-4136
Recibido 7 de Noviembre 2009;
Aceptado 15 de Febrero 2010
Resumen
La PEGilación es la conjugación de una proteína y/o péptido con una o más moléculas de poli(etilen glicol). El poli(etilen glicol) es un polímero no toxico, no inmunogénico y esto aprobado por la FDA (Food and Drug Administration, USA). En los últimos años, la PEGilación ha sido utilizada para mejorar las propiedades fisicoquímicas de proteínas y drogas terapéuticas, por lo que esta tecnología ha impactado fuertemente a la industria bio-farmacéutica. La PEGilación permite prolongar el tiempo de residencia en el cuerpo, mejorar la estabilidad, aumentar la solubilidad, disminuir la proteólisis y excreción renal. Desde el surgimiento de esta tecnología, diferentes proteínas han sido PEGiladas para el tratamiento de enfermedades como: hepatitis C, leucemia, artritis reumatoide, etc. Este artículo de revisión presenta una descripción del desarrollo de la PEGilación en los últimos años, así como de los procedimientos usados para la producción de bio-conjugados. Además, se revisan las estrategias de purificación utilizadas para la recuperación de proteínas PEGiladas, siendo este uno de los grandes retos en el proceso debido a que la reacción de PEGilación puede generar bio-conjugados con diferentes grados de PEGilación. Por último, se presentan las aplicaciones de dichos bio-conjugados y los retos futuros que se identifican para su aplicación genérica.
Palabras clave: PEG, PEGilación, proteínas terapéuticas, bio-conjugados.
Abstract
PEGylation is the covalent attachment of protein and/or peptide to poly(ethylene glycol). The poly(ethylene glycol) is a polymer, non toxic, non immunogenic, and FDA (Food and Drug Administration, USA) approved. In the last years, PEGylation has been used to improve the physicochemical properties of some proteins and therapeutic drugs; this technology has impacted heavily on the bio-pharmaceutical industry. PEGylation prolongs the body-residence time and stability, decreases the proteolysis and renal excretion. Since the emergence of this technology, some proteins have been PEGylated for the treatment of diseases including hepatitis C, leukemia, rheumatoid arthritis, etc. This review presents a description of the PEGylation development in the last years and the chemical procedures used to obtain some bio-conjugated products. Strategies of purification used to obtain PEGylated proteins are reviewed; purification is one of the major problems to establish suitable processes due to the fact that the reaction can generate bio-conjugates with different degree of PEGylation. Finally the applications of PEGylated proteins and the future challenges that are identified for generic application are presented.
Keywords: PEG, PEGylation, therapeutic proteins, bio-conjugates.
1. Introducción
La revolución biotecnológica y nanotecnológica ha producido novedosos péptidos y proteínas que están siendo utilizados como nuevas drogas para el tratamiento del cáncer y de diversas enfermedades (Harris y Chess, 2003; Parveen y Sahoo, 2006). Algunas técnicas han sido desarrolladas para mejorar las propiedades terapéuticas de dichas macromoléculas, éstas incluyen la alteración de la secuencia de aminoácidos para reducir su degradación o la fusión de péptidos con inmunoglobulina o albúmina para incrementar la vida media. Hasta ahora, la técnica más exitosa ha sido la conjugación de péptidos y/o proteínas a una o varias cadenas de poli(etilen glicol) (PEG), llamada PEGilación (Ryan y col., 2008).
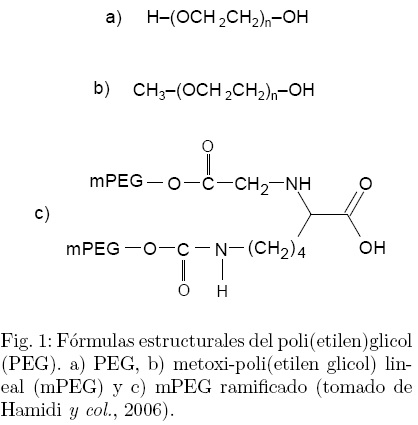
El término PEGilación ha sido utilizado desde 1977 después de que Abuchowsky y colaboradores describieran por primera vez un método para adherir covalentemente una o varias moléculas de PEG a una proteína (Abuchowsky y col., 1977). El PEG es un poliéter lineal o ramificado con un grupo hidroxilo en cada extremo (Fig. 1), este polímero es altamente soluble en agua así como en varios solventes orgánicos y está aprobado por la FDA para su administración en seres humanos (Morar y col., 2006; Wattendorf y Merkle, 2008). Muchos de los beneficios de la PEGilación de proteínas están ligados a las propiedades del PEG. El PEG es inerte, no tóxico y no inmunogénico, además es fácilmente desechado por el cuerpo a través del riñón (pesos moleculares del polímero menores a 20 kDa), o del hígado (pesos moleculares arriba de 20 kDa) (Morar y col., 2006).
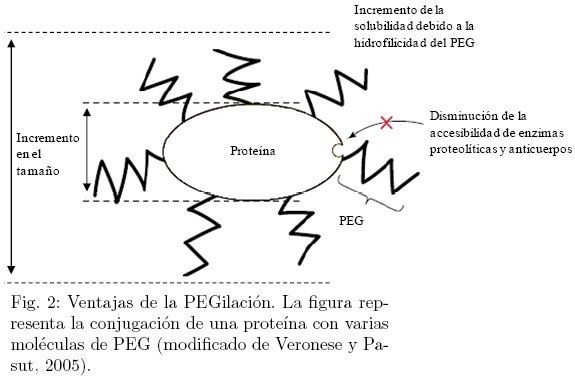
La conjugación de PEG con una proteína generalmente mejora sus propiedades debido a que aumenta su vida media, causa una reducción del reconocimiento de la proteína por el sistema inmune, aumenta su resistencia al ataque proteolítico, aumenta su solubilidad y estabilidad (Fig. 2). La mayoría de estos fenómenos pueden ser explicados debido a la expansión del radio hidrodinámico del conjugado proteína-PEG como un resultado de la capacidad del PEG de coordinar numerosas moléculas de agua y de la alta flexibilidad de la cadena polimérica (Gaberc-Porekar y col., 2008).
Existen varios métodos químicos y enzimáticos para llevar a cabo la PEGilación (Veronese y Pasut, 2005). El primer paso en el proceso es la "activación" de la molécula de PEG, la modificación de PEG más utilizada es el metoxi-PEG (mPEG) (Fig. 1) (Hamidi y col., 2006). El PEG activado puede ser ligado a un sitio específico de las proteínas, frecuentemente sobre un grupo amino, sulfidrilo u otro grupo nucleofílico. En muchos casos, el sitio preferido para la modificación es el grupo amino de la lisina o el grupo amino N-terminal de la cadena polipeptídica (Veronese y Pasut, 2005; Hamidi y col., 2006). Sin embargo, la PEGilación del grupo amino genera un alto número de isómeros lo que dificulta en gran medida el siguiente paso en el proceso de PEGilación, la purificación de los conjugados (Veronese y Pasut, 2005). Debido a los costos extremadamente altos de los procesos de producción de proteínas terapéuticas, uno de los retos en la ingeniería de la reacción de PEGilación es generar reacciones sitio-específicas lo más eficientes posibles, que produzcan un solo conjugado sin alterar las propiedades fisicoquímicas de la proteína de interés.
La purificación de proteínas PEGiladas envuelve la remoción de todas las especies moleculares que no sean parte del producto de interés, que pueden incluir a la proteína no modificada y a la proteína con diferentes grados de PEGilación (mono-, di-, tri-, etc.). Actualmente los procesos de purificación de proteínas PEGiladas están dominados por la cromatografía de exclusión molecular e intercambio iónico. Otros métodos también han sido utilizados aunque con menor frecuencia, ejemplos de ellos son la cromatografía en fase reversa y la cromatografía de interacción hidrofóbica, ultrafiltración, electroforesis, electroforesis capilar, diálisis, sistemas de dos fases acuosas, etc. (Delgado y col., 1997; Fee y Van Alstine, 2006).
Desde el surgimiento de la PEGilación, un gran número de proteínas han sido PEGiladas en ellas se incluyen: factores de crecimiento, adenosin desaminasa, asparaginasa, interferones, ribonucleasa A, albúmina de suero bovino, α-lactoalbúmina, entre otras. Muchas de ellas están siendo utilizadas en el tratamiento de enfermedades como: leucemia, artritis reumatoide, hepatitis C, acromegalia, etc. (Veronese y Pasut, 2005; Gaberc-Porekar y col., 2008).
A pesar de que en los últimos años los trabajos en el desarrollo de los procesos de PEGilación se han intensificado notablemente, aún no se han encontrado métodos eficientes que eleven el rendimiento en la recuperación de los productos bio-conjugados y disminuyan los altos costos de producción. La ingeniería química y bioquímica juegan un papel fundamental en el diseño de reacciones en donde se controle el sitio de PEGilación de manera que se evite la generación de proteínas multiPEGiladas. Otra área de oportunidad es la ingeniería de bioseparaciones de proteínas PEGiladas, puesto que aún no se han encontrado procesos que puedan ser aplicados de manera genérica en la etapa de purificación.
El objetivo de este artículo es el de presentar un panorama general del estado del arte en cuanto a la reacción de PEGilación, las estrategias de purificación utilizadas para la recuperación de proteínas PEGiladas, las aplicaciones y los retos futuros que se identifican en el desarrollo de dichos conjugados proteína-polímero.
2. Reacción de PEGilación: producción de proteínas PEGiladas
Para llevar a cabo la reacción de PEGilación, se deben tomar en cuenta varios factores que incluyen el objetivo por el cual una proteína debe de ser PEGilada. La estructura y el tamaño del PEG son dos variables que limitan el proceso; por ejemplo, PEGs ramificados incrementan el peso molecular de la proteína mono-PEGilada, pero también pueden limitar la disponibilidad estérica del sitio de PEGilación. Además, otros factores como el tiempo de reacción, pH, temperatura, concentración de PEG y proteína deben ser tomados en cuenta (Gaberc-Porekar y col., 2008).
En una reacción tópica, un PEG activado se hace reaccionar con uno o más residuos de lisina o con el grupo amino N-terminal. La PEGilación de otros sitios nucleofílicos tales como cisteína, histidina, arginina o tirosina también son posibles. Por otro lado, es posible utilizar enzimas que se encarguen de la conjugación de la proteína con el PEG.
Al llevar a cabo la reacción, la solución de proteína es mezclada con el PEG activado bajo condiciones de pH, temperatura y agitación controladas. Las moléculas de proteína mono-PEGiladas con los sitios más reactivos son las primeras en formarse, los sitios menos reactivos forman las especies di-PEGiladas y asó sucesivamente (Morar y col., 2006).
2.1. Modificación del grupo amino
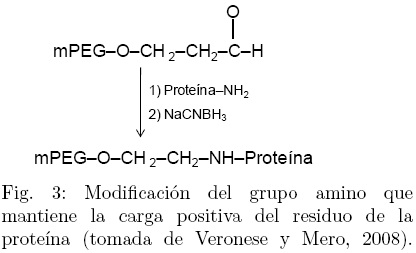
La modificación química más común para llevar a cabo la reacción de PEGilación se da en los grupo ε-amino de los residuos de lisina, a través de alquilación o acilación (Fee y Van Alstine, 2006; Veronese y Mero, 2008). La alquilación mantiene la carga positiva del grupo amino, mientras que la acilación genera una pérdida de la carga debido a la formación de una amida (Veronese y Mero, 2008). En una proteína tópica las lisinas constituyen el 10 % del total de los aminoácidos, su disponibilidad hace que la conjugación sea sencilla; sin embargo, el gran número de sitios presentes para la conjugación dificulta la posibilidad de obtener un número específico de aductos por lo que es muy común que se generen mezclas de PEGameros. Una forma de controlar la reacción es cambiar el pH, a valores altos de pH (arriba de 8.0) se favorece la conjugación con los grupos ε-amino de las lisinas presentes, mientras que una reacción a pH ácido favorece el enlace con el grupo amino N-terminal (Gaberc-Porekar y col., 2008). Los agentes para la modificación de grupos amino incluyen: mPEG-diclorotriazina, mPEG-tresilato, mPEG-succimidil carbonato, mPEG-N-hidroxisuccimida, mPEG-propilaldehído, mPEG-p-nitrofenil-carbonato, etc. (Roberts y col., 2002; Veronese y Mero, 2008). En la Fig. 3, se muestra una de las reacciones más utilizadas para llevar a cabo la modificación del grupo amino N-terminal, en dicha reacción el aldeh ído interacciona con la amina para producir una base de Schiff que finalmente es reducida a una amina secundaria estable (Veronese y Mero, 2008).
2.2. Modificación de residuos de cisternas
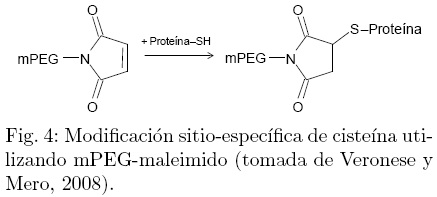
Los polímeros utilizados para la modificación de cisteínas incluyen a: mPEG-maleimido (Fig. 4), mPEG-iodoacetato, mPEG-tiol, mPEG-vinilsulfona y mPEG-piridildisulfido. La PEGilación sitio-específica de residuos de cisteína rara vez se lleva a cabo, debido a que este aminoácido, cuando está presente, se encuentra participando en los enlaces disulfuro o es requerido para la actividad biológica (Vero-nese y Mero, 2008). En ausencia de cisteínas libres en la proteína nativa, una o más cisteínas pueden ser insertadas por ingeniería genética; sin embargo, en ocasiones se pueden generar puentes disulfuro incorrectos y por lo tanto la dimerización de la proteína (Roberts y col., 2002; Veronese y Mero 2008).
2.3. PEGilación específica utilizando enzimas
La conjugación específica de PEG al grupo amido de una glutamina o al grupo hidroxilo de las serinas y treoninas es solo posible utilizando enzimas. Existen enzimas que reconocen a la glutamina como sustrato, llamadas transglutaminasas (Veronese y Pasut, 2005). Sato (2002) reporto que la glutamina de las proteínas puede ser el sustrato de la enzima transglutaminasa, si un PEG-amino es usado como donador nucleofílico, por lo que el PEG puede ser ligado a la proteína a través de un residuo de glutamina.
La reacción para la producción de proteínas PEGiladas juega un papel fundamental en el proceso de PEGilación, los productos que se obtienen son a) la proteína en sus diferentes grados de PEGilación, b) el PEG en exceso y c) la proteína que no logró reaccionar. El conocimiento de la estructura primaria de la proteína es fundamental, el uso de herramientas como la bioinformática pueden ayudar a predecir los sitios de PEGilación y las posibles consecuencias sobre la estructura tridimensional, además de facilitar el proceso de purificación. A pesar de que la PEGilación de cisteínas genera mezclas menos complejas, sigue siendo más utilizada la PEGilación de los grupos amino debido a que las cisteínas son aminoácidos que generalmente participan en el sitio activo o en la conformación de la estructura tridimensional, lo que en muchas ocasiones afecta negativamente a la proteína. El diseño de la reacción debe de ser específico para la proteína de interés, dependiendo de sus propiedades fisicoquímicas y de su aplicación.
3. Estrategias de purificación de proteínas PEGiladas
La purificación de proteínas PEGiladas consiste en remover todas las especies que no formen parte del producto de interés, lo que involucra dos retos principalmente: 1) la separación de las proteínas PEGiladas del resto de los productos de la reacción y 2) el sub-fraccionamiento de las proteínas PEGiladas en base al grado de PEGilación y a los isómeros posicionales o PEGómeros. La purificación se complica debido a que no solo se deben tomar en cuenta las caracterósticas de la proteína, también la naturaleza amfipática del PEG afecta fuertemente al proceso de separación (Fee y Van Alstine, 2006). En la Tabla 1 se muestran algunos de los métodos utilizados para la separación de proteínas PEGiladas. En esta Tabla 1 es evidente que PEG de distintos pesos moleculares han sido utilizados para la obtención de productos PEGilados. Adicionalmente, se ha documentado que para la recuperación de las proteínas PEGiladas, métodos cromatográficos y no-cromatográficos han demostrado su factibilidad.
3.1. Métodos cromatográficos
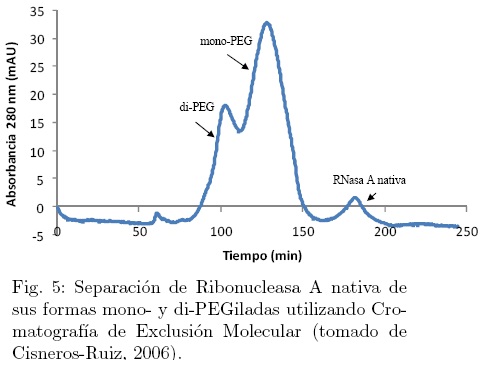
Históricamente, la cromatografía de exclusión molecular (Size Exclusion Chromatography, SEC) ha sido ampliamente usada para la separación de productos PEGilados debido al significativo incremento del radio hidrodinámico de los conjugados comparado con las especies nativas. El poder de resolución de la cromatografía de exclusión para diferentes especies PEGiladas no es muy alto (Fig. 5). Esta técnica es inherentemente inadecuada para resolver mezclas de isómeros que tienen el mismo número de cadenas de PEG ligadas a la proteína, pero en diferentes sitios (Garberc-Porekar y col., 2008).
La cromatografía de intercambio iónico (Ion-Exchange Chromatography, IEC) ofrece la posibilidad de efectuar la separación del PEG, la proteína nativa y las especies PEGiladas en un solo paso. Debido a esto, IEC es comúnmente utilizada para separar proteínas PEGiladas; sin embargo, el método requiere ser optimizado. Para ello, debe tomarse en cuenta que el PEG es un polímero neutral pero puede afectar la carga de las proteínas en tres maneras diferentes. Primero, la presencia del PEG conjugado puede proteger la carga superficial de la proteína y de este modo debilitar el enlace con la resina de intercambio iónico. Segundo, la conjugación a residuos de aminoácidos que altera la carga neta de la proteína o cambia a ciertos valores de pH altera la carga potencial y por lo tanto el punto isoeléctrico (pI). Tercero, la superficie de la proteína en donde se localiza el PEG puede formar puentes de hidrógeno (Fee y Van Alstine, 2006).
La cromatografía de intercambio catiónico es especialmente ventajosa y parece ser el método más fino para separar mezclas de PEGilados (Kinstler y col., 2002; Fee y Van Alstine, 2006; Garberc-Porekar y col., 2008). En la PEGilación aleatoria (básicamente grupos amino), el orden usual es que eluyan primero las especies altamente PEGiladas, después las di-PEGiladas seguidas de las mono-PEGiladas, la proteína no PEGilada eluye al final; sin embargo, el mismo orden de elución se puede obtener cuando se requiere separar proteínas PEGiladas sobre un residuo de cisteína (Seely y col., 2005). Aunque la cromatografía de intercambio catiónico es altamente efectiva para resolver mezclas complejas de proteínas PEGiladas, cargar demasiado la columna puede disminuir la resolución. La mayoría de los espacios de la columna están ocupados por el PEG resultando en una baja capacidad del medio en términos de masa de proteína por volumen de resina. El tiempo de vida útil del medio cromatográfico usado es relativamente corto, por lo que se requiere empacar la columna en repetidas ocasiones. Todos estos factores contribuyen a generar altos costos de separación, a pesar de el uso de resinas de intercambio iónico relativamente económicas (Garberc-Porekar y col., 2008).
La cromatografía de fase reversa (Reverse Phase Chromatography, RPC) es una opción atractiva para la resolución de conjugados proteína-polímero debido a que la cadena del PEG sobresale del conjugado actuando como un sitio hidrofóbico y de esa manera dominar la interacción con la superficie hidrofóbica (Daly y col., 2005; Cisneros-Ruiz, 2006). Sin embargo, RPC puede estar limitada por diferentes factores, incluyendo cambios estructurales en los productos proteícos de interés, además de bajos niveles de recuperación debido a la desnaturalización causada por el uso de solventes orgánicos (Cisneros-Ruiz, 2006).
La cromatografía de interacción hidrofóbica ( Hydrophobic Interaction Chromatography, HIC) ha sido aplicada con menos frecuencia para la separación de proteínas PEGiladas. Esta técnica generalmente trabaja pobremente debido a que el PEG por só mismo también se liga al medio, lo que interviene en la separación (Fee y Van Alstine, 2006; Garberc-Porekar y col., 2008). Cisneros-Ruiz y colaboradores (2009) reportaron que bajo ciertas condiciones es posible separar ribonucleasa A nativa de sus especies PEGiladas; sin embargo, no es posible separar las proteína mono-PEGilada de la di-PEGilada. Algunos autores consideran que esta técnica no ha sido debidamente explotada, por lo que es necesario realizar más investigación al respecto (Fee y Van Alstine, 2006).
En términos generales, las técnicas cromatográficas clásicas para la separación de proteínas, no ofrecen de manera individual un desempeño óptimo para la purificación de conjugados proteína-polímero. En muchas ocasiones es necesario utilizar un conjunto de las técnicas antes mencionadas, algunos autores han sugerido que la cromatografía de exclusión molecular seguida por intercambio iónico e interacción hidrofóbica podrían ser la mejor propuesta de una aplicación generica para la purificación de proteínas PEGiladas (Fee y Van Alstine, 2006; Garberc-Porekar y col., 2008).
3.2. Métodos no cromatográficos
El incremento en tamaño de los conjugados proteína-PEG ha sido explotado para llevar a cabo su separación haciendo uso de membranas de ultrafiltración. Con mayor frecuencia, dicha técnica ha sido empleada para remover el agua y la solución buffer del resto de los componentes de la reacción de PEGilación; sin embargo, también es posible separar la proteína nativa de las moléculas PEGiladas asó como retirar el PEG remanente (Lee y Park, 2002; Pabst y col., 2007; Molek y Zydney, 2007), además ha sido examinado su uso potencial para la separación de los conjugados de manera cuantitativa. El diseño y optimización para la aplicación de la ultrafiltración en la recuperación de proteínas PEGiladas requiere de la adecuada selección del tamaño de poro de la membrana, el pH, fuerza ionica y el flujo del filtrado (Molek y Zydney, 2007).
Sistemas de dos fases acuosas (SDFA) también han sido utilizados para la separación de proteínas PEGiladas; sin embargo, reportes que documenten la caracterización de proteínas PEGiladas en estos sistemas no son muy comunes. SDFA es un método de separación líquido-líquido en donde la separación está basada en la diferencia de partición de los solutos entre las fases (Rito-Palomares, 2004), que se visualiza como una alternativa atractiva para la recuperación de proteínas PEGiladas. En este contexto, estudios previos mostraron que los conjugados PEG-proteína de las proteínas albúmina, factor de estimulación de colonias de granulocitos y macrofágos e inmunoglobulina G, se comportan diferente que sus equivalentes proteínas nativas en sistemas que utilizan PEG y dextrano como formadores de fases. Los resultados muestran que el coeficiente de partición (K) incrementa con el número de moléculas de PEG ligadas a la proteína (Delgado y col., 1994; Delgado y col., 1997). Si bien estos estudios demostraron el potencial de utilizar SDFA para la recuperación de conjugados proteína-PEG, la falta de una caracterización extensa del comportamiento de partición es evidente. Alternativamente, Sookkumnerd y Hsu (2000) explotaron la distribución a contracorriente en sistemas de dos fases acuosas (PEG-fosfatos) como técnica para purificar conjugados PEG-lisozima. Los resultados de esta investigación mostraron que a través de esta técnica es posible separar cada una de las especies PEGiladas y la proteína nativa. A pesar de los estudios realizados, una extensa caracterización de los conjugados proteína-polímero utilizando estrategias que explotan los mecanismos de partición en dos fases acuosas es necesaria.
Como se ha podido apreciar, se han realizado diversos esfuerzos por mejorar los procesos de purificación de proteínas PEGiladas, la mayoría de ellos utilizando métodos cromatográficos. Sin embargo, los procesos siguen llevándose a cabo en varias etapas, lo que prolonga el tiempo de recuperación de los bio-conjugados e impacta negativamente en el rendimiento del proceso de PEGilación. Es en este punto donde herramientas de ingeniería química y bioquímica puede ser de gran impacto en el desarrollo de métodos de separación más rápidos y efectivos. Lo ideal será el diseño de procesos con dos etapas, una de recuperación primaria (utilizando métodos como ultrafiltración, diálisis o sistemas de dos fases acuosas) en donde se separen el PEG y la proteína que no reaccionaron y una segunda etapa (cromatográfica) que permita la separación de los diferentes bio-conjugados (mono-PEGilados, di-PEGilados, etc.).
Aunque los procesos cromatográficos son los más utilizados en la separación de bio-conjugados, hasta ahora no se conocen modelos matemáticos que ayuden a predecir el comportamiento de las proteínas PEGiladas en el proceso de purificación , lo cual será de gran ayuda en la optimización e intensificación de los métodos de separación.
4. Aplicaciones, tendencias y retos futuros
Diferentes clases de drogas proteicas, como enzimas, citoquinas y anticuerpos han sido significativamente mejoradas debido al proceso de PEGilación. La Tabla 2 compila los ejemplos más importantes de bio-conjugados aprobados por la FDA, que explotando las ventajas de la PEGilación, han sido utilizados en la terapia de diversas enfermedades (Veronese y Pasut, 2005; Fishburn, 2008). PEG-amadasa bovina (PEG-adenosin deaminasa, Adagen®, Enzon Inc.) fue la primera proteína PEGilada en ser comercializada satisfactoriamente. Fue aprobada por la FDA en 1990 para tratar la enfermedad de inmunodeficiencia combinada severa (Severe Combined Im-munodeficiency, SCID). Adenosin desaminasa fue PEGilada aleatoriamente con PEG 5 kDa para extender el tiempo que permanece en el plasma y reducir su inmunogenicidad. Este fue un paso predominante en el desarrollo de la PEGilación porque se demostró por primera vez la viabilidad de esta tecnología (Veronese y Mero, 2008).
La segunda proteína biológicamente activa en ser conjugada con PEG fue L-asparaginasa (PE-Gaspargasa; Oncaspar®, Enzon Inc.). PEGaspargasa fue aprobada por la FDA en 1994 para pacientes en los cuales la proteína no modificada (o nativa) provocaba una reacción alérgica. La conjugación de la proteína con múltiples cadenas de PEG 5 kDa incrementó el tiempo de eliminación tres veces más comparado con la proteína nativa. El producto PEGilado fue tan efectivo como la droga nativa en el tratamiento de pacientes con leucemia linfoblástica aguda, además mostró un bajo grado de inmunogenicidad (Graham, 2003).
El factor de crecimiento de colonias de granulocitos ( Granulocyte Colony-Stimulating Factor, G-CSF) es el mayor regulador de la granulopoyesis in vivo. Su tiempo de vida media es relativamente corto (3.5-3.8 h) por lo que a diario se requieren de múltiples dosis. El conjugado PEG-G-CSF, pegfilgrastim (Neulasta®, Amgen Inc.), fue producido por la unión de una molécula de PEG 20 kDa a el grupo α-amino del residuo N-terminal de metionina. Pegfilgrastim permanece en el plasma el tiempo suficiente para permitir una simple inyección subcutánea para tratamientos de quimioterapia (Kinstler y col., 2002; Veronese y Mero, 2008).
Los interferones combinados con ribavirina son los tratamientos más usados para tratar infecciones virales, en su forma nativa, tienen un tiempo de vida muy corto (4-5 h). PEG-interferón α2a (Pega-sys®, Hoffman La Roche Inc.) fue obtenido por el acoplamiento covalente de PEG-N-hidroxisuccimida 40 kDa a un residuo de lisina. Dicha reacción produce una mezcla de cuatro isómeros mono-PEGilados en Lys31, Lys21, Lys131 y Lys134. Recientemente, los isómeros de PEG-inerferón a2a fueron separados cromatograficamente y su actividad fue evaluada; los isómeros Lys31 y Lys134, fueron los más activos. Lo que demuestra que es posible diseñar nuevos PEG-interferones que retengan mayor actividad biológica que la proteína nativa, además de que se evidencia que aún hace falta investigación sobre estrategias de purificación más eficientes (Veronese y Mero, 2008).
Las ventajas de la PEGilación no están limitadas a su aplicación en proteínas terapéuticas, también han sido utilizadas para mejorar la estabilidad en solventes orgánicos y la eficiencia catalítica de proteínas como la lacasa, utilizada en procesos de biorremediación debido a su capacidad de oxidar un amplio rango de compuestos fenólicos y poliaromóticos (Vandertol-Vanier y col., 2002; López-Cruz y col., 2006). Otra proteína utilizada también como biocatalizador en reacciones de oxidación de compuestos de estructura química diversa y que representan un problema de contaminación ambiental, es el citocromo C. El citocromo C ha sido modificado químicamente mediante PEGilación, lo que ha permitido aumentar su estabilidad térmica a temperaturas mayores a 100°C (García-Arellano y col., 2002). La PEGi-lacíon tambiéen podría ser utilizada para mejorar la estabilidad de proteínas de afinidad (v.gr. proteína A) utilizadas en lechos cromatográficos para la separación de anticuerpos.
Además de proteínas y péptidos, otras moléculas como: cofactores, oligonucleótidos, lípidos sacáridos y bio-materiales están siendo PEGilados, lo que representa un área de oportunidad para el desarrollo de diversas investigaciones en el área.
Hasta ahora, el desarrollo de la PEGilación proteínas ha estado enfocado en su aplicación terapéutica, que sin duda ha sido de gran impacto para el desarrollo de nuevas drogas. Sin embargo, esta técnica puede mejorar la estabilidad de prácticamente cualquier proteína, de ahí la necesidad de profundizar la investigación en este campo pues aún existen diversos retos por superar.
En cuanto a la producción (reacción) de bio-conjugados, es necesario diseñar reacciones de PEG-ilación sitio-específicas que eviten la formación de PEGámeros sin dañar el sitio catalítico; además de conocer a detalle las características intramoleculares de las especies PEGiladas que ayuden a entender su comportamiento bajo diferentes condiciones. La optimización de la reacción de PEGilacíon es crucial, puesto que el exceso tanto del PEG como de la proteína que no reaccionan aumenta la viscosidad de la solución, lo que complica el proceso de purificación. Sería ideal contar con procesos compuestos por una etapa de recuperación primaria (v.gr. ultrafiltración, fases acuosas, etc.) y una de purificación (utilizando métodos cromatográficos). Otra alternativa es llevar a cabo la reaccoón de PEGilación y la separación en un solo paso utilizando cromatografía de exclusión molecular , esta es una técnica que ha sido muy poco explorada por lo cual tiene que ser afinada, pero ofrece la posibilidad de realizar tanto el proceso de producción como el de purificación a través de una misma etapa con la ayuda de sistemas cromatográficos.
Conclusiones
La PEGilacíon es una técnica versátil que permite superar muchas de las limitaciones farmacológicas de las proteínas terapéuticas. Durante el desarrollo de esta técnica han surgido importantes avances en cuanto a la reacción de PEGilacíon, la generación de más bio-conjugados, el entendimiento de su comportamiento y las estrategias para su purificación. Sin embargo, aún se presentan nuevos retos en materia de ingeniería, tanto en la preparación como en la purificación de las moléculas PEGiladas. Los métodos clásicos de separación han sido útiles pero no ofrecen una resolución óptima; siguen siendo procesos en varias etapas, de alto costo y con rendimientos bajos, además de que en casos muy específicos no ha sido posible separar los isómeros conformacionales. De manera que es necesario profundizar en la investigación de métodos no convencionales de separación que puedan ser aplicados en la purificación de proteínas PEGiladas. Los productos aprobados por la FDA son una clara demostración del éxito de la PEGilación tanto en el mejoramiento de las propiedades de las proteínas terapéuticas como de su aplicación en el tratamiento de diversas enfermedades; sin embargo, aún hace falta profundizar sobre la aplicación de proteínas PEGiladas en diversas áreas de la biotecnología.
Agradecimientos
Los autores agradecen el soporte financiero del CONACyT (Proyecto 53654) y del Tecnológico de Monterrey a través de la Cátedra de Bioingeniería y Nano-biopartículas (CAT-161).
Referencias
Abuchowski, A., McCoy, J.R., Palczuk, N.C., Van Es, T. y Davis, F.F. (1977). Effect of covalent attachment of polyethylene glycol on immunogenicity and circulating life of bovine liver catalase. The Journal of Biological Chemistry 252, 3582-3586. [ Links ]
Arduini, R.M., Li, Z., Rapoza, A., Gronke, R., Hess, D.H., Wen, D., Miatkowski, K., Coots, C., Kaffashan, A., Viseux, N., De-laney, J., Domon, B., Young, C.N., Boyn-ton, R., Chen, L.L., Chen, L., Betzenhauser, M., Miller, S., Gill, A., Pepinsky, R.B., Hochman, P.S. y Baker, D.P. (2004). Expression, purification, and characterization of rat interferon-β, and preparation of an N-terminally PEGylated form with improved pharmacokinetic parameters. Protein Expression and Purification 34, 229-242. [ Links ]
Calceti, P., Salmaso, S., Walker, G. y Bernkop-Schnürch, A. (2004). Development and in vivo evaluation of an oral insulin-PEG delivery system. European Journal of Pharmaceutical Sciences 22, 315-323. [ Links ]
Cisneros-Ruiz, M. (2006). Chromatographic separation of conjugates polymer-protein. PhD Thesis. Tecnologico de Monterrey. Monterrey, N.L. Mexico. [ Links ]
Cisneros-Ruiz, M., Mayolo-Deloisa, K., Przybycien, T.M. y Rito-Palomares, M. (2009). Separation of PEGylated from unmodified ribonuclease A using sepharose media. Separation and Purification Technology 65, 105-109. [ Links ]
Daly, S., Przybycien, T.M. y Tilton, R.D. (2005). Adsorption of poly(ethylene glycol)-modified ribonuclease A to a poly(lactide-coglycolide) surface. Biotechnology and Bioengineering 90, 856-868. [ Links ]
Delgado, C., Malik, F., Selisko, B., Fisher, D. y Francis, G.E. (1994). Quantitative analysis of polyethylene glycol (PEG) in PEG-modified proteins/cytokines by aqueous two-phase systems. Journal of Biochemical and Biophysical Methods 29, 237-250. [ Links ]
Delgado, C., Malmsten, M. y Van Alstine, J.M. (1997). Analytical partitioning of poly(ethylene glycol)-modified proteins. Journal of Chromatography B 692, 263-272. [ Links ]
Dou, H., Zhang, M., Zhang, Y. y Yin, C. (2007). Synthesis and purification of mono-PEGylated insulin. Chemical Biology &Drug Design 69, 132-138. [ Links ]
Fee, C.J. y Van Alstine, J.M. (2004). Prediction of the viscosity radius and the size exclusion chromatography behavior of PEGylated proteins. Bioconjugate Chemistry 15, 1304-1313. [ Links ]
Fee, C.J. y Van Alstine, J.M. (2006). PEG-proteins: reaction engineering and separation issues. Chemical Engineering Science 61, 924-939. [ Links ]
Fishburn, C.S. (2008). The pharmacology of PE-Gylation: balancing PD with PK to generate novel therapeutics. Journal of Pharmaceutical Science 97, 4167-4183. [ Links ]
Gaberc-Porekar, V., Zore, I., Podobnik, B. y Menart, V. (2008). Obstacles and pitfalls in the PEGylation of therapeutic proteins. Current Opinion in Drug Discovery & Development 11, 242-250. [ Links ]
García-Arellano, H., Valderrama, B., Saab-Rincón y Vazquez-Duhalt, R. (2002). High temperature biocatalysis by chemically modified cytochrome C. Bioconjugate Chemistry 13, 1336-1344. [ Links ]
Graham, M.L. (2003). Pegaspargase: a review of clinical studies. Advanced Drug Delivery Reviews 10, 1293-1302. [ Links ]
Hamidi, M., Azadi, A. y Rafiei, P. (2006). Pharmacokinetic consequences of pegylation. Drug Delivery 13, 399-409. [ Links ]
Harris, J.M. y Chess, R.B. (2003). Effect of PE-Gylation on pharmaceuticals. Nature Reviews Drug Discovery 2, 214-221. [ Links ]
Kim, T.H., Lee, H. y Park, T.G. (2002). Pegylated recombinant human epidermal growth factor (rhEGF) for sustained release from biodegradable PLGA microspheres. Biomaterials 23, 2311-2317. [ Links ]
Kinstler, O., Molineux, G., Treuheit, M., Ladd, D. y Gegg, C. (2002). Mono-N-terminal poly (ethylene glycol)-protein conjugates. Advanced Drug Delivery Reviews 54, 477485. [ Links ]
Lee, H. y Park, T.G. (2002). Preparation and characterization of mono-PEGylated epidermal growth factor: evaluation of in vitro biologic activity. Pharmaceutical Research 19, 845-851. [ Links ]
Li, D., Manjula, B.N. y Acharya, A.S. (2006). Extension arm facilitated PEGylation of hemoglobin: correlation of the properties with the extent of PEGylation. The Protein Journal 25, 263-274. [ Links ]
López-Cruz, J.I., Viniegra-González, G. y Hernández-Arana, A. (2006). Thermostability of native and pegylated Myceliophthora thermophila laccase in aqueous and mixed solvents. Bioconjugate Chemistry 17, 1093-1098. [ Links ]
Molek, J.R. y Zydney, A.L. (2007). Separation of PEGylated alpha-lactalbumin from unreacted precursors and byproducts using ultra-filtration. Biotechnology Progress 23, 1417-1424. [ Links ]
Morar, A.S., Schrimsher, J.L. y Chavez, M.D. (2006). PEGylation of proteins: A structural approach. BioPharm International, 34-48. [ Links ]
Pabst, T.M., Buckley, J.J., Ramasubramanyan, N. y Hunter, A.K. (2007). Comparison of strong anion-exchangers for the purification of a PEGylated protein. Journal of Chromatography A 1147, 172-182. [ Links ]
Parveen, S. y Sahoo, S.K. (2006). Nanomedicine. Clinical applications of polyethylene glycol conjugated proteins and drugs. Clinical Pharmacokinetics 45, 965-988. [ Links ]
Reddy, K.R., Modi, M.W. y Pedder, S. (2002). Use of peginterferon alfa-2a (40 kD) (Pegasys®) for the treatment of hepatitis C. Advanced Drug Delivery Reviews 54, 571-586. [ Links ]
Rito-Palomares, M. (2004). Practical application of aqueous two-phase partition to process development for the recovery of biological products. Journal of Chromatography B 807, 3-11. [ Links ]
Roberts, M.J., Bentley, M.D. y Harris, J.M. (2002). Chemistry for peptide and protein PEGylation. Advanced Drug Delivery Reviews 54, 459-476. [ Links ]
Ryan, S.M., Mantovani, G., Wang, X., Haddleton, D.M. y Brayden, D.J. (2008). Advances in PEGylation of important biotech molecules: delivery aspects. Expert Opinion on Drug Delivery 5,371-383. [ Links ]
Sato, H. (2002). Enzymatic procedure for site-specific PEGylation of proteins. Advanced Drug Delivery Reviews 54, 487-504. [ Links ]
Seely, J.E., Buckel, S.D., Green, P.D. y Richey, C.W. (2005). Making site-specific PEGylation work. BioPharm International, 30-42. [ Links ]
Sookkumnerd, T. y Hsu, J.T. (2000). Purification of PEG-protein conjugates by countercurrent distribution in aqueous two-phase systems. Journal of Liquid Chromatography & Related Technologies 23, 497-503. [ Links ]
Vandertol-Vanier, H.A., Vazquez-Duhalt, R, Tinoco, R. y Pickard, M.A. (2002). Enhanced activity by poly(ethylene glicol) modification of Coriolopsis gallica laccase. Journal of Industrial Microbiology and Biotecnhology 29, 214-220. [ Links ]
Veronese, F.M. y Mero, A. (2008). The impact of PEGylation on biological therapies. Bio-Drugs 22, 315-329. [ Links ]
Veronese, F.M. y Pasut, G. (2005). PEGylation, successful approach to drug delivery. Drug Discovery Today 10, 1451-1458. [ Links ]
Wang, Y.S., Youngster, S., Grace, M., Bausch, J., Bordens, R. y Wyss, D.F. (2002). Structural and biological characterization of pegylated recombinant interferon alpha-2b and its therapeutic implications. Advanced Drug Delivery Reviews 54, 547-570. [ Links ]
Wattendorf, U. y Merkle, H.P. (2008). PEGylation of surface modied microparticles. Journal of Pharmaceutical Sciences 97, 4655-4669. [ Links ]
Zhai, Y., Zhao, Y., Lei, J., Su, Z. y Ma, G. (2009). Enhanced circulation half-life of site-specic PEGylated rhG-CSF: optimization of PEG molecular weight. Journal of Biotechnology 142, 259-266. [ Links ]














