Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
REB. Revista de educación bioquímica
versión impresa ISSN 1665-1995
Rev. educ. bioquím vol.33 no.2 Ciudad de México jun. 2014
Artículos
Poliaminas: pequeños gigantes de la regulación metabólica
Claudine Guasco Herrera, Jorge Luis Chávez Servín, Roberto Augusto Ferriz Martínez, Karina de la Torre Carbot, Elizabeth Elton Puente y Teresa García Gasca
Facultad de Ciencias Naturales. Universidad Autónoma de Querétaro. Av. De las Ciencias s/n. Juriquilla, Querétaro. CP 76230. México. Correo E: tggasca@uaq.edu.mx
Recibido: 22 de marzo de 2014.
Aceptado: 10 de junio de 2014.
Resumen
Las poliaminas son moléculas alifáticas nitrogenadas de bajo peso molecular con grupos amino distribuidos de forma regular a lo largo de su estructura. Entre sus principales funciones destacan el empaquetamiento de ácidos nucleicos, la modulación de receptores de membrana y canales iónicos, la regulación de la expresión génica y la señalización celular. Son capaces de inducir apoptosis, participan en el ciclo celular, modulan el sistema inmune y participan en el balance redox del organismo. Se consideran moléculas antinflamatorias y se asocian a la longevidad. Sin embargo, las poliaminas están implicadas en cáncer y enfermedades neurodegenerativas por lo que actualmente son dianas potenciales en farmacología.
Palabras clave: Agmatina, espermidina, espermina, putrescina, poliaminas.
Abstract
Polyamines are nitrogenated aliphatic molecules of low molecular weight with regular-distributed amino groups along its structure. Among their main functions are packaging of nucleic acids, modulation of membrane receptors and ion channels, regulation of gene expression and cell signaling. They can induce apoptosis, participate in cell cycle, modulate the immune system and the redox balance of the body. They are considered anti-inflammatory molecules and are associated with longevity. However, poliamines are involved in cancer and neurodegenerative diseases, then they are potential targets in pharmacology.
Key words: Agmatine, espermidine, espermine, putrescine, polyamines.
INTRODUCCIÓN
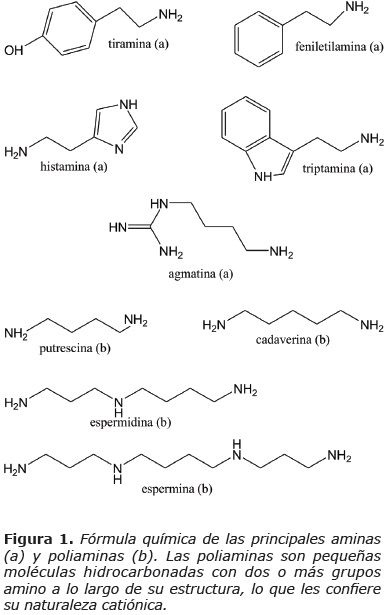
Descubiertas por Antonie van Leeuwenhoek en 1678 (1), estas moléculas pequeñas son actualmente el foco de atención de numerosas investigaciones. Las poliaminas son moléculas policatiónicas constituidas por varios grupos amino a lo largo de la cadena (Fig. 1). Las aminas se pueden clasificar en alifáticas (putrescina, espermidina, espermina, cadaverina), aromáticas (tiramina, feniletilamina) o heterocíclicas (histamina, triptamina) (2). En los seres humanos las poliaminas provienen de dos fuentes, por un lado, un origen endógeno por la biosíntesis de novo e interconversiones entre ellas mismas, así como de las secreciones digestivas (especialmente intestinal y pancreática) y las descamaciones y los productos del catabolismo de las propias células intestinales. Por otro lado, un origen exógeno a partir del consumo dietético y mediante la producción de poliaminas por los microorganismos intestinales (3). Estas moléculas pequeñas se relacionan con numerosos procesos celulares como la división celular, el empaquetamiento de ácidos nucleicos, la replicación del DNA y otros. En el presente trabajo se presenta un panorama general de estos pequeños gigantes del metabolismo.
SÍNTESIS DE POLIAMINAS
La L-arginina es un amino ácido precursor de muchas moléculas importantes en la fisiología celular, incluyendo las poliaminas. En microorganismos y en plantas, las poliaminas se generan a través de la conversión de L-arginina a ornitina a través de la arginasa o arginina descarboxilasa (ADC) y posteriormente a agmatina y a putrescina. La mayoría de las células de mamíferos tienen la capacidad de producir las poliaminas que necesitan a partir de ornitina por acción de la ornitina descarboxilasa (ODC) que produce putrescina, la cual origina espermidina y espermina a través de la acción de la espermidina sintasa y espermina sintasa, respectivamente (Fig. 2). La cadaverina se produce a partir de lisina; la ruta depende de la especie y del momento del desarrollo en que se produce. Además, las poliaminas se originan a partir de los enterocitos exfoliados y éstos se han considerado como una posible fuente de poliaminas luminales (4, 5).
Las poliaminas se catabolizan mayoritariamente por desaminación oxidativa por la diaminooxidasa (DAO), enzima que se ha localizado en diferentes tejidos como la mucosa intestinal, el hígado y el riñon. La pustrescina se puede oxidadar por la DAO, produciendo alfa-aminobutiraldehído en lugar de convertirse a espermidina. Este aldehido puede posteriormente ser oxidado a gama-aminobutirato (GABA) o dar origen a compuestos cíclicos. Además, la putrescina puede también acetilarse por una enzima microsomal y la monoacetilputrescina se oxida por una monoaminaoxidasa, para producir GABA, lo que ocurre en tejidos como el cerebro que tienen baja actividad de la DAO. La acetilación de las poliaminas puede llevarse a cabo también por una enzima nuclear que, con espermidina como sustrato, forma preferentemente N1-acetilespermidina. Las poliaminas acetiladas han sido encontradas en cantidades pequeñas en sangre y orina, pero no es clara la importancia de la acetilación en la excreción de estos compuestos (5).
La poliamina oxidasa (PAO) participa en la degradación de estas moléculas y de sus derivados acetilados, ya que cataliza la desaminación oxidativa de espermina produciendo espermidina o putrescina, dependiendo de la naturaleza del sustrato (6). La agmatina se cataboliza por la agmatinasa y forma putrescina (7). La actividad catabólica de PAO y de la espermina oxidasa generan altas cantidades de peróxido de hidrógeno lo cual favorece la apoptosis (8).
La homeostasis de las poliaminas está fuertemente regulada y depende del equilibrio entre la velocidad de su biosintesis, catabolismo, excreción y absorción. El transporte a través de la membrana está reconocido como un factor importante en la homeostasis de poliaminas (9). Adicionalmente, la ODC es degradada muy rápidamente cuando el nivel de poliaminas incrementa. La degradación de esta enzima está dada por una via independiente de ubicuitinas a través de la antizima, una proteina inducida por poliaminas. Una vez que la OCD se asocia con la antizima se degrada por la unidad 26S del proteasoma (10).
POLIAMINAS Y REGULACIÓN METABÓLICA
Numerosos estudios realizados en seres humanos y en animales de experimentación han evidenciado la importancia de las poliaminas en los estados de salud y enfermedad. Son fundamentales en el hombre en los procesos de señalización, replicación, transcripción, traducción, crecimiento, desarrollo, diferenciación y apoptosis celulares. Participan en la maduración y mantenimiento del tracto gastrointestinal, en la estimulación del sistema inmunitario, en la modulación de diferentes actividades enzimáticas. Están relacionadas en la carcinogénesis y en el crecimiento de tumores, así como antioxidantes naturales, entre otras acciones (7) (Fig. 3).
1. Poliaminas, estabilización de ácidos nucléicos y expresión génica. Las poliaminas participan en la condensación y agregación del DNA. A bajas concentraciones la putrescina se une de forma preferencial a los surcos menores y mayores de la doble cadena del DNA, mientras que la espermina y la espermidina sólo a los mayores. A altas concentraciones la unión de la putrescina es débil mientras que la espermidina y espermina se unen fuertemente a los surcos menores y mayores aunque la espermina se une preferentemente a los surcos mayores. También se han observado uniones electrostáticas al esqueleto azúcar-fosfato sin alterar la estructura B del DNA; por el contrario, las poliaminas favorecen la estabilización de la doble cadena (11). Se ha encontrado que las poliaminas modulan la conformación cuádruplex en la región promotora y afectan la expresión de genes como c-myc, c-fos, p21 y p53 (12, 13). La espermina se involucra en muchos procesos celulares como la regulación de la transcripción al afectar la capacidad de unión de proteínas al RNA y la interacción con el DNA para promover su condensación y protegerlo de la desnaturalización y agentes ionizantes como la radiación y especies reactivas de oxígeno (ROS) (5).
La metilación del DNA y las histonas es uno de los principales medios de control epigenético. El grupo metilo se deriva de una molécula esencial en la célula, S-adenosilmetionina (SAM); sin embargo, las poliaminas también requieren SAM para su síntesis. El incremento en la cantidad de poliaminas puede causar la interrupción de la metilación celular, lo que puede conducir a la expresión anormal de genes y a la interrupción de otros procesos celulares dependientes de la metilación (14).
2. Poliaminas y cascadas de señalización. La disminución de poliaminas en células intestinales induce la activación de la proteína cinasa B (Akt/PKB), mediando la supresión de la apoptosis a través de la inhibición de la caspasa 3 (15). Se ha observado que el agotamiento de poliaminas celulares induce la fosforilacion de la cinasa 1 dependiente de fosfoinosítido (PDK1), que induce la fosforilación de Akt/PKB lo cual se asocia con el bloqueo de la apoptosis (16). Por otro lado, la espermidina ha mostrado capacidad para inhibir la inflamación en células de microglia bloqueando la vía del fosfoinosítido 3 cinasa (PI3K), la cual activa Akt/PKB y cinasas mitogénicas (MAPKs) así como la translocación de la subunidad p65 del factor nuclear potenciador de las cadenas ligeras kappa de las células B activadas (NF-kB) y la expresión de interleucina 6 (IL6) y del factor de necrosis tumoral alfa (TNF-a) (17). La espermidina también estimula la fosforilación de cinasas reguladas por señales extracelulares (ERK1 y ERK2) y la activación del oncogen c-myc relacionado con procesos de malignización (18).
3. Poliaminas, apoptosis y proliferación celular. En el tejido intestinal se ha observado que la disminución de poliaminas, debida a la inhibición de la ODC, inhibe la proliferación del epitelio intestinal (5) y promueve la acumulación de p53 lo que puede favorecer la apoptosis (12). El agotamiento de poliaminas provoca arresto del ciclo celular en G1 por inducción de p21 y Gadd45a y reducción de la expresión de ciclinas. Sin embargo, células carentes de poliaminas permanecen viables ya que se encienden mecanismos como la autofagia (13).
4. Poliaminas, estrés oxidativo, envejecimiento y longevidad. La forma en la que las poliaminas actúan sobre el estrés oxidativo parece estar vinculada con su capacidad para atrapar radicales libres (19) y para estimular la expresión de enzimas de fase 2 como la NAD(P)H quinona oxidoreductasa, la glutatión S-transferasa, la subunidad reguladora de la gama-glutamil cisteína ligasa y la UDP-glucuronil transferasa, vía la activación del elemento de respuesta a antioxidantes por el factor de transcripción Nrf2 (20). Sin embargo, el catabolismo acelerado de poliaminas genera estrés oxidativo (21).
El nivel de poliaminas disminuye con la edad de forma específica en cada tejido. Nishimura y col. (22) observaron que los niveles de espermidina disminuyeron en 11 de 14 tejidos en ratones hembra de 3, 10 y 26 semanas. Mientras que la espermina disminuyó únicamente en piel, corazón y músculo, la putrescina se mantuvo baja en todos los casos. La espermidina disminuyó marcadamente en timo, bazo, ovario, hígado, estómago, pulmón, riñón, corazón y músculo. En piel se observó un nivel máximo de espermidina en ratones de 10 semanas de edad y una reducción significativa en ratones de 26 semanas. Se observó que las poliaminas reducen el daño oxidante en ratones senoles. En levaduras se ha observado también la reducción de estrés oxidante a través de la inhibición de histona-acetiltransferasas, lo que regula mecanismos de autofagia, suprime la necrosis y aumenta la longevidad (23). En la "mosca de la fruta" (Drosophila melanogaster), el tratamiento con espermidina 1 mM es capaz de aumentar la longevidad y la actividad locomotora después del tratamiento con paraquat 20 mM. El tratamiento con paraquat 5 mM mostró que moscas atg7-/(gen 7 relacionado con autofagia) no mejoraron las tasas de sobrevivencia por lo que el mecanisno está relacionado con autofagia (24). Se ha observado que el envejecimiento cronológico (envejecimiento post-mitótico) y el envejecimiento replicativo (envejecimiento de células madre) en levaduras disminuyen significativamente por la suplementación de espermidina, efecto posiblemente relacionado con la reducción de la acetilación de residuos de lisina (Lys9, Lys14 y Lys18) de la histona H3 (25).
5. Poliaminas y cáncer. El metabolismo de las poliaminas está frecuentemente alterado en las células cancerosas y se asocia con concentraciones de poliaminas superiores a los observado en células normales. De hecho, la inhibición de poliaminas o de su biosíntesis es una estrategia potencial para la quimioterapia del cáncer. Se ha demostrado en muchos sistemas celulares que las poliaminas son necesarias para el crecimiento óptimo. Sin embargo, en enfermedades hiperplásicas hay un aumento en la actividad de la enzima ODC y de los niveles de las poliaminas en los tejidos dañados. Se ha observado la activación simultánea de la biosíntesis de poliaminas y la amplificación de protooncogenes (18, 26).
A pesar de que algunos tejidos como médula ósea, páncreas, mucosa intestinal y próstata presentan altos niveles de poliaminas, éstas aumentan en tejido tumoral. En sangre de individuos sanos los leucocitos presentan mayores niveles de poliaminas que eritrocitos y plaquetas pero en individuos con cáncer los niveles de poliaminas incrementan. En suero se encuentran en forma libre y no conjugada como en orina sin embargo, los niveles de poliaminas en orina podrían ser utilizados como marcadores de la eficacia de tratamientos quimioterapéuticos (27).
Uno de los primeros eventos en la proliferación de célular es la inducción de la biosíntesis de poliaminas y se sabe que la sobreexpresión de la ODC más allá de cierto umbral mínimo puede inducir la transformación celular y la promoción del tumor. Si bien, la presencia de poliaminas es necesaria para la proliferación celular, su acumulación puede desencadenar en apoptosis. La vía de retorno a través de la espermidina/espermina-N(1)- acetiltransferasa (SSAT) y PAO desempeñan un papel regulador importante en este comportamiento bivalente (28). Se ha postulado que la regulación de SSAT es clave para mantener la homeostasis de poliaminas y se visualiza como un blanco para la quimioterapia contra el cáncer (29).
En cáncer colorectal, la inhibición de la ODC disminuye el crecimiento de los tumores y el desarrollo de adenomas colorrectales. Se ha observado que la ingesta dietética de poliaminas por arriba de la cantidad promedio de una población (332 uM/ día), se asocia con más un 39% de probabilidad de presentar adenoma colorectal, por lo que el riesgo de dicho padecimiento puede ser modificable a través de la dieta (30). Se sabe que las poliaminas están involucradas en el proceso de angiogénesis ya que se produce en respuesta al crecimiento del tumor. La difluorometilornitina (DFMO), que inactiva irreversiblemente a la ODC, es el ejemplo más estudiado de un inhibidor del metabolismo de las poliaminas que suprime el desarrollo del cáncer en modelos animales (31).
6. Poliaminas y dieta. La dieta provee una cantidad importante de poliaminas. La ingesta de poliaminas en la leche materna se considera esencial para la maduración postnatal del sistema inmunológico y el intestino delgado (32). La leche materna es un alimento rico en poliaminas. La espermina, espermidina y putrescina se relacionan con el desarrollo gastrointestinal del recién nacido ayudando a evitar alergias alimentarias y disminuyendo la permeabilidad de las proteínas antigénicas. Las enzimas PAO y DAO generan al-dehídos, aminoácidos y peróxido de hidrógeno en calostro humano y leche materna, lo que podría tener potenciales efectos antimicrobianos mediante estrés oxidante. Probablemente, PAO está presente en la leche materna durante todo el período de lactancia y contribuye así a los efectos protectores de la leche humana (6).
La agmatina muestra un papel positivo en la producción de secretagogos (como insulina, adrenalina y noradrenalina) y su beneficio a nivel neuronal, vascular, metabólico y en funciones terapéuticas. Su presencia en humanos se atribuye principalmente a la dieta, sobre todo en productos fermentados. En particular, niveles altos de agmatina se observan en las bebidas alcohólicas como el vino, la cerveza y el sake, lo que parece confirmar el papel de las levaduras en su producción (33). La dieta mediterránea contiene importantes cantidades de poliaminas, principalmente putrescina, espermidina y espermina, la putrescina es comúnmente la poliamina mayoritaria en alimentos. El aceite de oliva, hortalizas, frutas, vino, queso, aves y carne roja presentan mayor cantidad de estas biomoléculas antinflamatorias (34) por lo que podrían estar implicadas en las propiedades nutracéuticas propias de la dieta mediterránea.
Por otra parte se han reportado niveles tóxicos de poliaminas en embutidos, lo que puede representar un riesgo potencial para la salud de las personas sensibles, o para quienes están en terapias farmacológicas con inhibidores de la monoaminooxidasa (35). Las aminas más frecuentes en alimentos son histamina, tiramina, putrescina, cadaverina, triptamina, (3-feniletilamina, espermina y espermidina. Si bien, las intoxicaciones alimentarias más frecuentes están relacionadas con la histamina y la tiramina; cuyos aminoácidos precursores son la histidina y tirosina, respectivamente, la intoxicación por histamina es la más conocida, existiendo referencias desde finales del siglo XIX sobre la incidencia de esta enfermedad, conocida como enfermedad escombroide debido a que los trastornos tenían lugar tras la ingestión de pescados del grupo Escombroidae. La intoxicación producida por tiramina se conoce también como reacción del queso, debido a los altos niveles que ésta presenta en algunos quesos. Además de su propia toxicidad, estudios recientes han demostrado que la tiramina favorece la adhesión de organismos patógenos como Escherichia coli O157:H7 a la mucosa intestinal (2).
CONCLUSIONES
Las poliaminas están involucradas en múltiples funciones biológicas así como en procesos patológicos. Su naturaleza catiónica les permite interaccionar con ácidos nucleicos y proteínas, por lo que se consideran elementos estructurales básicos y promueven la homeostasis. Su desregulación afecta procesos epigenéticos, de proliferación celular y apoptosis por lo que se ven relacionadas con el cáncer y otros padecimientos. Su estudio como blancos terapéuticos es motivo de investigaciones en la actualidad. Adicionalmente, sus funciones como componentes de la leche materna revelan su importancia a nivel inmunológico y como posibles prebióticos. Se hace necesario profundizar en el conocimiento bioquímico y funcional para comprender mejor el papel de estos pequeños gigantes de la regulación metabólica y aprovechar dicho conocimiento en beneficio de la salud.
REFERENCIAS
1. Bouchereau A, Aziz A, Larher F, Martin-Tanguy J (1999) Polyamines and environmental challenges: recent development. Plant Sci 140:103-125 [ Links ]
2. Fernández M, Alvarez MA (2008) Las Aminas Biógenas en los alimentos. Agrocsic. 2-8. Disponible en: http://digital.csic.es/bitstream/10261/5771/1/IPLA_AGROCSIC_2.pdf [ Links ]
3. Minois N, Carmona-Gutierrez D, Madeo F (2011) Polyamines in aging and disease. Aging 3:1 17. [ Links ]
4. Greene JM, Feugang JM, Pfeiffer KE, Stokes JV, Bowers SD, Ryan PL (2013) L-arginine enhances cell proliferation and reduces apoptosis in human endometrial RL95-2 cells. Rep Biol Endocrinol 11:15 pp. [ Links ]
5. Wang S-Y, Lee Y-L, Lai Y-H, Chen JJW, Wu W-LYuann JMP,Su W-L,Chuang S-M,Hou M-H (2012) Spermine attenuates the action of the DNA intercalator actinomycin D, on DNA binding and the inhibition of trasncription and DNA Replication. PLoS ONE 7: e47101. [ Links ]
6. Bjelakovic L, Kocic G, Bjelakovic B, Najman S, Stojanovic D, Jonovin M, Pop-Trajkovic Z (2012) Polyamine Oxidase and Diamine Oxidase Activities in Human Milk during the First Month of Lactation. Iran J Pediatr. 22: 218-222. [ Links ]
7. Ruiz-Cano D, Pérez-Llamasa F, Zamora S (2012) Polyamines, implications for infant health. Arch Argent Pediatr. 110(3):244-250. [ Links ]
8. Chaturvedi R, Cheng Y, Asim M, Bussiére FI, Xu H, Gobert AP, Hacker A, Casero RA Jr, Wilson KT (2004) Induction of polyamine oxidase 1 by Helicobacter pylori causes macrophage apoptosis by hydrogen peroxide release and mitochondrial membrane depolarization. J Biol Chem 279:40161-40173. [ Links ]
9. Aouida M, Leduc A, Poulin R, Ramotar D (2005) AGP2 encodes the major permease for high affinity polyamine import in Saccharomyces cerevisiae. J. Biol. Chem. 280:24267-24276. [ Links ]
10. Murakami Y, Matsufuji S, Hayashi S, Tanahashi N, Tanaka K (2000) Degradation of Ornithine Decarboxylase by the 26S Proteasome. Biochem Biophys Res Comm. 267:1-6 [ Links ]
11. Ouameur AA, Tajmir-Riahi HA (2004) Structural Analysis of DNA Interactions with Biogenic Polyamines and Cobalt(III) hexamine Studied by Fourier Transform Infrared and Capillary Electrophoresis. J Biol Chem. 279:42041-42054. [ Links ]
12. Bhattacharya S, Ray RM, Johnson LR (2009) Role of polyamines in p53-dependent apoptosis of intestinal epithelial cells. Cell Signal 21:509-522 [ Links ]
13. Landau G, Ran A, Bercovich Z, Feldmesser E, Horn-Saban S, Korkotian E, Jacob-Hirsh J, Rechavi G, Ron D, Kahana C (2012) Expression Profiling and Biochemical Analysis Suggest Stress Response as a Potential Mechanism Inhibiting Proliferation of Polyamine-depleted Cells. J Biol Chem 287:35825-35837. [ Links ]
14. Brooks Wesley H (2012) Autoimmune Diseases and Polyamines. Clin Rev Allergy Immunol. 42:58-70. [ Links ]
15. Zhang M, Wang H, Tracey KJ (2000) Regulation of macrophage activation and inflammation by spermine: a new chapter in an old story. Crit Care Med 28:N60-N66. [ Links ]
16. Keledjian KM, Marasa BS, Wang JY, Rao JN (2012) Induced PDK1 kinase activity suppresses apoptosis in intestinal epithelial cells by activating Akt signaling following polyamine depletion. Int J Clin Exp Med 5:221-228. [ Links ]
17. Choi YH, Park HY (2012) Anti-inflammatory effects of spermidine in lipopolysaccharidestimulated BV2 microglial cells. J Biomed Sci 19:31. [ Links ]
18. Bachrach U, Wang Y-C, Tabib A (2001) Polyamines: New cues in cellular signal transduction. Physiology 16:106-109. [ Links ]
19. Ha HC, Sirisoma NS, Kuppusamy P, Zweier JL, Woster PM, Casero RA (1998) The natural polyamine spermine functions directly as a free radical scavenger. Proc Natl Acad Sci USA. 95:11140-11145. [ Links ]
20. Kwak MK, Kensler TW, Casero RA Jr (2003) Induction of phase 2 enzymes by serum oxidized polyamines through activation of Nrf2: effect of the polyamine metabolite acrolein. Biochem Biophys Res Commun. 305(3):662-70. [ Links ]
21. Cerrada-Gimenez M, Pietilä M, Loimas S, Pirinen E, Hyvönen MT, Keinänen TA, Jänne J, Alhonen L (2011) Continuous oxidative stress due to activation of polyamine catabolism accelerates aging and protects against hepatotoxic insults. Transgenic Res. 20:387-396. [ Links ]
22. Nishimura K, Shiina R, Kashiwagi K, Iagarashi K (2006) Decrease in polyamines with aging and their ingestion from food and drink. J Biochem. 139: 81-90. [ Links ]
23. Eisenberg T, Knauer H, Schauer A, Büttner S, Ruckenstuhl C, Carmona-Gutierrez D, Ring J, Schroeder S, Magnes C, Antonacci L, Fussi H, Deszcz L, Hartl R, Schraml E, Criollo A, Megalou E, Weiskopf D, Laun P, Heeren G, Breitenbach M, Grubeck-Loebenstein B, Herker E, Fahrenkrog B, Fröhlich KU, Sinner F, Tavernarakis N, Minois N, Kroemer G, Madeo F (2009) Induction of autophagy by spermidine promotes longevity. Nat Cell Biol 11:1305-14. [ Links ]
24. Minois N, Carmona-Gutierrez D, Bauer MA, Rockenfeller P, Eisenberg T, Brandhorst S, Sigrist SJ, Kroemer G, Madeo F (2012) Spermidine promotes stress resistance in Drosophila melanogaster through autophagy-dependent and independent pathways. Cell Death Dis. 3:e401. [ Links ]
25. Morselli E, Galluzzi L, Kepp O, Criollo A, Chiara MM, Tavernarakis N, Madeo F, Kroemer G (2009) Autophagy mediates pharmacological lifespan extension by spermidine and resveratrol. Aging. 1(12): 961-970. [ Links ]
26. Bachrach U (2004) Polyamines and Cancer: Minireview article. Amino Acids 26:307-309. [ Links ]
27. Loria D, Sacerdote de Lustig E (1980) Poliaminas y cáncer. Medicina (Buenos Aires) 40:607-612. [ Links ]
28. Medina MA, Quesada AR, Nuñez de Castro I, Sanchez-Jimenez F (1999) Histamine, Polyamines, and Cancer. Biochem Pharmacol. 57:1341-1344. [ Links ]
29. Pegg AE (2008) Spermidine/spermine-N1-acetyltransferase: a key metabolic regulator. Am J Physiol Endocrinol Metab 294: E995-E1010. [ Links ]
30. Vargas AJ, Wertheim BC, Gerner EW, Thomson CA, Rock CL, Thompson PA (2012) Dietary polyamine intake and risk of colorectal adenomatous polyps. Am J Clin Nutr. 96:133-141. [ Links ]
31. Meyskens FL Jr, Gerner EW (1999) Review Development of difluoromethylornithine (DFMO) as a chemoprevention agent. Clin Cancer Res. 5(5):945-51. [ Links ]
32. Atiya Ali M, Strandvik B, Sabel KG, Palme Kilander C, Strömberg R, Yngve A (2013) Polyamine levels in breast milk are associated with mothers' dietary intake and are higher in preterm than full-term human milk and formulas. J Hum Nutr Diet. doi: 10.1111/jhn.12156. [ Links ]
33. Galgano F, Caruso M, Condelli N, Favati F (2012) Agmatine in Fermented Foods. Front Microbiol. 3: 1-7. [ Links ]
34. Thanh Binh PN, Soda K, Kawakami M (2011) Mediterranean diet and polyamine intake: possible contribution of increased polyamine intake to inhibition of age-associated disease. Nutr Diet Suppl. (3):1-7. [ Links ]
35. Papavergou EJ, Savvaidis IN, Ambrosiadis IA (2012) Levels of biogenic amines in retail market fermented meat products. Food Chem. 2012 135:2750-2755. [ Links ]














