Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Boletín médico del Hospital Infantil de México
versión impresa ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.70 no.6 México nov./dic. 2013
ARTÍCULO DE REVISIÓN
Raquitismos hipofosfatémicos hereditarios
Hereditary hypophosphatemic rickets
Luis Velásquez-Jones,1 Mara Medeiros-Domingo2
1 Jefe del Departamento de Nefrología, Dr. Gustavo Gordillo Paniagua
2 Jefe del Laboratorio de Investigación en Nefrología
Hospital Infantil de México Federico Gómez. México D.F., México
Autor de correspondencia:
Dr. Luis Velásquez-Jones
Correo electrónico: velasquezjones@hotmail.com
Fecha de recepción: 01-10-13
Fecha de aceptación: 05-11-13
Resumen
Los raquitismos hipofosfatémicos hereditarios (RHH) son un grupo de enfermedades caracterizadas por la pérdida renal de fosfatos, que ocasionan retardo del crecimiento, raquitismo y osteomalacia. La forma más común es el raquitismo hipofosfatémico ligado al cromosoma X, el cual es causado por mutaciones inactivantes en el gen PHEX.
Las otras formas de los síndromes hipofosfatémicos hereditarios presentan menor prevalencia. Estas incluyen el raquitismo hipofosfatémico autosómico dominante, el raquitismo hipofosfatémico autosómico recesivo tipos 1 y 2 y el raquitismo hipofosfatémico hereditario con hipercalciuria.
En este artículo se revisan las bases genéticas de los diferentes tipos de RHH, las manifestaciones clínicas, las características bioquímicas en sangre y orina y los nuevos aspectos de su tratamiento.
Palabras clave: raquitismos hipofosfatémicos hereditarios, raquitismo/osteomalacia, hipofosfatemia, tratamiento con fosfatos, 1,25-dihidroxivitamina D3.
Abstract
Hereditary hypophosphatemic rickets (HHR) are a group of diseases characterized by renal phosphate wasting causing growth retardation, rickets and osteomalacia. The most common form is the X-linked dominant hypophosphatemic rickets caused by inactivating mutations in the PHEX gene.
The other hereditary hypophosphatemic syndromes present a lower prevalence. These include autosomal dominant hypophosphatemic rickets, autosomal recessive hypophosphatemic rickets types 1 and 2 and the hereditary hypophosphatemic rickets with hypercalciuria.
This article reviews the genetic basis of the different types of HHR, clinical manifestations, biochemical characteristics in blood and urine and new aspects of treatment.
Key words: Hereditary hypophosphatemic rickets; rickets/osteomalacia; hypophosphatemia; phosphate therapy; 1,25-dihydroxyvitamin D3.
INTRODUCCIÓN
El riñón es el órgano más importante en la regulación del balance de fósforo corporal. Solamente las formas ionizadas y en complejos del fosfato plasmático se ultrafiltran en el glomérulo. En los túbulos renales de la nefrona se reabsorbe aproximadamente entre 80 a 97% del fósforo filtrado. En el túbulo proximal se reabsorbe entre 70 a 80% del fósforo, 5 a 10% en el túbulo distal y 2 a 3% en el túbulo colector.1
En el túbulo proximal, el transporte del fósforo se encuentra acoplado al del sodio. En este segmento de la nefrona el transporte del fósforo es mediado por los cotransportadores sodio-fosfato. Se han descrito tres cotransportadores sodio-fosfato (NaPi), denominados tipo I, tipo II y tipo III. De éstos, se considera que el cotransportador sodio-fosfato tipo IIa es el más importante, ya que es el responsable de aproximadamente 70% de la reabsorción del fosfato en el túbulo proximal de la nefrona.1,2 Los cotransportadores sodio-fosfato toman un ion de fósforo y, en unión con tres iones de sodio, los liberan en el citoplasma de las células del túbulo proximal de la nefrona; de esta parte, el fósforo sale de la célula por acción de la bomba Na+-K+-ATPasa, que se encuentra en la parte basolateral de la célula tubular.1
Otro participante importante de la homeostasis del fosfato es la absorción intestinal. La mayor parte del fósforo ingerido se absorbe en el duodeno y, principalmente, en el yeyuno, por medio de difusión pasiva a través de los espacios paracelulares. Cuando la concentración del fósforo en la luz intestinal es baja, este puede ser absorbido activamente por medio de un proceso transcelular dependiente del cotransportador sodio-fosfato tipo IIb.1,2
Para mantener un balance neutral del fosfato, la cantidad de fosfato absorbida en el intestino debe ser semejante a la cantidad excretada, principalmente en la orina. Este balance es mantenido y regulado por la acción coordinada de diferentes hormonas y factores, como la hormona paratiroidea, el factor de crecimiento fibroblástico-23 (FGF-23) y la forma activa de la vitamina D, la 1α,25-dihidroxivitamina D3 (1α,25(OH)2D3).1
Se han descrito diversos cuadros de hipofosfatemias hereditarias. En cada uno se presenta disminución de la reabsorción tubular renal de fosfato, asociada con raquitismo y osteomalacia.1,3 Estas alteraciones difieren entre sí con base en su modo de transmisión hereditaria, manifestaciones clínicas, metabolismo de la vitamina D y respuesta al tratamiento.
La forma más frecuente de las hipofosfatemias familiares es heredada como un rasgo dominante ligado al cromosoma X y se refiere como raquitismo hipofosfatémico ligado al cromosoma X o hipofosfatemia ligada a X, y comprende casi 80% de los casos de raquitismos hipofosfatémicos hereditarios. Las dos formas que se transmiten por herencia autosómica incluyen el raquitismo hipofosfatémico autosómico dominante y el raquitismo hipofosfatémico autosómico recesivo.3 Finalmente, la última variante es el raquitismo hipofosfatémico hereditario con hipercalciuria, el cual se hereda como un rasgo autosómico dominante (Cuadro 1).1,3
RAQUITISMO HIPOFOSFATÉMICO LIGADO AL CROMOSOMA X
Definición
El raquitismo hipofosfatémico ligado al cromosoma X (RHLX), o hipofosfatemia ligada a X, ha recibido también los nombres de "raquitismo resistente a la vitamina D", "raquitismo hipofosfatémico familiar", "raquitismo hipofosfatémico resistente a la vitamina D" y "diabetes de fosfatos.4,5 El término de "raquitismo resistente a la vitamina D" ya no debería utilizarse, porque esta alteración no se caracteriza por resistencia a la vitamina D. Se ha estimado una incidencia de 1:20,000 y, como se ha mencionado, es la forma más frecuente de los raquitismos hipofosfatémicos hereditarios.6
Genética y fisiopatogenia
El RHLX es una alteración ligada al cromosoma X con penetrancia completa después del año de edad. Se ha localizado en el locus Xp22.1.7 El gen PHEX codifica la producción de una proteína de 749 aminoácidos que ha sido referida como PHEX (del inglés Phosphate regulating gene with Homologies to Endopeptidases on the X chromosome ).8 Desde su descripción, se han identificado diferentes mutaciones en este gen en los pacientes con RHLX.9,10
El gen PHEX codifica una metaloproteinasa zinc M13 que se expresa en hueso y dientes, y en menor grado en el pulmón, ovario y testículos, pero no en el riñón. Este gen codifica una peptidasa unida a membranas, cuyo sustrato es un factor fosfatúrico humoral, el FGF-23.11,12
El FGF-23 es producido principalmente en los osteocitos del hueso13 e induce la pérdida renal de fosfato por medio de la supresión de la expresión de los cotransportadores sodio-fosfato tipos IIa y IIc en la superficie apical del túbulo proximal de la nefrona, condicionando el desarrollo de hiperfosfaturia.13-16 Además, el FGF-23 induce -a través de la inhibición de la expresión del CYP271B, el cual codifica la acción de la 1-α-hidroxilasa- la menor producción del metabolito activo de la vitamina D, la 1α,25(OH)2D3, lo que disminuye la absorción de fosfato en intestino y hueso.13,16-18
En condiciones normales, PHEX degrada el FGF-23 en fragmentos inactivos, evitando de esta manera el aumento excesivo de la excreción de fosfatos y el desarrollo de hipofosfatemia. Sin embargo, las mutaciones en PHEX en los pacientes con RHLX19,20 permiten que se mantengan niveles elevados del FGF-23. Esto induce alteraciones de la reabsorción tubular renal de fosfatos y desarrollo de hipofosfatemia.21 Recientemente, se ha sugerido que la acción de PHEX se lleva a cabo a través de un metabolito intermediario, la proteína de matriz extracelular (MEPE), la cual controla los niveles circulantes de FGF-23.3 A su vez, la acción del FGF-23 es mediada a través de los receptores del FGF-23 subtipos 1, 3 y 4 y el correceptor transmembranal Klotho.13,22
En la patogenia de la enfermedad se encuentra un defecto en la reabsorción tubular renal de fosfato y una menor producción de la 1α,25(OH)2D3 por el riñón; además, después del tratamiento, puede producirse el desarrollo de hiperparatiroidismo secundario, y aun terciario a largo plazo.23 Por otro lado, se ha planteado la hipótesis que la hipofosfatemia grave induce el desarrollo de las lesiones raquíticas al comprometer la apoptosis de los condrocitos hipertróficos en la placa de crecimiento del hueso.24
Manifestaciones clínicas
La manifestación clínica más común en el RHLX es el retardo en el crecimiento corporal con talla baja. Los pacientes afectados habitualmente no presentan hipotonía o debilidad muscular, tetania o crisis convulsivas, manifestaciones frecuentes en los niños con raquitismo dependiente o deficiente de vitamina D.25
La alteración bioquímica fundamental, la hipofosfatemia, puede estar presente desde el nacimiento o desarrollarse a la edad de seis hasta 12 meses. Cuando aparece la hipofosfatemia, se retarda el crecimiento esquelético y, en ocasiones, también la edad ósea.5
En los niños afectados que desarrollan lesiones raquíticas, la enfermedad se reconoce habitualmente cuando el niño comienza a caminar; sin embargo, si se realizan estudios radiográficos óseos en el primer año de vida, pueden observarse las lesiones raquíticas iniciales.
A medida que progresa el crecimiento corporal en los niños sin tratamiento, ocurren deformaciones de los miembros inferiores, que incluyen el desarrollo de genu valgum o genu varum , debido a la presencia de lesiones raquíticas epifisarias en la parte distal del fémur y proximal de la tibia.5 En los casos graves pueden presentarse deformaciones óseas, como coxa vara o tibias en forma de sable. Las fracturas óseas son más frecuentes en los adultos afectados.
Habitualmente, la longitud del tórax es normal en los niños con RHLX, por lo que la talla baja es debida principalmente al acortamiento de las extremidades inferiores.17 Algunos pacientes desarrollan deformidades torácicas, principalmente el denominado "tórax en quilla". En cambio, a diferencia de lo que se observa en pacientes con raquitismo deficiente o dependiente de vitamina D, es rara la presentación de rosario costal y deformación de las extremidades inferiores (Cuadro 2).5

Además, los pacientes con las formas graves de RHLX pueden presentar deformaciones de la región maxilofacial, con retardo del desarrollo dental y fracturas, abscesos y pérdidas dentarias; asimismo, se observa con frecuencia agrandamiento de la cavidad que contiene la pulpa.6,26
Las manifestaciones clínicas del raquitismo son habitualmente menos aparentes en las mujeres que en los varones de la misma familia;17 sin embargo, las mujeres pueden también presentar deformaciones óseas graves. Por otro lado, pueden observarse amplias variaciones en el compromiso óseo y en el retardo en el crecimiento en los miembros de una familia, aun del mismo sexo, a pesar de la presencia de grados comparables de hipofosfatemia.
Laboratorio y gabinete
Las alteraciones bioquímicas básicas en los niños con RHLX consisten en la presencia de hipofosfatemia, aumento de la fosfatasa alcalina y fosfaturia (Cuadro 3).1,5
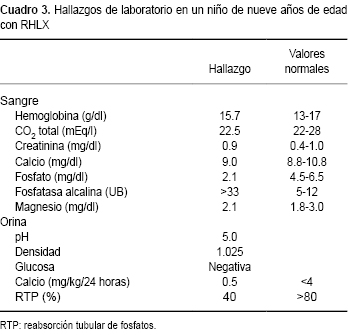
En los pacientes afectados se ha observado variación en la edad de aparición de la hipofosfatemia, desde la etapa neonatal hasta después de los seis meses.5
Los niveles séricos de fosfatasa alcalina se encuentran elevados, particularmente en los niños con evidencias de raquitismo.
La concentración de calcio en suero puede hallarse normal o ligeramente reducida; el magnesio sérico es habitualmente normal, al igual que la concentración de creatinina en estos pacientes con filtración glomerular conservada.
Los niveles de hormona paratiroidea circulante son habitualmente normales. Sin embargo, algunos pacientes pueden desarrollar, después de períodos largos de tratamiento con fosfatos, hiperparatiroidismo secundario o terciario.27
Los niveles del metabolito activo de la vitamina D, la 1α,25(OH)2D3, se encuentran habitualmente en límites normales, pero estos niveles son inadecuadamente bajos en relación con el grado de hipofosfatemia.1 En algunos pacientes se encuentran niveles bajos en suero de la 1α,25(OH)2D3 (Cuadro 1).
Raramente se ha observado acidosis metabólica en algunos niños con RHLX, la cual se corrige con el tratamiento convencional con fosfatos y vitamina D. Se ha especulado que esta alteración transitoria del equilibrio ácido-base puede ser consecuencia de una disminución de la acidez titulable o de la depleción de fosfatos que afecta la producción de la adenosina 5-trifosfatasa y, por ende, la reabsorción de bicarbonato en el túbulo de la nefrona.28
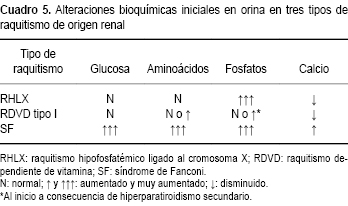
Los hallazgos descritos en sangre contrastan con las alteraciones observadas en el raquitismo dependiente de vitamina D tipo I y el síndrome de Fanconi. En el primer caso, es frecuente la hipocalcemia grave con valores de fosfato en suero normales o ligeramente bajos a consecuencia de la elevación de los niveles de hormona paratiroidea; asimismo, en estos casos los niveles en suero de la 1α,25(OH)2D3 se encuentran muy reducidos o son indetectables. En los casos de los niños con síndrome de Fanconi, además de la hipofosfatemia grave se encuentra acidosis metabólica hiperclorémica a consecuencia del cuadro de acidosis tubular proximal acompañante (Cuadro 4).29
Característicamente, los pacientes con RHLX presentan disminución de la reabsorción tubular proximal renal de fosfato y aumento de su excreción urinaria; asimismo, el transporte tubular máximo para la reabsorción de fosfato se encuentra reducido al igual que el porcentaje de reabsorción tubular de fosfatos.
El valor normal de la reabsorción tubular de fosfato (RTP) es mayor de 80% y se calcula de la siguiente forma:
RTP = 1 - [(Up/Pp) x (Pcrea/Ucrea)]
donde Pp, Up, Pcrea y Ucrea se refieren a las concentraciones en plasma (P) y orina (U) de fosfato (p) y creatinina (crea).1,28
El umbral máximo representa la concentración de fosfato en el plasma por arriba de la cual la capacidad de reabsorción tubular renal del fosfato se encuentra ya saturada. Cuando este último valor se relaciona con la velocidad de filtración glomerular (VFG) se denomina "transporte tubular máximo de fosfato" (TmP/VFG).30 En niños entre dos y 15 años de edad los valores normales de TmP/VFG varían de 3.5 a 7.5 mg/dl (1.15 a 2.44 mmol/l).1,28 Este valor se calcula de acuerdo a la fórmula siguiente:
TmP/VFG = Pp - [(Up x Pcrea)/Ucrea]
La excreción urinaria de calcio es normal o baja en los pacientes no tratados. Habitualmente, estos pacientes no presentan aminoaciduria ni glucosuria, lo cual permite realizar el diagnóstico diferencial con los pacientes con síndrome de Fanconi quienes, además de la hipofosfatemia también grave, presentan la tríada urinaria característica de fosfaturia, glucosuria y aminoaciduria (Cuadro 5).23
Gabinete
Es frecuente el hallazgo de lesiones esqueléticas raquíticas en niños con RHLX. En casos graves pueden observarse, además, diversos grados de desmineralización ósea.
Los defectos de calcificación del cartílago epifisario se detectan en las radiografías, fundamentalmente en las terminaciones distales de los huesos largos. Con singularidad ocurre una ampliación del espacio entre las epífisis y las metáfisis, y la línea metafisaria de calcificación presenta apariencia irregular y "deshilachada", conformando la imagen "en copa" con concavidad hacia el lado epifisario.5
Histológicamente, la lesión esquelética es generalizada y se caracteriza por la presencia de proporciones aumentadas de osteoide no mineralizado (colágeno) y defectos de mineralización.
Tratamiento
Debido a que la función del gen PHEX no ha sido dilucidada por completo, aún no se encuentra disponible un tratamiento específico dirigido a la alteración fisiopatológica subyacente en esta enfermedad.
Por lo anterior, el tratamiento recomendado al día de hoy continúa siendo la combinación de fosfato y 1α,25(OH)2D3. Se ha observado que los niños que lo inician a edades tempranas, antes del año de edad, presentan menor afectación de su crecimiento, que aquellos que lo inician tardíamente.31 En los últimos años se ha sugerido la utilidad de la hormona de crecimiento en estos pacientes.
La preparación oral de fosfato recomendada consiste en la disolución de 136 g de fosfato sódico dibásico y 58.5 g de ácido fosfórico (N.F. 85%) en un litro de agua. Un mililitro de la solución contiene 30 mg de fósforo elemental.
La dosis de fosfato recomendada varía de 30 a 90 mg/kg/día, con promedio de 60 mg/kg/día repartida en cuatro tomas.17,28 Otros autores han recomendado dosis iniciales menores, de 20 a 40 mg/kg/día.16 Desde el punto de vista práctico, si se utiliza la solución de fosfatos, se puede iniciar con tomas de 5 ml (150 mg) cuatro veces al día (600 mg/día), y posteriormente incrementar la dosis a 10 ml (300 mg) o 15 ml (450 mg), cuatro veces al día,2 para alcanzar dosis total de 1 a 2 g por día.1 Los principales problemas que se presentan son la frecuencia con la que las dosis deben ser administradas durante el día y el desarrollo de cuadros diarreicos en las primeras semanas.5 Este tratamiento deberá continuarse hasta que ha concluido el crecimiento. Posteriormente, deberá individualizarse en la edad adulta.1
Es recomendable que el tratamiento con la solución de fosfatos se administre simultáneamente con 1α,25(OH)2D3. Es conveniente, al inicio, indicar dosis bajas de la vitamina D activa, e incrementarla progresivamente. La dosis recomendada es de alrededor de 0.02 a 0.03 μg/kg/día,16,17,28 lo que, por ejemplo en un niño de 8 kg, significa la administración de una segunda dosis de 0.25 μg por día, por vía oral.
Recientemente se ha sugerido el empleo de calcimiméticos, como el cinacalcet, como tratamiento adyuvante de los pacientes con RHLX.6 En ocho pacientes con RHLX se observó que la administración de una dosis de fosfatos indujo incremento transitorio del fosfato sérico, disminución del calcio ionizado y elevación de los niveles de la hormona paratiroidea; en cambio, la administración concomitante de fosfatos y cinacalcet dio como resultado mayor reducción del calcio ionizado, supresión de la hormona paratoroidea y mayor incremento del fosfato en el suero.2,32
Se deben vigilar mensualmente lan concentraciones de calcio, fosfato y creatinina en sangre, así como la excreción de calcio urinario, con el fin de evitar en lo posible el desarrollo de hipercalcemia e hipercalciuria.
El tratamiento temprano combinado con la solución de fosfatos y el metabolito activo de la vitamina D, permite mejorar la velocidad de crecimiento y las alteraciones bioquímicas y radiográficas del raquitismo. Con respecto a esto se ha observado que los pacientes tratados presentan un incremento de la densidad volumétrica mineral ósea trabecular de la parte distal del radio, aunque esta densidad volumétrica es menor en la zona cortical de la diáfisis. Ello refleja, probablemente, que el defecto de la mineralización ósea no se corrige por completo con el tratamiento empleado actualmente.33
En los niños que presentan deformaciones óseas importantes se requieren habitualmente intervenciones quirúrgicas, sobre todo osteotomías en miembros inferiores.
Por otro lado, durante el tratamiento con la solución de fosfatos y vitamina D, pueden ocurrir episodios de hipercalcemia e hipercalciuria; estos últimos han mostrado correlación con el desarrollo de nefrocalcinosis en estos pacientes.19,28,34 También se ha observado que los pacientes que han desarrollado nefrocalcinosis y calcificaciones en los tejidos del corazón, han recibido las dosis más altas de fosfatos y de 1α,25(OH)2D3.2,28,35 Por consiguiente, el lograr concentraciones normales de fosfatos en el suero que sean permanentes no debe ser un objetivo obligado del tratamiento con fosfatos (lo cual, además, es difícil de lograr debido a la poca tolerancia a su ingesta), por el riesgo del desarrollo de hiperparatiroidismo y nefrocalcinosis.2,16 Cuando un paciente desarrolla hipercalciuria (relación calcio/creatinina en una muestra de orina mayor de 0.3 o más de 4 mg/kg/24 horas en colección de orina de 24 horas) durante el tratamiento, se ha sugerido el uso de la solución de citrato de potasio, ya que la alcalinización de la orina es útil para evitar la precipitación del calcio en los túbulos renales.28
Un biomarcador importante de la respuesta esquelética es la actividad de la fosfatasa alcalina en el suero. Esta se encuentra moderadamente elevada antes del tratamiento y disminuye progresivamente con él, por lo que es un indicador útil de la mejoría de las lesiones óseas.16
Asimismo, como se ha mencionado, se ha descrito el desarrollo de hiperparatiroidismo terciario como complicación del tratamiento instituido. Esto ha llevado a la indicación de paratiroidectomía en algunos pacientes.35-37
La falla del crecimiento lineal en niños con RHLX se ha atribuido a la hipofosfatemia y a una alteración en el metabolismo óseo. Sin embargo, las causas responsables no han sido completamente definidas. Se ha propuesto que en algunos pacientes puede, además, ocurrir una deficiencia en la producción de la hormona de crecimiento, agravando así el retraso del mismo. Sin embargo, se han comprobado defectos en la secreción de la hormona del crecimiento solo en algunos pacientes afectados.2
El tratamiento con la hormona del crecimiento recombinante humana en pacientes con RHLX es aún controversial.17,38 En un estudio reciente se demostró que el tratamiento con la hormona de crecimiento dio como resultado un incremento sostenido del crecimiento lineal, tanto de la estatura en posición sentada como de las extremidades inferiores, sin agravio en la desproporción entre los segmentos superior e inferior del cuerpo.39
El tratamiento con hormona de crecimiento deberá ser evaluado tempranamente en el curso de la enfermedad, después que se han controlado las manifestaciones clínicas, bioquímicas y radiológicas del raquitismo. Sobre todo en aquellos pacientes que continúan con retraso en la velocidad de crecimiento o en quienes hubo retraso en el diagnóstico de la enfermedad.17 Por otro lado, Haffner y colaboradores han descrito que la administración de la hormona de crecimiento puede conducir a un crecimiento desproporcionado del tronco en estos pacientes, lo cual puede considerarse un efecto negativo del tratamiento.40 Además, existe la posibilidad de agravamiento de las deformaciones de los miembros inferiores.2,16
Recientemente, se han realizado estudios en el modelo del ratón hipofosfatémico, en los que se ha empleado un inhibidor de la acción del FGF-23.41,42 En estos estudios se ha demostrado que el tratamiento durante cuatro semanas induce aumento en el peso corporal, de los niveles circulantes de fosfato y de 1,25(OH)2D3 en suero y de la expresión del cotransportador NaPi-IIa en el túbulo renal, con mejoría de la mineralización ósea evaluada por histomorfometría.41
Evolución y pronóstico
La mayoría de los pacientes mantienen un crecimiento lineal en talla adecuado cuando reciben tempranamente el tratamiento con la solución de fosfatos y la vitamina D. El tratamiento temprano corrige las deformidades de los miembros inferiores, reduce el número de cirugías correctivas y mejora la talla al llegar a la edad adulta.16 Sin embargo, se ha observado que muchos niños que ya presentan retraso del crecimiento al inicio del tratamiento, aunque mantienen después una velocidad normal del crecimiento, no experimentan el brote de crecimiento que corrija el déficit inicial.17,38 Lo anterior apoya el concepto que la talla final de los niños con RHLX depende del percentil de talla en que se encuentre el paciente al inicio del tratamiento.43 Por consiguiente, es evidente que debe realizarse el mejor esfuerzo para llevar a cabo el diagnóstico temprano de la enfermedad, antes de que, durante los primeros dos años de vida, ocurra una desaceleración evidente del crecimiento y el desarrollo de deformaciones esqueléticas.17,28,38
RAQUITISMO HIPOFOSFATÉMICO AUTOSÓMICO DOMINANTE
El raquitismo hipofosfatémico autosómico dominante (RHAD) se caracteriza por la presencia de pérdida renal de fosfatos con desarrollo de hipofosfatemia persistente en familias con la forma autosómica dominante de herencia.1
Genética y fisiopatología
Los estudios en familias han mostrado que el gen implicado FGF23 se encuentra en el cromosoma 12p13 y codifica la producción del péptido FGF-23.44 Se ha demostrado que los pacientes con RHAD presentan elevadas concentraciones del FGF-23 con relación a la hipofosfatemia grave presente. Se ha observado una mejoría concomitante de la hipofosfatemia en los pacientes que, durante su evolución, muestran una reducción de los niveles del FGF-23.44 El FGF-23 mutado circulante presenta una vida media más prolongada. También, se han descrito fluctuaciones en los niveles séricos del FGF-23 entre valores normales y elevados, dependiendo de si el paciente afectado presenta o no hipofosfatemia.3
Manifestaciones clínicas
En estas familias se ha observado una penetrancia variable del defecto genético, con algunos pacientes que presentan el defecto de la reabsorción de fosfatos desde la niñez y otros hasta la adolescencia o la edad adulta.45 Así, algunos pacientes afectados con RHAD pueden presentar concentraciones normales de fosfatos y FGF-23 en suero durante la etapa de la lactancia y la niñez. Esto explica el impacto diferente de la enfermedad sobre el crecimiento corporal en las familias afectadas. En ellas, algunos miembros pueden no presentar alteraciones del crecimiento y otros, retraso grave del crecimiento corporal.2
Los pacientes que manifiestan la enfermedad desde la niñez presentan raquitismo y deformación de las extremidades inferiores en forma semejante a lo observado en los niños con RHLX. En cambio, en aquellos cuya enfermedad se diagnostica en la edad adulta se observa dolor óseo, debilidad muscular y algunas zonas de fracturas óseas, pero no ocurre deformación de las extremidades inferiores.1,45 En algunos pacientes que inician las manifestaciones clínicas de su enfermedad en la niñez se ha observado desaparición del defecto en la reabsorción tubular renal de fosfatos después de la pubertad.45 Lo anterior indica que la alteración del metabolismo del fosfato podría ser compensado por factores hormonales u otros aun no reconocidos.46
Laboratorio
Al igual que los pacientes con RHLX, los estudios en sangre muestran hipofosfatemia grave con reducción de la RTP y del TmP/VFG, con concentraciones normales de calcio, bicarbonato, creatinina y hormona paratiroidea.45 La concentración de la 1α,25(OH)2D3 es normal, pero también se considera inadecuada para la hipofosfatemia presente. Los pacientes afectados no presentan hipercalciuria, hiperaminoaciduria ni glucosuria (Cuadro 1).
Tratamiento
El tratamiento de los pacientes con RHAD es semejante al recomendado para los niños con RHLX.
RAQUITISMOS HIPOFOSFATÉMICOS AUTOSÓMICOS RECESIVOS
El raquitismo hipofosfatémico autosómico recesivo (RHAR) es una forma rara de los raquitismos hereditarios hipofosfatémicos. Se han reconocido dos variantes denominadas tipo 1 y tipo 2.2,6,47
Genética
El RHAR tipo 1 es causado por mutaciones inactivantes del gen DMP1, localizado en el cromosoma 4q22, que codifica para la proteína DMP1 (Dentin Matrix Protein-1) . Estas dan como resultado la elevación secundaria de los niveles séricos del FGF-23.2 La proteína DMP1 se expresa principalmente en líneas celulares de osteoblastos y osteocitos.3
El RHAR tipo 2 se desarrolla por mutaciones del gen ENPP1, ubicado en el cromosoma 6q23, que codifica la ectonucleótido pirofosfatasa/fosfodiesterasa 1 (ENPP1).2,6,16
Manifestaciones clínicas
Habitualmente, las alteraciones óseas no se presentan desde el nacimiento, sino durante la etapa de la niñez y aún en la edad adulta.3 En forma semejante a la variable de RHAD, los pacientes afectados pueden presentar crecimiento normal, en tanto que otros desarrollan deformidades óseas importantes (genu valgum) y retraso grave del crecimiento corporal.2
Laboratorio
Las alteraciones en sangre son semejantes a las observadas en los pacientes con RHLX. Se observan hipofosfatemia, normocalcemia, niveles elevados de fosfatasa alcalina, niveles normales o elevados del FGF-23 y niveles de 1α,25(OH)2D3 normales o inadecuadamente bajos.2,3,6
En orina, además de la hiperfosfaturia puede observarse excreción disminuida o normal del calcio (Cuadro 1).2
Tratamiento
El tratamiento es semejante al indicado en los pacientes con RHLX.
RAQUITISMO HIPOFOSFATÉMICO HEREDITARIO CON HIPERCALCIURIA
Se han descrito solamente casos esporádicos de pacientes con raquitismo hipofosfatémico hereditario con hipercalciuria (RHHH).48-53 La enfermedad fue inicialmente descrita en una población de origen beduino con altos índices de consanguinidad.4,48,54 Se ha definido el tipo de herencia como la variante autosómica recesiva.3,53
Genética
Se ha demostrado que el RHHH es causado por una mutación bialélica en el gen SLC34A3 ubicado en el cromosoma 9q34,54 el cual codifica para el cotransportador de sodio-fosfato tipo IIc (NaPi-IIc) en el túbulo proximal de la nefrona.3,55,56 Al parecer, estos pacientes comparten probablemente el mismo defecto genético que los pacientes con hipercalciuria idiopática, ya que ambas alteraciones han sido encontradas en los miembros de un mismo árbol familiar.1
Patogenia
En contraste con los casos de RHLX y RHAD, los pacientes con RHHH responden adecuadamente a la hipofosfatemia que presentan al incrementarse los niveles de la 1α,25(OH)2D3 en respuesta a la estimulación de la enzima 1α-hidroxilasa. La elevación de los niveles de la 1α,25(OH)2D3 induce la mayor absorción de calcio y fosfato del tracto gastrointestinal y la supresión de la secreción de la hormona paratiroidea. Además, ocurre hipercalciuria como consecuencia de los niveles elevados del metabolito activo de la vitamina D.54
Manifestaciones clínicas
Las principales manifestaciones clínicas del RHHH incluyen dolor óseo, deformidades esqueléticas, talla baja y debilidad muscular.54 Cuando la enfermedad se presenta desde la lactancia o en la niñez, son evidentes las alteraciones radiológicas del raquitismo.48 Los niveles séricos del FGF-23 no se encuentran elevados en los pacientes con RHHH, lo cual resalta el papel importante que tiene la hipofosfatemia como causa del retraso del crecimiento.2
Laboratorio
Las alteraciones bioquímicas en sangre del RHHH incluyen hipofosfatemia, concentración de calcio normal, aumento de la fosfatasa alcalina, valores disminuidos de la hormona paratiroidea y concentración elevada de la 1α,25(OH)2D3.53 Los niveles del FGF-23 en el suero se encuentran habitualmente normales, aunque pueden observarse elevados.56
En orina se demuestra la pérdida renal de fosfato, con reducción de la RTP y del TmP/VFG. La elevación de los niveles en suero de la 1α,25(OH)2D3 se asocia con un aumento importante de la excreción de calcio en la orina (Cuadro 1).53
Los pacientes afectados pueden desarrollar cuadro de litiasis renal recidivante y nefrocalcinosis.53,57
Tratamiento
La administración de la solución de fosfatos en los pacientes con RHHH induce mejoría del crecimiento, desaparición del dolor óseo, de la debilidad muscular y de los signos radiológicos del raquitismo. La concentración plasmática de fosfato aumenta y se observa la reducción de los niveles séricos de fosfatasa alcalina y la 1α,25(OH)2D3. Por otro lado, se observa disminución de la excreción urinaria de calcio, aunque no se modifican la RTP y el TmP/VFG.1 No se recomienda, en estos pacientes, la administración de la 1α,25(OH)2D3.53
REFERENCIAS
1. Velásquez JL. Alteraciones Hidroelectrolíticas en Pediatría. México: Editorial Prado; 2010. p. 328. [ Links ]
2. Santos F, Fuente R, Mejia N, Mantecon L, Gil-Peña H, Ordoñez FA. Hypophosphatemia and growth. Pediatr Nephrol 2013;28:595-603. [ Links ]
3. Bonnardeaux A, Bichet DG. Inherited disorders of the renal tubule. En: Taal MW, Chertow GM, Marsden PA, Skorecki K, Yu ASL, Brenner BM, eds. Brenner and Rector's The Kidney. Philadelphia: Elsevier Saunders; 2012. pp. 1584-1625. [ Links ]
4. Tenenhouse HS, Econs MJ. Mendelian hypophosphatemia. En: Scriver CR, Beaudet AL, Sly WS, Valle D, eds. The Metabolic and Molecular Bases of Inherited Diseases. New York: McGraw-Hill; 2001. pp. 5039-5967. [ Links ]
5. Velásquez JL, Dorantes AL, Ajuria ML. Raquitismo hipofosfatémico resistente a la vitamina D. Bol Med Hosp Infant Mex 1984;41:561-568. [ Links ]
6. Gattineni J, Baum M. Genetic disorders of phosphate regulation. Pediatr Nephrol 2012;27:1477-1487. [ Links ]
7. Mächler M, Frey D, Gal A, Orth U, Wienker TF, Fanconi A, et al. X-linked dominant hypophosphatemia is closely linked to DNA markers DXS41 and DXS43 at Xp22. Hum Genet 1986;73:271-275. [ Links ]
8. The HYP Consortium. A gene (PEX) with homologies to endopeptidases is mutated in patients with X-linked hypophosphatemic rickets. Nat Genet 1995;11:130-136. [ Links ]
9. Durmaz E, Zou M, Al-Rijjal RA, Baitei EY, Hammami S, Bircan I, et al. Novel and de novo PHEX mutations in patients with hypophosphatemic rickets. Bone 2013;52:286-291. [ Links ]
10. Morey M, Castro-Feijoó L, Barreiro J, Cabanas P, Pombo M, Gil M, et al. Genetic diagnosis of X-linked dominant hypophosphatemic rickets in a cohort study: tubular reabsorption of phosphate and 1,25(OH)2D serum levels associated with PHEX mutation type. BMC Med Genet 2011;12:116. [ Links ]
11. Schiavi CS, Kumar R. The phosphatonin pathway: new insights in phosphate homeostasis. Kidney Int 2004;65:1-14. [ Links ]
12. Takeda E, Taketani Y, Sawada N, Sato T, Yamamoto H. The regulation and function of phosphate in the human body. Biofactors 2004;21:345-355. [ Links ]
13. Bonewald LF, Wacker MJ. FGF23 production by osteocytes. Pediatr Nephrol 2013;28:563-568. [ Links ]
14. Safirstein R. Vitamin D receptor in bone regulates osteoclastogenesis, FGF23 production, and phosphate homeostasis. Kidney Int 2007;71:289. [ Links ]
15. Forster IC, Hernando N, Biber J, Murer H. Proximal tubular handling of phosphate: a molecular perspective. Kidney Int 2006;70:1548-1559. [ Links ]
16. Carpenter TO, Imel EA, Holm IA, Jan de Beur SM, Insogna KL. A clinician's guide to X-linked hypophosphatemia. J Bone Miner Res 2011;26:1381-1388. [ Links ]
17. Ariceta G, Langman CB. Growth in X-linked hypophosphatemic rickets. Eur J Pediatr 2007;166:303-309. [ Links ]
18. Liu S, Gupta A, Quarles LD. Emerging role of fibroblast growth factor 23 in a bone-kidney axis regulating systemic phosphate homeostasis and extracellular matrix mineralization. Curr Opin Nephrol Hypertens 2007;16:329-335. [ Links ]
19. Cho HY, Lee BH, Kang JH, Ha ILS, Cheong HI, Choi Y. A clinical and molecular genetic study of hypophosphatemic rickets in children. Pediatr Res 2005;58:329-333. [ Links ]
20. Roetzer KM, Varga F, Zwettler E, Nawrot-Wawrzyniak K, Haller J, Foster E, et al. Novel PHEX mutation associated with hypophosphatemic rickets. Nephron Physiol 2007;106:8-12. [ Links ]
21. Quarles LD. FGF23, PHEX, and MEPE regulation of phosphate homeostasis and skeletal mineralization. Am J Physiol Endocrinol Metab 2003;285:E1-E9. [ Links ]
22. Gattineni J, Baum M. Regulation of phosphate transport by fibroblast growth factor 23 (FGF23): implications for disorders of phosphate metabolism. Pediatr Nephrol 2010;25:591-601. [ Links ]
23. Schmitt CP, Mehls O. The enigma of hyperparathyroidism in hypophosphatemic rickets. Pediatr Nephrol 2004;19: 473-477. [ Links ]
24. Demay MB, Sabbagh Y, Carpenter TO. Calcium and vitamin D: what is known about the effects on growing bone. Pediatrics 2007;119:S141-S144. [ Links ]
25. Velásquez JL, Gordillo PG. Raquitismo dependiente de vitamina D tipo I: tratamiento con 1,25-dihidroxivitamina D. Bol Med Hosp Infant Mex 1984;41:36-40. [ Links ]
26. Pereira CM, de Andrade CR, Vargas PA, Coletta RD, de Almeida OP, Lopes MA. Dental alterations associated with X-linked hypophosphatemic rickets. J Endod 2004;30:241-245. [ Links ]
27. Mäkitie O, Kooh SW, Sochett E. Prolonged high-dose phosphate treatment: a risk factor for tertiary hyperparathyroidism in X-linked hypophosphatemic rickets. Clin Endocrinol (Oxf) 2003;58:163-168. [ Links ]
28. Vaisbich MH, Koch VH. Hypophosphatemic rickets: results of a long-term follow-up. Pediatr Nephrol 2006;21:230-234. [ Links ]
29. Velásquez JL. Raquitismo de origen renal. En: Meneghello RJ, ed. Diálogos en Pediatría. Santiago de Chile: Mediterráneo; 1995. pp. 225-230. [ Links ]
30. Mota HF, Velásquez JL. Trastornos Clínicos de Agua y Electrólitos. México: McGraw-Hill Interamericana; 2004. p. 143. [ Links ]
31. Quinlan C, Guegan K, Offiah A, O'Neill R, Hiorns MP, Ellard S, et al. Growth in PHEX-associated X-linked hypophosphatemic rickets: the importance of early treatment. Pediatr Nephrol 2012;27:581-588. [ Links ]
32. Alon US, Levy-Olomucki R, Moore WV, Stubbs J, Liu S, Quarles LD. Calcimimetics as an adjuvant treatment for familial hypophosphatemic rickets. Clin J Am Soc Nephrol 2008;3:658-664. [ Links ]
33. Cheung M, Roschger P, Klaushofer K, Veilleux LN, Roughley P, Glorieux FH, et al. Cortical and trabecular bone density in X-linked hypophosphatemic rickets. J Clin Endocrinol Metab 2013;98:E954-E961. [ Links ]
34. Bacchetta J, Salusky IB. Evaluation of hypophosphatemia: lessons from patients with genetic disorders. Am J Kidney Dis 2012;59:152-159. [ Links ]
35. Sun GE, Suer O, Carpenter TO, Tan CD, Li-Ng M. Heart failure in hypophosphatemic rickets: complications from high-dose phosphate therapy. Endocr Pract 2013;19:e8-e11. [ Links ]
36. McHenry CR, Mostafavi K, Murphy TA. Tertiary hyperparathyroidism attributable to long-term oral phosphate therapy. Endocr Pract 2006;12:294-298. [ Links ]
37. Savio RM, Gosnell JE, Posen S, Reeve TS, Delbridge LW. Parathyroidectomy for tertiary hyperparathyroidism associated with X-linked dominant hypophosphatemic rickets. Arch Surg 2004;139:218-222. [ Links ]
38. Mäkitie O, Doria A, Kooh SW, Cole WG, Daneman A, Sochett E. Early treatment improves growth and biochemical and radiographic outcome in X-linked hypophosphatemic rickets. J Clin Endocrinol Metab 2003;88:3591-3597. [ Links ]
39. Zivicnjak M, Schnabel D, Staude H, Even G, Marx M, Beetz R, et al; Hypophosphatemmic Rickets Study Group of the Arbeitsgemeinschaft für Pädiatrische Endokrinologie and Gesellschaft für Pädiatrische Nephrologie. Three-year growth hormone treatment in short children with X-linked hypophosphatemic rickets: effects on linear growth and body disproportion. J Clin Endocrinol Metab 2011;96:E2097-E2105. [ Links ]
40. Haffner D, Nissel R, Wühl E, Mehls O. Effects of growth hormone treatment on body proportions and final height among small children with X-linked hypophosphatemic rickets. Pediatrics 2004;113:e593-e596. [ Links ]
41. Zhang MY, Ranch D, Pereira RC, Armbrecht HJ, Portale AA, Perward F. Chronic inhibition of ERK1/2 signaling improves disordered bone and mineral metabolism in hypophosphatemic (Hyp) mice. Endocrinology 2012;153:1806-1816. [ Links ]
42. Wöhrle S, Henninger C, Bonny O, Thuery A, Beluch N, Hynes NE, et al. Pharmacological inhibition of fibroblast growth factor (FGF) receptor signaling ameliorates FGF23-mediated hypophosphatemic rickets. J Bone Miner Res 2013;28:899-911. [ Links ]
43. Baroncelli GI, Bertelloni S, Ceccarelli C, Saggese G. Effect of growth hormone treatment on final height, phosphate metabolism, and bone mineral density in children with X-linked hypophosphatemic rickets. J Pediatr 2001;138:236-243. [ Links ]
44. Imel EA, Hui SL, Econs MJ. FGF23 concentrations vary with the disease status in autosomal dominant hypophosphatemic rickets. J Bone Miner Res 2007;22:520-526. [ Links ]
45. Econs MJ, McEnery PT. Autosomal dominant hypophosphatemic rickets/osteomalacia: clinical characterization of a novel renal phosphate-wasting disorder. J Clin Endocrinol Metab 1997;82:674-681. [ Links ]
46. Kruse K, Woelfel D, Strom TM. Loss of renal phosphate wasting in a child with autosomal dominant hypophosphatemic rickets caused by a FGF23 mutation. Horm Res 2001;55:305-308. [ Links ]
47. Prié D, Friedlander G. Genetic disorders of renal phosphate transport. N Engl J Med 2010;362:2399-2409. [ Links ]
48. Tieder M, Modai D, Samuel R, Arie R, Halabe A, Bab I, et al. Hereditary hypophosphatemic rickets with hypercalciuria. N Engl J Med 1985;32:611-617. [ Links ]
49. Proesmans WC, Fabrey G, Marchal GJ, Gillis PL, Bouillon R. Autosomal dominant hypophosphataemia with elevated serum 1,25-dihydroxyvitamin D and hypercalciuria. Pediatr Nephol 1987;1:479-484. [ Links ]
50. Chen C, Carpenter T, Steg N, Baron R, Anast C. Hypercalciuric hypophosphatemic rickets, mineral balance, bone histomorphometry, and therapeutic implications of hypercalciuria. Pediatrics 1989;84:276-280. [ Links ]
51. Tieder M, Arie R, Bab I, Maor J, Liberman UA. A new kindred with hereditary hypophosphatemic rickets with hypercalciuria: implications for correct diagnosis and treatment. Nephron 1992;62:176-181. [ Links ]
52. Tieder M, Modai D, Shaked U, Samuel R, Arie R, Halabe A, et al. "Idiopathic" hypercalciuria and hereditary hypophosphatemic rickets. Two phenotypical expressions of a common genetic defect. N Engl J Med 1987;316:125-129. [ Links ]
53. Areses-Trapote R, López-García JA, Ubetagoyena-Arrieta M, Eizaguirre A, Sáez-Villaverde R. Hereditary hypophospahtemic rickets with hypercalciuria: case report. Nefrologia 2012;32:529-534. [ Links ]
54. Bergwitz C, Roslin NM, Tieder M, Loredo-Osti JC, Bastepe M, Abu-Zahra A, et al. SCL34A3 mutations in patients with hereditary hypophosphatemic rickets with hypercalciuria predict a key role for the sodium-phosphate cotransporter NaPi-IIc in maintaining phosphate homeostasis. Am J Hum Genet 2006;78:179-192. [ Links ]
55. Ichikawa S, Sorenson AH, Imel EA, Friedman NE, Gertner JM, Econs MJ. Intronic deletions in the SLC34A3 gene cause hereditary hypophosphatemic rickets with hypercalciuria. J Clin Endocinol Metab 2006;91:4022-4027. [ Links ]
56. Braithwaite V, Pettifor JM, Prentice A. Novel SLC34A3 mutation causing hereditary hypophosphataemic rickets with hypercalciuria in a Gambian family. Bone 2013;53:216-220. [ Links ]
57. Kremke B, Bergwitz C, Ahrens W, Schütt S, Schumacher M, Wagner V, et al. Hypophosphatemic rickets with hypercalciuria due to mutation of SLC34A3/NaPi-IIc can be masked by vitamin D deficiency and can be associated with renal calcifications. Exp Clin Endocrinol Diabetes 2009;117:49-56. [ Links ]
Nota
Este artículo puede ser consultado en versión completa en: http://www.medigraphic.com/BMHIM














