Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Boletín médico del Hospital Infantil de México
versión impresa ISSN 1665-1146
Bol. Med. Hosp. Infant. Mex. vol.65 no.1 México ene./feb. 2008
Artículo de Revisión
Apuntes para la historia de la enfermedad de Chagas en México
Notes for the history of Chagas' disease in Mexico
Óscar Velasco-Castrejón, Beatriz Rivas-Sánchez
Laboratorio de Medicina Tropical, Unidad de Medicina Experimental, Facultad de Medicina-UNAM, Hospital General de México, México, D. F., México.
Solicitud de sobretiros:
Dr. Óscar Velasco Castrejón,
Álvaro Obregón Núm. 12-303, Col.
Roma, C.P. 06700, México, D. F., México.
Fecha de recepción: 14-09-2007.
Fecha de aprobación: 12-12-2007.
Resumen
El trabajo intenta resumir los datos históricos más importantes sobre el conocimiento de la enfermedad de Chagas en México y su correlación con otros países latinoamericanos, desde el descubrimiento de los triatóminos, de los cuales se desconocía en ese entonces su capacidad de transmisión, hasta los recientes trabajos sobre eliminación de la transmisión vectorial y por hemotransfusión, así como los intentos de mejorar el diagnóstico de la enfermedad, utilizando métodos de biología molecular.
Entre los datos más importantes sobre México, se citan los de los descubrimientos de la enfermedad de Chagas, de los transmisores y reservorios, así como la forma en que la Campaña Nacional de Erradicación Palúdica, simultáneamente al control de la malaria, evitó que México se convirtiera en un país hiperchagásico, mediante los rociados periódicos intradomiciliarios con DDT y otros insecticidas, la existencia de Chagas visceral y congénito, así como otros datos seroepidemiológicos obtenidos por la encuesta serológica nacional, los de riesgo de transmisión de Trypanosoma cruzi por hemotransfusión, además de los principales trabajos de los autores mexicanos más reconocidos, desde Mazzotti hasta nuestros días. También se hace un reconocimiento al único investigador que ha logrado simultáneamente, descubrir al transmisor, al agente etiológico y a la enfermedad: Carlos Chagas.
Finalmente, en vista de que se están detectando casos frecuentes de miocardiopatía aparentemente chagásica negativos por serología y otros métodos diagnósticos a T. cruzi, y positivos, incluso por cultivo a Leptospira interrogans, se hace hincapié en el diagnóstico de esta bacteriosis en ese tipo de enfermos.
Palabras clave: Enfermedad de Chagas; triatóminos; DDT.
Abstract
This work attempts to summarize the most important historical data concerning knowledge on Chagas' disease in Mexico and its correlation with other Latin-American countries, from the discovery of triatomines, whose transmission capacity was unknown at the time to recent works that treat elimination forms of transmission by vectors and blood transfusion, as well as intents to improve disease diagnosis by means of molecular biology. Among the most important data on Mexico, we mention those related with the discovery of Chagas' disease and its disease transmitters and reservoir, and the manner in which the Campaña Nacional de Erradicacion Paludica simultaneously controls malaria and Chagas' disease, which avoided Mexico becoming to be a hyperchagasic country. This national campaign employed the method of periodic spraying of DDT and other insecticides within the population's households. Thus, we additionally have noted the existence of visceral and congenital Chagas' disease. Other important information comprises epidemiologic data obtained through the Encuesta Nacional Seroepidemiologica vs Enfermedad de Chagas and the Encuesta sobre el Riesgo de Transmision de Trypanosoma cruzi by Hemotransfusion, in addition to the mains works of the most widely recognized Mexican authors from Mazzotti to date. We also attempt to recognize herein the sole researcher who achieved simultaneous discovery of the disease's transmitter, its etiologic agent, and the disease itself: Carlos Chagas. Finally, in view of that fact that at present frequent detection has occurred of cases of cardiomyopathy apparently due to Chagas' disease that are, on the one hand, negative for serology test and other diagnostic means for T. cruzi and that on the other hand have been confirmed as positive for Leptospira interrogans by tests including Leptospira isolates, we emphasize the importance of diagnosing the presence of this bacteria in the previously mentioned type of patient.
Key words: Chagas' disease; triatomines; DDT.
En la actualidad se dice que los triatóminos son genéticamente resistentes al DDT, sin embargo, en muchas regiones del país, estos insectos desaparecieron tanto de la vivienda humana como de su entorno, merced al rociado sistemático con DDT de millones de viviendas situadas en las zonas palúdicas de México, llevado a cabo por la Campaña Nacional de Erradicación Palúdica (CNEP) iniciada en México en 1956.1 Este insecticida dejó de aplicarse en México y en muchos otros países del tercer mundo en 1999, para favorecer nuevos productos, supuestamente menos tóxicos, pero mucho más caros, por lo que los países pobres sólo pueden utilizarlos en forma selectiva, lo que ha ocasionado un nuevo incremento del problema de transmisión vectorial.2,3
Se debe recordar que durante muchos años, las personas de gran parte del país, fueron testigos de la desaparición de los triatóminos de sus viviendas, de tal manera que individuos menores de 4050 años residentes de algunas regiones endémicas, no los conocen hoy en día; en cambio sus padres, relatan, barrían decenas de ellos, uno o dos días después de la aplicación del insecticida (observaciones realizadas por Velasco-Castrejón durante sus múltiples viajes a las zonas endémicas de paludismo y Chagas).4
Debido a las continuas exageraciones que se propalaron sobre el DDT, particularmente sobre su toxicidad,2,5 y a las presiones internacionales para que no se aplicara, los países que lo utilizaban fueron orillados a usar los insecticidas sintéticos, mucho más caros, y al parecer menos efectivos, ya que es común que aproximadamente seis meses a un año después de la aplicación de éstos, se recupere la infestación de la vivienda y de su entorno por los triatóminos, lo que no ocurrió en muchas poblaciones palúdicas mexicanas, donde el DDT se roció cada seis meses, sin que se presentara toxicidad en los habitantes ni en los rociadores. Al respecto, Edwards,2 un connotado investigador y defensor del DDT, demostró la escasa toxicidad de este insecticida para el humano, ingiriendo una cucharada semanal del DDT en polvo durante mucho tiempo, sin presentar ningún problema de salud (Fig. 1), en contraposición con el libro de Carlson,5 The Silent Spring, el cual constituye una de las más importantes publicaciones anti-DDT.

LOS CRONISTAS
Seguramente, los pobladores autóctonos de América conocieron muy bien a los triatóminos y los diferenciaron perfectamente de aquellas chinches depredadoras y, particularmente, de las fitófagas (coreidos), de las cuales algunas especies, aún en la actualidad, les sirven de alimento. Es muy probable, además, que conocieran su capacidad vectorial, conocimiento que se perdió con la destrucción de tantos códices indígenas que los conquistadores pensaban fueron inspirados por fuerzas diabólicas. Entre tanta ignorancia de los conquistadores, llegaron algunos hombres preclaros, que luchando contra la inercia destructora del conquistador, no sólo evitaron la pérdida de algunos de ellos, sino que aportaron valiosos conocimientos científicos e históricos al describir muchos hallazgos y observaciones.
Entre los cronistas de Indias que escribieron sobre los triatóminos se cuentan: Francisco López de Gómara6 (1514) "Hay muchas garrapatas y chinches con alas" (El Darien, Panamá), posiblemente refiriéndose a Rhodnius pallescens o a Triatoma dimidiata.7
En 1523, Antonio de Herrera8 publicó: Francisco de Garay en Pánuco, Veracruz (México), el ejercito expedicionario fue víctima de... "molestias de los mosquitos i pitos, que pican y dejan señal como chinches, i suelen causar calenturas" (En algunos lugares a los triatóminos de América se les conoce como pitos, y probablemente Herrera, se refirió a T. dimidiata, común en esa región.
En 1535, Gonzalo Fernández de Oviedo9 dijo acerca de las Islas de Chara o San Lucas y Potosí (Golfo de Nicaragua): "Para mi fue cosa nueva y enojosa, de muchas chinches en los bohíos, con alas, e no parecen de día, ni avía pocas de noche, e son mas diligentes e prestas y enojosas que las de España, e pican mas mayores que aludas grandes... I estas chinches en toda la provincia de Nicaragua las hay". Sin embargo, en la época moderna, fue hasta 1949, cuando se describió el primer caso autóctono de enfermedad de Chagas en Nicaragua, y es hasta enton ces cuando se observaron chinches infectadas.7,10 Seguramente Gonzalo Fernández de Oviedo,9 se refirió a Rhodnius prolixus, común en la actualidad en esos lugares.
En 1569, Fray Bernardino de Sahagún,11 informó que en Nueva España: "hay muchas cucarachuelas que son pardillas y tienen dos maneras de alas con las que vuelan, son ponzoñosas, donde pican imprimen comezón e hinchazón...", informando que desde entonces la infestación de la vivienda y su entorno era común en México.
En 1590, Fray Ronaldo de Lizárraga,12 hizo la primera descripción de los triatóminos y sus hábitos hematófagos nocturnos en Argentina.
En 1591, Juan de Cárdenas,13 al tratar del reino de nueva Galicia, expresó: "Las chinches que llaman de compostela, en este Reino de la Nueva Galizia, mas enojosas y malas son que las arañas", posiblemente Triatoma picturata o Triatoma longipennis, comunes aún en esa región.
En 1773-1775, de Gueer, según Usinger,14 realizó la primera descripción científica de los triatomas (Triatoma rubrofasciata).
Felix de Azara,15 durante su estancia en Argentina (1781-1801), describió a los triatóminos argentinos y los llamó, por primera vez, vinchucas, nombre quechua que se popularizó grandemente en ese país, y más tarde en toda Sudamérica.
En 1811, Latreille16 describió a T. dimidiata y a Panstrongylus geniculatus, basado en los ejemplares capturados por Von Humboldt en Ecuador.
T. dimidiata, por otra parte, el triatómino más extendido en México, y posiblemente el más importante como transmisor, fue registrado en este país por Champion17 en 1899.
Aparentemente, la primera referencia en nuestro país sobre la existencia de triatóminos, posterior a los cronistas, fue realizada por Burmeister18 en 1835 y se trató de T. phyllosoma.
En 1848, Herich-Schaeffer,19 describió Conorhinus mexicanus (Triatoma mexicana) que ha tomado importancia en los últimos años.
De 1859 a 1900, Stal,20,21 hizo las contribuciones más importantes del siglo XIX sobre la sistemática de los triatóminos, al estudiar los géneros Rhodnius, Eratyrus y Belminus y otros muchos triatóminos.
ANTECEDENTES
Durante los siglos XVI y XVII, los colonizadores portugueses de Brasil sufrieron de mal do bicho, Mal do Engasso, o mal do culo, posiblemente problemas esofágicos y colónicos (megacolon) causados por Trypanosoma cruzi, y en el último caso, complicada por una parasitación masiva por helmintos.22-24
En 1882 murió Darwin de problemas cardiológicos, debidos posiblemente a tripanosomiasis americana, aparentemente contraída durantesus correrías científicas por América del Sur.25
LOS PRECURSORES
En 1909, Carlos Chagas, realizó la proeza nada común de descubrir el parásito (T. cruzi), uno de sus transmisores y la enfermedad causada por aquél, siendo la primera vez que se descubre el parásito y al transmisor antes que a la enfermedad. Lo anterior ocurrió en Lassance, Minas Gerais, Brasil (aquí es importante citar al Ing. ferroviario Cantarino Mota y al médico Belisario Perina, quienes le informaron a Chagas acerca de la existencia de los "barbeiros", chinches hematófagas que colonizaban las viviendas y se nutrían de animales y humanos mientras dormían).26-30 Un año antes, Chagas estudió una niña de dos años Berenice Soarez de Moura, de quien se sospechó paludismo, y en la cual observó por primera vez en un humano en América, tripanosomas móviles en la sangre periférica, que al ser teñidos con los colorantes de Romanouski, resultaron lo que más tarde llamaron T. cruzi. Previamente, en esa misma vivienda, Chagas había observado el mismo parásito en un gato.28
Esta niña estudiada cuando estaba muy grave, aparentemente "curó", desarrollando enfermedad de Chagas indeterminada y murió por otras causas a los 73 años de edad.29-31
Además del magno descubrimiento, Carlos Chagas y sus colaboradores iniciaron trabajos fundamentales para sentar las bases del conocimiento de esa enfermedad (Fig. 2).
Así, G. Vianna32 en 1911, describió las formas tisulares de T. cruzi y las lesiones anatomopatológicas del corazón en los casos de Chagas crónico.
Guerreiro y Machado,33 en 1913, ensayaron con éxito la reacción de fijación de complemento (RFC), para el diagnóstico serológico de la enfermedad de Chagas, la que después fue utilizada por múltiples autores para realizar serodiagnóstico y, desde luego, estudios seroepidemiológicos.
Mayer y Rocha-Lima,34 aclararon algunos aspectos de la anatomía patológica y de la evolución del parásito en los tejidos.
También en 1913, Brumpt,35,36 descubrió y describió el mecanismo de transmisión natural de T. cruzi (picadura y posterior contaminación de piel y mucosas por las deyecciones del triatómino), e inició el uso del xenodiagnóstico, fundando las bases para que, atendiendo a la rapidez de la defecación como principal factor y a la magnitud de la infestación de la vivienda humana, se iniciara la clasificación de los triatóminos como buenos y malos transmisores.
En 1914, Segovia,37 en El Salvador, describió el primer caso de enfermedad de Chagas agudo fuera de Brasil.
En 1919, Téjera38 describió los primeros casos en Venezuela y estudió a R. prolixusi, sin duda el transmisor más importante después de Triatoma infestans,38 que se distribuye geográficamente desde la parte norte del cono sur hasta Chiapas y Oaxaca en México.39-41
Un año después, el mismo autor descubrió Triasoma rangeli en R. prolixusi.42
En noviembre de 1934, murió súbitamente Carlos Chagas de un infarto masivo del miocardio,43 que sus familiares y alumnos deslindaron de T. cruzi.
En 1935, Cecilio Romaña,44 notable investigador argentino, describió el signo de puerta de entrada de T. cruzi (signo de Chagas, Mazza, Romaña),45 con lo que dio un gran impulso al estudio de la enfermedad de Chagas que había caído en el descrédito, porque Chagas, en su afán de desarrollar el conocimiento sobre la enfermedad, había incluido, como causadas por T. cruzi, entre otras enfermedades, al bocio endémico y al cretinismo, aparentemente por haber detectado a T. cruzi en la sangre periférica de algunos de estos enfermos, que sufrían, además, enfermedad de Chagas indeterminada.46
En 1939, Días y col.,47 iniciaron las primeras encuestas serológicas en Brasil, utilizando como prueba la RFC implementada por Guerreiro y Machado.33
Neiva,48 inició los estudios de la biología de los transmisores, Villela49 trabajó sobre los aspectos clínicos, y Ezequiel Días,50 estudió el cuadro hemático.
Gaspar Vianna describió, como asentamos líneas atrás, la imagen anatomopatológica de la enfermedad crónica.32
En 1940, 31 años después del descubrimiento de Chagas, Mazzotti51 realizó el descubrimiento de los dos primeros casos de enfermedad de Chagas en Tejomulco-Oaxaca, México.
En 1949, Laranja y col.52 iniciaron los primeros trabajos de electrocardiografía (ECG) en el diagnóstico de la enfermedad de Chagas y publicaron que ésta, incluso, podía ser diagnosticada por este medio.
En ese mismo año, Pellegrino53 alertó al mundo sobre el peligro de la transmisión de la enfermedad de Chagas por la transfusión sanguínea, al realizar las primeras comprobaciones serológicas sobre este hecho, mecanismo de transmisión, que se convirtió más tarde, en el segundo en importancia.
En 1950, Días y col.54 iniciaron un estudio integral sobre el cuadro clínico de la cardiopatía chagásica en Bambui, Brasil, una de las zonas de endemia tradicionales de la enfermedad de Chagas en ese país.
En 1953, Dao,55 en Venezuela, describió los primeros casos congénitos de enfermedad de Chagas.
En 1956, Köberle56 inició el estudio de la patogénesis de las complicaciones digestivas de la enfermedad de Chagas.
ANTECEDENTES EN MÉXICO
Hoffman,57 en 1928, publicó sobre la gran abundancia y domiciliación de T. dimidiata en Las Choapas, Veracruz.
En 1938, el mismo autor dio a conocer el que quizá fue el primer caso de enfermedad de Chagas en un mexicano oriundo de Veracruz (desmentido por Mazzotti).
Ese mismo año, Mazzotti51 describió los dos primeros casos reconocidos oficialmente de enfermedad de Chagas agudos en México, y dos años antes, observó por primera vez un triatómino infectado naturalmente por T. cruzi en este país (1936),58 y posteriormente, la infección en otros géneros y especies: T. pallidipennis, T. dimidiata (1937), R. prolixusi (1938), T. rubida (1938), así mismo, estudió la distribución geográfica de los triatóminos en el país, además de una nueva especie (T. hegneri)59 y coadyuvó al estudio y descubrimiento de múltiples especies en el país.40 Además, entre otras cosas, infectó garrapatas e inoculó ratones para estudiar el comportamiento en estos roedores. Una especie de Triatoma le fue dedicada en su honor: T. mazzotti.
Mazzotti, es sin duda, hasta la fecha, el chagólogo mexicano más destacado (Fig. 3).

En 1938, Bernal-Flandes60 publicó sobre transmisores y tripanosomátidos en Veracruz.
En 1949, Palomo-Erosa61 describió dos casos de enfermedad de Chagas en Yucatán.
En 1946, Laranja y col.,52 que habían sido invitados a un Congreso de Cardiología en México, realizaron a petición de Ignacio Chávez el primer estudio clínico-serológico en México (Apatzingán, Michoacán)62 y le dieron un gran impulso al estudio de la enfermedad de Chagas en este país, al ponerse en contacto con algunos de los primeros investigadores mexicanos, como Aguirre-Pequeño.63,64
En 1946, murió el reconocido investigador argentino Salvador Mazza de un infarto al miocardio, mientras estudiaba la enfermedad de Chagas en el estado de Nuevo León.
En 1959, Palencia y Montaño65 publicaron un caso de enfermedad de Chagas en Sonora, por aislamiento de T. cruzi, que constituye el caso agudo más septentrional descrito hasta ahora en el territorio mexicano.
En 1956-1967, Biagi y col.,66,67 y Tay y col.,68-70 del Departamento de Parasitología y Microbiología de la Facultad de Medicina de la Universidad Nacional Autónoma de México, realizaron varias microencuestas seroepidemiológicas en diferentes estados de México. Describieron los dos primeros casos de miocardiopatía chagásica comprobada parasitológicamente,71 y montaron la técnica de inmunofluorescencia indirecta para el diagnóstico de la enfermedad de Chagas, que sirvió para realizar una tesis de licenciatura; desafortunadamente, no la volvieron a usar, ya que en ese momento hubiese significado tecnología de punta en el diagnóstico de la enfermedad chagásica.72
En 1956, como se dijo anteriormente, la CNEP inició el rociado masivo de insecticidas de las zonas palúdicas que en México coinciden también con muchas de las áreas de endemia chagásica.1
En 1964, Tay y col.,68-70 aprovechando la amplia dispersión en el país de los pasantes de la Facultad de Medicina, realizaron un estudio sobre la distribución geográfica de los triatóminos en México, de la que más tarde se desprendieron múltiples trabajos.
En 1968, Tayocupó el puesto de Biagi, y trabajó sobre las mismas líneas de investigación, particularmente sobre virulencia de cepas mexicanas de T. cruzi, comandando el grupo de Parasitología de la Facultad de Medicina durante varios años.73
En la década de los años setenta, Goldsmith y col.74,75 realizaron importantes estudios seroepidemiológicos en Oaxaca y Chiapas. Zárate y Zárate,41,42 unos de sus alumnos, aportaron también brillantes estudios seroepidemiológicos, pero particularmente publicaron un estudio sobre la distribución geográfica de los triatóminos en México, que sigue siendo el trabajo mexicano más valioso sobre el particular.
En 1972-1974, Zavala-Velásquez y col.76,77 realizaron sendas encuestas: seroepidemiológica y de transmisores en el estado de Yucatán. En 1972, Zavala-Velásquez78 usó por primera vez el nifurtimox para el tratamiento de la enfermedad de Chagas en México, y hasta la fecha, Zavala-Velásquez continúa activo y es el chagólogo representativo de ese estado.
Al inicio de la década de los años setenta, Velasco-Castrejón y col.79,80 iniciaron el estudio de la enfermedad de Chagas en el estado de Jalisco, y publicaron los primeros estudios sobre esa enfermedad, independientemente de los reportes de casos de la CNEP.
En 1976, Tellaeche publicó en el Boletín informativo de la Dirección de Investigación de la Secretaría de Salud, casos de enfermedad de Chagas aguda descubiertos por los microscopistas de la CNEP.81
En 1976, Ortega y col.82 realizaron un estudio clínico-epidemiológico sobre la enfermedad de Chagas en Chiapas, en la que consignan la gran infestación de la vivienda humana por R. prolixusi, así como el elevado porcentaje de xenodiagnósticos positivos (76.7%) en León Brindis, Chiapas.
En 1978, el Instituto Nacional de Cardiología (INC) dio nuevas señales de vida en cuanto a enfermedad de Chagas, al ser publicado un artículo sobre cinco casos de esta entidad, comprobados y estudiados por Marcuschamer y Reyes.83
En 1979, Tay y col.84 publicaron un resumen sobre los conocimientos entomológicos, de reservorios, casos humanos y distribución geográfica en Jalisco, y en 1992, hace lo mismo a nivel nacional.85
En la década de los años ochenta, Velasco-Castrejón y Guzmán-Bracho,86 realizaron estudios seroepidemiológicos en diversas entidades federativas de México, entre los que destacan la detección de 25% de seroprevalencia en 4 200 muestras sanguíneas. Además del realizado en El Reparo, pequeña comunidad del municipio de Sayula, Jalisco, inmediatamente después de la muerte de dos niños por Chagas agudo, y en la cual se encontró 72% de seroprevalencia a T. cruzi, utilizando dos técnicas serológicas y en cuyo estudio se utilizaron por primera vez en México, antígenos estandarizados anti-T. cruzi, procedentes del Instituto Fatala Chabén de Argentina,87 se realizó el diagnóstico parasitológico del brote de Tuxcueca, uno de los más extraordinarios ocurrido en el mundo, donde enfermaron nueve de 12 individuos en sólo dos semanas. Los hallazgos de ese brote rompen las especulaciones matemáticas de Rabinovitch y col.,88 sobre el tiempo y el número de picaduras necesarias para infectar a una familia habitantes de una vivienda (Fig. 4).
Así mismo, en una vivienda cercana a la de los niños muertos en El Reparo, utilizando el método hora-hombre, después de aplicar un insecticida repelente, desprendiendo aproximadamente 1 m2 de adobe, encontraron en el entramado de una pared de bahareque de un cuarto que servía de dormitorio a dos muchachas y a cuatro perros, más de 150 triatóminos pertenecientes a tres especies diferentes: T. dimidiata, Triatoma longipennis y Triatoma barberi, compartiendo el nicho ecológico.89
RESERVORIOS
En 1944, Mazzotti40 describió un perro (Canis familiaris) infectado por T. cruzi en Oaxaca.
En 1947, Aguirre-Pequeño,64 descubrió el primer reservorio silvestre de T. cruzi en México, un tlacuache (Didelphis marsupialis) infectado en Nuevo León. Ese mismo año, Días,90 reportó un tlacuache infectado en el estado de Michoacán. Ese mismo reservorio ha sido estudiado ampliamente en Yucatán por Zavala-Velásquez y col.76 a partir de 1984.
En 1947, Aguirre-Pequeño64 describió un armadillo infectado en el estado de Nuevo León (Dasypus novemcintus).
Dos años después, Mazzotti y Dias91 redescribieron la infección en un armadillo.
Ese mismo año, Beltrán y Pérez-Reyes,92 describieron a la rata de alcantarilla (Ratus norvergicus) infectada por T. cruzi en la Ciudad de México.
En 1957, Biagi y col.,93 redescribieron al armadillo (Dasypus novemcinctus) infectado por T. cruzi.
En 1970, Velasco-Castrejón y col.94 describieron de nuevo al perro (Canis familiaris) parasitado por T. cruzi en Tepechitlán, Zacatecas, así como la gran infestación de una sala de cine por triatóminos (T. longipennis), que seguramente "picaban" a los cinéfilos dormidos durante la función, ya que al colectarlos, un día después, encontraron muchas chinches "repletas" de sangre humana.
En 1977, Zárate y col.95 describieron las preferencias alimentarias de 528 ejemplares de T. barberi: roedores cricétidos, roedores múridos, gatos, perros y bovinos.
En 1979, Tay y col.84 describieron ardillas de tierra (Sciurus vulgaris) y ratones (Mus musculus) infectados por T. cruzi en Jalisco.
En 1984, Aluja96 observó de nueva cuenta miocarditis por T. cruzi en un perro. Se trató de un cachorro de Samoyedo, cuyos hermanos de camada también murieron de miocarditis aguda, en la ciudad de Cuernavaca, Morelos, donde este tipo de defunciones es muy frecuente en cánidos, y la enfermedad en ellos es comúnmente transmitida por T. pallidipennis que comparte su ecotopo viviendo frecuentemente en el interior de sus perreras, donde puede observarse el ciclo biológico completo de esta chinche.97 Por otro lado, T. pallidipennis es muy mala transmisora de T. cruzi al hombre por no habitar la vivienda (sólo penetra por las noches) y ser defecadora tardía.
En un estudio realizado por Velasco-Castrejón,97 y Guzmán-Bracho98 en 1984, se descubrió que T. pallidipennis habita comúnmente los "caños" del drenaje doméstico de la vivienda en algunas poblaciones de Morelos conurbadas o no, con Cuernavaca, de donde por la noche penetran a la vivienda humana, para alimentarse de perros y humanos.
En 1986, Zárate y Zárate42 encontraron por primera vez en México, T. rangeli en R. prolixusi de Oaxaca y Chiapas.
En 1989, Cruz-Reyes99 describió a Phylander opossum parasitado por T. cruzi, en Los Tuxtlas, Veracruz.
En ese mismo año, Cortés, Velasco-Castrejón y col. describieron la infección de T. cruzi en vacas (Bos taurus) en el estado de Morelos, México, en las cuales se alimenta frecuentemente T. pallidipennis. Sin embargo, en Sudamérica, donde también ha sido encontrado infectado este animal, más que reservorio de T. cruzi se le considera un huésped transitorio e ineficiente, ya que al ser inoculado experimentalmente con cepas virulentas de T. cruzi, eliminan al parásito en forma rápida, quizá debido a mecanismos humorales o celulares de defensa (Fig. 5).10C
En 1997, se describió una curiosidad científica: la muerte de un oso polar por cardiopatía chagásica, comprobada parasitológicamente (Ursus maritimus) en un zoológico de la ciudad de Guadalajara. Esta comunicación fue realizada por Jaime-Andrade y col.101
Depredadores de T. cruzi
En 1944, Peláez102 describió en México a Telenomus fariai, parásito de los huevos de triatóminos, descrito originalmente por Costa-Lima103 en Brasil en 1927.
Triatomas mexicanos, distribución geográfica y descubridores de redúvidos, transmisores de T. cruzi en México
En México se han descrito hasta la fecha 34 especies de triatóminos, pertenecientes a siete diferentes géneros, aunque sin duda el género Triatoma (tres segmentos antenales, Laporte 1932), es con mucho el más abundante con 27 especies, con lo cual, esta entomofauna en México es, después de Brasil, la más rica en especies en América (Cuadro 1) (Fig. 5).
En México, los triatóminos se distribuyen en todas las entidades federativas, y han sido colectados desde el nivel del mar hasta los 2 400 m de altitud sobre el mismo (T. barberi, en Libres, Puebla, colectada en un estudio realizado por nuestro grupo en 1987).104 En el estado de Jalisco se distribuyen 11 especies, mientras que en los estados de Tabasco, Campeche, Aguascalientes y Tlaxcala, se distribuye una sola especie. Otros estados donde existen muchas especies son: Sinaloa con nueve, Nayarit y Veracruz con ocho.
Los últimos triatóminos descubiertos y descritos para México fueron: T. brailowski en 1984,105 T. bolivari en 1984,106 T. gomeznunesi en 1994, y T. bassolsae en 1995.107
Recientemente, Vidal y col.,108 del INDRE, ponen de relieve la numerosa presencia de T. mexicana en San Luis Potosí, estado que en los últimos años se ha convertido en uno de los principales focos de enfermedad de Chagas aguda.
Miocardiopatía chagásica crónica en México
En 1950, Perrín,109 del Instituto Nacional de Cardiología (INC), publicó el primer caso de miocardiopatía chagásica crónica en México como resultado del impulso dado por los investigadores brasileños Laranja y col.52 al estudio de la enfermedad de Chagas durante su estancia en este país. Después de unos años de bonanza, ese impulso desapareció y durante muchos años el INC, negó terminantemente la existencia de la miocardiopatía chagásica en México, impidiendo de esa manera mejorar el conocimiento de la enfermedad y el conocimiento y difusión entre los cardiólogos mexicanos, que al igual que sus maestros, negaron la existencia de esa enfermedad.
En 1964, Biagi y Gómez-Arce71 dieron un nuevo impulso al estudio de tripanosomiasis en México, al describir dos nuevos casos de miocardiopatía chagásica, diagnosticados por el hallazgo del parásito.
En 1979, Salazar-Schettino y col.110 describieron el tercer caso de miocardiopatía chagásica en México.
En 1983, Reyes y col.111 publicaron un artículo sobre miocardiopatía crónica por T. cruzi en Guerrero y Oaxaca.
En 1981, Tay y col.112 describieron el primer caso de megacolon mexicano por hallazgo de T. cruzi, y tres años después, Salazar-Schettino y col.113 describieron un nuevo caso mediante serología.
En ese año, Cortés y col.114 aislaron T. cruzi de cinco casos de miocardiopatía chagásica por xenodiagnóstico, procedentes de Oaxaca.
También en 1985, Velasco-Castrejón y Guzmán-Bracho86 realizaron un estudio en 13 individuos con Chagas indeterminado, de ambos sexos, de edades que oscilaron de los ocho a los 81 años, que años antes habían sido diagnosticados de Chagas agudo por observación de T. cruzi en sangre periférica, de lo que se desprende de que en México, dejando evolucionar naturalmente a los individuos infectados, un caso agudo puede evolucionar a miocardiopatía chagásica crónica tan temprano como cinco años después de padecer la fase aguda.
En ese mismo año, Cortés y col.114 publicaron el primer caso mexicano de miocardiopatía chagásica diagnosticado por xenodiagnóstico, que requirió la colocación de un marcapaso de demanda en México.
En 1986, ocurrió un brote extraordinario de enfermedad de Chagas en Tuxcueca, Jalisco. Este brote fue estudiado en forma integral por la Secretaría de Salud (SSa) de Jalisco y el Departamento de Parasitología del INDRE86 y publicado subrepticiamente por el grupo de Hernández y col.115 del Hospital Civil de Guadalajara, quienes sólo habían estudiado la parte clínica de los pacientes, la publicación refiere el descubrimiento de una nueva zona de endemia, cuando esa región era reconocida como tal, muchos años antes. Entre las inexactitudes que cometieron, fue el de observar T. cruzi en las ratas capturadas en esa vivienda, cuando en realidad los tripanosomas observados en ellas correspondieron a Triatoma lewisi, parásito común en las ratas, así como el de que los transmisores fueron T. pallidipennis y Triasoma phyllosoma intermedia (¿?), cuando la SSa de Jalisco había capturado y enviado al INDRE para su estudio, antes de que la vivienda fuera rociada con insecticidas, siete ejemplares de T. barberi, infectados con T. cruzi y dos ratas, infectadas con T. lewisi.86
En 1987, se publicó de la misma manera, el primer caso de síndrome de inmunodeficiencia adquirida (SIDA) y enfermedad de Chagas en un niño de Jalisco, que había sido estudiado y diagnosticado por el grupo de la Universidad de Guadalajara, y en especial por Trujillo.89
Ese mismo año, Velasco-Castrejón y Trujillo116 estudiaron el caso de una enfermera de 23 años de edad, nativa de Tuxcueca, Jalisco, que sufría de miocardiopatía y megacolon, positiva al xenodiagnóstico. En ese mismo artículo, los autores refirieron otros dos casos de megacolon provenientes de Tapachula, Chiapas y Oaxaca.116 En 1993, el grupo de la Universidad de Guadalajara describió otro caso de megaesófago chagásico en el estado de Jalisco.117
En 1994, Velasco, asociado a Estrada y Zaragoza, del Centro estatal de la transfusión sanguínea de la Paz, Baja California, refirieron el primer caso mortal de tripanosomiasis americana ocurrido en ese estado, transmitido por Dipetalogaster maximus (Fig. 6), chinche considerada curiosidad científica hasta entonces, por vivir debajo de las piedras ("chinche piedrera") y alimentarse principalmente de lagartijas, y que ahora, debido a la invasión de su ecosistema, ha sido colectada en viviendas de las colonias situadas a las afueras de la ciudad de la Paz, Baja California Sur.

En 1993-1994, Campos y col.,118 apoyados por personal de Entomología de la SSa del estado de Oaxaca, realizaron un estudio clínico-epidemiológico en la Costa Chica en población urbana y rural debidamente aleatorizada, encontrando una seroprevalencia de 9%.
En 1994, Mendoza-González y col.119 estudiaron 60 casos de miocardiopatía chagásica crónica procedentes de la Costa Chica de Oaxaca y Guerrero, entre los cuales 10% sufrían de dilatación esofágica y megacolon.
En 1994, Ruegsegger120 realizó seguimiento de chagásicos crónicos migrantes, mediante clínica, serología y electrofisiología. Estos pacientes procedían de Santa María Loxicha, Oaxaca, donde previamente habían sido diagnosticados por serología por el Departamento de Parasitología del INDRE, en un estudio de campo, realizado durante un curso sobre enfermedad de Chagas ofrecido por esta institución a la SSa de Oaxaca.
A partir de entonces, diversos grupos de investigadores y trabajadores de la salud han estudiado y publicado numerosos casos de miocardiopatía chagásica, efectividad de insecticidas a base de piretroides sintéticos, nuevas encuestas entomoseroepidemiológicas regionales y de hemodonadores, así como diversos estudios de biología molecular. Entre los investigadores nuevos más activos en este período se encuentran Rangel y col.,121 Ramsey y col.,122-125 Monteón-Padilla,126,127 Cruz y col.,128 Sosa y col.,129 Espinoza y col.,130 López y col.,131 Hernández y col.,132 Bosseno y col.,133 Dumonteil,134 Dumonteil y col.,135 y el grupo de la Escuela Nacional de Ciencias Biológicas, Instituto Politécnico Nacional.107,136-138
Chagas neonatal
En 1996, Guzmán-Bracho y col.139 describieron el primero y hasta ahora único caso publicado en nuestro país sobre enfermedad de Chagas congénita en México (Sahuayo, Mich.). Se trató de una recién nacida, femenina, febril, a quien al realizarse una biometría hemática se le descubrió el parásito en sangre. Este caso, que debiera haber sido el inicio de un programa nacional o regional paraelestudiode Chagas congénito, nunca tuvo eco, a pesar de que esta modalidad de la enfermedad chagásica debe ser muy común en las zonas de endemia mexicanas, tal como lo sugieren Ramsey y col.,123 al analizar la Encuesta Serológica Nacional realizada por Velasco-Castrejón y col.140 publicada en 1992.
Terapéutica
Desde 1983 se inició la terapia sistemática de la enfermedad de Chagas en México, con los dos fármacos antichagásicos clásicos, el nifurtimox y el benzimidazol, merced a la compra de un pequeño lote de esos medicamentos para la Sección Clínica del Instituto de Salubridad y Enfermedades Tropicales. Estos medicamentos habían sido ya ampliamente utilizados en el cono sur, particularmente en pacientes agudos, ya que se decía que no debería utilizarse en pacientes crónicos, si no se quería agravarlos seriamente, ya que existe una hipótesis sobre autoinmunidad en enfermedad de Chagas.141-143
En los últimos años, pese a que aún existen muchos defensores de esta teoría, hay grandes evidencias sobre su falsedad, particularmente debido al agravamiento que ocurre en el enfermo chagásico crónico cuando se le aplican inmunodepresores.144-146
Por lo tanto, en la actualidad ya no deben existir impedimentos para la terapia del enfermo crónico con estos fármacos. En México, después de tratar varias decenas de este tipo de pacientes con estos medicamentos, Velasco-Castrejón,147 ha observado mejoría clínica importante, particularmente cuando el enfermo cardiaco no responde a la terapia cardiológica sintomática. Además, nunca ha observado el agravamiento que se decía volvía prohibitivo el uso de estos fármacos. Lo anterior debería constituir una llamada de atención a las autoridades de la SSa de México para que revisen este capítulo y liberen el medicamento antichagásico para su uso en pacientes crónicos, particularmente cuando en los países endémicos, pese al control y al intento exitoso de la eliminación de la transmisión vectorial y por hemotransfusión, persisten millones de enfermos crónicos que no deben ser olvidados.148
Sin embargo, ninguno de estos medicamentos está cerca de ser el ideal, debido principalmente a los serios efectos colaterales que producen.
Este tema ha sido muy descuidado por los investigadores mexicanos, a grado tal que Nogueda-Torres y col.,136 de la Escuela Nacional de Ciencias Biológicas (ENCB), Instituto Politécnico Nacional, publicaron el primer artículo mexicano sobre el particular en 1991, y en 1997, López-Antuñano149 volvió a hacerlo, y hasta la fecha es el mexicano más enterado sobre ese rubro.
Por otro lado, Zavala-Castro y col.,150 estudiando el perfil proteico del kinetoplasto de T. cruzi, trataron de encontrar blancos potenciales para nuevos medicamentos. Es importante mencionar que en la actualidad, el nifurtimox, que había sido retirado del mercado por una disposición de la Organización Mundial de la Salud (OMS), está de nuevo a disposición de los enfermos mexicanos distribuido por la SSa en forma gratuita, ya que el benzimidazol, que supuestamente tiene una eficacia igual o mayor que el primero, por su nula actividad anti-amastigote, no es de ninguna manera el antichagásico más recomendado.
Sobre ese particular, Melchor y col.,151 han producido en México, con éxito, el nifurtimox, para realizar estudios en ratones con leishmaniasis experimental, por lo que se podría, posteriormente y después de las pruebas necesarias, pasar al uso humano.
Biología molecular
En 1992, Zavala y col.152 publicaron el primer trabajo sobre biología molecular de T. cruzi en México, demostrando la heterogeneidad de los aislados mexicanos.
A partir de esa fecha, Escobedo y col.,153 y Ramos y col.,154 han trabajado sobre este tema, y principalmente Espinosa y col.130 También con el objetivo de crear una vacuna específica.153,154 Espinosa y col.130 han laborado particularmente sobre los genotipos de T. cruzi, encontrando que casi todos los aislados mexicanos pertenecen al grupo 1, y que el grupo 2, mayormente virulento, es muy poco frecuente en México.132,133 Este grupo correspondería a las cepas Z2 y Z3 de Miles y col.,155 quienes encontraron que la cepa Z2 es la causante de megavísceras digestivas en las regiones central y oriental de Brasil, donde estas visceromegalias son comunes, y no existen en Venezuela ni Centroamérica. Sin embargo, sí parecen distribuirse en algunas regiones de México, donde se han detectado casos de megacolon y megaesófago chagásicos (Oaxaca, Chiapas, Jalisco), y debe ser frecuente en la Costa Chica de Guerrero y Oaxaca, donde 10% de los 60 pacientes con miocardiopatía crónica estudiados por Mendoza-González y col.,119 presentaron visceromegalias digestivas.
Por otro lado, Barrera y col.,156 analizando el perfil molecular de las cepas yucatecas de T. cruzi, demostraron su separación filogenètica de las del resto del país. En el año 2002, Zavala-Castro y col.150 estudiaron el perfil proteico del kinetoplasto del epimastigote de T. cruzi, en busca de blancos potenciales para la producción de medicamentos anti-T. cruzi, como se mencionó en el capítulo anterior.
Antecedentes históricos del programa de erradicación de la transmisión de T. cruzi en América Latina
El programa pionero se inició a fines de 1940 en Minas Gerais, Brasil, basándose en la mejoría de la vivienda y el rociado intradomiciliario de insecticidas.157
Durante el sexenio 1975-1981, se realizó la primera Encuesta Seroepidemiológica Nacional (Brasil). En 1978-1979, Segura y col.158 de Argentina, publicaron una encuesta sobre seroprevalencia nacional de Chagas en reclutas militares.
De 1980-1985 se realizaron estudios seroepidemiológicos en nueve países que poseían escasa información sobre su endemia chagásica, auspiciados por el TDR: Chile, Colombia, Ecuador, Honduras, Nicaragua, Panamá, Perú y Uruguay, usando un protocolo estandarizado.159
De 1987 a 1993 se desarrolló un programa común para la adquisición y utilización de nuevos equipos para el control de vectores en estudios de campo multinacionales para asegurar eficacia y bajos costos.159
En 1988 a 1989, Velasco-Castrejón y col.,140 realizaron la Encuesta Seroepidemiológica Nacional sobre enfermedad de Chagas en 66 678 muestras de población abierta de todo el país, en población urbana y rural, de todas las edades; muestra diseñada para obtener la representatividad del total de la población mexicana (Encuesta Seroepidemiológica Nacional). Las edades de los individuos muestreados estuvieron comprendidas entre 1 y 98 años. El resultado de la seroprevalencia fue de 1.6% de positividad, que equivale a 1 472 000 infectados.
Este trabajo, para los epidemiólogos entendidos, constituyó un verdadero parteaguas sobre el conocimiento de la enfermedad de Chagas en México, ya que por primera vez se demostró la distribución geográfica y la importancia real de esta enfermedad en el país. Para realizar este estudio, se elaboró el primer antígeno mexicano estandarizado para el diagnóstico de anticuerpos vs T. cruzi, con la asesoría de Elsa Segura, entonces directora del Instituto Fatala Chabén de Argentina.
Ese mismo año, el grupo de la Universidad de Guadalajara realizó una encuesta seroepidemiológica en el estado de Jalisco.160
En el período de 1987-1990 se produjeron por parte del INDRE, antígenos estandarizados para iniciar el diagnóstico serológico para el control de hemodonadores en los Bancos de Sangre mexicanos, a la vez que se realizaron diversos cursos de capacitación a nivel nacional para preparar a los encargados y técnicos de laboratorio para el diagnóstico de esta enfermedad en sus respectivas entidades federativas.
En 1991 ocurrió el lanzamiento de la iniciativa de los países del cono sur para la interrupción de la transmisión vectorial y hemotransfusional de T. cruzi (Fig. 7).161
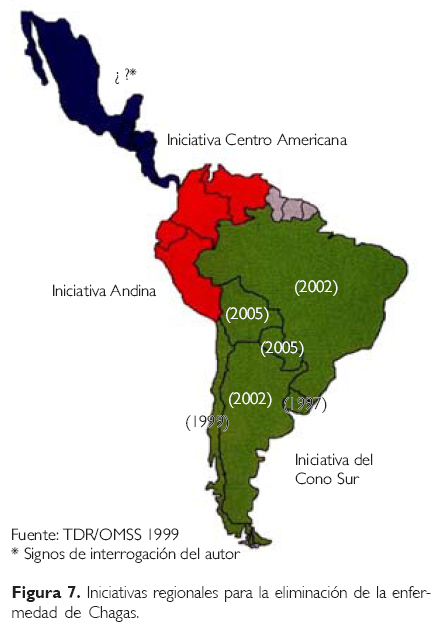
En 1997 se realizó el lanzamiento de la Iniciativa de los Países Andinos162 y Centroamericanos163 para iniciar la interrupción de la transmisión de T. cruzi. En ésta, México fue invitado pero no envió ningún representante.
En 1997, Uruguay fue certificado libre de transmisión vectorial y transfusional de T. cruzi.164
En 1999, Chile fue certificado libre de transmisión vectorial.165
En el año 2000, algunas provincias de Brasil fueron certificadas libres de transmisión.166
Las estrategias utilizadas para la eliminación vectorial y por hemotransfusión de T. cruzi, que sin duda han sido muy exitosas, se resumen en la figura 8.
Antecedentes de eliminación de la transmisión de T. cruzi por hemotransfusión
En 1949, Pellegrino53 identificó hemodonadores infectados (Belo-horizonte).
En 1950, Freitas y col.,167 identificaron hemorreceptores infectados.
En 1972, Cerisola y col.,168 demostraron seropositividad elevada en hemofílicos multitransfundidos.
En 1978, Goldsmith y col.169 reportaron 4.4% de seropositividad en hemodonadores en la ciudad de Oaxaca, en el primer estudio sobre hemodonadores y enfermedad de Chagas realizado en México.
En 1985, el grupo del INDRE, utilizando antígeno comercial argentino, estudió hemodonadores del Centro Nacional de la Transfusión Sanguínea, encontrando 0.67% de seropositividad.170
Posteriormente, en 1987, ya con antígeno estandarizado producido en México, Velasco-Castrejón y col.,171 estudiaron hemodonadores de la ciudad de Acapulco, Guerrero, encontrando 11.2% de seropositividad en los hemodonadores familiares y 19% en los remunerados, lo que habla del peligro de haber sido hemotransfundido en ese tiempo en esa ciudad.
En 1987, Monteón-Padilla y col.,126 encontraron 2% de seropositividad en hemodonadores del Distrito Federal.
En 1989, el grupo del INDRE, asociados a Salinas del Banco de Sangre del Hospital Rubén Leñero, encontraron seroprevalencia de 2% en los hemodonadores de ese hospital.
En 1991, García,172 encontró seroprevalencia de 1% en 2 115 hemodonadores de la Cruz Roja Mexicana en el Distrito Federal.
En 1995, en un taller sobre el control de calidad de la sangre en bancos de sangre de la Ciudad de México, auspiciado por la OMS y la SSa,173 Velasco-Castrejón174 propuso que "como debido a la elevada migración de campesinos a las principales ciudades de México, la enfermedad de Chagas se distribuye a nivel nacional, por lo tanto, no sólo debe realizarse el tamizaje serológico anti-T. cruzi en las consideradas zonas endémicas, sino en la totalidad de este país".
De 1996 a 1997, Guzmán-Bracho y col.,175 realizaron una encuesta en 64 969 hemodonadores mexicanos procedentes de 18 entidades federativas de México, encontrando una seroprevalencia de 1.5%, observándose que algunas de las ciudades que reciben migrantes campesinos tuvieron mayor seroprevalencia que la observada en las zonas llamadas endémicas.
En el año 2001, la SSa y el Comité Interinstitucional de Bancos de Sangre acordaron la OBLIGATORIEDAD DEL TAMIZAJE anti-T. cruzi en bancos de sangre mexicanos, esta Norma fue publicada en el año 1992 en el Diario Oficial de México, pero hasta la fecha es incumplida, como en general es ignorado el grave problema chagásico en México.148,176,177
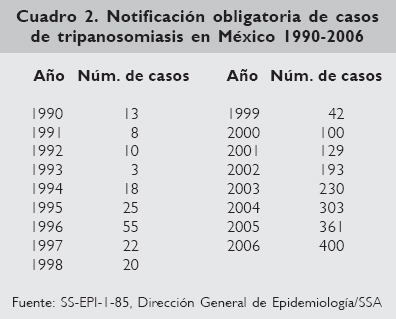
También en 1990 se hizo obligatoria la notificación de los casos de enfermedad de Chagas en México.
Como se puede observar en el cuadro 2, a pesar del gran desconocimiento, y del escaso interés por la notificación de casos de enfermedad de Chagas, éstos se han incrementado año con año.
Tripanosomiasis o leptospirosis
Es común que los estudiosos de enfermedad de Chagas, observen pacientes clínica y epidemiológicamente con "enfermedad de Chagas típica" pero con serología, cultivo, xenodiagnóstico y otras pruebas diagnósticas para ésta negativas, que les crean confusión.
Este hecho fue estudiado por Novoa-Montero178 en las regiones rurales de Venezuela, quien no encontró asociación significativa entre infección chagásica y miocardiopatía crónica, dando lugar a la aceptación de la existencia de miocardiopatía crónica indiferenciada o miocarditis venezuelensis, descrita años atrás por diversos patólogos venezolanos, entidad de la que no pudieron precisar su etiología, pero que de ninguna manera atribuyeron a T. cruzi.179-184
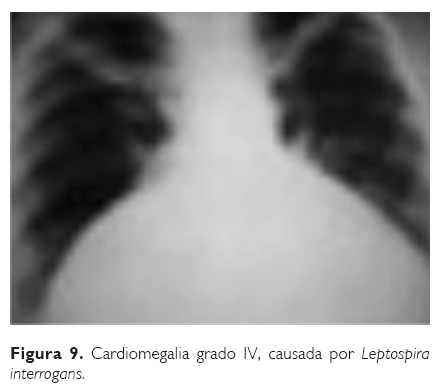
Nuestro nuevo grupo (Laboratorio de Medicina Tropical, UME, UNAM-Hospital General de México), ha encontrado frecuentemente la presencia de Leptospira en sangre, orina y otros fluidos orgánicos148,185 en este tipo de pacientes, que además, han mejorado con la aplicación de medicamentos específicos contra esa enfermedad. Entre ellos, se estudió un caso de miocardiopatía con cardiomegalia grado IV, sospechoso de padecer miocardiopatía chagásica crónica, internado en un hospital general, quien murió con el diagnóstico histopatológico de miocardiopatía idiopática y fue negativo a todas las pruebas para detectar T. cruzi, incluyendo los hallazgos histológicos. Este paciente había presentado previamente síntomas y signos muy sugestivos de leptospirosis, además de haberle sido aislado Leptospira pomona de sangre periférica antes de su muerte (Fig. 9).184
Por lo anterior, creemos un deber alertar a los estudiosos de la enfermedad de Chagas de que muchos de los casos de miocarditis venezuelensis o miocarditis idiopática en nuestros países, se pueden deber a la infección crónica por Leptospira interrogans, por lo cual se deben enviar las muestras de este tipo de pacientes a laboratorios especializados para su diagnóstico y tratamiento correctos.
Palavras pronunciadas pelo professor Cecilio Romaña Perante o túmulo de Carlos Chagas no dia 5-7-1959
Señores:
Estamos aquí reunidos en esta gran ciudad, orgullo de América, para celebrar el descubrimiento de una grave endemia: genial hallazgo, realizado por un glorioso americano.
Nada más natural que nuestro primer gesto sea llegarnos hasta su tumba y decirle al maestro: levantaos y venid con nosotros que aún necesitamos de vuestro espíritu para completar la obra, que precisamos de vuestro corazón para elevarla, de vuestra sonrisa indulgente para humanizar nuestro trabajo, y de vuestra cultivada elocuencia para darle el énfasis que necesita. Venid que celebraremos juntos el esfuerzo y las luchas de vuestro descubrimiento, apenas acrecentado por pequeño labor nuestro.
REFERENCIAS
1. Academia Nacional de Medicina: Simposium sobre la lucha palúdica en el mundo y en México. Gac Med Mex. 1975; 6: 389-408. [ Links ]
2. Edwards G. Mosquitos, DDT and human health. 21st Century. Sci Technol. 2002; 15: 16-32. [ Links ]
3. Roberts D, Curtis C, Tren R, Sharp B, Sheff C, Bate R. Malaria control and public health. Emerg Infect Dis. 2004; 10: 1170-1. [ Links ]
4. Goldsmith RS, Zárate RJ, Zárate LG, Kagan I, Jacobson LB, Morales G. Estudios clínicos y epidemiológicos de la enfermedad de Chagas en Oaxaca, México, y un estudio complementario de siete años. 1. Cerro del Aire. Bol Sanit Panam. 1986; 2: 100. [ Links ]
5. Carlson R. The silent spring. New York: Miffin ed.; 1958. [ Links ]
6. López-de Gomara F. Hispania Victrix. Historia General de las Indias. Parte 1 y 2. En: "Biblioteca de autores españoles. Historiadores primitivos de Indias", editor. Madrid, España: Real Academia Española; 1946. [ Links ]
7. León LA. Contribución a la historia de los transmisores de la enfermedad de Chagas. An Congr Ind D Chagas. 1962; 3: 761-70. [ Links ]
8. Herrera A. Historia General de los hechos Castellanos en las Islas y Tierra firme del Mar Océano. Década 3a. Libro V. Cap. V. Buenos Aires, Argentina: Ed. Guarania; 1944. p. 265. [ Links ]
9. Fernández-de Oviedo y Valdez G. Historia General y Natural de las Indias, Islas y Tierra firme del Mar Océano. Tomo VII. Cap. XXI. Buenos Aires, Argentina: Ed. Guarania; 1944. p. 271-2. [ Links ]
10. Zeledón R. Los vectores de la enfermedad de Chagas en América. Simposio Internacional sobre enfermedad de Chagas. Buenos Aires: Sociedad de Parasitología de Argentina; 1972. p. 327-45. [ Links ]
11. Sahagún-Fray B. Historia Natural de las cosas de la Nueva España. México: Ed. Porrúa; 1989. p. 87-92. [ Links ]
12. Lizárraga-Fray R. Descripción breve de toda la tierra del Perú, Tucumán, Río de la Plata y Chile. En: "Historiadores de Indias". Tomo II. Madrid, España; 1909. p. 544-645. [ Links ]
13. Cárdenas Juan de. Primera parte de los problemas y secretos maravillosos de las Indias. En: Ocharte P, editor. 2a ed. México: Museo Nacional de Arqueología; 1913. p. 183. [ Links ]
14. Usinger RL. The triatomine of North and Central America and the West Indies and their public health significance. Washington, USA; 1944. p. 2-3. [ Links ]
15. Azara Felix de. Voyages dan L'Amerique Meridionale. Chap. VI. Paris; 1809. p. 208-9. [ Links ]
16. Latreille PA. Insectes de I'Amerique recueilles pendant le voyage de MM. de Humboldt et Bonpland. En: Humboldt A, Bonpland A, editores. Voyage aux regions equinoxiales du noveau continent. Recueil d'observations de Zoologie et d'anatomie comparée faites dans I'Ocean Altantique, dans I'interieur do nouveau continent et dans la mer du Sud. Paris, France; 1811. p. 197-397. [ Links ]
17. Champion GC. Insecta Rhynchota. Hemiptera-Heteroptera. En: Godwin and Salvin, editores. Biologia Centrali Americana. London; 1899. Vol. 2. p. XVI-416. [ Links ]
18. Burmeister H. Handbuch der Entomologie. Part 1; 1835. Vol. 2. p. iv-400. [ Links ]
19. Herrich-Schaeffer GAW. Die Wanzenartigen Insecten. Vol. 8. Nürnberg; 1848. p. 130. [ Links ]
20. Stal C. Hemiptera Fabriciana. Fabricianska Hemipterarter, efter de I Kopenhamn och kiel forvarade typexemplarem granskade och Beskrifne. I. K. Sven Vetensk Akad Handl. 1868; 7: 1-148. [ Links ]
21. Stal C. Enumeratio Hemipterorum, II. K. Sven Vetensk Akad Handl. 1872; 10: 110-2. [ Links ]
22. Guerra F. American trypanosomiasis. An historical and a human lesson. J Trop Med Hyg. 1970; 73: 105-18. [ Links ]
23. Martínez-Palomo A. Carlos Chagas, o la fuerza de la voluntad. En: Ciencia, Salud y Desarrollo. Capítulo X. México: El Colegio Nacional; 1996. p. 117-25. [ Links ]
24. Almeida-Prado A. Mal de engaso ou doença de Chagas? (Bloqueio A-V total) São Paulo Médico. 1945; 18: 95-112. [ Links ]
25. Darwin C. Viaje de un naturista alrededor del mundo. Tomo II. cap XV. Barcelona, España: Ed. Iberia; 1932. p. 45. [ Links ]
26. Chagas C. Nova tripanosomiase humana. Estudos sobre a morfologia e o ciclo evolutivo do Schizotrypanum cruzi n. gen., sp., agente etiologico de nova entidade morbida do homen. Mem Inst Osw Cruz. 1909; 1: 158-218. [ Links ]
27. Chagas C. Nova especie morbida do homen, produzida por um Trypanosoma (Trypanosoma cruzi). Nota previa. Brasil Medico. 1909; 23: 161. [ Links ]
28. Chagas C. Aspecto clinico da nova entidade morbida produzaida pelo Schizotrypanum cruzi. Brasil Medico. 1910; 24: 263-5. [ Links ]
29. Lewinsohn R. 1922- "Prophet in His Own Country: Carlos Chagas and the Nobel Prize" Perspectives in Biology and Medicine. Autumn. 2003; 46: 532-49. [ Links ]
30. Haro AI de. Algunos hechos históricos relacionados con la enfermedad de Chagas. Rev Mex Patol Clin. 2003; 50: 109-12. [ Links ]
31. De Lana M, Chiari CA, Chiari E, Morel CM, Gonçalves AM, Romanha AJ. Characterization of two isolates of Trypanosoma cruzi obtained from the patient Berenice, the first human case of Chagas' disease described by Carlos Chagas in 1909. Parasitol Res. 1996; 82: 257-60. [ Links ]
32. Vianna G. Contribuição para o estudo da anatomia patologica da molestia de Carlos Chagas. Esquizotripanose humana ou Tireodite parasitaria. Mem Inst Oswaldo Cruz. 1911; 3: 276-94. [ Links ]
33. Guerreiro C, Machado A. Da reação de Bordet-Gengou na molestia de Carlos Chagas como lemento de diagnóstico. Brasil Medico. 1913; 23: 225. [ Links ]
34. Mayer M, Rocha-Lima H. Zum verhalten von Schizotrypanum cruzi im warm blutern un arthropoden. Arch Schiffs Tropenhyg. 1914; 18: 101-1036. [ Links ]
35. Brumpt E. Le Xenodiagnostique. Application au diagnostic de quelques infections parasitaires et en particullier á la trypanosomose de Chagas. Bull Soc Pathol Exot. 1914; 7: 706. [ Links ]
36. Brumpt E. Precis de parasitologie. Paris: Libraries de I'Academie de Medicine; 1949. Vol II. p. 1220. [ Links ]
37. Segovia JC. Un caso de tripanosomiasis. Arch Hosp Rosales (San Salvador). 1913; 8: 249-54. [ Links ]
38. Tejera E. La trypanosomose americaine ou maladie de Chagas au Venezuela. Bull Soc Pathol Exot. 1919; 12: 509-13. [ Links ]
39. Mazzotti L. Triatomineos de México y su infección natural por T. cruzi. Chagas Med (Mex). 1940; 20: 95. [ Links ]
40. Mazzotti L. Comentario sobre la distribución geográfica de algunas de las especies de Triatomineos que existen en México. Rev Inst Salubr Enferm Trop (Mex). 1962; 22: 75-8. [ Links ]
41. Zarate LG, Zarate RJ. A checklist of the triatominae (Hemiptera: Reduviidae) of Mexico. Internat J Entomol. 1985; 27: 102-27. [ Links ]
42. Zarate LG, Zarate RJ. T. rangeli y T. cruzi in Rhodnius prolixus in Chiapas, Mexico. En: Molecular and Biochemical Parasitology. Abstract of the 5th International Congress of Parasitology. Toronto, Canada: Elsevier Biomedical Publ.; 1982. p. 299. [ Links ]
43. Pinto D. 2005. (Comunicación personal). [ Links ]
44. Romaña C. Acerca de un síntoma inicial de valor para el diagnóstico de forma aguda de la enfermedad de Chagas. La conjuntivitis esquizotripanósica unilateral (Hipótesis sobre la puerta de entrada conjuntival de la enfermedad). MEPRA (Buenos Aires). 1935; 22: 16-28. [ Links ]
45. Dias E. O sinal de Romaña e sua influência na evolução no estuda dos conhecimmentos sobre a molestia de Chagas. Brasil Medico. 1939; 53: 965-70. [ Links ]
46. Chagas C. Molestia de Carlos Chagas ou Thyroidite parasitaria. Nova doença humana transmitida pelo berbeiro (Chonorhinus megistus). Manguinhoos: Segunda Conferencia na Acad Nal Med.; 1911. p. 28. [ Links ]
47. Dias E, Laranja FS, Nobrega G. Doença de Chagas. Mem Inst Oswaldo Cruz. 1945; 43: 495-581. [ Links ]
48. Neiva A. Informacoes sobre a biolojia da Vinchuca, Triatoma infestans klug. Mem Inst Oswaldo Cruz. 1913; 5: 24-31. [ Links ]
49. Villela E. Molestia de Chagas. Descrição clinica, 1a. Parte. Fhola Medica. 1923; 4: 33-5. [ Links ]
50. Dias E. Molestia de Carlos Chagas. Estudos hematologicos. Mem Inst Oswaldo Cruz. 1912; 4: 34-61. [ Links ]
51. Mazzotti L. Dos casos de enfermedad de Chagas en el estado de Oaxaca. México. Gac Med Mex. 1940; 70: 417-20. [ Links ]
52. Laranja FS, Dias E, Nobrega G. O electrocardiograma na cardiopatia cronica da doença de Chagas. II Congreso Interamericano de Cardiología. Tomo III. México, D. F.: Edición del Instituto Nacional de Cardiología; 1948. p. 1470-7. [ Links ]
53. Pellegrino JA. Transmissao doença de Chagas pela transfusao de sangue. Rev Brasil Med. 1949; 6: 5. [ Links ]
54. Dias E, Laranja FS, Pellegrino J. Estudos sobre a importancia social da doença de Chagas I. Inquerito clinico epidemiologico nas vizinhancas de Bambui, Oeste de Minas. Brasil Medico. 1948; 62: 412-3. [ Links ]
55. Dao LL. La enfermedad de Chagas en el distrito de Aragua (estado Anzoategui, Venezuela). Rev Policlin Caracas. 1949; 14: 17-32. [ Links ]
56. Köeberle F. Patología y anatomía patológica de la enfermedad de Chagas. Bol Oficina Sanit Panam. 1961;51: 404-28. [ Links ]
57. Hoffman CC. Nota acerca de un probable transmisor de la tripanosomiasis humana en el estado de Veracruz. Rev Mex Biol. 1928; 8: 12-8. [ Links ]
58. Mazzotti L. Investigación sobre la existencia de la enfermedadde Chagas en el país. Demostración de tripanosomasen los reduvideos transmisores. Medicina (Mex).1936; 16: 584-5. [ Links ]
59. Mazzotti L. Estudios sobre T. hegneri. I. Infección naturaly experimental con T. cruzi. II Intento de cruzamiento con T. dimidiata. Rev Inst Salub [ Links ]
60. Bernal-Flandes F. Anotaciones sobre triatomas y Trypanosoma. Rev Med Veracruzana. 1938; 18: 2533-8. [ Links ]
61. Palomo-Erosa E. Triatoma dimidiata (lat) de Yucatán. Algunas consideraciones sobre su prevalencia, distribución biológica e infección por Trypanosoma cruzi. Med Rev Mex. 1940; 361: 175-7. [ Links ]
62. Dias E, Laranja FS, Nobrega G. Clínica y terapéutica de la enfermedad de Chagas. Med Rev Mex. 1948; 28: 224-36. [ Links ]
63. Dias E, Perrin TG, Brenes M. Nota previa sobre las primeras comprobaciones serológicas de la enfermedad de Chagas en México. Arch Inst Cardiol Mex. 1949; 17: 20-4. [ Links ]
64. Aguirre-Pequeño E. Presencia de Trypanosoma cruzi en mamíferos y triatomideos de Nuevo León. Arch Med Mex. 1947; 5: 350-8. [ Links ]
65. Palencia L, Montaño R. Un nuevo caso de tripanosomiasis en México. Rev Fac Med (Mex). 1959; 1: 737-40. [ Links ]
66. Biagi FF. Enfermedad de Chagas en Tutuapan, Estado de México. Prensa Med Mex. 1956; 21: 463-5. [ Links ]
67. Biagi FF, Tay J, Guzmán-García C, Fong PF. Tetitlán, Guerrero, foco endémico de enfermedad de Chagas en México. Rev Fac Med (Mex). 1964; 6: 625-31. [ Links ]
68. Tay J, Goycolea O, Biagi FF. Observaciones sobre enfermedad de Chagas en la Mixteca Baja, nuevo caso humano en la República Mexicana. Bol Oficina Sanit Panam (USA). 1961; 51: 322-7. [ Links ]
69. Tay J, Navarrete CE, Corominas ER, Biagi FF. La enfermedad de Chagas en el municipio de Tuxpan estado de Michoacán, México. Rev Fac Med (Mex). 1966; 8: 263-70. [ Links ]
70. Tay J. Localidades de triatóminos mexicanos y su infección natural por Trypanosoma cruzi. Medicina. 1969; 49: 35-41. [ Links ]
71. Biagi F, Gómez-Arce E. Los dos primeros casos de miocardiopatía chagásica, comprobados en México. Arch Inst Cardiol Mex. 1965; 35: 611-23. [ Links ]
72. Biagi FF, Tay J, Martinez MR. La reacción de inmunofluorescencia en el diagnóstico de la enfermedad de Chagas. Bol Oficina Sanit Panam (USA). 1964; 57: 237-40. [ Links ]
73. Tay J, Gutiérrez QM, Salazar–Schettino PM. Estudios sobre seis cepas mexicanas de T. cruzi. Rev Invest Salud Publica (Mex). 1973; 33: 67-76. [ Links ]
74. Goldsmith RS, Kagan IG, Zárate CR, Reyes GMA, Cedeño FJ. Estudios epidemiológicos de la enfermedad de Chagas en Oaxaca, México. Bol Oficina Sanit Panam. 1979; 87: 1-7. [ Links ]
75. Goldsmith RS, Ortega M, Zárate RJ, Zárate LG, Beltrán F. Encuestas seroepidemiológicas de la enfermedad de Chagas en Chiapas, México. Arch Invest Med. 1983; 14: 43-50. [ Links ]
76. Zavala-Velázquez J, Panzón CJ, Flores CM, Damián CAG. La enfermedad de Chagas en Yucatán. Estudio serológico en humanos y animales. Salud Publica Mex. 1984; 26: 254-9. [ Links ]
77. Zavala-Velázquez J. Enfermedad de Chagas en Yucatán (1972-74). CONACYT: Informe final del proyecto 027; 1972. [ Links ]
78. Zavala-Velázquez JE. La enfermedad de Chagas en el estado de Yucatán, México (1940-2002). Rev Biomed. 2003; 14: 35-43. [ Links ]
79. Velasco-Castrejón O, Luna VA, García J. Estudio clínico y epidemiológico de un nuevo caso humano de enfermedad de Chagas en Jalisco, México. Prensa Med Mex. 1970; 35: 438-40. [ Links ]
80. Velasco-Castrejón O, Tay J, Luna VA. La enfermedad de Chagas en el estado de Jalisco: República Mexicana. Presentación de tres nuevos casos humanos. Rev Invest Salud Publica (Mex). 1974; 34: 107-13. [ Links ]
81. Dirección General de Investigación en Salud Pública. Hallazgos de tripanosomas (Schizotrypanum) en muestras de sangre tomadas a febriles del área palúdica de México. Boletín informativo. Vol. 7 y 8. México, D. F.: Dirección General de Investigación en Salud Pública, SSA; 1976. [ Links ]
82. Ortega GM, Beltrán HF, Zavala-Velázquez J. Enfermedad de Chagas en Chiapas. Estudios clínicos epidemiológicos. Salud Publica Mex. 1976; 18: 837-43. [ Links ]
83. Marcuschamer MJ, Reyes LP. Enfermedad de Chagas en México. Reporte de 5 casos comprobados. Arch Inst Cardiol Mex. 1978; 48: 952-66. [ Links ]
84. Tay J, Salazar-Schettino PM, Velasco M, Haro I, de García YY, Gutiérrez QM. Estudio epidemiológico de la enfermedad de Chagas en el estado de Jalisco. Salud Publica Mex. 1979; 21: 145-9. [ Links ]
85. Tay J, Schenone H, Sanchez JT, Robert L. Estado actual de los conocimientos sobre la enfermedad de Chagas en la República Mexicana. Bol Chil Parasitol. 1992; 47: 43-53. [ Links ]
86. Velasco-Castrejón O, Guzmán-Bracho C. Importancia de la enfermedad de Chagas en México. Rev Latinoamer Microbiol. 1986; 28: 275-83. [ Links ]
87. Velasco-Castrejón O, Ramírez J, Sánchez B, Trujillo F, Guzmán BC. La enfermedad de Chagas en Jalisco. Rev Mex Parasitol. 1989; 2: 29-32. [ Links ]
88. Rabinovitch JE, Leal JA, Feliciangeli MD. Domiciliary biting frequency and blood ingestion of the Chagas disease vector Rhodnius prolixus Stal in Venezuela. Trans R Soc Trop Med Hyg. 1979; 73: 272-83. [ Links ]
89. Velasco-Castrejón O, Guzmán-Bracho C, Cruz RJ, López OO, González DF. La enfermedad de Chagas. Publ Tec INDRE No. 8. . México, D. F.: Dirección General de Epidemiología, SSa; 1991. [ Links ]
90. Dias E. Importancia continental da doença de Chagas. Brasil Medico. 1948; 62: 217-9. [ Links ]
91. Mazzotti L, Dias E. Resumen de los datos publicados sobre la enfermedad de Chagas en México. Rev Soc Mex Hist Nat. 1949; 10: 103-11. [ Links ]
92. Beltrán E, Pérez-Reyes J. Hallazgo de Schizotrypanum cruzi en una rata (Rattus novergicus) en la Ciudad de México. Rev Inst Salub Enf Trop. 1950; 10: 235-8. [ Links ]
93. Biagi FF, Pérez TR, Goycolea O, Tay J. Estado actual de nuestros conocimientos sobre la enfermedad de Chagas en México II. Infección en vertebrados. An Congreso Internacional Sobre doença do Chagas. Rio de Janeiro; 1959. p. 383-402. [ Links ]
94. Velasco-Castrejón O, Romero LR, Mendiola GJ, Brambila CA. Contribución al conocimiento de la enfermedad de Chagas en México. Observaciones epidemiológicas en Tepechitlán, Zacatecas. Rev Invest Salud Publica. 1970; 30: 197-204. [ Links ]
95. Zarate LG, Zarate CR, Tempelis CH, Goldsmith RS. The biology and behavior of Triatoma barberi (Hemiptera: Reduviidae) in Mexico. I. Blood meal sources and infection with Trypanosoma cruzi. J Med Entomol. 1980; 17: 103-6. [ Links ]
96. Aluja SA. Miocarditis por Trypanosoma cruzi en un perro. Vet Mex. 1985; 15: 41-4. [ Links ]
97. Velasco-Castrejón O. Estado actual de la enfermedad de Chagas en México. Seminario Internacional de Parasitología Animal. AMPVE-SARH. Morelos, México: 1986. p. 40-69. [ Links ]
98. Guzmán-Bracho C. Enfermedad de Chagas en Progreso, Jiutepec, Morelos. I. Encuesta seroepidemiológica. Tesis de Especialidad. Inst Salub Enf Trop Mex. 1985. [ Links ]
99. Cruz-Reyes A. Phylander opossum Congreso Nacional sobre enfermedad de Chagas, Tepic, Nayarit, México: 1989. [ Links ]
100. Pinto-Dias JC, Rodrigues-Coura J. Clínica e terapêutica da doença de Chagas. Uma abordagem práctica para o clínico geral. Rio de Janeiro, Brasil: Editora Fiocruz; 1997. [ Links ]
101. Jaime-Andrade JG, Ávila D, Lozano KFJ, Hernández GRJ, Magallón GE, Kasten MMJ, et al. Acute Chagas' cardiopathy in a polar bear (Usrsus maritimus) in Guadalajara, Mexico. Rev Soc Brasileira Med Trop. 1997; 30: 337-40. [ Links ]
102. Peláez D. Algunas notas sobre el hallazgo en México de un microhimenóptero parásito de los huevos de Triatoma pallidipennis (Stäl). Ciencias. 1944; 5: 29. [ Links ]
103. Costa-Lima AM de. Sur le Telenomus fariai nouveau parasite endophage des oeufs de Triatoma megista Burm. Comptes Rendus Sci Mem Soc Biol. 1927; 97: 1350. [ Links ]
104. Xicotencatl MC, Márquez ACR. Estudio serológico y entomológico de la enfermedad de Chagas en San Juan Atenco, Puebla (tesis). Puebla, México: Escuela de Ciencias Químicas; 1987. [ Links ]
105. Martínez A, Carcavallo RU, Pelaez D. Triatoma brailovskyi, nueva especie de triatominae de México. Chagas. 1984; 1: 39-42. [ Links ]
106. Carcavallo R, Galindo-Giron I, Jurgerg J, Lent H. Atlas of Chagas disease vectors in the Americas. Rio de Janeiro, Brasil: Ed. Fiocruz; 1998. [ Links ]
107. Alejandre AR, Nogueda TB, Cortéz JM, Jurberg J, Galvao C, Carvallo R. Triatoma balssolsae sp. n. do México, com uma chave para as espécies do complexo "phyllosoma" (Hemiptera, Reduviidae). Mem Inst Oswaldo Cruz. 1999; 94: 353-9. [ Links ]
108. Vidal AV, Martínez CC, Ibáñez BS. Infección natural de chinches Triatominae con Trypanosoma cruzi asociadas a la vivienda humana en México. Salud Publica Mex. 2000; 42: 496-503. [ Links ]
109. Perrín M. La cardiopatía chagásica. Arch Inst Cardiol Mex. 1950; 20: 31-49. [ Links ]
110. Salazar-Schettino PM, Castrejón J, Rodríguez H, Tay J. Miocarditis chagásica crónica en México. Tercer caso comprobado por exámenes parasitoscópicos. Prensa Med Mex. 1979; 44: 115-20. [ Links ]
111. Reyes P, Mendoza M, Marcushamer MJ, García Z. Miocardiopatía congestiva y tripanosomiasis americana (estudio clínico y serológico). Salud Publica Mex. 1983; 2: 139-44. [ Links ]
112. Tay J, Salazar–Schettino PM, Ontiveros A, Jiménez J. Estudio epidemiológico de enfermedad de Chagas en una población de Oaxaca. Primer caso de megasigmoides en México. Parasitol (Mex). 1985; 1: 17-24. [ Links ]
113. Salazar-Schettino PM, Tay J, Bucio MI, Haro I, de Anzures ME, Flores AG. Primer caso de megaesófago con serología positiva a Trypanosoma cruzi. Rev Invest Salud Publica (Mex). 1984; 26: 452-5. [ Links ]
114. Cortés JM, Velasco-Castrejón O, Labastida MH, Melchor AH, Duarte N, de Torre R. La enfermedad de Chagas en Santiago Yosotiche, Oaxaca, México. SaludPublica Mex. 1985; 27: 60-5. [ Links ]
115. Hernández MI, Ericsson CH, Delgadillo C, Paredes P, Paredes M. New focus of Chagas disease in Mexico. Lancet. 1987; 1: 100. [ Links ]
116. Velasco-Castrejón O, Trujillo F. La visceromegalia digestiva por T. cruzi en México. Med Cult (Mex). 1990; 5: 4-7. [ Links ]
117. Ocampo-González S, López LS, Gálvez GB, Trujillo CF, Covarrubias PA. Megaesófago chagásico con serología y xenodiagnóstico positivo. Rev Gastroenterol (Mex). 1993; 58: 36-8. [ Links ]
118. Campos SA, Díaz AA, Velasco-Castrejón O, Guzmán BC, Rodríguez EA. Situación epidemiológica de la tripanosomiasis americana en la Costa de Oaxaca. Informe Técnico Final. Oaxaca, México: Colegio Médico de Oaxaca "Dr. Aurelio Valdivieso" A.C.; 1996. [ Links ]
119. Mendoza-González J de D, Miranda LIE, Velasco-Castrejón O, Tinoco RO, Maciela P, Made J. Cardiopatía chagásica crónica. Presentación de 60 casos. Arch Inst Cardiol Mex. 1995; 65: 546-50. [ Links ]
120. Ruegsegger RGL. Información sobre la enfermedad de Chagas en San Agustín, Loxicha, Oaxaca. Publicación personal. [ Links ]
121. Rangel H, Gatica R, Ramos C. Detection of antibodiesagainst Trypanosoma cruzi in donors from a blood bankin Cuernavaca, Morelos, Mexico. Arch Medical Res.1998; 29: 79-82. [ Links ]
122. Ramsey JM, Alvear AL, Ordóñez R, Muñoz G, GarcíaA, López R, et al. Risk factors associated with houseinfestation by the Chagas disease vector Triatoma pallidipennisin Cuernavaca metropolitan area, Mexico. MedVet Entomol (England). 2005; 19: 219-28. [ Links ]
123. Ramsey JM, Ordoñes R, Tello LA, Phols JL, Sánchez V,Peterson AT. Actualidades sobre la epidemiología de la enfermedad de Chagas en México. En: Ramsey JM,Tello-López A, Pohls JL, editores. Iniciativa para la vigilancia y el control de la enfermedad de Chagas en la República Mexicana. Cuernavaca, México: Instituto Nacional de Salud Pública; 2003. p. 85-103. [ Links ]
124. Ramsey JM, Schofield CJ. Control of Chagas diseasevectors. Salud Publica Mex. 2003; 45: 123-8. [ Links ]
125. Ramsey JM. Distribution of domestic triatominae andstratification of Chagas' disease transmission in Oaxaca,Mexico. Med Vet Entomol. 2000; 14: 19-30. [ Links ]
126. Monteón-Padilla VM, Guzmán-Bracho C, Floriani VJ,Ramos EA, Velasco-Castrejón O, Reyes PA. Diagnóstico serológico de la enfermedad de Chagas: autosuficiencia y concordancia interlaboratorios. Salud PublicaMex. 1995; 37: 232-5. [ Links ]
127. Monteón-Padilla VM, Vargas AG, Vallejo AM, ReyesPA. Miocardiopatía dilatada. La cardiopatía chagásicacrónica en el Instituto Nacional de Cardiología "Ignacio Chávez". Arch Cardiol Mex. 2002; 72: 148-52 [ Links ]
128. Cruz RD, Reyes PA, Monteón PVM, Ortiz MAR, VargasAG. MHC class I and class II genes in mexican patientswith Chagas disease. Human Immunol. 2004; 65: 60-5. [ Links ]
129. Sosa JF, Mazariego-Arana M, Hernández BN, Garza MV,Cárdenas M, Reyes PA, et al. Electrocardiographic findingsin Mexican chagasic subjects living in high andlow endemic regions of Trypanosoma cruzi infection.Mem Inst Oswaldo Cruz. 2003; 98: 605-10. [ Links ]
130. Espinosa B, Vera-Cruz JM, González H, Ortega E, HernándezR. Genotype and virulence correlation withinMexican stocks of Trypanosoma cruzi isolated from patients.Acta Trop. 1998; 15: 63-72. [ Links ]
131. López OV, Pérez NN, Piñero D, Ortega E, HernándezR, Espinosa B. Biological characterization and geneticdiversity of Mexican isolates of Trypanosoma cruzi. ActaTrop. 1998; 69: 239-54. [ Links ]
132. Hernández R, Herrera J, Bosseno MF, Brenière, EspinozaB. Trypanosoma cruzi: Data supporting in Mexican stocks. J Parasitol. 2001; 87: 1178-81. [ Links ]
133. Bosseno MF, Bernabé Ch, Magallón GE, Lozano KF, Ramsey J, Espinoza B, et al. Predominant of Trypanosoma cruzi lineage I in Mexico. J Clin Microbiol. 2002; 40: 627-32. [ Links ]
134. Dumonteil E. Update on Chagas'disease in Mexico.Salud Publica Mex. 1999; 41: 322-7. [ Links ]
135. Dumonteil E, Gourbiere S, Barrera PM, Rodríguez FE, Ruiz PH, Baños LO, et al. Geographic distribution of Triatoma dimidiata and transmission dynamic of Trypanosoma cruzi in the Yucatan Peninsula of Mexico. Am J Trop Med Hyg. 2002; 67: 176-83. [ Links ]
136. Nogueda-Torres B, Baeza RI, Wong RC. Orientación actual de la quimioterapia de la enfermedad de Chagas. Acta Medica. 1991; 27: 37-56. [ Links ]
137. Martínez A, Barcenas ONM, Nogueda-Torres B, Alejandre AR, Lino RM, Magallón GE, et al. Role of two Triatoma (Hemiptera: Reduviidae: Triatomae) species in the transmission of Trypanosoma cruzi (Kinetoplastida: Trypanosomatidae) to man in the West Coast of Mexico. Mem Inst Oswaldo Cruz. 2001; 96: 141-4. [ Links ]
138. Mazaraiego-Arana MA, Ramírez SJE, Alejandre AR, Nogueda- Torres B. Activity and residual effect of two formulations of lambdacyhalothrin sprayed on palm leaves to Rhodnius prolixus. Mem Inst Oswaldo Cruz. 2002; 97: 353-7. [ Links ]
139. Guzmán-Bracho, La Huerta C, Velasco-Castrejón O. Chagas disease first congenital case report in Mexico. Arch Med Res. 1998; 29: 195-6. [ Links ]
140. Velasco-Castrejón O, Valdespino JL, Tapia CR, Salvatierra B, Guzmán BC, Magos C, et al. Seroepidemiología de la enfermedad de Chagas en México. Salud Publica Mex. 1992; 34: 186-96. [ Links ]
141. Cossio PM, Diez C, Szarfman A, Kreutzer E, Candiolo B, Arana RM. Chagasic cardiopathy. Demonstration of a serum gamma globulin factor witch reacts with endocardium and vascular structures. Circulation. 1974; 49: 13-21. [ Links ]
142. Acosta AM, Santos-Buch CA. Autoimmune myocarditis induced by Trypanosoma cruzi. Circulation. 1985; 71: 1256-61. [ Links ]
143. Engman DM, León JS. Pathogenesis of Chagas heart disease: role of autoimmunity. Acta Trop. 2002; 81: 123-32. [ Links ]
144. Davila DF, Rossel RO, Donis JH. Cardiac parasympathetic and abnormalities: cause or consequence of Chagas heart disease. Parasitol Today. 1989; 5: 327-9. [ Links ]
145. Tarleton R, Downs M, Zhang L. Chagas disease: Associated heart damage not due to autoimmune reactions. Vaccine Weekly. 1997; 22: 7-8. [ Links ]
146. Kierszembaum F. Chagas' disease and the autoimmunity hypothesis. Clin Microbiol Rev. 1999; 12: 210-23. [ Links ]
147. Velasco-Castrejón O. La enfermedad de Chagas en México. Infectol. 1992; 12: 783-91. [ Links ]
148. Velasco-Castrejón O. La enfermedad de Chagas, contribuciones del INDRE y de la clínica de Medicina Tropical para su estudio, tratamiento, control y eliminación de la transmisión de T. cruzi. Primer encuentro internacional sobre enfermedad de Chagas en México. 1999. [ Links ]
149. López-Antuñano FJ. The chemotherapy of infections by Trypanosoma cruzi (quimioterapia de las infecciones producidas por Trypanosoma cruzi). Salud Publica Mex.1997; 39: 463-71. [ Links ]
150. Zavala-Castro JE, Acosta VK, Guzmán ME, Rosado BME, Rosales EJL. Stage specific kinetoplast DNA-binding proteins in Trypanosoma cruzi. Acta Trop. 2000; 76: 139-46. [ Links ]
151. Melchor P, Pozas R, Velasco-Castrejón O, Carballo JA, Rivas-Sánchez B, Reyes LJ. Síntesis y evaluación de la actividad leishmanicida de 5-nitrofuranos. México: XXXIII Congreso Mexicano de Química. Fortín de las Flores, Veracruz. 26 de octubre; 1998. [ Links ]
152. Zavala CJ, Velasco CO, Hernández R. Molecular characterization of Mexican stocks of Trypanosoma cruzi using total DNA. Am Trop Med Hyg. 1992; 47: 201-9. [ Links ]
153. Escobedo OFJ, Rosales-Encina JE, Ramírez SMJ, Arjona TAD, Dumonteil E. Inmunización y tratamiento terapéutico con una vacuna de DNA que codifica para el antígeno TSA-1 de Trypanosoma cruzi. México, D. F.: Memorias- Primer Encuentro Internacional sobre Enfermedad de Chagas en México. Noviembre; 1999. p. 85. [ Links ]
154. Ramos LA, López MA, Talamás RP, Rosales-Encina JL. Am230 de Trypanosoma cruzi induce la producción de óxido nítrico por macrófagos. México, D. F.: Memorias- Primer Encuentro Internacional sobre Enfermedad de Chagas en México. Noviembre; 1999. p. 87. [ Links ]
155. Miles MA, Cedillos RA, Povoa MM, Souza AA, Pratz AA, Macedo V. Do radically dissimilar T. cruzi strains (Zimodems) cause Venezuelan and Brazilian forms of Chagas disease? Lancet. 1981; 10: 1338-40. [ Links ]
156. Barrera PMA, Rodríguez FME, Guzmán ME, Zavala-Velazquez J, Dumontiel E. Biological behavior of three strains of Trypanosoma cruzi from Yucatan, Mexico. Rev Biom. 2001; 12: 224-30. [ Links ]
157. Dias E, Laranja FS, Pellegrino J. Estudos sobre a importanciasocial da doença de Chagas. Inquerito clínicoepidemiológico feito nas vizinhanças de Bambui. Minas Gerais. Brasil Medico. 1948; 62: 412-3. [ Links ]
158. Segura EL, Pérez AC, Yanowsky JF, Andrade J, Wynne GJ. Disminución en la prevalencia de infección por Trypanosoma cruzi, en hombres jóvenes de la Argentina. Bol Oficina Sanit Panam. 1980; 100: 493-510. [ Links ]
159. Moncayo A. Chagas disease: Current epidemiological trends after the interruption of vectorial and transfusional transmission in the Southern Cone Countries. Mem Inst Oswaldo Cruz. 2003; 98: 577-91. [ Links ]
160. Trujillo CF, Lozano KF, Soto MM, Hernández GR. The prevalence of Trypanosoma cruzi infection in blood donors in the state of Jalisco, Mexico. Rev Soc Bras Med Trop. 1993; 26: 89-92. [ Links ]
161. WHO Control of Chagas disease. Report of a WHO Expert Committee. WHO Tech Report Ser. 1991; 811: 1. [ Links ]
162. OPS/OMS. Informes de las iniciativas de los países andinos 1997, Bogotá, febrero y Tegucigalpa, octubre; 1997. [ Links ]
163. OPS/OMS. Informe de la IV reunión de la Comisión Intergubernamental de la Iniciativa de Centroamérica. Cd. de Panamá; 2001. [ Links ]
164. UNDP/World bank/WHO. Uruguay declared free of Chagas disease transmission. TDR News. 1998; 56: 6. [ Links ]
165. WHO. Chagas disease, interruption of transmission in Chile. Wkly Epidemiol Rec. 1999; 2: 9-11. [ Links ]
166. WHO. Chagas disease, interruption of transmission in Brazil. Wkly Epidemiol Rec. 2000; 19: 153-5. [ Links ]
167. Freitas JLP, Biancalana A, Amato N. Primeiras verificacoes de transmissao accidental de molestia de Chagas ao homen por transfusao de sangre. Rev Paul Med. 1952; 30: 36-40. [ Links ]
168. Cerisola JA, Rabinovitch A, Álvarez M, Di Corleto CA, Pruneda J. Enfermedad de Chagas y la transfusión de sangre, Bol Oficina Sanit Panam. 1982; 73: 203-21. [ Links ]
169. Goldsmith RS, Zárate CR, Kagan IG. El potencial de transmisión en la enfermedad de Chagas por transfusión sanguínea: Hallazgos serológicos entre donadores en el estado de Oaxaca. Salud Publica Mex. 1978; 22: 439-44. [ Links ]
170. Toledo I. Seroprevalencia de anti-T. cruzi en hemodonadores del Centro Nacional de la Transfusión Sanguínea. Tesis de licenciatura. Fac. C. Químicas, UNAM. México; 1986. [ Links ]
171. Velasco-Castrejón, Gudiño I, Tinoco O, Guzmán BC. Prevalencia serológica de la enfermedad de Chagas en hemodonadores de Acapulco, Gro. Rev Asoc Mex Bioq Clin. 1987; 12: 53. [ Links ]
172. García RMG. Determinación de anticuerpos contra T. cruzi en hemodonadores de la Cruz Roja Mexicana. Tesis de Licenciatura. Fac. C. Químicas, UNAM. México; 1992. [ Links ]
173. Schmunis G. Taller sobre el control de calidad de la sangre, en bancos de sangre de México. Cocoyoc, Morelos, México: OMS, SSa. Cocoyoc; 1995. [ Links ]
174. Velasco-Castrejón O. Estudio Centinela para T. cruzien hemodonadores mexicanos. Taller sobre el control de calidad de la sangre en bancos de sangre de México. Cocoyoc, Morelos, México: OMS, SSa; 1995. [ Links ]
175. Guzmán-Bracho CL, García-García J, Florián-Verdugo S, Guerrero-Martínez M, Torres-Cosme C, Ramírez Melgar, et al. Riesgo de transmisión de T. cruzi por transfusión de sangre en México. Pan Am J Public Health. 1998; 4: 94-8. [ Links ]
176. Norma Oficial Mexicana NOM-003-SSA2-1993, "Para la disposición de sangre humana y sus componentes con fines terapéuticos"; 1993. [ Links ]
177. Médicos sin Fronteras. Evaluación exploratoria: Tripanosomiasis americana: Enfermedad de Chagas. Chiapas, México: enero-agosto; 2004. [ Links ]
178. Novoa-Montero D. Miocardiopatía crónica endémica rural venezolana ¿chagásica? Venezuela: Publicación de la gobernación del Edo. Mérida No. 11; 1985. [ Links ]
179. Jaffe R. Sobre la miocarditis crónica como causa de muerte en Venezuela. Bol Hosp. 1937; 36: 112-26. [ Links ]
180. Jaffe R. Chronische myokarditis in Venezuela. Schweis Z Allg Path. 1944; 18: 942-6. [ Links ]
181. Salfelder K. Miocarditis de etiología desconocida. Rev Poli Clin Caracas. 1953; 22: 127-9. [ Links ]
182. Kozma C, Jaffe R, Jaffe W. Estudo experimental sobre a patogenia das miocarditis. Arq Bras Cardiología. 1960; 13: 151-60. [ Links ]
183. Kozma C, Drayes B. Estudios inmunopatológicos en diversas cardiopatías. Gac Med Caracas. 1961; 7: 251-64. [ Links ]
184. Velasco-Castrejón O, González, Rivas-Sánchez B, Soriano-Rosas J. Miocardiopatía con gran cardiomegalia, causada por leptospira en México. La Habana, Cuba: II Reunión Internacional de Leptospirosis. 26-28 de mayo; 2004. [ Links ]
185. Velasco-Castrejón O, Rivas-Sánchez B. VECOVISION, un nuevo método imagenológico para el diagnóstico definitivo de leptospirosis. International Scientific Meeting of Leptospirosis, 2001. Habana, Cuba. Rev Cubana Med Trop. 2002; 54: 78. [ Links ]
Nota
Dedicatoria: A la memoria del maestro y amigo: Dionisio Peláez, un grande de la parasitología mexicana. A los heroicos trabajadores de la desaparecida Campaña Nacional para la Erradicación del Paludismo (CNEP) y al DDT, insecticida que aplicado en millones de viviendas mexicanas de 1956 a 1999, abatieron las cifras de morbimortalidad por paludismo y salvaron a México de sufrir una gran endemia chagásica. Con respeto y cariño














