Se define la taquiarritmia supraventricular en el período neonatal como la taquicardia originada por encima del haz de His; en clínica se caracteriza por una frecuencia cardíaca > 220 lpm, en reposo y sin llanto, y en el electrocardiograma se identifican ondas P nulas o un eje de la onda P alterado. En su mayor parte son taquicardias de complejo QRS estrecho, es decir, duración del complejo QRS < 80 ms, sin cambios en la morfología del QRS durante el ritmo sinusal. Estas características permiten reconocer la activación ventricular a través del sistema de His-Purkinje, si bien no todas las taquicardias supraventriculares son de complejo estrecho, como se describe en este artículo.
La prevalencia de las taquiarritmias neonatales no se ha establecido por completo; algunos autores informan incidencias que varían entre 1% y 5% durante los primeros días de vida1,2; la taquicardia supraventricular es la arritmia sostenida más común en el período neonatal3. Su presentación clínica es inespecífica, puede ser muy sutil e incluye palidez, cianosis, irritabilidad, diaforesis, taquipnea o dificultad en la alimentación. Es fundamental para el personal de salud conocer los intervalos de frecuencia cardíaca media y las variaciones observadas a corto y largo plazos; de esa manera, la observación y la vigilancia de las tendencias individuales son una herramienta que permite establecer una sospecha diagnóstica oportuna.
La frecuencia cardíaca y su variabilidad en los neonatos dependen de varios factores que pueden jugar un papel importante en la regulación cronotrópica interindividual. Un estudio de Singh, et al.4 encontró una correlación entre las medidas de variabilidad de la frecuencia cardíaca entre hermanos que fueron significativamente más altas que entre cónyuges, lo que sugirió un factor genético que produce los mecanismos tanto cardíacos como extracardíacos de regulación de la frecuencia. Asimismo, Kupper, et al. documentaron una relación positiva entre los polimorfismos genéticos, la influencia ambiental y la variabilidad de la frecuencia cardíaca5.
Los recién nacidos de término tienen una capacidad de adaptación rápida y eficiente al medio extrauterino; sin embargo, los prematuros pueden mostrar un control cardiovascular inmaduro. Un estudio de 2013 documentó la correlación entre la edad gestacional en recién nacidos de pretérmino y la frecuencia cardíaca: a menor edad gestacional mayor media de frecuencia cardíaca y menor variabilidad6. Esto implica un efecto de la edad gestacional en la regulación de la frecuencia cardíaca.
Los recién nacidos prematuros tienen frecuencias cardíacas basales de 100 a 180 lpm, suficientes para cubrir sus requerimientos metabólicos. La principal explicación de este efecto es la dinámica de equilibrio entre el sistema nervioso autónomo y el predominio del tono simpático, dado que la madurez del primero se ve reflejada en un incremento del tono parasimpático7.
El primer paso para identificar las taquiarritmias neonatales es el reconocimiento de un incremento anormal de la frecuencia cardíaca esperada o que no corresponde a los parámetros de tendencia individual. Con posterioridad se debe valorar la repercusión hemodinámica del paciente. Casi todas las taquiarritmias del período neonatal, en pacientes con corazón estructural y funcionalmente normal, se toleran bien y carecen de signos específicos8.
Se considera que una taquiarritmia es benigna cuando no pone en riesgo la vida del neonato y no requiere intervención inmediata9. Sin embargo, algunas arritmias pueden tener efecto notable en la estabilidad hemodinámica y en general pueden precipitar episodios de bajo gasto cardíaco o miocardiopatía inducida por arritmias, dado su carácter incesante. Es por ello que, ante la sospecha de taquiarritmia, el electrocardiograma es la herramienta diagnóstica principal para la confirmación de las alteraciones del ritmo cardíaco y por tanto es preciso conocer los hallazgos normales propios de la etapa neonatal10.
En las primeras horas de vida se observan grandes cambios hemodinámicos que aseguraran la supervivencia extrauterina. En la etapa prenatal, el ventrículo derecho (VD) expulsa sangre hacia el lecho vascular pulmonar, que es un circuito de alta resistencia, mientras que el ventrículo izquierdo (VI) lo hace hacia uno de baja resistencia sistémica. Esto propicia el predominio de las fuerzas vectoriales del VD en el electrocardiograma neonatal11; con posterioridad, con el incremento de las resistencias vasculares sistémicas y la disminución de las vasculares pulmonares, efecto de la elevación de la presión arterial de oxígeno, se favorece el predominio gradual de las fuerzas vectoriales del VI.
Las variaciones de la frecuencia cardíaca, pausas sinusales y complejos prematuros son las alteraciones identificadas con más frecuencia en neonatos sin anormalidades cardíacas estructurales; la vigilancia continua en las unidades de cuidados intensivos hace posible reconocer complejos auriculares prematuros en el 50% de los recién nacidos sanos, en particular durante los primeros días de vida, ocasionados por inestabilidad eléctrica y hemodinámica transitoria12.
El curso clínico es dependiente de la presencia o ausencia de enfermedad cardíaca estructural; los pacientes con anormalidades cardíacas en general son más susceptibles a la inestabilidad hemodinámica y al desarrollo de insuficiencia cardíaca, que exigen intervención oportuna. Las arritmias en las cardiopatías congénitas tienen los mismos mecanismos electrofisiológicos que en los pacientes con corazón estructuralmente sano, pero su abordaje es casi siempre un reto y requiere el conocimiento fisiológico de la cardiopatía.
El estrés hemodinámico crónico crea un sustrato electrofisiológico y anatómico favorable para las arritmias, ya sea por la anomalía subyacente o por ser el resultado de una intervención quirúrgica13. Todo esto justifica un ecocardiograma transtorácico en pacientes con arritmias de relevancia clínica.
Algunos neonatos con corazón sin anormalidades estructurales tienen factores de riesgo adicionales que pueden predisponer a la génesis de taquiarritmias, entre ellos la infusión de catecolaminas, las alteraciones hidroelectrolíticas, la hipoxemia, el incremento del tono simpático o parasimpático, las cardiopatías adquiridas como la miocarditis o las enfermedades hereditarias que causan alteraciones en los canales iónicos14. Asimismo, la lista de fármacos que pueden afectar la duración del intervalo QT y favorecer la generación de arritmias letales, como la taquicardia ventricular de puntas torcidas (torsades de pointes), es larga. Para consultar estos medicamentos administrados con regularidad en la práctica clínica con diversos fines, como antibióticos, antihistamínicos o protectores gástricos, puede consultarse la página www.crediblemeds.org.
Comprender la fisiopatología de las taquiarritmias permite al personal de salud valorar los factores que pueden participar en la aparición de una taquiarritmia y cuáles de ellos pueden modificarse o vigilarse de modo riguroso.
Mecanismos de las taquiarritmias neonatales
De forma típica, las arritmias cardíacas se pueden dividir en trastornos de la formación del impulso, trastornos de la conducción del impulso eléctrico o una combinación de estos dos mecanismos (Tabla 1)
Tabla 1 Mecanismo de las arritmias cardíacas
| Trastorno de la formación del impulso | |
|---|---|
| Automatismo | Tipo |
| Fenómeno de calentamiento y enfriamiento
Sin respuesta a maniobras vagales Sin respuesta a cardioversión eléctrica |
Automatismo normal alterado |
| Automatismo anormal | |
| Actividad desencadenada | Tipo |
| Sólo pueden producirse en presencia de un PA* previo | Pospotenciales tardíos |
| Pospotenciales tempranos | |
| Trastornos de la conducción del impulso | |
| Reentrada | Tipo |
| Inicio y terminación súbitos
Respuesta a maniobras vagales Respuesta a adenosina y fármacos bloqueadores del NAV Respuesta a cardioversión eléctrica |
Reentrada anatómica |
| Reentrada funcional | |
PA: potencial de acción; NAV: nodo auriculoventricular.
Trastornos de la formación del impulso
Las alteraciones de la formación del impulso engloban los siguientes mecanismos:
Las taquicardias que corresponden a mecanismos de automaticidad tienen fenómenos de calentamiento y enfriamiento, lo cual hace referencia al aumento gradual de la frecuencia cardíaca o la disminución hasta su cesación.
En el automatismo normal alterado, las células del nodo sinusal, el nodo auriculoventricular o el sistema de His-Purkinje poseen propiedades de potenciación o supresión de su actividad, lo que altera la jerarquía presentada en condiciones normales, en la cual el nodo sinusal tiene la frecuencia más alta de descarga y los marcapasos subsidiarios una frecuencia más baja15. En este tipo de arritmias, la actividad del sistema nervioso autónomo es determinante; el sistema nervioso simpático incrementa la frecuencia de descarga de las células marcapasos y, por el contrario, la célula reduce e hiperpolariza la actividad parasimpática; de esta manera se espera que las arritmias ocasionadas por este mecanismo muestren una disminución de la frecuencia con las maniobras vagales y se aceleren después al suspender la maniobra, no que terminen.
El automatismo anormal hace referencia a un mecanismo en el cual las células auriculares y ventriculares tienen propiedades de automatismo espontáneo, de las que carecen en condiciones normales, de tal manera que una descarga eléctrica única puede generar un latido ectópico aislado y múltiples descargas pueden precipitar una taquicardia automática sostenida16. Se ha relacionado con alteraciones hidroelectrolíticas, como hipercalcemia, acidosis e incremento del tono simpático17.
La actividad desencadenada es un mecanismo fisiopatológico en el cual se inicia un impulso cardíaco durante o inmediatamente después de un potencial de acción, una vez que se alcanza el potencial umbral18. Los potenciales generados en las fases 2 y 3 se conocen como pospotenciales tempranos y los registrados en la fase 4 pospotenciales tardíos15. La intoxicación digitálica, la elevación de catecolaminas circulantes, la isquemia, la hipocalcemia, la hipoxia, las fenotiazinas y los fármacos antiarrítmicos de clase III son algunos de los factores relacionados con su aparición19.
Trastornos de la conducción del impulso
La reentrada es el mecanismo encargado con más frecuencia de las taquiarritmias en la edad pediátrica y neonatal; se define por una propagación de la onda de activación que vuelve a su lugar de origen. Existen dos tipos de reentrada: anatómica y funcional. Las características clínicas de estas taquicardias son inicio y terminación súbitos y mínima variación de la longitud de ciclo del circuito, lo que se refleja en un R-R regular, y responden a las maniobras vagales y la cardioversión eléctrica con terminación de la taquicardia20. Corresponden a este mecanismo fisiopatológicos la reentrada auriculoventricular, la reentrada intranodal AV, y el flúter y la fibrilación auriculares.
Este tipo de arritmias requiere que existan dos vías con propiedades electrofisiológicas distintas (velocidad de conducción y refractariedad), las cuales deben conectarse proximal y distalmente hasta formar un circuito eléctrico. El frente de onda debe retrasarse lo suficiente en algún punto para posibilitar la recuperación del tejido y el estímulo debe tener un bloqueo anterógrado unidireccional. Si estas condiciones existen, el mecanismo de reentrada puede desencadenarse por un estímulo prematuro que logre introducirse en el circuito21,22. Algunos circuitos de reentrada pueden estar presentes al nacimiento como vías auriculoventriculares o intranodales que se degeneran y pierden su capacidad de conducción. El tratamiento de un solo episodio agudo tiene un pronóstico excelente, con resolución en cerca del 50% durante el primer año de vida23.
Complejos auriculares prematuros
Los complejos auriculares prematuros también se denominan latidos auriculares prematuros o extrasístoles auriculares. Son latidos tempranos, que nacen en cualquier parte de la aurícula diferente del nodo sinusal; en las series más antiguas se informa una prevalencia de complejos prematuros auriculares y ventriculares en electrocardiogramas en los recién nacidos del 1% y alrededor del 11% en la vigilancia Holter de 24 horas; los latidos auriculares prematuros son los más frecuentes.
Los principales riesgos que plantean los latidos prematuros supraventriculares incluyen la bradicardia causada por contracciones bloqueadas y el riesgo de que la ectopia auricular frecuente se convierta en taquicardia supraventricular e insuficiencia cardíaca; sin embargo, los estudios sólo informan un riesgo del 0.5% de presentarla24.
Los latidos auriculares prematuros pueden ser conducidos; en este caso, el electrocardiograma registra una onda P temprana, con un eje y morfología diferentes respecto de los de la P sinusal normal; suelen ir seguidos de un QRS usual estrecho, pero cuando ocurren de forma muy temprana pueden originar un QRS aberrante25. Los síntomas se producen cuando hay ectopias auriculares frecuentes y no conducidas, lo que lleva a la bradicardia, o se conducen sin suficiente recuperación del gasto cardíaco, lo cual provoca hipotensión.
Los latidos auriculares prematuros conducidos con aberración se observan en el electrocardiograma con una onda P prematura que conduce a los ventrículos con retraso o con un bloqueo de rama (fenómeno de Ashman). El QRS ancho prematuro que causa una aberración de conducción se confunde a menudo con las contracciones ventriculares prematuras; para distinguirlas se puede buscar la onda P prematura que deforma a la onda T anterior26. Se presentan en el hipertiroidismo, trastornos metabólicos (hipoglucemia, hipopotasemia, hipercalcemia) o hipóxicos, durante la infusión de fármacos como los estimulantes b, antidepresivos, intoxicación digitálica, así como elementos endocavitarios exógenos (catéteres, vías centrales) o endógenos (tumores), o bien en pacientes con persistencia de la vena cava superior izquierda27.
Si el paciente es asintomático y la exploración física es normal, los latidos auriculares prematuros casi siempre son benignos y no requieren casi nunca más estudios; no obstante, si el paciente muestra síntomas, puede tratarse de una manifestación de un circuito de reentrada subyacente o un foco automático con potencial de taquicardia supraventricular, por lo que podrían indicarse una vigilancia Holter o un registro de episodios.
En los pacientes asintomáticos sólo está indicado ampliar los estudios, ante latidos muy frecuentes o sospecha de múltiples focos (morfología variable de la onda P), en cuyo caso deben considerarse hipertiroidismo, cardiopatía estructural o miocardiopatía como posibles diagnósticos diferenciales25.
Principales formas de taquicardia supraventricular
El término taquicardia supraventricular hace referencia a las taquicardias originadas por encima del haz de His; por lo general se caracterizan por ser taquicardias con complejos QRS estrechos (< 80 ms), aunque un porcentaje menor de las taquicardias supraventriculares puede cursar con complejos QRS anchos (> 80 ms)25. Dentro de este grupo de taquicardias supraventriculares con complejos anchos se hallan la taquicardia que aparece a través de una vía accesoria auriculoventricular con movimiento circular antidrómico y las que se desarrollan en presencia de bloqueo de rama preexistente o funcional.
En el caso ideal de contar con un electrocardiograma inicial es útil la comparación de la morfología del complejo QRS, ya que un complejo QRS sin variación durante la taquicardia, comparado con el electrocardiograma inicial en sinusal, indica que la despolarización ventricular ocurre a través del sistema de conducción normal del neonato.
Taquicardia sinusal
La taquicardia sinusal es el prototipo de taquicardia automática, más a menudo secundaria a trastornos sistémicos como fiebre, hipotensión que requiere incremento de la frecuencia cardíaca para asegurar las demandas energéticas, alta circulación de catecolaminas y en algunos casos hijos de madres con alteraciones tiroideas como la tirotoxicosis. Su característica electrocardiográfica es un eje de la onda P originada del nodo sinusal (positiva en DI, DII y AVF), sin alteración de la morfología en una misma derivada y por lo general con conducción AV 1:128.
Taquicardia auricular ectópica
La taquicardia auricular ectópica (TAE) es un ejemplo de taquicardia que ocurre por automatismo anormal en un foco auricular único, originado en células auriculares que patológicamente poseen automatismo y tienen inicio gradual con fenómenos de calentamiento. Las características electrocardiográficas incluyen un eje anormal de la onda P, lo cual representa la despolarización auricular originada de un sitio distinto del nodo sinusal y puede existir bloqueo auriculoventricular (AV) de primer o segundo grados29. La administración de adenosina y la cardioversión eléctrica no son casi nunca útiles para terminar este tipo de taquicardia, cuando el sitio de la generación de los estímulos no es un foco único, sino múltiple en la aurícula; en el electrocardiograma se identifican al menos tres morfologías diferentes de la onda P, lo que configura una taquicardia auricular multifocal con un ritmo auricular caótico.
Taquicardia ectópica de la unión
La taquicardia ectópica de la unión corresponde a un incremento del automatismo en las células del nodo AV o proximal en el haz de His y es el trastorno del ritmo más frecuente encontrado en el posoperatorio de una intervención cardioquirúrgica30. Su curso clínico varía de forma amplia y en la taquicardia ectópica de la unión del posoperatorio se espera se resolución en un curso 24 a 48 h y, por el contrario, cuando su carácter es congénito o idiopático tiende a experimentar un curso incesante, con la posibilidad de producir insuficiencia cardíaca inducida por taquicardia31,32. La característica electrocardiográfica incluye una taquicardia del complejo QRS estrecho, con mayor tasa ventricular que auricular, es decir, más complejos QRS que ondas P. Algunas medidas que han mostrado efectividad para este tipo de taquicardia es la hipotermia inducida33 y el tratamiento con amiodarona o procainamida34.
Flúter auricular
Es efecto de un circuito de reentrada localizado en la aurícula derecha (AD) que incluye al istmo cavo tricúspide, con activación pasiva de la aurícula izquierda; el curso típico tiene un sentido levógiro. En el electrocardiograma se identifica de manera característica en las derivaciones DII, DIII y AVF una ondulación continua con una deflexión negativa aguda conocida como dientes de sierra y una deflexión bifásica en V135. Pueden presentarse frecuencias auriculares altas de 300 a 600 lpm, con bloqueo 2:1 o 3: 1 por bloqueo funcional en el nodo AV36. El flúter auricular se acompaña de defectos cardíacos estructurales, anomalías cromosomáticas y otros estados patológicos en aproximadamente un tercio de los casos tempranos. Por lo tanto es importante una valoración detallada de estos pacientes y asimismo descartar afección cardíaca estructural y valorar la localización profunda de catéteres venosos centrales37.
Fibrilación auricular
La fibrilación auricular (FA) se ha relacionado con múltiples microcircuitos de reentrada, que ocurren en la aurícula izquierda38. Es una arritmia rara en neonatos, ya que para que los microcircuitos puedan mantenerse son necesarios un desencadenante y un sustrato auricular que permitan la sostenibilidad de la arritmia; por lo tanto, es más común en pacientes con cardiopatías congénitas que afecten a la válvula mitral, válvula aórtica, miocardiopatías y síndrome de Wolff-Parkinson-White (WPW)39,40. Los hallazgos electrocardiográficos incluyen una actividad eléctrica auricular de baja amplitud, con intervalos RR variables debido a la conducción variable a través del nodo AV.
Taquicardia por reentrada auriculoventricular (AV)
En la arritmia por reentrada auriculoventricular existen vías accesorias anormales que comunican eléctricamente las aurículas con los ventrículos, las cuales pueden conducir de manera anterógrada, es decir, de las aurículas a los ventrículos, o retrógrada, de los ventrículos a las aurículas, sin incurrir en el retraso fisiológico del nodo AV. Algunas de estas vías tienen la propiedad de conducir en las dos direcciones y otras sólo de manera retrógrada, lo que dificulta su diagnóstico, ya que en el electrocardiograma basal la actividad anterógrada se oculta.
Por el contrario, en la vía accesoria con actividad manifiesta anterógrada, de manera típica en ritmo sinusal, se visualiza una preexcitación ventricular con QRS ancho, es decir, > 80 ms, onda delta y un intervalo PR corto, lo que representa la conducción desde las aurículas hasta los ventrículos a través de la vía accesoria. Este síndrome lo describieron de modo inicial Wolff, Parkinson y White (WPW) en 193041. El término WPW se reserva para un electrocardiograma con los hallazgos descritos en ritmo sinusal relacionado con taquiarritmia.
La forma más común de taquicardia ante vías accesorias AV es la taquicardia con movimiento circular ortodrómico (Fig. 1A) en la cual la activación anterógrada de los ventrículos tiene lugar por el sistema de conducción normal (His-Purkinje) y la activación auricular sucede de manera retrógrada (de los ventrículos a las aurículas) a través de la vía accesoria; en el electrocardiograma es posible observar una taquicardia con complejos QRS estrechos, RR regular y onda P retrógrada (negativa en AVF).
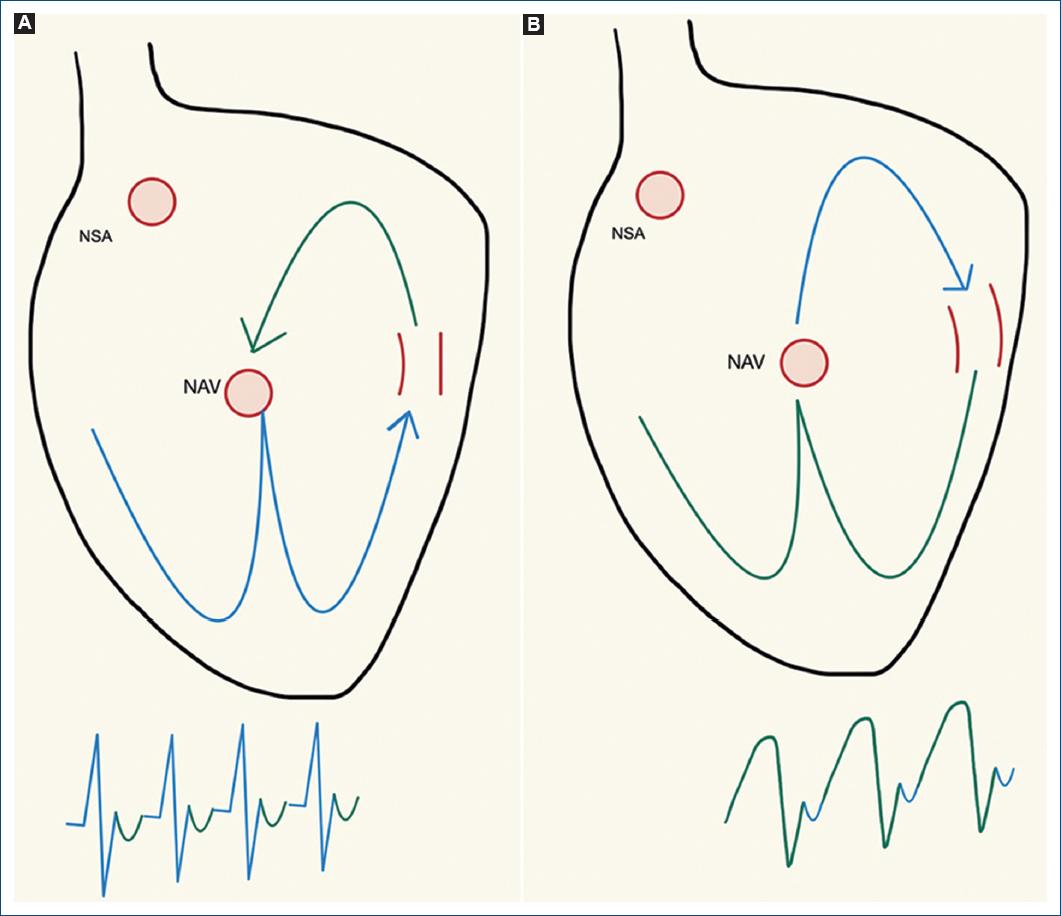
Figura 1 A: esquema de una taquicardia supraventricular por reentrada por vía accesoria, con movimiento circular ortodrómico; se observa que la despolarización ventricular ocurre a través del sistema de conducción normal, lo cual produce complejos QRS estrechos de morfología similar a la observada en el ECG en ritmo sinusal y la despolarización auricular retrógrada a través de la vía accesoria, lo cual produce en el ECG ondas P retrógradas, con un intervalo RP corto. B: se identifica una taquicardia supraventricular por vía accesoria con movimiento circular antidrómico, en la cual la despolarización ventricular ocurre a través de la vía accesoria y produce en el ECG un complejo QRS ancho y la despolarización auricular de manera retrógrada a través del nodo AV.
Existe otro tipo de taquicardias menos comunes, como la fibrilación auricular preexcitada, en la cual las vías accesorias peligrosas llevan a la conducción de todos los estímulos auriculares y producción de frecuencias ventriculares altas que pueden desencadenar el colapso del paciente36 y la taquicardia con movimiento circular antidrómico en la cual la activación anterógrada tiene lugar a través de la vía accesoria y la retrógrada auricular a través del sistema de conducción normal, como se muestra en la Figura 1B, de tal manera que los hallazgos electrocardiográficos son los de una taquicardia con complejos QRS anchos, RR regular y onda P retrógrada. Existen otras causas para la aparición de complejos QRS anchos en presencia de taquicardia supraventricular, como el bloqueo de rama fisiológico o preexistente.
Los recién nacidos en los que se identifica una taquicardia incesante por un período > 24 h se hallan en riesgo de desarrollar insuficiencia cardíaca e inestabilidad hemodinámica. La miocardiopatía inducida por arritmia es un fenómeno infrecuente, pero puede ser letal y total o parcialmente reversible con el control de la taquicardia42,43. Un estudio realizado en The Hospital for Sick Children de Toronto identificó algunos factores predictores de taquicardia resistente en lactantes con corazones estructuralmente normales, además de encontrar que los pacientes con mayor riesgo de taquicardia resistente eran aquellos que tenían la taquicardia a una edad menor (10.2 ± 2.5 días), disfunción ventricular y una conducción ventrículo-arterial más lenta44.
Taquicardia recíproca de la unión
Es un tipo de arritmia que ocurre por un mecanismo reentrante poco común y en la mayor parte de los casos participa una vía accesoria posteroseptal decreciente, con baja velocidad de conducción45. De manera característica es incesante y las características electrocardiográficas son las de una taquicardia con complejos QRS estrechos, regulares, con un intervalo RP muy largo y uno PR normal, pero con un eje de la onda P anormal, a diferencia del sinusal. Por lo general es difícil de tratar con los fármacos iniciales; las bajas frecuencias cardíacas de la taquicardia rara vez producen síntomas, pero su carácter incesante puede desencadenar miocardiopatía arrítmica46.
Taquicardia por reentrada en el nodo AV
El circuito de reentrada se localiza alrededor del nodo AV (NAV), una vía rápida con mayor velocidad de conducción, período refractario prolongado y una vía lenta con menor velocidad de conducción y un período refractario corto. Si un estímulo logra introducirse en el circuito en el momento en que la vía rápida se encuentra en el período refractario (Fig. 2), la conducción de ese estímulo puede ocurrir por la vía lenta, la cual tiene un período refractario corto, y de esta manera se inicia el circuito de la taquicardia25.
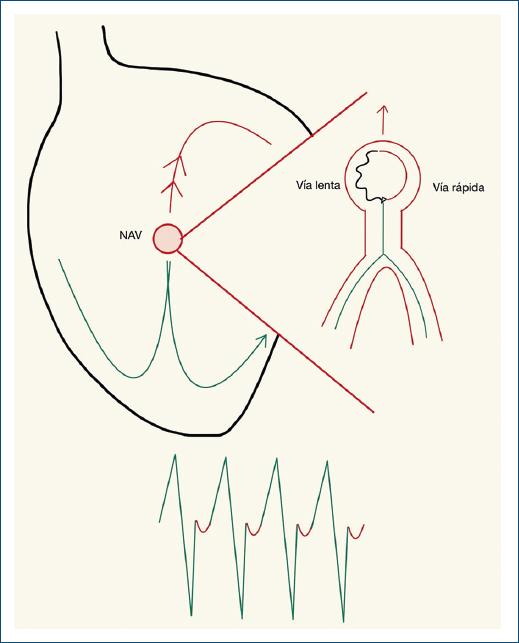
Figura 2 Esquema de una taquicardia supraventricular por reentrada a nivel del nodo AV en la cual las dos vías (rápida y lenta) se encuentran dentro del nodo AV a partir del cual tiene lugar la despolarización ventricular de manera anterógrada, con aparición de complejos QRS estrechos y despolarización auricular de manera retrógrada.
La reentrada del NAV es rara en recién nacidos; en su forma típica, la conducción anterógrada tiene lugar por la vía lenta y la conducción retrógrada a través de la vía rápida40. Esto se representa en el ECG en actividad auricular inmediatamente después del complejo QRS, con RP muy corto (< 70 ms) o incluso actividad eléctrica auricular (onda P) indetectable, dado que ocurre casi al mismo tiempo que la activación ventricular47.
En los casos de reentrada AV atípica, en la cual la activación anterógrada sucede por la vía rápida y la activación retrógrada auricular por la vía lenta, se reconoce un tipo de taquicardia con RP largo, que podría simular un intervalo PR normal; sin embargo, el eje de la onda P anormal, invertida en AVF, puede ayudar a sospechar el diagnóstico48.
Tratamiento
El tratamiento siempre debe iniciar de acuerdo con la estabilidad hemodinámica del niño y es necesaria la vigilancia completa y adecuada, además de establecer un acceso vascular siempre que sea posible. Si la taquicardia afecta el estado hemodinámico, los estudios no deben retrasar el tratamiento y el médico debe prever la utilización de antiarrítmicos.
En los casos estables es importante descartar causas orgánicas, como sucede en el hipotiroidismo e hipertiroidismo, alteraciones hidroelectrolíticas, hipoglucemia, afectación estructural y consumo de fármacos que alteran la conducción49. Es importante revisar la colocación de catéteres como causa de la arritmia.
Los latidos prematuros supraventriculares desaparecen y no requieren tratamiento, al igual que los ventriculares que pueden considerarse benignos siempre y cuando no sean frecuentes, aparezcan en un corazón sin anormalidades anatómicas, y sean latidos aislados con una única morfología10.
Las taquicardias supraventriculares secundarias a mecanismo de reentrada en pacientes con estabilidad hemodinámica pueden considerarse maniobras vasovagales, las cuales han demostrado ser efectivas en el 70% de los casos50. En los neonatos, el uso de compresas frías en la cara sin cubrir la boca y la nariz es lo más apropiado y no se recomienda la estimulación rectal debido a los potenciales efectos adversos. Las maniobras vagales producen un bloqueo a nivel del nodo AV y de esta manera terminan el circuito de la taquicardia.
Si la taquiarritmia no cede con las maniobras vagales, la adenosina está indicada a una dosis de 0.1 mg/kg con un paso rápido de ésta (es necesaria una llave de tres vías para su lavado y levantar el brazo), que puede repetirse una segunda vez a la misma dosis e incluso una tercera al doble (0.2 mg/kg)49. La adenosina induce un bloqueo farmacológico del nodo AV, el cual forma parte del circuito de la taquicardia y lleva a la terminación del mecanismo fisiopatológico. Debe señalarse que la vía umbilical está contraindicada para el uso de adenosina por su rápido metabolismo51.
Ante inestabilidad hemodinámica o insuficiencia cardíaca descompensada, está indicada una descarga sincronizada, previa dosis de morfina, a 0.5-1 J/kg con ascenso hasta 2 J/kg10. La amiodarona a dosis de 5 mg/kg en 20 minutos seguida por una infusión continua de 10 mg/kg/24 h ha demostrado ser efectiva en pacientes con una fracción de expulsión disminuida52. En el suceso inusual de falla terapéutica, se ha administrado flecainida a dosis de 1.5 a 2 mg/kg en tres a cinco minutos o propafenona a dosis de 1.5 mg/kg.
Asimismo, en todos los casos con taquicardias supraventriculares paroxísticas, la profilaxia antiarrítmica debe iniciarse para evitar recurrencias con flecainida (2-7 mg/kg/día en tres dosis), propafenona (10-15 mg/k/día en tres dosis) o amiodarona con una dosis de carga de 10 a 20 mg/kg/día en una a dos administraciones por 10 días con una dosis de mantenimiento de 3 a 7 mg/kg/día en una o dos dosis, o bien sotalol en 2 a 8 mg/k/día en dos a tres dosis. Los medicamentos tipo 1C y la amiodarona pueden acompañarse de betabloqueadores como el propanolol a dosis de 1 a 3 mg/kg/día en tres a cuatro dosis, con ajuste progresivo desde bajas dosis según sea la frecuencia cardíaca (FC) neonatal y su tolerancia (no debe mantenerse una FC < 100 lpm)1,49.
La taquicardia auricular ectópica corresponde a un mecanismo de automaticidad anormal, por lo cual la cardioversión eléctrica suele ser inefectiva o podría suprimirla sólo de manera transitoria. La administración de adenosina no afecta las taquicardias automáticas, pero se logra un bloqueo AV sin afectar la frecuencia auricular; esto ayuda a distinguirlas de las taquicardias supraventriculares por mecanismos reentrantes40. De no tratarse de manera oportuna es posible una miocardiopatía inducida por taquicardia, en cuyo caso la mejor opción disponible son los fármacos bloqueadores de los receptores b.
La taquicardia de la unión que no se relaciona con cirugía en los neonatos es muy rara, pero si se presenta tiene alta morbimortalidad porque es incesante. Cuando responde suele hacerlo al tratamiento con amiodarona49.
Para el flúter auricular en recién nacidos, consecuencia de un circuito de reentrada dentro de la aurícula derecha, es necesario descartar cardiopatía estructural. En ausencia de enfermedad cardíaca estructural y estabilidad hemodinámica, la arritmia puede ceder espontáneamente después de 24 a 48 h en el 26% de los casos. Para los demás escenarios, el tratamiento de elección es la cardioversión eléctrica electiva o farmacológica con amiodarona (5 mg/kg en 20 min); algunos otros fármacos usados con éxito son la digoxina y la propafenona53. Los neonatos sin sustrato arritmogénico no presentan casi nunca recurrencias1,10.
La fibrilación auricular es una arritmia rara en neonatos, en la cual no sólo se incluye un sustrato arritmogénico sino algunos factores predisponentes que pueden ser susceptibles de modificación, como la mal posición de los catéteres intracardíacos54, administración de catecolaminas y algunos compuestos antimicrobianos con efecto proarrítmicos55. La FA eleva el riesgo de episodios tromboembólicos, lo cual debe tenerse en cuenta en el momento de ofrecer el tratamiento de cardioversión eléctrica; en consecuencia, se recomienda obtener un ecocardiograma que descarte coágulos intracardíacos; la duración de la FA paroxística es muy corta y por tanto no supone un riesgo para la generación de trombos. El tratamiento médico de la FA es similar al del flúter auricular.
Por último, conocer la fisiopatología de las taquiarritmias en el período neonatal facilita una identificación oportuna con el fin de ofrecer la mejor conducta terapéutica farmacológica y disminuir los desenlaces potencialmente letales en esta población vulnerable.











 nueva página del texto (beta)
nueva página del texto (beta)


