Introducción
La válvula aórtica bicúspide (VAB) es la cardiopatía congénita más frecuente en la población general. Lejos de ser solo una malformación valvular inocente, supone una enfermedad compleja y heterogénea1. Su espectro puede consistir, en su extremo más benigno, en un hallazgo incidental, permaneciendo como anomalía subclínica a lo largo de la vida, o bien, en un extremo más grave, llegar a ser origen de una disfunción valvular que pueda condicionar el pronóstico a corto plazo del paciente1. En el seno de esta dispersión clínica interindividual, las complicaciones en la edad media adulta se saben comunes, otorgando una carga de morbilidad mucho mayor que la de cualquier otra cardiopatía congénita2. Derivado de todo ello, se ha producido un progresivo interés científico en los últimos años acerca de la VAB, con avances importantes en el campo de la embriología y la genética que buscan explicar la etiología de esta malformación. Se ha arrojado luz sobre su patogenia y sobre su alta asociación con la dilatación de aorta, con la que actualmente llega a englobarse dentro de un mismo síndrome. Fruto de este conocimiento creciente surge la razón de este artículo, con el que pretendemos revisar los aspectos más relevantes de esta cardiopatía congénita.
Anatomía y subtipos morfológicos
Clásicamente se atribuyen a Leonardo da Vinci, en el siglo xv, las primeras descripciones anatómicas sobre esta anomalía valvular. Hoy en día, se define como VAB la existencia de dos velos valvulares, si bien hay una gran variabilidad individual respecto a las características pormenorizadas de la válvula: simetría, presencia de rafe, carácter de las comisuras, etc.1-3. Uno de los velos se genera mayoritariamente por la fusión o ausencia de separación de dos de los primitivos velos durante el desarrollo valvular. Así, los dos velos suelen ser de tamaño desigual, siendo de mayor superficie el fusionado. Por otro lado, en la mayoría de las válvulas bicúspides hay un rafe, es decir, una cresta fibrosa dirigida desde el borde libre valvular hasta la pared arterial, que representa la «zona de unión» de los componentes del velo de mayor tamaño. La forma de apertura valvular y la posición del rafe (cuando se halla) van a definir los diferentes subtipos de VAB. Existen varias clasificaciones descritas por diferentes autores4-6, pero una de las más extendidas es la de Sievers y Schmidtke4. Estos autores diferencian tres subtipos según la ausencia de rafe o la presencia de uno o dos rafes (tipos 0, 1 y 2, respectivamente), y luego realizan una subdivisión según la posición espacial del rafe y los velos. De este modo, en el tipo 0, en el que no hay rafe (VAB «pura»), existen dos subcategorías: a) posición lateral, estando los velos a derecha e izquierda, y b) posición anteroposterior de los velos. En el tipo 1 existen tres velos anatómicos, pero dos velos funcionales por la presencia del rafe; es el tipo más frecuente. El rafe puede situarse entre los velos izquierdo y derecho (L-R, por sus siglas en inglés), que es el subtipo más común; entre el derecho y el no coronariano (R-N); o bien, por último, entre el no coronariano y el izquierdo (N-L), el subtipo menos común de los tres. Por último, e infrecuente, el tipo 2 tiene dos rafes, presentes prácticamente en todos los casos entre los velos izquierdo y derecho (L-R) y entre los velos derecho y no coronariano (R-N) (Fig. 1).
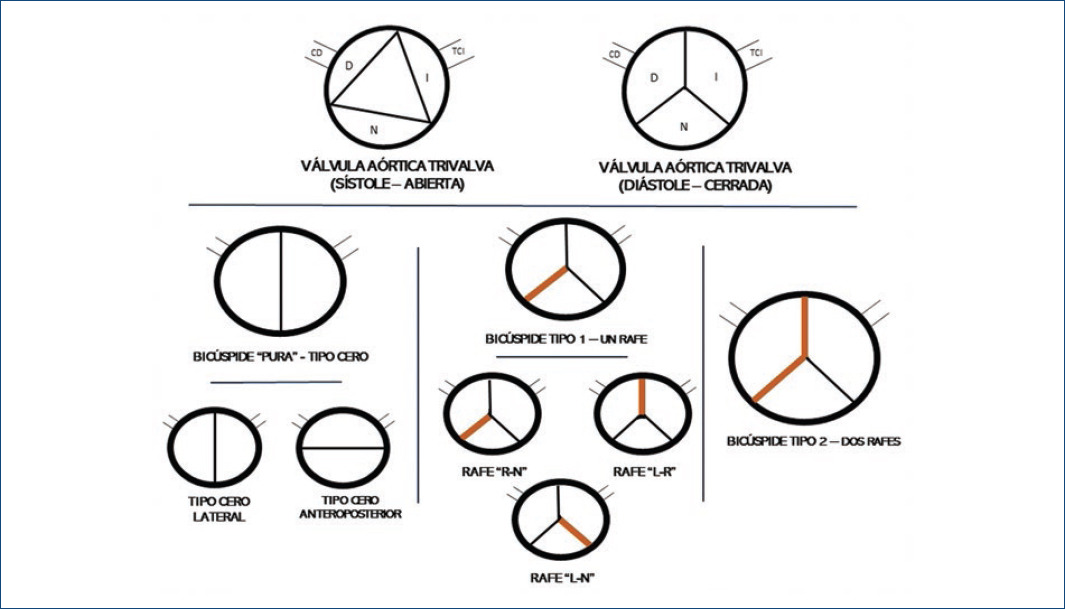
Figura 1 Esquema de la clasificación de los tipos de válvula bicúspide según Sievers y Schmidtke4. CD: coronaria derecha; D: seno coronario derecho; I: seno coronario izquierdo; L: left (izquierdo); N: seno no coronariano; R: right (derecho); TCI: tronco coronario izquierdo.
Epidemiología
La prevalencia estimada de la VAB en la literatura oscila entre el 0.5% y el 2% de la población1,2,7, si bien la prevalencia real no es del todo conocida por no existir un cribado poblacional extenso y tener un curso en muchas ocasiones asintomático. La mayoría de los estudios clásicos se realizaron en cohortes de pacientes caucásicos, pero ya existen en la literatura estudios en otras poblaciones y se observan variaciones geográficas en cuanto a su prevalencia. Así, en población asiática se ha descrito una prevalencia similar8. En población originaria de África subsahariana hay discordancia en la prevalencia, pero parece ser menor9. En un estudio centroamericano con 2750 pacientes no seleccionados que acudían a realizarse un ecocardiograma se observó VAB en un 4.9% de ellos10. Se ha descrito una baja prevalencia entre la población afroamericana y caribeña, que oscila entre el 0.11% y el 0.28%11. Tiene predominancia en el sexo masculino (alrededor de 3:1)3. Un interesante estudio de cribado realizado por Tutar, et al.12 en recién nacidos describe una prevalencia mayor en los niños (7.1 por 1000 niños) que en las niñas (1.9 por 1000 niñas). Estas diferencias según el sexo sugieren que el cromosoma X puede desempeñar un papel importante en su origen, apoyado también por la alta incidencia de VAB en el síndrome de Turner13.
Diagnóstico
El diagnóstico suele realizarse tras la auscultación de un soplo de estenosis o insuficiencia aórtica, la aparición de síntomas o de modo casual durante un estudio ecocardiográfico. El diagnóstico se basa en la imagen bidimensional con ecocardiografía transtorácica, y así lo recogen las actuales guías de práctica clínica: «la ecocardiografía transtorácica es la modalidad de imagen recomendada para la evaluación inicial de la válvula aórtica y la aorta torácica, incluida la evaluación de la función de la válvula hemodinámica de la válvula; con una evidencia científica de clase I»14. Este tipo de diagnóstico no invasivo y aplicable a grandes grupos de población ha posibilitado la realización de estudios más amplios sobre la VAB. Para establecer el diagnóstico, la válvula debe visualizarse en sístole (válvula abierta) en una vista paraesternal en el eje corto. No debe realizarse en diástole (válvula cerrada), ya que el rafe puede hacer que la válvula aparezca como trivalva, generando confusión3,14,15. Cuando la válvula se encuentra muy calcificada, como sucede en las estenosis avanzadas, diferenciar las cúspides valvulares es más difícil y el diagnóstico es menos preciso. La ecografía transesofágica ofrece una visión más detallada y de mejor calidad, por lo que puede utilizarse cuando existan dudas. En algunas ocasiones, otras pruebas de imagen diagnósticas, como la resonancia magnética (RM) cardiaca o la tomografía computarizada (TC), ayudan a confirmar el diagnóstico de la malformación congénita, aunque estas técnicas suelen ser más utilizadas para el estudio de la aorta3,15,16.
Aspectos etiopatogénicos
El desarrollo anómalo de la válvula bicúspide se integra, hoy en día, en las llamadas anomalías del tracto de salida del ventrículo izquierdo, incluida en este espectro junto con la coartación de aorta, el síndrome del corazón izquierdo hipoplásico, etc. Por ejemplo, aproximadamente el 50% de los pacientes con coartación asocian VAB3,13,15 (Fig. 2). Además, se observa una marcada heterogeneidad genética subyacente a la VAB, apareciendo ligada a distintas cromosomopatías y enfermedades genéticas13. Se ha descrito una mayor prevalencia de VAB en el síndrome de Down (trisomía 21) o en el síndrome de DiGeorge (monosomía 22q11), así como en el síndrome de Turner, con una prevalencia del 15-30% en pacientes con esta enfermedad; también en el síndrome de Marfan, en el de Loeys-Dietz y el de William-Beuren13. A pesar de que ha habido un gran interés durante las últimas décadas por descubrir los mecanismos que dan lugar a la formación de la valvulopatía bicúspide, los genes y las interrelaciones de las moléculas implicadas en el desarrollo normal del tracto de salida del ventrículo izquierdo no se conocen aún de forma adecuada. Se han relacionado con VAB varias vías de señalización que son clave en el desarrollo morfológico normal del corazón: superfamilia del factor de crecimiento tumoral beta (TGF-β), familia GATA, Tbx20, sintetasa 3 del óxido nítrico (eNOS3), NOTCH1 o Wnt/β-catenina, entre otros1,15,17,18. Se sabe que el desarrollo de la VAB no se debe a un solo gen, y actualmente, para una mejor clasificación de las mutaciones relacionadas, se distinguen dos grupos. Por un lado, existen alteraciones genéticas descritas en pacientes con VAB que se relacionan con síndromes clínicos, como por ejemplo las mutaciones en FBN1 (síndrome de Marfan) o en TGFBR1/2 (síndrome de Loeys-Dietz)18. Por otro lado, existen las alteraciones no sindrómicas, por ejemplo las mutaciones en GATA5, PITX2 o CLIP21,18. Entre las formas esporádicas o no sindrómicas, las mutaciones en el gen NOTCH1 son las más estudiadas. Se han descrito familias con mutaciones en este gen que se comporta con un patrón de herencia autosómica dominante. Las rutas de señalización de NOTCH1 están altamente conservadas entre especies, ya que tienen un papel fundamental en procesos de diferenciación celular, desarrollo celular y comunicación intercelular, y desempeñan una función crucial en la organogénesis embrionaria y en particular en el desarrollo del sistema cardiovascular18. Además, la inhibición de NOTCH1 conduce, a su vez, a una señalización defectuosa en la vía del TGF-β, existiendo una relación entre estas dos vías que afecta al correcto remodelado de la matriz vascular y al desarrollo correcto de la válvula aórtica. La familia GATA de factores de transcripción ha sido involucrada en los procesos de diferenciación celular18. Varios genes, GATA4, GATA5 y más recientemente GATA6, han sido relacionados con el desarrollo de VAB18-20. También la proteína óxido nítrico sintetasa (NOS) ha sido relacionada con la morfogénesis valvular. Concretamente, NOS-3, constitutiva del tejido vascular, presenta mutaciones relacionadas con el desarrollo de VAB18. No solo surgen con fuerza estudios genéticos, sino también epigenéticos (cambios heredables en la expresión génica sin cambios en la secuencia de ADN) en el ámbito de la VAB. Se han estudiado mecanismos relacionados con la metilación del ADN, modificaciones de histonas, etc. Un estudio demostró una hipermetilación de la región correspondiente a GATA4 y una hipometilación en ACTA2 en individuos con VAB, en comparación con sujetos controles21. También se han estudiado microARN y lncARN (ARN largos no codificantes) relacionados con la VAB. En un amplio estudio con microarrays, Yanagawa, et al.22 demostraron una expresión diferencial de 34 microARN comparando pacientes con VAB y válvula aórtica tricúspide (VAT), e identificaron el miR-141 como regulador de la calcificación acelerada valvular. A pesar de los grandes esfuerzos en los últimos años, con multitud de investigaciones en este campo del saber científico, aún se desconoce cuál es la base ontogenética del desarrollo de la VAB.
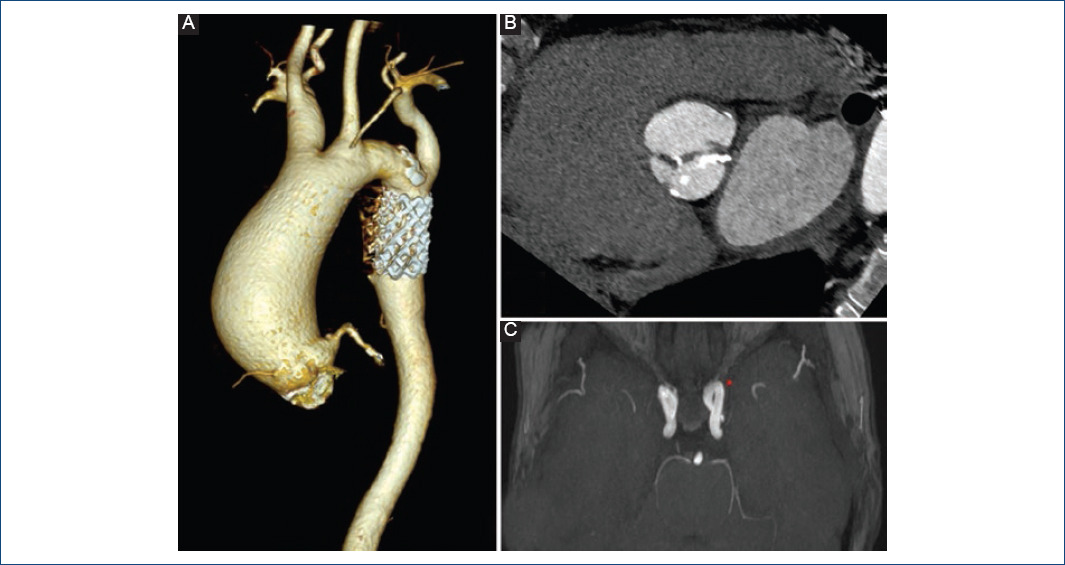
Figura 2 Paciente con aortopatía bicúspide y coartación de aorta intervenida en la edad adulta mediante implante de stent. A: reconstrucción tridimensional de tomografía computarizada (TC) que muestra un aneurisma de aorta ascendente y el stent en la zona de coartación. B: TC que muestra la válvula aórtica bicúspide con zonas de calcificación en sus velos. C: los pacientes con coartación de aorta pueden presentar aneurismas del polígono de Willis, por lo que se recomienda su cribado.
Cribado familiar, ¿es necesario?
Los determinantes genéticos y epigenéticos, como hemos visto, son complejos, de modo que la VAB se asocia a distintos patrones de herencia. En muchos casos se describe una herencia familiar autosómica dominante con baja penetrancia y expresividad variable17. Los estudios de cribado en familiares de primer grado de pacientes con VAB muestran prevalencias variables entre el 4% y el 22%, aunque clásicamente se ha establecido una prevalencia en familiares de primer grado en torno al 10%17,21. También hay constancia de una mayor prevalencia de VAB entre familiares de primer grado de pacientes con algunas cardiopatías congénitas, como coartación de aorta, defectos de tabicación, dilatación de aorta, etc. Basándose en estos datos, las guías de práctica clínica recomiendan realizar un cribado con ecocardiograma transtorácico a los familiares de primer grado de los pacientes con VAB14,17.
Curso clínico y complicaciones
Dado que solo los pacientes sintomáticos, con o sin enfermedad valvular, buscan atención médica, existe una laguna de conocimiento sobre las consecuencias reales de tener VAB. De este modo, es posible que el conocimiento actual de la enfermedad no se ajuste a la realidad, al observar en la práctica médica únicamente aquellos individuos con complicaciones. La evolución natural de la cardiopatía congénita se ha intentado evaluar en distintos estudios prospectivos, en los que se ha demostrado una amplia variabilidad de presentación y comportamiento, que puede ir desde el desarrollo de una estenosis grave en la infancia hasta tener un curso asintomático durante prácticamente toda la edad adulta1,3,15,23.
La complicación más frecuente en los pacientes con VAB es la disfunción valvular por estenosis o insuficiencia1,3 (Fig. 3). En la infancia, el curso típico es asintomático. En la juventud y la primera edad adulta, la mayor parte de las consultas y de las intervenciones quirúrgicas son por insuficiencia aórtica grave23,24. El mecanismo etiológico puede ser funcional, por dilatación de la raíz de la aorta, o primario valvular por prolapso, degeneración mixomatosa o endocarditis. Posteriormente, los individuos suelen desarrollar estenosis aórtica por un proceso de calcificación valvular acelerada, precisando intervención a una edad 20-30 años menor que los pacientes con VAT estenóticas23-26. Desde el punto de vista morfológico, la calcificación parece suceder de manera similar a lo que ocurre en la VAT. Las investigaciones actuales tratan de dilucidar si la variabilidad en la edad de presentación de la calcificación en la VAB respecto a la VAT se debe predominantemente a factores mecánicos o genéticos1,15. El manejo de la estenosis aórtica y de la insuficiencia aórtica debe ser el mismo en los pacientes con VAB que en aquellos con VAT, siguiendo las guías de práctica clínica actuales14,27,28.
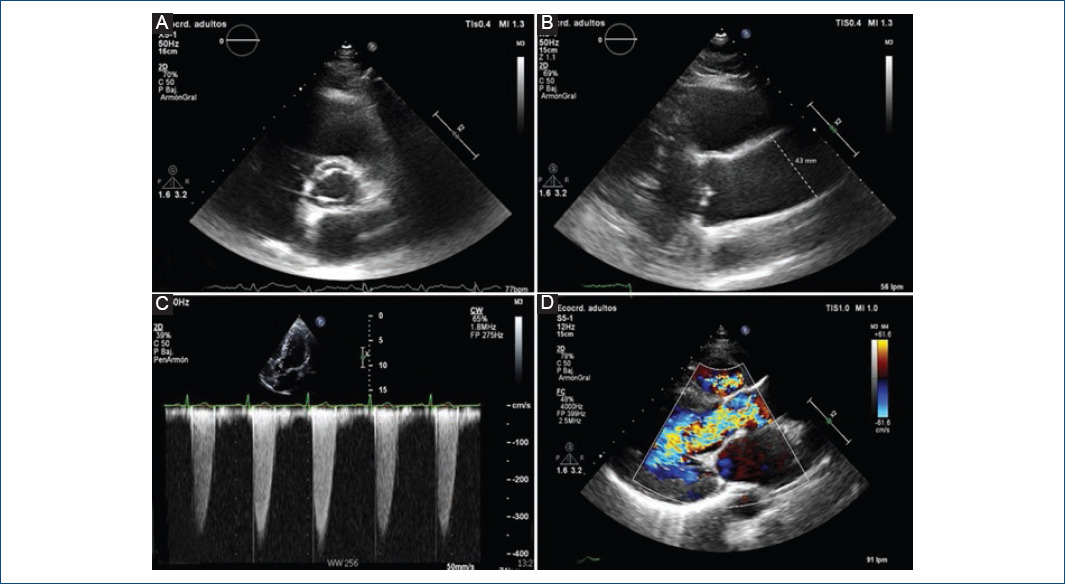
Figura 3 Imágenes de ecocardiograma transtorácico. A: visión en paraesternal en el eje corto en la que se observa una válvula aórtica bicúspide de tipo 1 (fusión de los velos coronarianos derecho e izquierdo) abierta en sístole. B: plano a nivel de la raíz de la aorta y la aorta ascendente que evidencia una importante dilatación aórtica (43 mm). C: gradiente transvalvular aórtico mediante Doppler continuo que muestra velocidades y gradientes elevados propios de una estenosis aórtica significativa. D: mediante Doppler color se ve un chorro de regurgitación diastólico que ocupa todo el tracto de salida del ventrículo izquierdo, propio de una insuficiencia aórtica grave, en un paciente con valvulopatía bicúspide.
La asociación más frecuente es con dilatación y aneurismas en la aorta torácica, por lo que en algunas publicaciones actuales las engloban dentro del mismo síndrome (Fig. 4). Está demostrado que los pacientes con VAB, en comparación con los que presentan VAT, tienen mayor riesgo de desarrollar dilatación de aorta ascendente y disección aórtica5,15. Sin embargo, los datos sobre la prevalencia de la asociación son variables (33-80% de los casos de VAB), quizá debido, aparte de a la propia heterogeneidad de la enfermedad, a la falta de consenso en los estudios sobre las medidas para definir dilatación, las técnicas de imagen usadas, la región de la aorta considerada, etc. Existe discordancia acerca de si el distinto morfotipo valvular bicúspide es o no un predictor de mayor riesgo de dilatación aórtica23,29. La etiología y la patogénesis de la dilatación aórtica en los pacientes con VAB es incierta hasta la fecha, pero se plantean dos teorías. Hay autores que abogan por la hipótesis hemodinámica-mecánica. El estrés mecánico sobre la pared aórtica ha sido estudiado mediante el análisis de los flujos por RM cuatridimensional. Debido a la apertura anómala de la VAB se forma un flujo excéntrico dirigido contra la pared aórtica, y sería esta fuerza tangencial constante la que termina por generar la dilatación29,30. Otros autores apoyan la hipótesis genética, que postula que existen unas alteraciones genéticas comunes al riesgo de desarrollo de aneurismas aórticos y a la aparición de VAB. El hecho de que la aortopatía se haya demostrado más frecuente en familiares de primer grado de individuos con VAB apoya esta teoría21. También es conocida la estrecha relación en el desarrollo embrionario entre las válvulas semilunares y el remodelado de la raíz de la aorta y la aorta ascendente; y a su vez, está demostrada la participación de las células de la cresta neural tanto en el desarrollo valvular como en el desarrollo de la pared aórtica31. Como resultado de ello, las alteraciones en las señales intracelulares e intercelulares podrían justificar la coexistencia de ambas patologías.
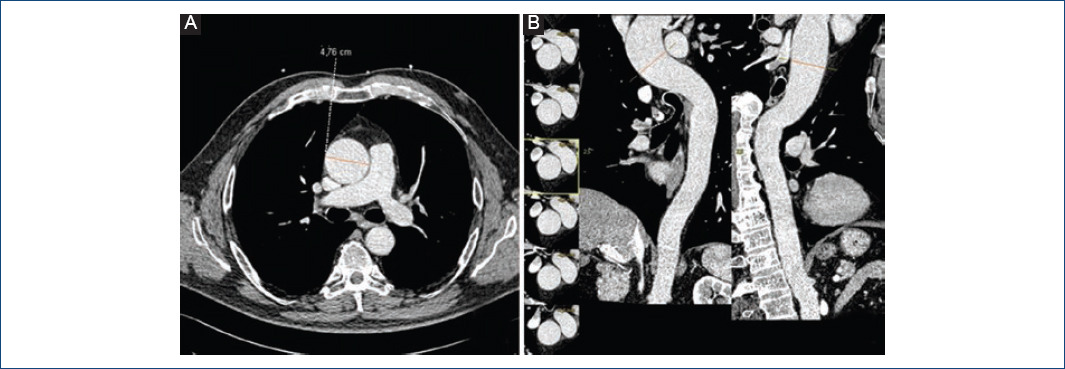
Figura 4 Tomografía computarizada de aorta. A: plano axial a nivel de los grandes vasos que muestra una dilatación importante de la aorta ascendente torácica (4.76 mm). B: reconstrucciones oblicuas de la aorta en las que se observa la dilatación de la aorta ascendente.
Una complicación no valvular, pero muy temida, es la disección aórtica. Los pacientes con VAB tienen mayor prevalencia de dilatación aórtica y, por ende, mayor riesgo en estos casos de disección aórtica, una patología aguda que condiciona una alta mortalidad cuando aparece. Suele tener lugar en la aorta ascendente23. Si bien la incidencia descrita es variable, en las grandes series poblacionales de seguimiento es baja (< 0.5%)23-25. En la infancia, las disecciones aórticas son muy raras. Sin embargo, en casos de síndrome de Marfan con dilatación de la pared aórtica sí existe mayor riesgo de disección aórtica en la infancia o en la adolescencia, hecho que asocia una alta morbimortalidad en estos pacientes32.
Otra complicación no valvular que clásicamente se relacionó con la VAB es la endocarditis infecciosa. El riesgo de endocarditis descrito en las primeras series era muy alto (10-30%)2, por lo que las guías de práctica clínica recomendaban realizar profilaxis antibiótica a todos los pacientes con VAB. Sin embargo, series más recientes y de mayor envergadura estiman que la incidencia de endocarditis en este subgrupo poblacional es mucho menor, del 0.3-2%23,24. Por este motivo, las actuales guías europeas y americanas de práctica clínica no recomiendan realizar profilaxis antibiótica en estos pacientes, excepto en aquellos con antecedente de endocarditis33.
A pesar de todas estas posibles complicaciones, las series de seguimiento de cohortes confirman un hecho importante: en la era actual, los individuos con VAB no tienen menor esperanza de vida que el resto de la población. En adultos asintomáticos con VAB y diferentes grados de disfunción valvular, la supervivencia a 10 años fue del 96 ± 1%24, y en adultos asintomáticos con VAB sin disfunción valvular significativa la supervivencia a 20 años fue del 90 ± 3%23.
En cuanto al seguimiento de los pacientes, va a depender de los síntomas y de la aparición de complicaciones. Se suelen realizar ecocardiogramas transtorácicos periódicos durante el seguimiento de un paciente asintomático con el fin de descartar la aparición de complicaciones silentes, como disfunción valvular o dilatación de aorta. Cuando existe disfunción valvular se siguen las recomendaciones de las guías de práctica clínica14,27,28 para valvulopatías: en caso de insuficiencia leve-moderada se realizará ecocardiograma cada 2 años, y si es grave, al año; en caso de estenosis, si la calcificación es importante en rango de leve-moderada, se realizará ecocardiograma cada año, y si es grave, cada 6 meses. Si existe dilatación de aorta ascendente o de raíz de aorta se recomienda la realización de un control mediante una técnica de imagen una vez al año. Es cierto que, si existe una adecuada ventana acústica, la ecocardiografía transtorácica es útil para realizar las medidas aórticas en el seguimiento del paciente, pero muchas veces esta ventana no resulta óptima y puede generar errores de medición. La RM y la TC usan una técnica de medición «doble oblicua» que proporciona una medida más exacta del segmento aórtico15. Cualquier aumento en el diámetro aórtico se recomienda confirmarlo con TC o RM. De ello se deriva que haya autores que defiendan que el seguimiento del paciente con dilatación aórtica se realice con estas pruebas de imagen.
Tratamiento quirúrgico, ¿cuándo está indicado?
Las indicaciones para actuar sobre la disfunción valvular en los pacientes con VAB son las mismas que en aquellos con VAT. Según las guías, a los pacientes sintomáticos con disfunción valvular grave, tanto insuficiencia como estenosis, se les debe ofrecer la intervención sobre la válvula14,27,28. Además, también debe recomendarse a pacientes que estén asintomáticos, pero con una insuficiencia grave con fracción de eyección del ventrículo izquierdo < 50%, diámetro telediastólico del ventrículo izquierdo > 70 mm o diámetro telesistólico del ventrículo izquierdo > 50 mm27,28. En los pacientes asintomáticos que se vayan a someter a otra cirugía cardiaca debe considerarse la actuación sobre la válvula aórtica en caso de disfunción valvular grave28. El recambio valvular por una prótesis mecánica o biológica es el tratamiento de elección, con una tasa de supervivencia a 15 años de alrededor del 80%15. La tasa de complicaciones al año es del 3-5%34. Hay que tener en cuenta que, en el caso de la VAB, al ser pacientes más jóvenes, con una mayor esperanza de vida, son más susceptibles de tener complicaciones derivadas del recambio protésico, ya sean secundarias a la necesidad de anticoagulación, riesgo de trombosis o tromboembolia en las prótesis mecánicas, degeneración protésica en las biológicas, o padecer una endocarditis en ambas34. Aunque el reemplazo valvular es el procedimiento estándar, debe considerarse la reparación de la válvula aórtica en centros con alta experiencia, ya que se ha comprobado su durabilidad a largo plazo y con menor tasa de complicaciones que la sustitución valvular. En los pacientes con comorbilidad, no susceptibles de cirugía cardiaca, se debe considerar la realización de un recambio valvular percutáneo34,35. La realización de TAVI (transcatheter aortic valve implantation) en pacientes con VAB presenta un mayor grado de complejidad, y precisa un estudio pormenorizado del anillo aórtico y la elección de la prótesis más adecuada de manera individual; y continúa teniendo peores resultados que en pacientes con VAT35. Si bien en un metaanálisis se describen similares mortalidad, necesidad de implante de marcapasos y tasa de ictus en comparación con la estenosis aórtica tricúspide, sigue demostrándose que los sujetos con VAB tienen una tasa de éxito significativamente menor con el implante, mayores complicaciones periprocedimiento, más insuficiencia paraprotésica residual moderada/grave y una tasa más alta de reconversión quirúrgica35.
Otros aspectos
Tratamiento médico
Se recomienda un control exquisito de las cifras de presión arterial en estos pacientes14. Además, con un nivel de evidencia bajo y extrapolado de estudios realizados en población con enfermedades del tejido conectivo, fundamentalmente síndrome de Marfan, se recomienda el uso de betabloqueantes y de inhibidores del sistema renina-angiotensina como fármacos preferentes14.
Embarazo
El embarazo no va a suponer un problema para una mujer sin disfunción valvular significativa y sin dilatación de la raíz de aorta1,15. La insuficiencia valvular aórtica suele ser bien tolerada por las mujeres sanas durante el embarazo. No sucede esto con la estenosis aórtica moderada o grave, que genera mayores problemas de salud cardiovascular con frecuentes descompensaciones y necesidad de hospitalización por insuficiencia cardiaca36,37. Por ello, se recomienda evitar el embarazo si se conoce una estenosis significativa. En caso de ser desconocida, cabe la posibilidad de realizar una valvuloplastia aórtica de rescate si llega a ser necesario. El embarazo con dilatación aórtica suele ser seguro, siendo las disecciones un evento infrecuente37. En las guías de práctica clínica no se recomienda el embarazo en las pacientes con dilatación aortica grave (enfermedades hereditarias de la aorta torácica, como síndrome de Marfan > 45 mm, VAB > 50 mm, dimensión aórtica > 27 mm/m2 de superficie corporal), si bien no hay suficiente evidencia científica detrás de esta recomendación de expertos37. Se recomienda realizar ecografías seriadas durante el embarazo si existe diagnóstico de dilatación aórtica38.
Ejercicio físico
Dado que la VAB afecta a pacientes jóvenes, son importantes las recomendaciones respecto al ejercicio físico. No obstante, hay pocos datos científicos acerca de este tema. Demostrado el beneficio del ejercicio físico para la salud, todo médico debe realizar recomendaciones sobre este a sus pacientes con VAB7. Para los pacientes sintomáticos se recomienda evitar el ejercicio; para los asintomáticos con insuficiencia grave que asocie dilatación del ventrículo izquierdo o estenosis grave se recomienda no participar en competiciones deportivas y no realizar sobreesfuerzos14,39. En aquellos con o sin disfunción valvular significativa que tengan dilatación de la raíz de la aorta (> 40 mm) se recomienda solo ejercicio moderado y no participar en competiciones deportivas de alta intensidad, ni realizar ejercicios isométricos39. Hay muchos pacientes asintomáticos con VAB y disfunción valvular leve-moderada que desean realizar ejercicio físico por placer o por sus beneficios para la salud; aunque no existe evidencia científica al respecto, la recomendación es que pueden realizar ejercicio físico moderado. Se les debe aconsejar que, ante cualquier síntoma tipo angina, palpitaciones o disnea, deben detener el ejercicio. Por último, es importante tener presente que a los pacientes con VAB sin disfunción valvular ni dilatación de la raíz de la aorta (< 40 mm) no se les deben recomendar restricciones respecto al ejercicio físico7,39.











 nueva página del texto (beta)
nueva página del texto (beta)


