Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.79 supl.2 Ciudad de México dic. 2009
PARTE II
Investigación Clínica
Control neural de la circulación periférica y de la presión arterial
Neural control of the peripheral circulation and blood pressure
Bruno Estañol,1 Manuel Porras–Betancourt,1 Gustavo Sánchez–Torres,2 Raúl Martínez–Memije,2 Oscar Infante,2 Horacio Sentíes–Madrid1
1 Laboratorio de Neurofisiología Clínica. Departamento de Neurología y Psiquiatría. Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán. México, D. F.
2 Departamento de Instrumentación Electromecánica. Instituto Nacional de Cardiología Ignacio Chávez. México, D. F.
Correspondencia:
Dr. Bruno Estañol.
Instituto Nacional de Ciencias Médicas y Nutrición Salvador Zubirán.
Vasco de Quiroga No. 15. Colonia Sección XVI.
Delegación Tlalpan. C.P. 14000. México, D. F.
Correo electrónico: bestanol@hotmail.com
Recibido el 24 de noviembre de 2008;
Aceptado el 20 de julio de 2009.
Resumen
En el siglo XIX, Claude Bernard descubrió la acción del sistema nervioso sobre el control de la circulación periférica. A principios del siglo XX, Ewald Hering descubrió el barorreceptor arterial y estudió el control reflejo de la frecuencia cardiaca y de la tensión arterial. Cowley y Guyton demostraron que la denervación de los barorreceptores de la carótida y de la aorta produce cambios persistentes en la tensión arterial en el animal experimental. El sistema nervioso autónomo es el principal regulador neural de la circulación y de la tensión arterial a corto plazo y latido a latido y ejerce su función mediante diversos reflejos que regulan el tono vasomotor, la frecuencia cardiaca y el gasto cardiaco. Con los nuevos métodos no invasivos que miden la tensión arterial latido a latido como el Finapres y con los métodos de medición de la variabilidad espectral de la frecuencia cardiaca y la tensión arterial, es posible en la actualidad medir muchas de las variables que regulan la circulación periférica y la tensión arterial. En este trabajo se presenta una revisión del control neural de la tensión arterial y de la frecuencia cardiaca, una breve reseña histórica y datos obtenidos con la medición de la tensión arterial latido a latido de manera no invasiva utilizando el sistema conocido como Finapres.
Palabras clave: Barorreceptor; Tensión arterial; Frecuencia cardiaca; Análisis espectral; México.
Abstract
In the XIX century Claude Bernard discovered the action of the nervous system on the peripheral circulation. In the first half of the XX century Ewald Hering discovered the baro–receptor and the reflex control of the heart rate and blood pressure. Cowley and Guyton demonstrated that that sino–aortic denervation induces persistent changes in the blood pressure in the dog. The autonomic nervous system is mainly responsible for the regulation of the circulation and blood pressure in the short term on a beat to beat basis. It controls the vasomotor tone, the heart rate and the cardiac output. With the advent of non invasive methods that measure the blood pressure on a beat to beat basis (Finapres) and with the methods of measurement of the variability of the blood pressure in the frequency domain (spectral analysis) we can currently measure many variables including heart rate, blood pressure, stroke volume, peripheral resistances and the baroreceptor sensitivity and make some inferences about their control mechanisms. These variables can be measured at rest in the supine position, standing up, during rhythmic breathing and during the Valsalva maneuver. In this article we present a review of the neural control of the blood pressure and heart rate.
Key words: Baroreceptor; Blood pressure; Heart rate; Spectral analysis; Mexico.
Introducción
En 1852 Claude Bernard (1815–1878), al estudiar la influencia de los nervios simpáticos sobre la temperatura de la oreja del conejo, descubrió que la destrucción del simpático cervical aumentaba la temperatura y producía enrojecimiento de la propia oreja. Para explicar estos cambios postuló la hipótesis de un tono vasomotor dado por el sistema nervioso simpático, ya que supuso que la pérdida de ese tono era lo que determinaba la vasodilatación cutánea.1
En el siglo XIX se descubrió que la tensión arterial presenta oscilaciones sincrónicas con la respiración y otras más lentas. las primeras, relacionadas con la respiración, se llaman ondas de Traube–Hering y las más lentas, no respiratorias, se denominan ondas de Mayer.2,3
En 1923, Heinrich Ewald Hering (1886–1948)3 descubre el reflejo barorreceptor. Remak había hecho la observación clínica de que en el ser humano el masaje del seno carotídeo producía bradicardia.4 Hering dedujo que debía existir un mecanismo regulador de la frecuencia cardiaca en el seno carotídeo y sometió esa hipótesis a su verificación experimental: colgó un peso de 64 gramos en el seno carotídeo de un perro y produjo taquicardia e hipotensión. Al retirar el peso se indujo bradicardia e hipertensión. Estos hallazgos se corroboran cuando la estimulación eléctrica del nervio del seno carotídeo produce bradicardia e hipotensión.4 Nueve años después, lord Edgar Douglas Adrian (1889–1977) descubre la base fisiológica del tono vasomotor: los nervios simpáticos descargan en forma tónica entre 2 a 3 Hz y mantienen una contracción uniforme y sostenida a lo largo de los vasos resistentes.5 Más tarde, Cowley y Guyton demostraron que la denervación de los barorreceptores de la carótida y de la aorta en el perro produce oscilaciones lentas y de gran amplitud en la tensión arterial perdurables para toda la vida del animal y que se deben a la imposibilidad de controlar la tensión arterial por parte del barorreceptor.6
A fines del siglo XX se descubrió que existe unidad entre el endotelio y el músculo liso arteriolar, y que los vasos sanguíneos que proporcionan la resistencia vascular cuentan con una densa inervación de nervios periféricos amielínicos muy delgados de tipo C, que conducen a una velocidad de 1.5 metro por segundo.7
Se redescubre que la frecuencia cardiaca, la tensión arterial sistólica y las fibras nerviosas autónomas que inervan los vasos musculares muestran oscilaciones respiratorias y no respiratorias similares a las descritas por ludwig Traube, Ewald Hering y Sigmund Mayer.8–19
Dentro del estudio de la regulación neural de la circulación hay aportaciones provenientes de españoles y mexicanos como las realizadas por los doctores José Joaquín Izquierdo (mecanismos de regulación de la circulación esplácnica), Isaac Costero (estructura histológica del cuerpo carotídeo), Fernando De Castro (estructura histológica del mecanorreceptor del seno carotídeo) y Arturo Rosenblueth (hipersensibilidad de los vasos sanguíneos denervados).7–12 Parte de este artículo fue publicada en el libro Tecnología en desarrollo puntal para la evolución de la cardiología.26
Regulación neural
La circulación periférica está regulada por mecanismos nerviosos y otros propios del sistema circulatorio. los primeros de éstos proporcionan una regulación rápida de la circulación y además controlan grandes porciones del sistema vascular de manera simultánea.6,13
El sistema nervioso autónomo (SNA) es el encargado de regular a la circulación; se divide en dos partes relativamente antagónicas denominadas sistema nervioso simpático (SNS) y sistema nervioso parasimpático (SNP). El SNS se origina de las columnas intermediolaterales de la médula espinal comprendida entre los segmentos T1 y l2 cuyas raíces se conectan con ganglios paravertebrales a su vez interconectados entre sí para conformar las llamadas cadenas simpáticas, de donde salen las fibras postganglionares hasta el órgano efector. El SNP se origina de los núcleos de los nervios craneales III, VII, IX y X, y de las columnas intermediolaterales de los segmentos medulares sacros segundo a cuarto. Sus fibras llegan a ganglios que están cercanos a los órganos efectores y de allí se originan las fibras postganglionares. De las fibras parasimpáticas, 75% se encuentra en los nervios vagos. Ambos componentes tienen aferencias hacia el sistema nervioso central, en especial hacia el sistema reticular activador ascendente del tallo encefálico.6,13
De las dos divisiones, la parte más importante en el control de la vasculatura le corresponde al SNS, mientras que el SNP tiene mayor influencia sobre la regulación cardiaca. El SNS inerva a casi todos los vasos sanguíneos, con predominio de las arteriolas, que se consideran como los vasos de resistencia. El SNP inerva a los vasos sanguíneos de las porciones craneales y sacras. la inervación simpática del corazón produce aumento de la fuerza de contracción y de la frecuencia cardiaca, mientras que la inervación parasimpática tiene el efecto opuesto.13
Regulación neural central de la circulación
La regulación central del tono vascular está dada por el centro vasomotor de la sustancia reticular del bulbo y del tercio inferior de la protuberancia. Este centro vasomotor consta de un área vasoconstrictora productora de noradrenalina (NA), C–1, localizada en la región anterolateral de la parte superior del bulbo, la que proyecta sus fibras a las neuronas simpáticas de la médula espinal; un área vasodilatadora, A–1, de localización más baja con respecto a la previa y que inhibe la acción de C–1, y un área sensitiva, A–2, localizada en el haz solitario, cuyas aferencias proceden de los nervios vagos y glosofaríngeos y es una de las estructuras más importantes para la integración del reflejo del barorreceptor (BR). las eferencias se conectan con los núcleos C–1 y A–1 para regular su función. las porciones laterales del centro vasomotor ejercen un efecto excitatorio sobre la función cardiaca, mientras que la porción medial tiene una función inhibitoria efectuada a través del nervio vago. El centro vasomotor también está controlado por áreas superiores, como la sustancia reticular de la protuberancia, mesencéfalo y diencéfalo, así como el hipotálamo y la corteza cerebral, en particular la parte anterior del lóbulo temporal, el área frontoorbitaria, la circunvolución del cuerpo calloso, la amígdala, el septum pellucidum y el hipocampo; todas éstas pueden tanto excitar como inhibir, de acuerdo con la porción que se active.13
Estas áreas se interrelacionan con las estructuras que influyen en la liberación de hormonas, la respuesta al estrés, las emociones, el control de la homeostasis y el ciclo circadiano, por lo que se reconocen variaciones en la función del sistema nervioso autónomo (SNA) supeditadas a la hora del día, el estado de ánimo, el grado de estrés y la homeostasis, entre otras. la integración neuroendocrina es muy importante en el control de la tensión arterial, sobre todo el sistema renina–angiotensina, pero no es tema de esta revisión.
Regulación neural periférica de la circulación
Para ejercer su función, el SNA recibe diversas señales de los barorreceptores, los cuales se encuentran en las paredes de los vasos sanguíneos, las cavidades cardiacas, la pared torácica y en los músculos. Estos receptores pueden detectar cambios en la presión arterial, en la presión arterial de O2 y CO2, el pH y la composición química del plasma. Los barorreceptores (BR) pueden ser sensibles a cambios lentos o rápidos en la deformación de la pared del vaso arterial y venoso (low pressure and high pressure baro receptors).
Dentro de los receptores se tiene a los BR, que detectan cambios en la presión arterial (PA), y a los quimiorreceptores (QR), cuya activación depende de los cambios en la composición química del plasma. Otro tipo de receptores, como los nociceptores, también pueden participar en la regulación.
Estos receptores participan en la integración de reflejos que permiten mantener una circulación con el mínimo de variaciones, puesto que ejercen directamente su acción sobre el SNA, el sistema cardiovascular y regulan la liberación de hormonas.14 la integración de estos mecanismos se explica en la Figura 1.
A continuación se describen los principales receptores y reflejos involucrados.
Reflejo axónico venoarteriolar
Cuando la presión intravenosa de las extremidades aumenta por encima de 25 mmHg (por ejemplo, al ponerse de pie la persona, o al inflarse un manguillo que ocluya la circulación venosa pero no la arterial) se estimula un reflejo axónico local que causa vasoconstricción de las arterias locales de la piel, de los músculos y el tejido adiposo,15 lo cual puede aumentar alrededor de 40% las resistencias vasculares periféricas (RVP).14
Reflejos cardiopulmonares
Hay varios receptores localizados en la cavidad torácica. Con base en su localización, pueden aumentar o disminuir las RVP y la frecuencia cardiaca (FC).16 También hay mecanorreceptores en las cavidades cardiacas, en particular en las aurículas, con aferencias vagales que inhiben el centro vasomotor. Estos receptores ejercen una inhibición tónica que es más evidente al aumentar el volumen dentro de las cavidades cardiacas. Cuando disminuye el volumen sanguíneo, se produce un reflejo que activa al SNS y que, a su vez, causa vasoconstricción, aumento de las RVP y disminución de la capacitancia venosa.14 Esto también inhibe la liberación de hormona antidiurética17,18 y del factor auricular natriurético.14
También se encuentran aferentes simpáticas mielinizadas que cuando se activan llegan al núcleo del haz solitario en el bulbo raquídeo y cuya función es la de aumentar las RVP, la función cardiaca y renal, así como inhibir al SNP. Si estas fibras se estimulan a bajas frecuencias producen un efecto depresor.19
Receptores pulmonares al estiramiento
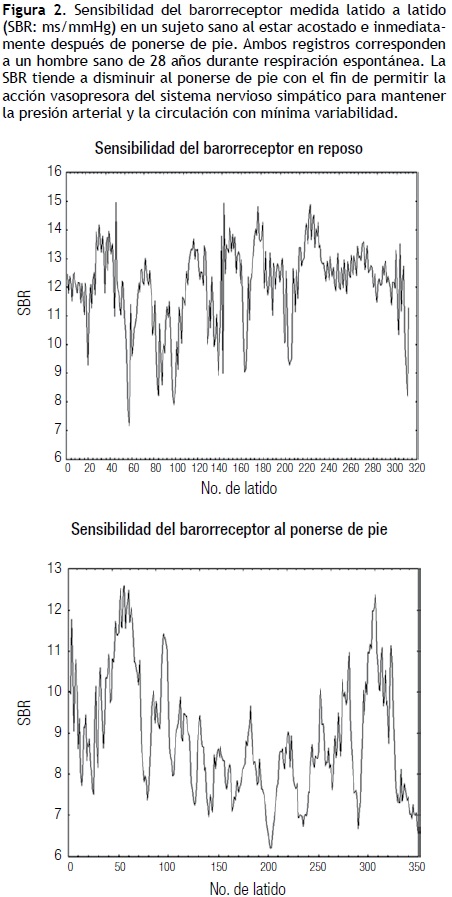
las aferencias vagales de los pulmones que son sensibles al estiramiento causan inhibición de la función simpática vascular, así como variaciones en la actividad del BR, que se sincroniza con la respiración; lo anterior lo logran mediante inhibición central del núcleo ambiguo en la inspiración y activación en la espiración.14,19,20 Esto lleva a que la PA se sincronice con la respiración, lo que se conoce como ondas respiratorias u ondas de Traube–Hering, tal como se muestran en la Figura 2. Durante el inicio de la espiración, hay disminución de la FC, de la contracción cardiaca, de las RVP y de la velocidad de conducción auriculoventricular por aumento de la actividad vagal cardioinhibidora, mientras que durante la inspiración ocurre lo opuesto, así como atenuación de los reflejos cardioinhibidores. Todo lo anterior lleva a la coordinación ciclo por ciclo de la FC, RVP, tiempo y fuerza de contracción, volumen sistólico de ambos ventrículos y retorno venoso.21
Barorreceptores arteriales de alta presión y sus reflejos
a) Barorreceptores con aferentes parasimpáticas
Las estructuras sensibles a la presión mecánica se encuentran en la pared de la mayor parte de los vasos arteriales, aunque se identifican dos estructuras principales de este tipo: el seno carotídeo y el seno aórtico. Ambos cuentan con inervación aferente parasimpática proporcionada por el nervio glosofaríngeo mediante el nervio de Hering, en el primero, y por el vago en el segundo.
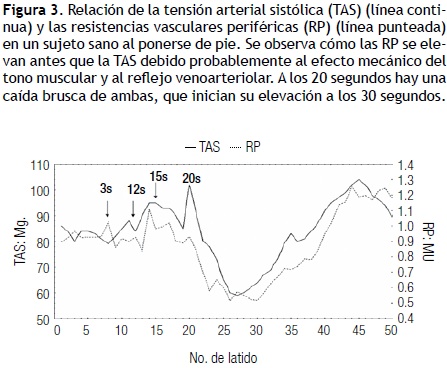
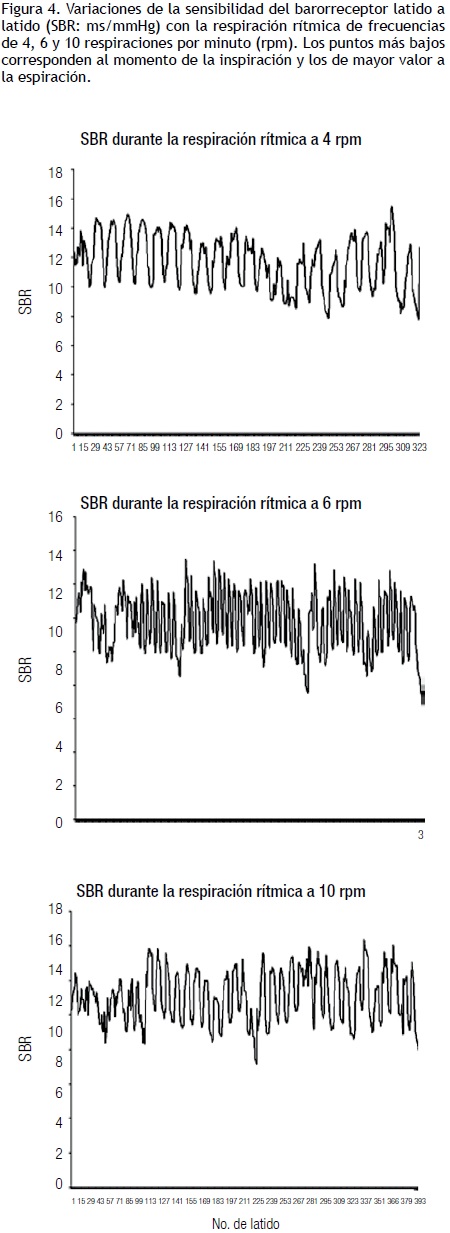
Estos receptores se activan por el aumento de presión sistólica, diastólica y del pulso sobre las paredes arteriales, lo que produce un reflejo que se integra en el núcleo del haz solitario que inhibe la acción simpática y conlleva la disminución de las RVP y de la PA, con aumento de la FC, la capacitancia venosa y el gasto cardiaco. la respuesta para mantener estable la presión arterial tiene una fase rápida mediada por el seno carotídeo y otra más lenta y estable mediada por el seno aórtico.14 Ambos BR poseen fibras mielínicas tipo A y amielínicas tipo C, con más abundancia de las primeras en el seno carotídeo y de las segundas en el seno aórtico. Este último se desempeña con presiones 30 a50 mmHg más altas que el seno carotídeo, lo que explica por qué el tiempo de reacción del seno carotídeo es más rápido que el del seno aórtico.22 Esta función está supeditada a la sensibilidad del barorreceptor (SBR), la cual es mayor al estar acostado y tiende a disminuir el estar de pie, lo que se evidencia con el cambio de posición de la primera a la segunda (Figura 2). la SBR es mayor a presiones arteriales medias entre 50 y 100 mmHg, para disminuir en forma significativa con valores superiores de 150 a 160 mmHg.19,22 Al ponerse de pie, hay una elevación inicial de la PAy de las RVP seguida de una hipotensión súbita que dura unos cuantos segundos y que tiende a estabilizarse a los 30 segundos, lo que por lo regular se logra antes de los 5 minutos. Al mismo tiempo, hay aumento de la FC que se relaciona inversamente con la disminución de la PA, y se estabiliza en el mismo lapso.14 Esto también puede observarse con la maniobra de Valsalva (Figura 3). Al valorarse la densidad espectral de la PA, RVP y del intervalo R–R se puede observar que durante el reposo tienen una distribución de frecuencias amplia con picos mayores HF que lF, pero al estar de pie la densidad tiende a ser mayor a frecuencias bajas lF, con una notoria disminución del pico a frecuencias de 0.3 a 0.4 Hz (HF). Algunos autores han encontrado que el pico HF de la presión arterial tanto en reposo como de pie es significativamente menor que el pico HF observado en el intervalo R–R.14,17 En la hipertensión arterial la SBR tiende a ser menor y por lo tanto a tener menor capacidad de regulación.22 la SBR también varía y tiende a sincronizarse durante la respiración rítmica, durante la cual muestra una tendencia a ser mayor durante la fase inspiratoria y menor durante la fase espiratoria (Figura 4). El balance simpato–vagal se mide con el cociente HF/lF, que es menor cuando la persona está en posición supina y aumenta cuando la persona se pone de pie por la activación del simpático y del barorreceptor en estas condiciones. Es de gran utilidad para el análisis de la proporción relativa de acción del vago y del simpático.26 Estos registros se obtuvieron con el Finapres, que mide la presión latido a latido. la sensibilidad del barorreceptor se obtuvo latido a latido, con el cociente intervalo RR en ms/presión sistólica en mmHg. Se tomó la presión sistólica del latido previo como ha sido reportado en la literatura.14
Los BR pueden reajustarse o recalibrarse (baroreceptor resetting) cuando hay elevación sostenida de la presión arterial. Esto produce aumento en el umbral de activación, disminución de la sensibilidad y de la frecuencia máxima de descarga, que progresan conforme lo hace la hipertensión, y puede revertirse si esta última se controla en etapas iniciales. Este reajuste ejerce efectos nocivos al permitir que la PA se regule a niveles más altos, lo que llega a causar degeneración de las terminales nerviosas. El reajuste predomina sobre las fibras tipo A y es escaso sobre las tipo C, lo que apoya el concepto de que las fibras del seno carotídeo guardan una relación más estrecha con el control agudo de la PA, mientras que el seno aórtico ejerce un control a largo plazo.22
b) Barorreceptores con aferentes simpáticos
La inervación predominante en los vasos sanguíneos es la simpática, con escaso aporte parasimpático, salvo en las estructuras faciales y de los cuerpos cavernosos. Esta inervación simpática proporciona también vías aferentes al BR que transcurren por los nervios simpáticos hasta los ganglios de las raíces dorsales de la médula espinal. Estas terminaciones son más abundantes en las cavidades cardiacas, la vena cava, el pericardio, las venas y arterias pulmonares, las cuales son en extremo sensibles y al ser estimuladas provocan aumento de la PA, del volumen cardiaco y de la fuerza de contracción.19,22
Quimiorreceptores y sus reflejos
Los QR son células quimiosensibles a la disminución de la concentración de oxígeno y al aumento de dióxido de carbono y de hidrogeniones. Se encuentran ubicados en estructuras pequeñas sobre las paredes vasculares que son objeto de un importante aporte sanguíneo, de las cuales los más importantes son el cuerpo carotídeo y el cuerpo aórtico. la activación de estos cuerpos, al disminuir el flujo sanguíneo sobre los mismos con reducción de la concentración de oxígeno y aumento de la de dióxido de carbono e hidrogeniones, excita las fibras nerviosas parasimpáticas que van junto a las de los BR al centro vasomotor, lo que determina un aumento de la PA. los QR sólo actúan cuando la PA se halla por debajo de 80 mmHg.13
Además de estos QR, existen terminaciones vagales quimiosensibles que no son estimuladas por la hipoxia con tanta intensidad como los QR de los cuerpos vasculares. Dos cúmulos de terminaciones vagales quimiosensibles son los principales causantes del reflejo vasodilatador. Uno de ellos son los "receptores J" de fibras C pulmonares ubicados en el área de intercambio gaseoso y que son los causantes del reflejo pulmonar quimiodepresor. El otro se encuentra en el corazón y los grandes vasos, incluidas las arterias coronarias, que responden a prostaglandinas y bradicinina con incremento de la FC y la contractilidad de los músculos cardiaco y liso vascular.22
Otro tipo de QR se encuentra en las terminaciones simpáticas cardiacas, las cuales responden a ácido láctico, a prostaglandinas y, en menor grado, a bradicinina; lo hacen activando fibras C, que son las responsables del dolor cardiaco y de un reflejo vasopresor.22
Ergoceptores
Son aferentes amielínicas quimiosensibles de pequeño calibre que se localizan en el músculo esquelético cuya activación por lo metabolitos producidos durante el ejercicio aumenta la actividad simpática, la presión arterial y el flujo sanguíneo locales. Este reflejo se denomina quimiorreflejo muscular.14
Neurotransmisores y neuromoduladores
En el sistema nervioso central existen un gran número de interconexiones entre los centros y núcleos relacionadas con el control de la circulación periférica, entre los cuales el número de neurotransmisores y neuromoduladores también es grande. Dentro de las principales sustancias que actúan sobre las neuronas simpáticas preganglionares están la sustancia P, GABA, glutamato, adrenalina, NA y vasopresina. las que actúan en el bulbo ventrolateral son glutamato, acetilcolina (ACh), GABA, serotonina, encefalina, NA, adrenalina, neuropéptido Y (NPY), vasopresina, endotelina, óxido nítrico (ON), angiotensina II y el factor auricular natriurético. Sobre el núcleo del haz solitario tienen efecto el glutamato, ON, sustancia P, GABA, glicina, ACh, serotonina, NA, NPY, vasopresina, angiotensina II y adenosina.18 Estos neurotransmisores provienen de aferentes vagales, del glosofaríngeo y de otras estructuras centrales que no están bien caracterizadas.18
El SNS ejerce su efecto periférico mediante la liberación de NA y el SNP lo hace mediante ACh, pero en las terminaciones nerviosas cardiacas se liberan en forma simultánea otros tipos de sustancias neurotransmisoras y neuromoduladoras. Ejemplo de ello son el 5' –trifosfato de adenosina (ATP), el NPY, el polipéptido intestinal vasoactivo (VIP), la somatostatina, la sustancia P, el péptido relacionado con el gen de calcitonina, el ON y el monóxido de carbono; todos ellos tienen funciones sinérgicas o antagónicas al neurotransmisor con el que se liberan.23
Sistema nervioso intrínseco del corazón
Las fibras eferentes de los plexos cardiacos hacen sinapsis con los cuerpos neuronales que existen en ganglios intracardiacos. Estos cuerpos neuronales se localizan de manera preponderante en la superficie epicárdica, pero también dentro del miocardio y en los tejidos del sistema de conducción. El número y distribución de las neuronas intrínsecas varía en las diversas especies. Varios investigadores han estudiado las características anatómicas y fisiológicas de las neuronas intracardiacas y se ha encontrado que en el humano existen sobre todo en cinco regiones auriculares y en cinco regiones ventriculares. Este sistema nervioso intrínseco interactúa con las fibras eferentes de una manera compleja para mantener un gasto cardiaco adecuado. las neuronas intrínsecas también reciben inervación aferente de los mecanorreceptores y quimiorreceptores localizados en tejidos cardiovasculares y pulmonares. la importancia de este sistema nervioso intrínseco del corazón no goza todavía de suficiente reconocimiento. Hoy en día se piensa que este sistema puede funcionar como un "minicerebro" dentro del corazón, en donde la información neural es procesada e integrada y de esa manera se logra un ajuste final de varios procesos fisiológicos.23,29
Comentario final
La regulación neural de la circulación periférica y de la presión arterial es importante en el corto plazo y latido a latido. la regulación neural es un proceso complejo en el que intervienen mecanismos reflejos que detectan los cambios de la presión arterial y la composición química del plasma. Los barorreceptores tienen ubicaciones estratégicas, en primer lugar en los vasos sanguíneos, el corazón y la pared torácica, que es donde se originan las vías aferentes de importantes reflejos nerviosos locales y centrales que mantienen en equilibrio presión arterial, frecuencia cardiaca y gasto cardiaco, así como las resistencias vasculares periféricas. El reflejo barorreceptor es muy importante en la regulación a corto plazo de la tensión arterial, resistencias periféricas, volumen latido y frecuencia cardiaca. la denervación de estas estructuras en el animal experimental produce oscilaciones perdurables en la tensión arterial. Con la aplicación de técnicas no invasivas que pueden medir latido a latido la tensión arterial, la frecuencia cardiaca, el gasto cardiaco y las resistencias periféricas, así como con el uso de métodos espectrales para medir la variabilidad, se pueden estudiar diversas variables fisiológicas que permiten entender mejor los trastornos del sistema nervioso autónomo cardiovascular. En estos momentos se dispone también de métodos no lineales para estudiar la variabilidad de la presión arterial que por ahora sólo se utilizan en estudios de investigación, pero que es factible que en el futuro puedan aplicarse a la clínica. Entre otros, en estos métodos se incluyen las gráficas de Poincaré o lorenz, la medición de las dimensiones fraccionales y el caos determinista, reconocimiento de los atrayentes y el exponente de liapunov.23–25 Asimismo, acaba de aparecer una revisión excelente del control integral de la compleja función cardiovascular y de la presión arterial que toma en cuenta los factores hemodinámicos, humorales, hormonales, renovasculares y neurales.26 Para una revisión del llamado "complejo sistema nervioso intracardiaco", se puede consultar la revisión de Kukanova y Mravec27 y la excelente revisión de Gert J. Ter Horst.23
Parte de este artículo fue publicada en el libro Tecnología en desarrollo puntal para la evolución de la cardiología.
Bibliografía
1. Bernard C. Introducción al estudio de la medicina experimental. Traducción del Dr. José Joaquín Izquierdo. 3ª Ed. México, Universidad Nacional Autónoma de México 1994. (La primera edición de este libro fue publicada por la imprenta universitaria con el título: Bernard, creador de la medicina científica, 1942. [ Links ])
2. Bernard C. Sur les effects de la section de la portion encéphalique du grand sympatique. Mem Soc De Biol (C.R.), tomo IV, pp. 168. [ Links ]
3. GerdZimmer H. Heinrich Ewald Hering and the carotid sinus reflex. Clin Cardiol 2004;27:485–6. [ Links ]
4. Hering HE. Die karotissinusreflexe auf herz und gefasse, vom normalphysiologischen, patologisch–physiologischen un klinishcen standpunkt. Dresden, Steinkopff 1927. [ Links ]
5. Adrian ED, Bronk DW. Discharges in mammalian sympathetic nerves. J Physiol 1932;74:115–133. [ Links ]
6. Cowley AW, Guyton AC. Baroreceptor reflex contribution in angiotensin II induced hypertension. Physiol Rev 1992;72:231 –5. [ Links ]
7. Cannon WB, Rosenblueth A. The supersensitivity of denervated structures. New York, Macmillan 1949. [ Links ]
8. Cannon WB, Rosenblueth A. Autonomic neuro–effector systems. New York, MacMillan 1937. [ Links ]
9. Rosenblueth A. The transmission of nerve impulses at neuroeffector junctions and peripheral synapses. New York, MIT Press and Wiley 1959. [ Links ]
10. Costero I. The carotid body. Mexico. Monograph Instituto Nacional de Cardiología 1970. [ Links ]
11. De Castro F. Sur la structure et I innervattion du sinus carotidien de l'homme et des mammifères. Nouveaux faits sur I innervation et la fonction du glomus caroticum. Madrid, Trab lab Invest Biol Univ 1928;25:33. [ Links ]
12. Izquierdo JJ, Koch E. Über den einfluss der nervi splanchici auf den arteriellen blutdruchk des kanninchens. Z Kreisl Forsch 1930;22:735. [ Links ]
13. Guyton AC. Anatomía y fisiología del sistema nervioso. 2ª Ed. Madrid, España, Editorial Médica Panamericana 1994. [ Links ]
14. Low PA. Clinical autonomic disorders. Evaluation and management. 2nd Ed. Philadelphia, USA, Lippincott–Raven Publishers 1997:61–71. [ Links ]
15. Henriksen O, Serjsen P. Local reflex in microcirculation in human skeletal muscle. Acta Physiol Scand 1977; 99:19–26. [ Links ]
16. Shepherd JT. The lungs as receptor sites for cardiovascular regulation. Circulation 1981; 63:1–10. [ Links ]
17. Shepherd JT, Mancia G. Reflex control of the human cardiovascular system. Rev Physiol Biochem Pharmacol 1986; 105:1–99. [ Links ]
18. Mathias CJ, Bannister R. Autonomic failure. A textbook of clinical disorders of the autonomic nervous system. 4th Ed. Oxford, UK. Oxford University Press 1999. [ Links ]
19. Donald DE, Shepherd JT. Autonomic regulation of the peripheral circulation. Ann Rev Physiol 1980; 42:429–39. [ Links ]
20. Seals DR. Influence of lung volume on sympathetic nerve discharge in normal humans. Circ Res 1990; 67:130–41. [ Links ]
21. Feldman JI, Ellenberger HH. Central coordination of respiration and cardiovascular control in mammals. Ann Rev Physiol 1988; 50:593–606. [ Links ]
22. Coleridge HM, Coleridge JCG. Cardiovascular afferents involved in regulation of peripheral vessels. Ann Rev Physiol 1980; 42:413–27. [ Links ]
23. Ter Horst GJ, Zipes DP. The nervous system and the heart. Neural supply to the heart. New Jersey, USA, Humana Press 2000:3–54. [ Links ]
24. Wagner CD, Persson PB. Chaos in the cardiovascular system: an update. Cardiovascular Res 1998;40:257–64. [ Links ]
25. Higgins JP. Nonlinear systems in medicine. Yale J Biol Med 2002;75:247–60. [ Links ]
26. Sánchez–Torres G, De León Peña A. Control cardiovascular: una visión integral. En: Sánchez Torres G (editor): Tecnología en desarrollo. Puntal en la evolución de la cardiología. México, Editorial Prado 2009:19–46. [ Links ]
27. Kukanova B, Mravic B. Complex intracardiac nervous system. Bratisl Lek Listy 2006;107:45–51. [ Links ]














