Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Archivos de cardiología de México
versión On-line ISSN 1665-1731versión impresa ISSN 1405-9940
Arch. Cardiol. Méx. vol.78 no.1 Ciudad de México ene./mar. 2008
Investigación básica
Modelo de estudio mediante microPET para la evaluación del metabolismo glucolítico en el miocardio de rata con 18F–FDG. Experiencia inicial en México
A method designed for the assessment of myocardial metabolism in rats with 18F–FDG using small–animal–PET. Initial experience in Mexico
Erick Alexánderson Rosas,*** Nayelli Ortega López,* Rafael Ojeda Flores,* Guillermo Mendoza Vázquez,* Gloria Adame Ocampo,* Aloha Meave González,*** Yolanda Saldaña Domínguez,* Pedro A Lamothe Molina,* Mónica Rodríguez Valero,* Leonardo García Rojas Castillo,* José Narro Robles*
* Universidad Nacional Autónoma de México (UNAM).
** Instituto Nacional de Cardiología Ignacio Chávez.
Correspondencia:
Dr. Erick Alexánderson Rosas.
Unidad PET/CT–Ciclotrón,
Edificio de Investigación, Planta Baja.
Facultad de Medicina, UNAM,
Ciudad Universitaria,
México, D.F. 04510.
Tel: 56232299/Fax: 56232115/
E–mail: alexanderick@yahoo.com.mx
Recibido: 8 de enero de 2008
Aceptado: 18 de enero de 2008
Resumen
Objetivos: Estandarizar un protocolo de adquisición para el estudio del metabolismo glucolítico miocárdico en ratas adultas.
Material y métodos: Se estudiaron 3 ratas macho adultas de la cepa Wistar en tres diferentes protocolos: el primero con acceso a libre demanda de comida y agua; el segundo con ayuno de 12 horas y el tercero con ayuno de 12 horas más la administración de una carga oral de glucosa al 50%. Se adquirieron imágenes del área torácica durante 30 minutos mediante el microPET; a los 30 y 60 minutos después de la administración de una dosis de 370 – 555 MBq de 18F–FDG por vía intraperitoneal. Se realizó un análisis comparativo y cualitativo de las imágenes obtenidas por dos médicos especialistas en el área.
Resultados: Se obtuvieron en total 18 estudios cardíacos; 6 para cada protocolo, donde se determinó que las mejores imágenes para fines de evaluación metabólica del miocardio fueron las correspondientes a los 60 minutos postadministración de la 18F–FDG del protocolo sin ayuno.
Conclusiones: Es factible establecer en nuestro servicio un protocolo válido para la valoración del metabolismo glucolítico, con el fin de utilizarlo en el estudio de viabilidad miocárdica en la cardiopatía isquémica.
Palabras clave: 18F–FDG. MicroPET. Viabilidad miocárdica.
Abstract
Purpouse: To standarize an acquisition protocol for the study of myocardial metabolism in adult rats.
Material and methods: Three Wistar adult male rats were studied in three different protocols: no fasting group, fasting group over a period of 12 hr before the study with only water provided ad libitum, and fasting group by the same time receiving an oral 50% glucose solution. Thirty–minute acquisition images were obtained with a micro–PET, thirty and sixty minutes after the administration of 370 – 555 MBq 18F–FDG. Comparative and visual analysis were performed by two experts in the field.
Results: Eigtheen studies were analyzed, six per group. The best images were those of the fist group, especially those taken at 60 minutes after the 18F–FDG administration.
Conclusion: It is possible to establish the non–fasting protocol for the assessment of myocardial metabolism to be used in the future for the myocardial viability evaluation in ischemic cardiopathy.
Key words: 18F–FDG. MicroPET. Myocardial viability.
Introducción
En las últimas décadas la incidencia de las enfermedades cardiovasculares ha aumentado de manera drástica a nivel mundial,1 especialmente en los países en vías de desarrollo, donde el estilo de vida se asemeja cada vez más a la observada en los países desarrollados, tanto por los hábitos higiénico–dietéticos (lo que conlleva a una mayor incidencia de obesidad y otras enfermedades crónico–degenerativas en el adulto joven) como un mayor número de personas sedentarias. Estadísticas del INEGI reportaron para fines del 2006 que la principal causa de muerte en nuestro país es la cardiopatía isquémica (CI) y entre ésta el infarto agudo del miocardio (IAM), con un promedio de 40 a 60 mil defunciones al año, especialmente en personas mayores de 65 años, seguida de padecimientos crónico–degenerativos como la diabetes mellitus y después los padecimientos oncológicos.2
En muchas ocasiones la enfermedad se manifiesta de manera inesperada, ya sea por infarto agudo de miocardio o bien por muerte súbita sin antecedentes clínicos relevantes, sin embargo, en otros casos, puede pasar inadvertido especialmente en los pacientes diabéticos. Dado estos antecedentes, se ha dirigido el diagnóstico hacia su detección precoz con el fin de intervenir la enfermedad en fases tempranas, evitando así repercusiones en la calidad de vida del paciente.
Actualmente se cuenta con una amplia gama de estudios tanto no invasivos como invasivos para el diagnóstico de la CI, por mencionar los más importantes están la ecocardiografía, la angiotomografía coronaria, la resonancia magnética (RM), la tomografía por emisión de fotón único (SPECT), la tomografía por emisión de positrones (PET) y la angiografía coronaria invasiva. Esto propicia la necesidad de definir la intervención más apropiada para cada paciente y evaluar su eficacia una vez que se elige el tratamiento. La utilidad en el diagnóstico de la isquemia miocárdica por las diferentes técnicas de imagen anteriormente mencionadas, ha sido reportada anteriormente en múltiples estudios,3–7 compitiendo por tener la mayor certeza diagnóstica en la determinación del tejido viable tras un evento de infarto miocárdico; donde se ha comprobado que los principales métodos diagnósticos utilizados para este fin son derivados de la medicina nuclear mediante el uso del SPECT utilizando cloruro de 201Talio con reinyección o bien, por medio del PET con un análogo de la glucosa como la desoxiglucosa marcada con 18Flúor (18F–FDG).8–11 Por el lado de la radiología la RM está demostrando ser tan efectiva como los estudios metabólicos con radiotrazadores prometiendo resultados alentadores en el diagnóstico de viabilidad miocárdica (VM).12–14
Actualmente el PET es uno de los métodos no invasivos que ofrece mayor precisión y por lo tanto certeza en el estudio de las diferentes vías metabólicas del corazón. Las aplicaciones clínicas más importantes en cardiología consisten en la evaluación de la viabilidad, metabolismo y perfusión miocárdica. Los trazadores frecuentemente usados para estudios del metabolismo son 18F–Flúor–2–desoxiglucosa (FDG), 11C–palmitato y 11C–acetato,15,16 y en el caso de perfusión el 13N–Amonio.
En humanos se han empleado distintos protocolos de PET con el fin de determinar VM, siendo hasta ahora el estudio de 18F–FDG el de mayor validez diagnóstica. Esto se puede explicar en base a que el miocardio en condiciones aeróbicas utiliza ácidos grasos en un 80% para sus requerimientos energéticos, sin embargo, durante un evento isquémico el miocardio cambia su metabolismo normal a ser dependiente de carbohidratos; siendo de esta manera el principio básico del uso del PET con un análogo de la glucosa como lo es la FDG.17
El estudio de la VM por PET en el área clínica está bien establecido, realizando el mismo en estado de ayuno mínimo de 8 horas, donde se determina el nivel de glucemia capilar, y en base al resultado se administra o no una carga oral de glucosa según los lineamientos establecidos por Schelbert y cols.18 Treinta minutos después, se administra una dosis de 10 mCi de 18F–FDG por vía intravenosa, dejando pasar entre 40 y 45 minutos después de administrar el trazador para la adquisición de las imágenes en el tomógrafo. Por tal motivo, el PET con 18F–FDG asociado a un estudio de perfusión (que puede ser con 13N–Amonio) permite la identificación, caracterización (miocardio hibernante) y cuantificación de la VM mediante la determinación de dos patrones: el patrón concordante («match»), caracterizado por la ausencia tanto de perfusión como de metabolismo (FDG), y el patrón discordante («mismatch»), que se caracteriza por la presencia de actividad metabólica (FDG) en ausencia de perfusión miocárdica. El valor predictivo positivo y predictivo negativo con la utilización de este método corresponde a un 83% y 84% respectivamente.17,19
Con el advenimiento de la imagenología molecular en los últimos 10 años, se ha fomentado la investigación básica como modelo de estudio de múltiples procesos fisiopatológicos en animales de experimentación (especialmente roedores pequeños), entre ellos la CI. A través del uso del microPET se han podido comprender múltiples vías patológicas; resultado de ello es la aplicación de nuevas terapias incluyendo genéticas, para la prevención y/o tratamiento de la isquemia miocárdica.20–27
El equipo de microPET es un tomógrafo en pequeña escala, diseñado especialmente para su uso en animales de experimentación, como son roedores de pequeño tamaño (ratas y ratones), conejos, reptiles y monos pequeños (en estos últimos especialmente para investigación neurológica), donde a través de la administración de fármacos, metabolitos, receptores o genes marcados con radiotrazadores se pueden estudiar múltiples vías metabólicas, fisiológicas o bien, procesos patológicos, para la investigación en el área de cardiología, neurología y oncología. Este equipo, presenta los mismos fundamentos físicos que un equipo PET de uso en humanos; consta de un anillo detector con cristales centelladores de germanato de bismuto (BGO) o de ortosilicato de lutecio (LSO), siendo estos últimos los más utilizados por su alta resolución espacial y otras características físicas que los hacen ideales.28
El equipo de microPET con el que cuenta la Unidad PET/CT Ciclotrón de la UNAM es el primero en su tipo en México y el resto de América Latina, por tal motivo, es de suma importancia establecer protocolos válidos con los que se permita proponer modelos experimentales para la realización de investigación básica relevante en el área de cardiología, dado que no existe la experiencia en nuestro país con el uso del microPET en corazón.
Objetivo
Demostrar cuál es el modelo de estudio más adecuado para el análisis del metabolismo cardíaco en ratas adultas.
Material y métodos
Animales
Se estudiaron 3 ratas macho adulto de la cepa Wistar, aparentemente sanas, con un peso promedio de 300 a 350 gramos. El manejo óptimo de los sujetos de experimentación se llevó a cabo bajo lineamientos de guías previamente establecidas.29
Los animales fueron estudiados en tres diferentes protocolos, todos ellos realizados en distintos tiempos (con al menos un día de diferencia entre cada uno), con el fin de utilizarlos como sus propios controles.
El diseño de los protocolos fue el siguiente: (1) sin ayuno (se les permitió libre acceso de comida y agua todo el tiempo, inclusive antes del estudio), (2) con ayuno (se restringió el acceso de comida 12 horas antes del estudio, sólo con acceso de agua a libre demanda) y (3) con ayuno con carga oral de glucosa (ayuno de 12 horas, con administración de una carga oral de glucosa al 50%, a una dosis de 0.4 mg de glucosa por gramo de peso corporal, 30 minutos antes de la administración de la 18F–FDG).
Estudio de microPET
Para cada protocolo se adquirieron dos rastreos de PET; el primero 30 minutos después de la administración de una dosis vía intraperitoneal de 370 – 555 MBq de 18F–FDG (como radiotrazador) y el segundo rastreo a los 60 minutos; esto con la finalidad de determinar cuál de las dos imágenes presentaba una mejor definición del miocardio ventricular.
El estudio de 18F–FDG se llevó a cabo bajo condiciones de anestesia a una dosis intramuscular de 10 mg/kg de ketamina aunada a una dosis intraperitoneal de 50 mg/kg de pentobarbital.
Los sujetos de experimentación se mantuvieron a temperatura ambiente, durante todo el desarrollo del trabajo.
Una vez anestesiados, los animales se colocaron en posición supina, con fijación externa de las cuatro extremidades; centrando el láser de posición a la altura del corazón para obtener imágenes de tórax. Se registró constantemente la frecuencia respiratoria así como el estado de sedación durante todo el tiempo de adquisición de las imágenes (Figs. 1a y 1b).
La adquisición de las imágenes se realizó en un equipo microPET Focus 120 de del tipo Concorde Microsystems LLC (SIEMENES Inc, Knox–ville, TN), el cual cuenta con un anillo detector de 17.2 cm de diámetro, con un campo de visión (FOV, por sus siglas en inglés) transaxial de 112 mm y 18 mm en el eje axial. El equipo se encuentra conformado por un total de 13,384 cristales detectores de LSO (Ortosilicato de Lutecio) de 1.5 x 1.5 x 1.0 mm cada uno.
La resolución intrínseca de los cristales en promedio es de 1.68 mm, con una resolución energética entre el 15 y 25% y un tiempo de resolución de 2.4 ns (nanosegundos) para fotones de 511 keV. Este equipo opera en modo 3D.
La resolución espacial del equipo es de 0.5 a 1.3 mm al centro de la cama para imágenes reconstruidas y su resolución volumétrica es de 8 mm3, el pico absoluto de sensibilidad es de 7.1%. La tasa de conteo está en el orden de las 800 kcps (kilocuentas por segundo) a una dosis de 88 MBq de radiotrazador.29
La reconstrucción de las imágenes se llevó a cabo con el algoritmo FBP utilizando un filtro de Rampa.
Resultados
El análisis de las imágenes se realizó de manera cualitativa por dos médicos, con el fin de evaluar la calidad de las imágenes y determinar cuál de las dos adquisiciones (30 o 60 minutos) resultaba más conveniente para el análisis de metabolismo miocárdico de la 18F–FDG.
Se obtuvieron imágenes en cortes axial, coronal y sagital en todos los estudios.
Comparación de las imágenes de 30 y 60 minutos
Se obtuvieron un total de 9 estudios por cada tiempo de adquisición, observando una mejor definición del área miocárdica en la imagen de 60 minutos en la mayoría de los casos (Fig. 2) especialmente para las imágenes de los protocolos 1 y 3; ya que en la imagen de 30 minutos aún se encuentra parte del radiotrazador por circulación sistémica, dando como resultado una cierta distribución de la 18F–FDG en tejidos blandos como son grasa parda, músculos torácicos (para–vertebrales e intercostales), mediastino y área pulmonar; en la imagen de 60 minutos dicha captación disminuye permitiendo una mayor definición de las paredes ventriculares para su adecuada valoración.
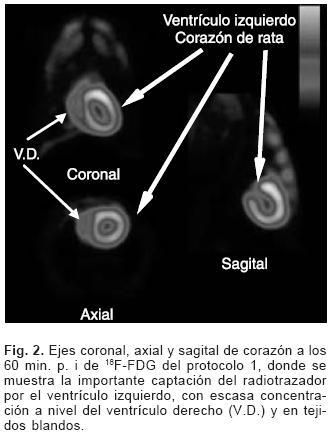
Comparación de las imágenes por tipo de protocolo
Tras la adquisición de los 3 protocolos, los 18 estudios obtenidos fueron analizados bajo las mismas condiciones de ventana de color, intensidad de gammas (máx. y mín.), esto con el fin de evitar la inadecuada manipulación de las mismas interpretando erróneamente las imágenes.
Con el protocolo 1 se obtuvieron las imágenes de mayor captación y definición de las paredes ventriculares izquierdas, especialmente con la imagen de 60 minutos. Como se muestra en las Figuras 3a y 3b se puede definir perfectamente el ventrículo izquierdo, parte del ventrículo derecho, con escasa captación del radiotrazador por tejidos blandos del tórax (Fig. 3c).
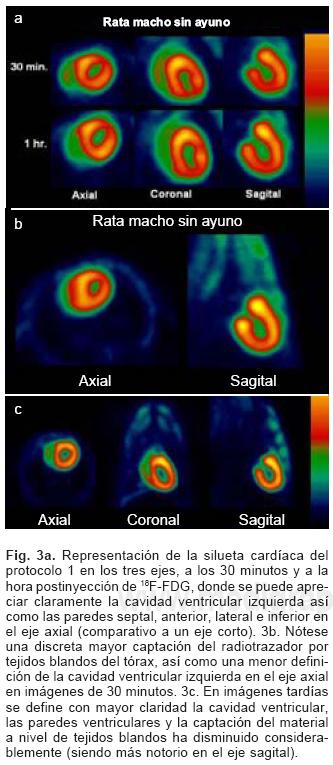
La calidad de imagen observada en el protocolo 1 se obtuvo sólo en un 50% de las imágenes del protocolo 3 (ayuno con carga de glucosa oral) pues en el resto, el grado de captación miocárdica fue menor, encontrando distribución de la 18F–FDG de manera importante a nivel muscular y grasa parda (Figs. 4a y b).
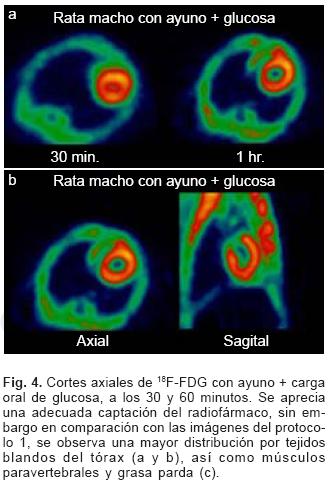
En el caso de las imágenes del protocolo 2, la captación del radiotrazador tanto por miocardio como en tejidos blandos del tórax es casi nula, sin poder definir completamente la silueta cardíaca en muchos casos (Figs. 5a y b).
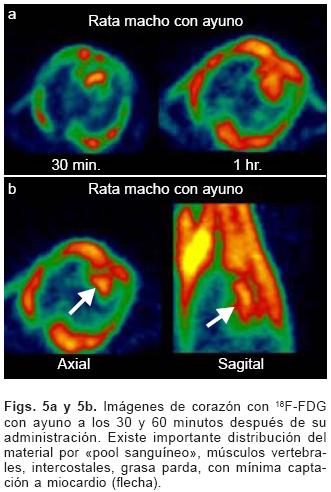
Discusión
El objetivo principal de la imagenología molecular mediante PET desarrollada en animales de experimentación como modelos de enfermedad es obtener información anatómica, fisiológica o bioquímica la cual comparte mucha similitud a la obtenida en los humanos; facilitando con esto, la correlación de los hallazgos obtenidos entre el área básica y la clínica. Además, la capacidad no invasiva de esta técnica imagenológica permite múltiples adquisiciones de un proceso en particular, facilitando así el estudio a través del tiempo de la progresión de la enfermedad o bien, de la respuesta terapéutica en el mismo animal. Así pues, la fisiopatología de la cardiopatía isquémica se ha traspolado al área de la investigación básica no sólo in vitro, sino también in vivo, donde resulta más factible poder realizar investigaciones para la intervención temprana del evento isquémico con resultados favorables.22–25
Como es sabido en condiciones normales, el flujo coronario aporta la suficiente cantidad de sustratos y oxígeno para los requerimientos de energía necesarios, cumpliendo así el adecuado funcionamiento y excreción celular. Cuando aumenta la demanda miocárdica, el flujo coronario puede llegar a aumentar entre 4 ó 6 veces, gracias a la vasodilatación secundaria a múltiples respuestas en el organismo: en condiciones no patológicas se puede mencionar el ejercicio físico, como ejemplo. El aumento se presenta de manera uniforme en los diferentes vasos coronarios y dicha capacidad de respuesta se denomina reserva funcional o reserva de flujo coronario.
En condiciones fisiológicas, los metabolitos llegan por la microcirculación siendo extraídos por los miocitos mediante diversos mecanismos, incluyendo procesos pasivos o por medio del transporte activo. El miocardio normal utiliza un 80% aproximadamente de ácidos grasos de cadena larga como fuente de energía, siendo la glucosa el sustrato adicional en estas circunstancias.16–19 En algunas ocasiones, el lactato puede llegar a ser fuente de energía. Estos metabolitos son metabolizados en el Ciclo de Krebs, obteniendo así ATP, H2O y CO2.30,31
Durante el ayuno se produce una lipólisis con el subsecuente aumento de ácidos grasos, lo que repercute en un aumento en su utilización. Por el contrario, en el postprandio existe un aumento de insulina produciéndose un aumento significativo de dicho metabolito por el miocardio, aumentando por consiguiente el uso de glucosa a través de proteínas transportadoras de glucosa dependientes de insulina (GLUT 1 y 4).17,32
Entendiendo este fenómeno fisiológico, se pueden explicar las características de las imágenes obtenidas en el protocolo 1 y 2, respectivamente; pues con la administración a libre demanda de alimento, se presentó una mayor captación del radiotrazador por el miocardio desde las imágenes tempranas, permitiendo una mejor definición de las paredes ventriculares en las imágenes tardías, asociado con menor captación de la 18F–FDG por tejidos blandos. En el caso de las imágenes de ayuno, se puede explicar el porqué casi no se visualiza la silueta cardíaca, pues bajo esas condiciones, el mayor aporte metabólico a nivel miocárdico está dado por los ácidos grasos, por lo que la 18F–FDG administrada se distribuye preferentemente a órganos vitales como es el cerebro, que en condiciones de ayuno, requiere glucosa como principal sustrato energético.
Convencionalmente los estudios de PET en humanos para la valoración de viabilidad miocárdica se realizan en condiciones de ayuno y si es posible, la suspensión de medicamentos cardiovasculares, tras la administración de una carga oral o intravenosa de glucosa. Sin embargo, múltiples estudios han reportado una variabilidad significativa en los niveles séricos de glucosa en los pacientes, haciendo difícil en ocasiones la determinación de una dosis apropiada para su adecuada distribución por el corazón. Es por esto que se ha propuesto el uso de insulina (especialmente en pacientes diabéticos) con el fin de establecer la llamada pinza (clamp) euglicémica–hiperinsulinémica, para asegurar una concentración estable de glucosa y así favorecer su captación por el tejido miocárdico; sin embargo este método resulta ser poco práctico, pues para obtener una mejor impregnación, se sugiere administrar de manera continua la insulina hasta completar la adquisición de las imágenes.18,33
Únicamente en la mitad de las imágenes obtenidas en el protocolo 3 se pudo valorar adecuadamente el corazón, dado que la absorción de la glucosa por vía oral puede variar de un animal a otro, además se deben tener en cuenta otros factores tales como la velocidad de absorción por la mucosa gástrica y duodenal, la velocidad de vaciamiento gástrico y el tránsito intestinal; lo que hace de esta técnica un método inespecífico con el cual se pueda lograr un estado metabólico ideal para la adecuada captación de la 18F–FDG por el miocardio.
Conclusiones
Actualmente los resultados obtenidos en roedores permiten evaluar alteraciones tanto perfusorias como metabólicas a nivel miocárdico, jugando un importante papel en el estudio de múltiples estados patológicos y no patológicos, como son la edad, obesidad, hipertensión arterial, hipertrofia ventricular, diabetes, e infarto al miocardio, entre otros.
El diseño de un protocolo adecuado en investigación básica para el estudio de estos y otros estados patológicos es de suma importancia dado la trascendencia que puede tener en el entendimiento y por consiguiente la intervención terapéuticaprecoz enelárea clínica.
El uso del microPET puede ser muy útil para el análisis molecular del metabolismo del corazón y puede generar un modelo útil para el estudio de la cardiopatía isquémica.
Agradecimientos
Adolfo Zárate Morales, Efraín Zamora Romo, Armando Flores Moreno, José Luis Alonso Morales.
Por el apoyo y tiempo brindado para la realización del presente trabajo.
Referencias
1. World Health Organization. Página Web disponible en: http://www.who.int/cardiovascular_diseases/prevention_control/en/ [ Links ]
2. Instituto Nacional de Estadística, Geografía e Informática. Página Web disponible en: http://www.inegi.gob.mx/est/default.aspx?c=2346 [ Links ]
3. Lefebvre C, Chénevert A, B ordeleau E, Ugolini P, Ouellet R, Sablayrolles J, et a: Coronary computed tomography angiography: overview of technical aspects, current concepts, and perspectives. Can Assoc Radiol J 2007; 58: 92–108. [ Links ]
4. Lombardo A, Rizzello V, Galiuto L, Natale L, Giordano A, Rebuzzi A, et al: Assessment of resting perfusion defects in patients with acute myocardial infarction: comparison of myocardial contrast echocardiography, combined first–pass/delayed contrast–enhanced magnetic resonance imaging and 99mTC–sestamibi SPECT. Int J Cardiovasc Imaging 2006; 22: 417–28. [ Links ]
5. Klein L, van Campen L, Sieswerda G, Kamp O, Visser C, Visser F: Glucose–insulin–potassium echocardiography detects improved segmental myocardial function and viable tissue shortly after acute myocardial infarction. J Am Soc Echocardiogr 2006; 19: 763–71. [ Links ]
6. Ropers D: Multislice computer tomography for detection of coronary artery disease. J interv Cardiol 2006; 19: 574–82. [ Links ]
7. Nikolaou K, Flohr T, Knez A, Rist C, Winters–perger B, Johnson T, et al: Advances in cardiac CT imaging: 64–slice scanner. Int J Cardiovascimaging. 2004; 20: 535–40. [ Links ]
8. Beanlands R, Dekemp R, Scheffel A, Nahmias C, Garnett S, Coates G: Can Nitrogen–13 Ammonia Kinetic Modeling Define Myocardial Viability Independent of Fluorine–18 Fluorodeoxyglucose? J Am Coll Cardiol 1997; 29: 537–43. [ Links ]
9. Slart R, Bax J, de Boer J, Willemsen A, Mook P, Oudkerk M, et al: Comparison of 99mTc–sesta–mibi/18FDG DISA SPECT with PET for the detection of viability in patients with coronary artery disease and left ventricular dysfunction. Eur J Nucl Med Mol imaging 2005; 32: 972–9. [ Links ]
10. Roelants V, Bernard X, Walrand S, Bol A, Coppens A, Jamart J, el al: Attenuation–corrected 99mTc–MIBI SPECT in overweight patients with chronic ischaemic dysfunction: a comparison to NH3 PET and implications for the diagnosis of myocardial viability. Nucl Med Commun 2006; 27: 815–21. [ Links ]
11. Meave A, Ricalde A, Sierra C F, García L, Alexánderson E: Estudio de la viabilidad miocárdica: Comparación de tomografía por emisión de positrones y resonancia magnética. Arch Cardiol Mex 2005; 75: 71–78. [ Links ]
12. Brodoefel H, Reimann A, Klumpp B, Fenchel M, Ohmer M, Miller S, et al: Assessment of myocardial viability in a reperfused porcine model: evaluation of different MSCT contrast protocols in acute and subacute infarct stages in comparison with MRI. J Comput Assist Tomogr 2007; 31:290–8. [ Links ]
13. Goldfarb J, Arnold S, Roth M, Han J: Tl–weighted magnetic resonance imaging shows fatty deposition after myocardial infarction. Magn Reson Med 2007; 57: 828–34. [ Links ]
14. Surányi P, Kiss P, Brott B, Simor T, Elgavish A, Ruzsics B, et al: Percent infarct mapping: an R1–map–based CE–MRI method for determining myocardial viability distribution. Magn Reson Med 2006; 56: 535–45. [ Links ]
15. Maki M, Haaparanta M, Nuutila P, Oikonen V, Luotolahti M, Eskola o, et al: Free fatty acid uptake in the myocardium and skeletal muscle using fluorine–18 fluoro–6–thia–heptadecanoic acid. J Nucl Med 1998; 39: 320–7. [ Links ]
16. Visser F: Imaging of cardiac metabolism using radiolabelled glucose, fatty acids and acetate. Coron Artery Dis 2001; 12: S12–8. [ Links ]
17. Alexánderson E, Gómez M, Benito I, Ruiz R, Ricalde A, Meave A: Tomografía por emisión de positrones (PET): Una herramienta útil para el estudio del metabolismo cardíaco. Arch Cardiol Mex 2004; 74: 220–28. [ Links ]
18. Schelbert H, Beanlands R, Bengel F, Knuuti J, Di Carli M, Machac J, et al: Pet myocardial perfusion and glucose metabolism imaging: part 2–guidelines for interpretation and reporting. J Nucl Cardiol 2003; 10: 557–71. [ Links ]
19. Alexánderson E: Utilidad de las técnicas nucleares en el estudio de la viabilidad miocárdica. Arch Cardiol Mex 2004; 74: 8–12. [ Links ]
20. Strauss HW, Grewal RK, Taskar NP: Molecular Imaging in Nuclear Cardiology. Semin Nucl Med 2004; 34: 47–55. [ Links ]
21. Meoli D, Sadeghi M, Krassilnikova S, Bourke B, Giordano F, Dione D, et al: Noninvasive imaging of myocardial angiogenesis following experimental myocardial infarction. J Clin invest 2004; 113: 1684–91. [ Links ]
22. Sokolova RI, Zhdanov VS: Hibernation and stunning as manifestations of ischemic dysfunction of the myocardium. Arkh Patol 2002; 64:50–4. [ Links ]
23. Wu J, Inubushi M, Sundaresan G, Schelbert H, Gambhir S: Positron emission tomography imaging of cardiac reporter gene expression in living rats. Circulation 2002; 106: 180–3. [ Links ]
24. Inubushi M, Wu J, Gambhir S, Sundaresan G, Satyamurthy N, Namavari M et al: Positron–emission tomography reporter gene expression imaging in rat myocardium. Circulation 2003; 107: 326–32. [ Links ]
25. Kudo T, Annata A, Cherry S, Phelps M, Schelbert H: Measurement of myocardial blood flow during occlusion/reperfusion in rats with dynamic microPET imaging. J Nucl Med 1998; 39: 9P. [ Links ]
26. Lapointe D, Bentourkia M, Cadorette J, Rodrigue S, Ouellet R, Bernard F, et al: High–resolution cardiac PET in rats. J Nucl Med 1999; 40: 185P. [ Links ]
27. Kreissl M, Wu H, Stout D, Ladno W, Schindler T, Zhang X, et al: Noninvasive measurement of cardiovascular function in mice with high–temporal–resolution small–animal PET. J Nucl Med 2006; 47: 974–80. [ Links ]
28. microPET_Siemens Focus 120 and 220. Siemens Medical Solutions USA, Inc. 2005. [ Links ]
29. Fueger B, Czernin J, Hildebrandt I, Tran C, Halpern B, Stout D, et al: Impact of Animal Handling on the Results of 18F–FDG PET Studies in Mice. J Nucl Med 2006; 47: 999–1006. [ Links ]
30. Gould K, Schelbert H, Phelps M, Hoffman E: Non invasive assesment of coronary stenoses with myocardial perfusion imaging during pharmacologic coronary vasodilatation. Am J Cardiol 1979;43: 200–208. [ Links ]
31. Sochor H, Pachinger O, Orgis E, Probst P, Kandl F: Radionuclide imaging alter coronary vasodilatation: myocardial scintigraphy with thallium–201 and radionuclide angiography alter administration of dipyridamole. Eur Heart J 1984; 5: 500–9. [ Links ]
32. Santalucia T, Camps M, Castello A, Munoz P, Nuel A, Testar X, et al: Developmental regulation of GLUT–1 (erythroid/Hep G2) and GLUT–4 (muscle/fat) glucose transporter expression in rat heart, skeletal muscle, and brown adipose tissue. Endocrinology 1992; 130: 837–46. [ Links ]
33. Baxx J, Veening M, Visser F, van Lingen A, Heine R, Cornel L, et al: Optimal metabolic conditions during Fluorine–18 fluorodeoxyglucose imaging; a comparative study using different protocols. Eur J Nucl Med 1997; 24: 35–41 [ Links ]














