Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
TIP. Revista especializada en ciencias químico-biológicas
versión impresa ISSN 1405-888X
TIP vol.14 no.1 Ciudad de México jun. 2011
Artículo original
Pigmentos en los testículos de cinco anfibios endémicos de Cuba (Eleutherodactylus turquinensis, E. cuneatus, E. glamyrus, Bufo longinasus longinasus y B. longinasus cajalbanensis)
Pigments on the testes of five amphibians endemic to Cuba (Eleutherodactylus turqumensis, E. cuneatus, E. glamyrus, Bufo longinasus longinasus y B. longinasus cajalbanensis)
Ana Sanz-Ochotorena1, María de Lourdes Segura-Valdés2, Yamilka Rodríguez-Gómez1, Reyna Lara-Martínez2 y Luis Felipe Jiménez-García2
1 Depto. de Biología Animal y Humana, Facultad de Biología, Universidad de La Habana, Cuba.
2 Lab. de Nanobiología Celular, Depto. de Biología Celular, Facultad de Ciencias, UNAM. Circuito Exterior, Ciudad Universitaria, C.P. 04510. México, D.F. E-mail: anita@fbio.uh.cu.
Artículo recibido el 09 de marzo de 2011;
Aceptado el 04 de mayo de 2011.
Resumen
Los vertebrados ectotérmicos pueden presentar un sistema pigmentario de función desconocida, aunque en algunos casos se han descrito los centros de melanomacrófagos con evidente función fagocítica; sin embargo, no es frecuente encontrar las gónadas pigmentadas en los anfibios anuros.
El objetivo fundamental del presente trabajo es informar y analizar la presencia de pigmentos en los testículos de tres especies de ranas endémicas cubanas y en un sapo cubano, también endémico. Se estudiaron las especies Eleutherodactylus turquinensis, E. cuneatus, E. glamyrusy Bufo longinasus (subespecies B. l. longinasusy B. l. cajalbanensis), las cuales fueron colectadas en las zonas occidental y oriental de la Isla de Cuba. Los ejemplares se anestesiaron con éter una vez que se trasladaron al laboratorio. Se extrajeron las gónadas y se procesaron para microscopía óptica y en el caso de B. longinasus también para microscopía electrónica de transmisión. Los resultados indican una morfología de los testículos similar a otros anuros, se observó una organización cística de las células sexuales en los túbulos seminíferos y todos los ejemplares estaban en espermatogénesis total. Los testículos de todas las especies estudiadas mostraron una pigmentación oscura y abundante en la túnica albugínea y en el tejido intersticial. Se observaron muchos melanosomas. Se analiza en el trabajo que la causa de la fuerte pigmentación testicular pueda ser una respuesta a la contaminación, asimismo, se propone que los pigmentos son producidos por otro tipo celular quizás similar a los melanomacrófagos y no por melanocitos.
Palabras Clave: Anfibios anuros, gónadas, pigmentos.
Abstract
Ectothermic vertebrates may have a pigment of unknown function, although in some cases melanomacrophage centers with apparent phagocytic function have been described; however, it is not common to find pigmented gonads in Anuran amphibians. The main objective of this paper is to report and analyze the presence of pigment in the testes of frogs (three species) and toads (one species), all of which are endemic to Cuba: Eleutherodactylus turquinensis, E. cuneatus, E.glamyrus, and Bufo longinasus(subspecies B. longinasus longinasusand B. longinasus cajalbanensis). The specimens were collected in western and eastern areas of the Island of Cuba and were anesthetized with ether once taken to the laboratory. Gonads were extracted and processed for light microscopy and, in the case of B. longinasus, also for transmission electron microscopy. The results show a morphology that is similar to that in other anuran testes; there was a cystic organization of sex cells in the seminiferous tubules and all animals were in total spermatogenesis. The testes of all studied species showed a dark and abundant pigmentation in the tunica albugínea and in the interstitial tissue. Many melanosomes were observed. In this paper, we analyze that the cause of strong testicular pigmentation may be a response to pollution and it is proposed that pigments are produced by another cell type similar to melanomacrophages, but not by melanocytes.
Key Words: Anuran amphibians, gonads, pigmentation.
Introducción
El sistema urogenital de anfibios está formado por órganos sexuales primarios, las gónadas y órganos accesorios o secundarios que incluyen los conductos. El término urogenital proviene del origen embrionario de riñones del tipo mesonefros en los anfibios adultos y de los conductos genitourinarios1,2. En los anfibios anuros los testículos son órganos pares, redondeados u ovoides, compactos y de manera general de color blanquecino. Ellos están rodeados por una capa fibrosa de tejido conectivo, la túnica albugínea3,4.
Recientemente, de Oliveira & Zieri5 y Moresco & de Oliveira6, han descrito un sistema pigmentario extracutáneo de función desconocida presente en algunos órganos de los anfibios como hígado, bazo, pulmones y corazón, entre otros. En este grupo de vertebrados ectotérmicos las células pigmentarias aparecen en el tegumento y en los pulmones como típicos melanocitos cuyo origen son las crestas neurales1 y en bazo7 e hígado como centros de melanomacrófagos8. Los melanomacrófagos que se encuentran en el hígado de los anfibios son conocidos como células de Kupffer9,10 y son capaces tanto de producir nuevos melanosomas como de fagocitar los viejos9.
Además, de Oliveira etal.11, Zieri etal.12 y Franco-Belussi et al.11 han informado la existencia de pigmentos en los testículos de algunas especies de anuros y lo han analizado como parte de ese sistema de pigmentación sin función aparente.
Por otra parte, es realmente notable que en Cuba, del Orden Anura, los ocho sapos del género Bufo y 52 ranitas del género Eleutherodactylus, de las 53 descritas, sean endémicos14 con una gran diversidad, problemas taxonómicos y peculiaridades morfológicas y reproductoras. En este trabajo se muestra y analiza la presencia de pigmentos en las gónadas de los machos de tres especies de ranas del género Eleutherodactylus y del sapo Bufo longinasus.
Materiales y métodos
Para realizar esta investigación se colectaron tres machos en las zonas oriental y occidental de Cuba en el hábitat propio de cada una de las especies que a continuación se mencionan:
1. Eleutherodactylus turquinensis (Barbour & Shreve, 1937). Es una rana grande entre las de su género, las hembras tienen 53 mm de longitud hocico-cloaca (LHC) y 37 mm los machos. En la Lista Roja de Especies Amenazadas de la UICN (Unión Internacional para la Conservación de la Naturaleza), aparece como "en peligro crítico de extinción". Está limitada a la Sierra Maestra y ocupa un área menor de 10 km2. Habita arroyos de montaña. Es el más acuático de todos los eleuterodactílidos cubanos.
2. Eleutherodactylus cuneatus (Cope, 1863). Es una ranita de talla moderada a grande (hembras 42.5-58.6 mm, machos 26.1-35.0 mm LHC). En la UICN aparece como "de menor preocupación" por su relativa abundancia, pero está restringida a la Sierra Maestra y el Macizo de Sagua-Baracoa, en la parte oriental de Cuba. Habita arroyos o zonas cercanas, es ribereña.
3. Eleutherodactylus glamyrus (Estrada & Hedges, 1997). Los adultos son de tamaño pequeño, de 24 mm hembras y 20 mm machos. Inscrita en la UICN como "en peligro", por disminución en el alcance y la calidad de su hábitat en la Sierra del Turquino, también en la zona oriental de la Isla. Esta ranita se halla distribuida en menos de cinco localidades. Es arbórea y habita bosques nubosos cerrados.
4. Bufo longinasus (Stejneger, 1905): hembras 30 mm, machos 27.7 mm LHC. Se conocen cuatro subespecies: Bufo longinasus longinasus, de las Alturas de Pizarras, B. l. cajalbanensis, de la meseta de Cajálbana, ambas en Pinar del Río, B. l. dunni en el macizo montañoso de Guamuhaya en la parte central de Cuba y B. l. ramsdeni, de la Meseta del Guaso, Guantánamo, en la zona sur oriental, esta última subespecie hace muchos años que no es observada. Este sapo, que es de los pequeños de Cuba, vive en arroyos de montaña. B. longinasus está inscrita en la UICN como "en peligro de extinción". Su hábitat disminuye y su distribución es fragmentada. Las subespecies estudiadas en el presente trabajo fueron B. l. longinasus y B. l. cajalbanensis.
Se colectaron tres machos de cada especie en las zonas oriental y occidental de Cuba en el hábitat propio de cada una.
Todos los animales fueron tratados éticamente. Los ejemplares se anestesiaron, se realizó una incisión longitudinal en el abdomen y otra transversal en la parte inguinal para visualizar las gónadas y conductos y, posteriormente, extraerlos. Se utilizó un microscopio estereoscópico Motic, modelo Diamond con objetivos de 2X y 4X.
Los fragmentos de testículos se fijaron en líquido de Bouin y fueron sometidos a la técnica clásica de inclusión en parafina. Los cortes se obtuvieron en un microtomo manual entre 5 y 7 μm y se colocaron en portaobjetos con albúmina como adherente. A las 24 horas los cortes se tiñeron mediante diferentes técnicas: hematoxilina y eosina, PAS-hematoxilina, tricrómica de Mallory y tricrómica de Gallego.
Las observaciones se realizaron en un microscopio Carl Zeiss modelo Axiomat, con objetivos de 20X, 40X y 100X. Las imágenes se digitalizaron mediante el programa Motic 2000, mediante el cual también se midieron el ancho y largo de los testículos a fin de obtener información sobre el tamaño de las gónadas en estas especies.
Las gónadas de B. longinasus y también el órgano de Bidder se procesaron por la técnica de microscopía electrónica de transmisión15, se fijaron en glutaraldehído al 2.5% en buffer fosfato a pH 7.4. Después, las muestras se lavaron con PBS y se postfijaron con tetraóxido de osmio al 1% en buffer fosfato a pH 7.4, por varias horas, posteriormente se enjuagaron y deshidrataron en alcoholes crecientes terminando con óxido de propileno. La preinclusión se realizó con una mezcla de óxido de propileno y resina epóxica 1:1 por16 horas. La inclusión se llevó a cabo con resina epóxica durante 16 horas a 60°C y se obtuvieron cortes semifinos y ultrafinos con un microtomo modelo Ultracut de Leica. Los semifinos se tiñeron con azul de toluidina. Los cortes ultrafinos se observaron bajo un microscopio JEOL JEM 1010.
Resultados
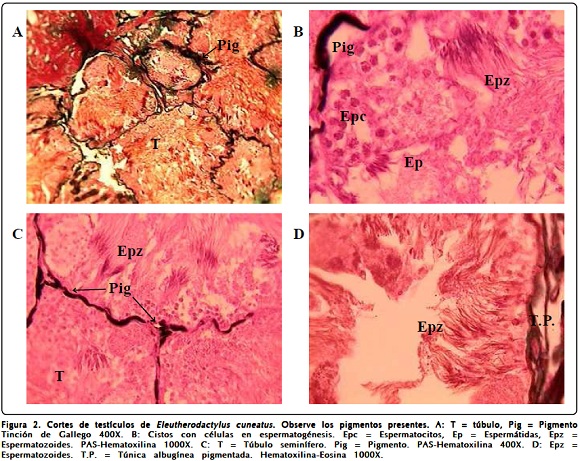
Los testículos de las ranas del género Eleutherodactylus utilizadas son muy pequeños, no sobrepasan los 4 mm de largo y los 3 mm de ancho (Tabla I, Figuras 1A y 3A). Las especies que presentan los menores valores son E. cuneatus y E. glamyrus.
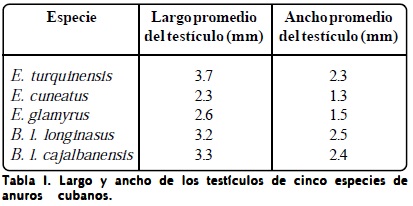
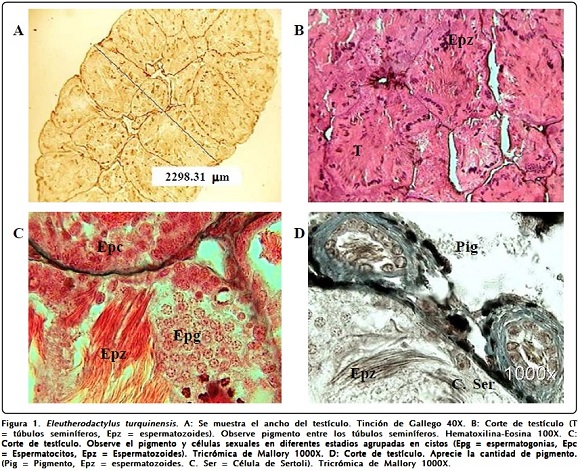
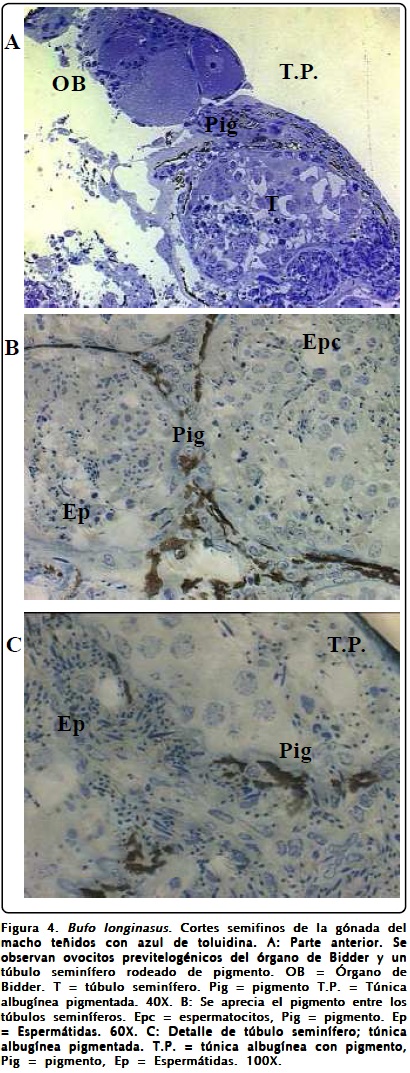
En las gónadas masculinas se observó una túnica albugínea de tejido conectivo con fibras y pigmentada, la cual se aprecia en las figuras 2D y 4C.
En los cortes de testículos se observan túbulos o lóbulos seminíferos que pueden apreciarse, por ejemplo, en las figuras 1C y 2B, en los cuales se distingue una disposición en cistos o quistes de las células sexuales en desarrollo y que constituyen las unidades morfológicas de los testículos, es decir, son los elementos seminíferos o productores de células sexuales de las gónadas.
En la Figura 1A, la cual corresponde a E. turquinensis, se observa el ancho o diámetro menor de los testículos de ese ejemplar.
En la Figura 1B se aprecian numerosos cistos de espermatozoides, sin embargo, en la Figura 1C, que corresponde a otro ejemplar de esta especie, pueden verse también cistos de espermatocitos y de espermatogonias. El pigmento es abundante en el tejido alrededor de los túbulos seminíferos.
Las fotomicrografías de la Figura 2 pertenecen a E. cuneatus y de nuevo se observan numerosos pigmentos muy oscuros rodeando a los túbulos (Figuras 2A, 2B y 2C) y en la túnica albugínea (Figura 2D). Se aprecian numerosos espermatozoides. E. glamyrus que es una ranita muy pequeña, tiene los testículos también muy pequeños, con un ancho y longitud que no llega a los 2 mm (Figura 3A). No obstante su pequeñez, este ejemplar se encuentra en plena madurez sexual mostrando una espermatogénesis muy avanzada y se pueden observar, además de numerosos espermatozoides en las Figuras 3B y 3C, cistos de espermatogonias y espermatocitos (Figura 3C). Se observa mucha pigmentación entre los túbulos seminíferos.
En el sapo B. longinasus, tanto en la subespecie B. longinasus longinasus, como B. longinasus cajalbanensis se encuentra el órgano de Bidder en la región anterior o cefálica del testículo (Figura 4A).
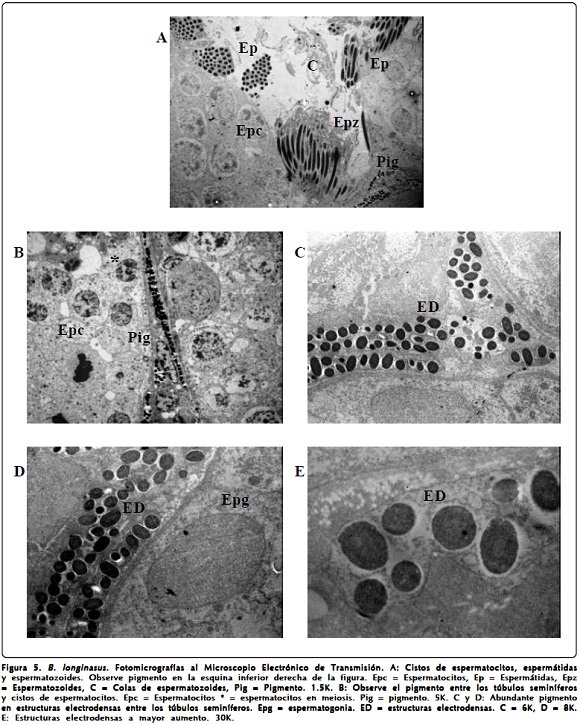
El sistema pigmentario del testículo se pone en evidencia en las fotomicrografías de los cortes semifinos y en las que corresponden al Microscopio Electrónico de Transmisión. En los cortes ultrafinos se aprecian gránulos electrodensos muy oscuros y abundantes entre los túbulos seminíferos que pueden observarse en la secuencia (Figuras 5A-5D).
La túnica albugínea es pigmentada y pareciera que desde ella se continuara el tejido intersticial también pigmentado que llega a rodear los túbulos seminíferos, detalle observado también en las otras especies.
Todas las preparaciones observadas correspondieron con animales en plena etapa reproductora que estaban en espermatogénesis total. Se apreciaron en ellas espermatogonias, espermatocitos primarios en meiosis (Figura 5B), espermatocitos secundarios, espermátidas en diferentes estadios (redondas y en diversos grados de alargamiento) y espermatozoides. Todas las células se observaron sustentadas por las células de Sertoli (Figura 1D). Entre los túbulos seminíferos hay tejido intersticial compuesto por células de Leydig, fibroblastos, pigmentos y vasos sanguíneos.
Pueden observarse los pigmentos tanto en la túnica albugínea, en el tejido intersticial y rodeando los túbulos seminíferos.
Discusión
La pigmentación de color café oscuro que se observa en los testículos de las especies en estudio puede ser debida a la presencia de células pigmentarias similares a los melanocitos. En los anuros esta característica no es frecuente y se ha informado en pocas especies, entre las cuales se encuentra el sapo africano con garras Xenopus laevis, el cual es un modelo animal de laboratorio8; y del Brasil en Physalaemus cuvieri11,16, Eupemphix nattereri12; otras especies del género Physalaemus y del género Pseudopaludicola13.
Sin embargo, el tipo de pigmento presente, sobre todo sus características ultraestructurales, como melanosomas, apreciadas en la caso de los testículos de B. longinasus, permiten proponer que quizás son centros de melanomacrófagos, o simplemente células productoras de pigmento, y no melanocitos. No se observaron en esas células las prolongaciones típicas de los melanocitos ni otras características que de Oliveira & Zieri5, encuentran para Physalaemusnattereri. Sí se observaron cuerpos densos como melanosomas similares a los encontrados en otros sitios en anfibios como las células de Kupffer del hígado10 o los macrófagos pigmentarios del bazo estudiados por Gallone et al.17
Las ranitas y el sapo cubanos de esta investigación muestran en la histología de los testículos la organización en redes de estructuras seminíferas, los denominados túmulos o lóbulos seminíferos rodeados por una capa fibrosa y pigmentada que es la túnica albugínea. Entre los túbulos seminíferos se halla el tejido intersticial compuesto por tejido conectivo con fibroblastos y fibras, vasos sanguíneos y células de Leydig18,19 además de los pigmentos.
Todas las especies estaban en espermatogénesis y se observó que el epitelio germinal estaba constituido por los tipos celulares típicos; las espermatogonias, espermatocitos primarios y secundarios en meiosis y espermátidas en proceso de espermiogénesis para convertirse en espermatozoides, los cuales se apreciaron muy largos en todas las especies. Sobre la longitud de los espermatozoides los resultados aquí mostrados corresponden con los encontrados para otras especies de ranitas cubanas20, con los informados acerca del sapo B. fustiger por Sanz-Ochotorena et al.21 y con lo que plantea Uribe-Aranzábal4 para los anuros.
Referente a la presencia de pigmentos en las ranas y el sapo cubanos, Zuasti etal.8, informan que los pigmentos extracutáneos forman un sistema pigmentario de función desconocida. Por su parte, de Oliveira etal.11, Zieri etal.12 y Franco-Belussi etal.11 se refieren a los pigmentos en los testículos de los anfibios estudiados por ellos de la misma manera.
En este trabajo pudiera analizarse, por una parte, que la existencia de pigmentos en las especies aquí presentadas se deba a una estrategia de protección a los testículos, ya que el pigmento melanina es un biopolímero muy importante, protector contra diversas agresiones citotóxicas y los rayos UV22.
Claro que las especies objeto del presente estudio no viven particularmente expuestas al sol al menos los adultos; E. turquinensis es muy acuática, E. cuneatus y B. longinusus son ribereñas y E. glamyrus vive en bosques cerrados.
Además, la biología reproductiva de las especies cubanas es prácticamente desconocida. Aún no se saben las particularidades de la fisiología reproductiva de estas ranitas y cómo ésta se relaciona con su ecología. Por ejemplo, E. turquinensis y E. cuneatus son especies muy cercanas desde el punto de vista filogenético23 muy nocturnas, que viven en ambientes relativamente frescos. Sin embargo, los autores del presente trabajo han observado a los juveniles de estas especies activos durante el día tomando sol en microhábitats con temperaturas considerablemente superiores a las registradas para los adultos (orillas de arroyos sin mucha cobertura boscosa en E. turquinensis, y parches de sol en la hojarasca del bosque y orillas de arroyos en E. cuneatus). Bufo longinasus es una especie diurna, y los machos vocalizan activamente en arroyos de montaña a menudo expuestos a la luz solar directa24. También se ha visualizado a E. glamyrus en parches de sol en la hojarasca de los bosques cerca del Pico Turquino (Luis M. Díaz, comunicación personal). La exposición a la luz solar directa puede estar relacionada con requerimientos térmicos diferenciados según la etapa de desarrollo e incluso con la síntesis de vitamina D3. La mayor pigmentación encontrada en los testículos en estas especies pudiera relacionarse con tales particularidades de los requerimientos fisiológicos de las especies y su ecología.
Además se propone que la pigmentación presente en los testículos pudiera ser un indicador de contaminación. Por ejemplo, Arencibia et al.25 informan que en una bahía contaminada en Guantánamo, Cuba, se encontraron en el riñón y en el hígado del pez Macaví (Albula culpes), un incremento del número de centros melanomacrófagos y Torres-Rodríguez et al.26 encontraron un aumento notable de los centros melonomacrófagos por efecto de contaminación de metales en Rana catesbeiana. Se sabe que en hembras de anfibios anuros un signo de atresia folicular es la conversión de folículos en cuerpos pigmentarios muy melánicos27 lo cual pudiera ser otra estrategia de protección.
Las poblaciones de anfibios en todo el mundo están disminuyendo por efectos de la contaminación ambiental y del hongo quítrido28, por lo cual una estrategia de mantener el acervo genético de la descendencia futura sería proteger las células sexuales.
Agradecimientos
A la Facultad de Ciencias de la UNAM por su apoyo para la realización de esta investigación. A la Dra. Guadalupe Hiriart del Instituto Nacional de Enfermedades Respiratorias (INER) de México, D.F. por su colaboración en las preparaciones histológicas.
Referencias
1. Gilbert, S.F. Developmental Biology (Ninth Edition, Sinauer Ass. Publishers, 2010) 711 págs. [ Links ]
2. Kardong, K. Vertebrates: Comparative Anatomy, Function, Evolution (McGraw-Hill Science/Engineering/Math, 5 edition, 2008) 800 págs. [ Links ]
3. Romer, A.S. & Parsons, T.S. The Vertebrate Body (Sixth edition, Saunders College Publishing, Philadelphia) (1986) 579 págs. [ Links ]
4. Uribe-Arnazábal, M.C. Aparato Reproductor Masculino. En: Atlas de Histología de Vertebrados (comp. Estrada, E. & Uribe, M.C) 133-148 (2002). [ Links ]
5. de Oliveira, C & Zieri, R. Testicular pigmentation in Physalaemus nattereri (Steindachner) (Amphibia, Anura) with anatomical obervations on the extracutaneus pigmentary system. Revista Brasilera de Zoologia 22, 454-460 (2005). [ Links ]
6. Moresco, R.M. & de Oliveira, C. A Comparative study of the extracutaneous pigmentary system in three Anuran Amphibian species evaluated during the breeding season. South American Journal of Herpetology 4(1), 1-8 (2009). [ Links ]
7. Scalia, M. et al. The spleen pigment in some Amphibia. Pigment Cell Research 17(2), 119-127 (2004). [ Links ]
8. Zuasti, A., Jiménez-Cervantes, C., García Borrón & Ferreri, C. The melanogenic system of Xenopus laevis. Archives of Histology and Citology 61, 305-316 (1998). [ Links ]
9. Sichel, G., Scalia, M., Mondio, F. & Corsaro, C. The amphibian Kupffer cells build and demolish melanosomes: an ultrastructural point of view. Pigment Cell Res 10, 271-287 (1997). [ Links ]
10. Prelovsek, P.M. & Bulog, B. Biogenesis of melanosomes in Kupffer cells of Proteus anguinus (Urodela: Amphibia). Pigment Cell Research 16(4), 345-350 (2003). [ Links ]
11. de Oliveira, C., Zanetoni, C. & Zieri, R. Morphological observations on the testes of Physalaemus cuvieri (Amphibia, Anura). Rev. Chil. Anat. 20(3), 263-268 (2002). [ Links ]
12. Zieri, R., Taboga, S.R. & de Oliveira, C. Melanocytes in the testes of Eupemphix nattereri (Anura, Leiuperidae): Histological, stereological, and ultrastructural aspects. The Anatomical Record 290, 795-800 (2007). [ Links ]
13. Franco-Belusi, L., Zieri, R., de Souza Santos, R., Moresco, R.M. & de Oliveira, C. Pigmentation in Anuran testes: Anatomical pattern and variation. The Anatomical Record 292, 178-182 (2009). [ Links ]
14. Díaz, L.M. & Cádiz, A. Guía taxonómica de los anfibios de Cuba. Abc Taxa 4, i-vi, 294 págs. (2008). [ Links ]
15. Vázquez-Nin, G.H. & Echevarría, O.M. Introducción a la Microscopía Aplicada a las Ciencias Biológicas (UNAM, Fondo de Cultura Económica, México, D.F., 2000). [ Links ]
16. de Oliveira, C., Santanna, A.C., Omena, P.M., Santos, L.R.S. & Zieri, R. Morphological considerations on the seminiferous structures and testes of anuran amphibians: Bufo crucifer, Physalaemus cuvieri, and Scinax fuscovarius. Biociências 11(1), 39-46 (2003). [ Links ]
17. Gallone, A., Guida, G., Maida, I. & Cicero, R. Spleen and liver pigmented macrophagues of Rana esculenta L. A new melanogenic system? Pigment Cell Research 15(1), 32-40 (2002). [ Links ]
18. Duellman, W.E. & Trueb, L. Biology of Amphibian (New York, McGraw-Hill, 1994) 670 págs. [ Links ]
19. de Souza Santos, L.R. & de Oliveira, C. Histological aspects and structural characteristics of the testes of Dendropsophus minutus (Anura, Hylidae). Micron doi:10.1016/j.micron.2008.03.006 (2008). [ Links ]
20. Rodríguez-Gómez, Y. Morfología de las gónadas de cuatro especies del género Eleutherodactylus (Anura. Leptodactylidae). Tesis doctoral. Universidad de la Habana. Cuba. 98 págs. (2008). [ Links ]
21. Sanz-Ochotorena, A., Segura-Valdés, M.L., Rodríguez-Gómez,Y., Lara Martínez, R. & Jiménez-García, L.F. Estructura y ultraestructura de la gónada de los machos de Bufo fustiger (Anura: Bufonidae). TIP Rev. Esp. Cienc. Quím. Biol. 11(2), 81-86 (2008). [ Links ]
22. Fowler, D.M. et al. Functional amyloid formation within mammalian tissue. PLoS Biol 4(1), e6 (2006). [ Links ]
23. Schmid, M. et al. The Chromosomes of Terraranan Frogs. Insights into Vertebrate Cytogenetics (eds. Schmid, B. & Hedges S.B.) 559 págs. (2010). [ Links ]
24. Díaz, L. & Cádiz, A. Pflege und Vermehrung von Bufo longinasus Stejneger, 1905: Ein Beitrag zur Erhaltung dieser Art. Aquaristik Fachmagazin and Aquarium heute 38(2), 18-21 (2006). [ Links ]
25. Arencibia, G. et al. Evaluación de la contaminación de la Bahía de Guantánamo, Cuba. XXV Congreso de Ciencias del Mar y XI Congreso Latinoamericano de Ciencias del Mar. Viña del Mar, Chile (2005). [ Links ]
26. Torres-Rodríguez, A., Puente-Lee, I., González, S. & Castrillón, M. Caracterización histológica y ultraestructural de los centros melanomacrófagos y su proliferación por efecto de los metales en hígado de Rana catesbeiana (Rana toro). Congreso Interamericano de Microscopía Electrónica. Rosario, Argentina. 23-26 (2009). [ Links ]
27. Ogielska, M., Rozenblut, B., Augustyñska, R.& Kotusz, A. Degeneration of germ line cells in amphibian ovary. Acta Zoologica (Stockholm) 91, 319-327 (2010). [ Links ]
28. Díaz, L.M., Cádiz, A., Chong, A. & Silva, A. First Report of Chytridiomycosis in a Dying Toad (Anura: Bufonidae) from Cuba: A New Conservation Challenge for the Island. Eco Health 4, 172-175 (2007). [ Links ]
Información sobre los autores
Ana Sanz-Ochotorena
Ana Sanz-Ochotorena es profesora Titular del Departamento de Biología Animal y Humana de la Facultad de Biología de la Universidad de la Habana, Licenciada en Ciencias Biológicas y Dr. en Ciencias Biológicas. Tiene 33 años de experiencia en la Educación Superior y ha impartido docencia de pregrado y postgrado en las siguientes asignaturas: Citología-Histología, Biología Comparada de Vertebrados, Zoología General, Zoología de Vertebrados, Anatomía Comparada de Vertebrados, Morfología Animal, Histología, Embriología y Biología del Desarrollo. Ha impartido más de 30 cursos y entrenamientos de postgrado nacionales e internacionales. Ha sido directora de Tesis de Diploma, de Maestrías y de dos doctorados. En el área de la investigación científica ha realizado investigaciones en el campo de la morfología, histología y microscopía electrónica y en biología de la reproducción en peces, anfibios y reptiles, entre otras. Ha participado en 51 eventos científicos nacionales e internacionales en los que ha presentado más de 65 trabajos. Fue líder de un Proyecto con el Royal Ontario Museum de Canadá y dirige otro con la Universidad Wüerzburg, Alemania. Tiene publicados un libro de texto y otros materiales docentes y más de 40 artículos nacionales e internacionales. Es una de los autores de lamonografía publicada en el 2010 "The Chromosomes of Terraranan Frogs; Insights into Vertebrate Cytogenetics" Ha realizado estancias de trabajo, investigación y superación en Hungría, Rusia, México, Canadá y España. Es MiembroTitularde la Sociedad Cubana de Ciencias Morfológicas, y del ejecutivo de la Sección de Microscopía Electrónica, pertenece al ej ecutivo de la Maestría en Zoología y Ecología, es Presidente de la Comisión Nacional de Carreras de Biología, Vicepresidente del Tribunal Nacional de Grados Científicos de Biología y Secretaria del Tribunal de Categorización para Profesores Auxiliares y Titulares. Perteneció al Comité Académico para el proceso de acreditación del doctorado en Ciencias Biológicas en Cuba que obtuvo el Premio a la Excelencia de la AU1P. Es Coordinadora Académica del Programa Pittsburgh en la Universidad de La Habana y dirigió el Departamento de Biología Animal y Humana por ocho años.
María de Lourdes Secura-Valdés
María de Lourdes Segura-Valdés es Bióloga, Especialista en Microscopía Electrónica y Doctora en Ciencias de la Facultad de Ciencias de la UNAM. Es fundadora del Laboratorio de Nanobiología Celular, Profesora Titular y fue Coordinadora General del Departamento de Biología Celular de la Facultad de Ciencias de la UNAM. Actualmente es Investigadora Nacional Nivel I. Ha participado en la publicación de más de 22 artículos científicos sobre diferentes aspectos de la matriz extracelular y el núcleo. Es miembro de la Asociación Mexicana de Microscopía y es profesora del programa de posgrado de la Especialidad en Microscopía Electrónica en Ciencias Biológicas de la UNAM.
Yamilka Rodríguez-Gómez
Yamillca Rodríguez-Gómez es Doctora en Ciencias Biológicas y Profesora Auxiliar del Departamento de Biología Animal y Humana de la Facultad de Biología de la Universidad de La Habana. Ha impartido las asignaturas de Zoología, Biología Celular, Biología del Desarrollo y actualmente, Morfología Animal. También imparte la asignatura de postgrado Anatomía Comparada de Vertebrados. Ha realizado investigaciones en el área de la Farmacología y la Morfología de Vertebrados, específicamente de anfibios y reptiles. Ha publicado varios artículos y presentado trabajos de investigación en congresos nacionales e internacionales y es miembro activo de las Sociedades de Zoología, Farmacología, Ciencias Morfológicas y de Pedagogos de Cuba.
Reyna Lara-Martínez
Reyna Lara-Martínez es Bióloga de la Facultad de Estudios Superiores Zaragoza y Maestra en Ciencias Biológicas de la UNAM. Actualmente es estudiante del Doctorado en Ciencias del Posgrado en Ciencias Biológicas de la UNAM. Ha publicado varios artículos y es profesora del programa de posgrado de la Especialidad en Microscopía Electrónica en Ciencias Biológicas de la UNAM.
Luis Felipe Jiménez-García
Luis Felipe Jiménez-García es Biólogo, Maestro y Doctor en Ciencias de la UNAM. Realizó una estancia posdoctoral en el Laboratorio de Coid Spring Harbor en Nueva York. Es Profesor Titular del Departamento de Biología Celular de la Facultad de Ciencias de la UNAM. Actualmente es Investigador Nacional Nivel II y miembro de la Academia Mexicana de Ciencias. Ha publicado más de 40 trabajos del área de la biología celular y molecular algunos de los cuales han sido en revistas como Cell, Molecular Biology of the Cell, Journal of Cell Science, Coid Spring Harbor Symposium on Quantitative Biology, etc. Es experto en todos los tipos de microscopía. Es fundador del Laboratorio de Nanobiología Celular y fue Coordinador de Investigación y Coordinador General del Departamento de Biología de la Facultad de Ciencias de la UNAM. Actualmente es Coordinador del Programa de Especialidad en Microscopía Electrónica en Ciencias Biológicas de la UNAM. Es Presidente de la Sociedad Iberoamericana de Biología Celular y organizó, en 2007, el X Congreso Iberoamericano de Biología Celular en la Ciudad de México. Su área de estudio es la biología celular del núcleo y del nucléolo.














