1. Introducción
El tratamiento de cáncer con hipertermia ha evolucionado gracias al estudio desarrollado por George Morris y su grupo de trabajo [1], donde se investiga las ventajas de las aplicaciones terapéuticas con calor, ellos han informado que la diatermia ordinaria está contraindicada cuando existe inflamación en los ganglios linfáticos, ya que provoca una hiperemia, luego la interferencia con el retorno venoso y consecuentemente la necrosis.
Con esta premisa inicia la idea de utilizar partículas magnéticas como medio de generación de calor en tejidos para el tratamiento del cáncer desarrollada por Gilchrist [2] y su grupo de trabajo quienes implementan esta técnica como una forma de tratar la metástasis.
Esto provoco el interés de muchos investigadores para poder desarrollar la teoría e implementar posteriormente la técnica en estudios in vitro e in vivo, se reportan por lo tanto numerosos artículos mostrando la efectividad del tratamiento de la hipertermia magnética in vitro. Así como otros reportan predicciones de la distribución de temperatura mediante técnicas analíticas y numéricas. El modelo ampliamente utilizado para representar la difusión de calor en sistemas biológicos para estos tipos de análisis es propuesto por primera vez por Pennes [3], también denominada ecuación de Bio-calor, este ha demostrado buen acuerdo con los correspondientes resultados experimentales.
Entre los estudios analíticos y numéricos como Bagaria et al [4] donde se analiza la generación de calor por un cumulo de nanoparticulas en forma esférica, en el caso real las nanoparticulas no se concentran en una esfera ya que estas viajan por el torrente sanguíneo, otro ejemplo es el mostrado en [5], donde se analiza distribución de temperatura por una distribución de nanoparticulas uniformes dentro de una esfera, en este análisis se ignoraran variables tales como la influencia del flujo sanguíneo en el perfil de temperatura etc. y el modelo de generación de calor es desarrollado por Rosensweig [6].
Todos estos estudios están restringidos en muchas variables, sin embargo conforme avanzan los estudios surgen las necesidades de implementar nuevos métodos que permitan suministrar más variables y cada vez acercarse a resultados más creíbles en la vida real, es por ello que los últimos estudios relacionados al aporte de la hipertermia magnética se han dado con simulaciones numéricas com FEM (elemento finito) COMSOL Multiphysics, para resolver la ecuación de Biocalor y con ello poder obtener resultados más precisos con respecto a la distribución de temperatura.
Ya que algunos parámetros asociados a la técnica de hipertermia magnética no han sido completamente entendidos, por lo tanto el potencial terapéutico de este método no ha sido explotado correctamente, algunas de las inconsistencias que presenta el método en la actualidad son: la distribución adecuada de nano partículas dentro del tumor ya que este es esencial para evitar la ocurrencia de áreas con defecto o exceso de temperatura que llevarían a dar un mal tratamiento, es decir que se requiere un mayor control sobre la cantidad depositada nano partículas con respecto a un volumen especifico del tumor.
No hay reportes en la literatura con respecto a un método dirigido a cuantificar la cantidad de nano partículas magnéticas en las zonas de interés en sistemas in vivo, por lo que con esto nos damos cuenta que es imperativo manejar una herramienta de energía térmica como evento previo a la determinación de distribuciones de energía térmica en las zonas tumorales.
El enfoque de este trabajo parte de proponer un método para cuantificar la cantidad de nano partículas de que tiene potencial aplicación en hipertermia. Viendo la distribución de temperatura en el tejido circundante a las nano partículas.
Donde la distribución de temperatura se obtiene gracias al modelo de la ecuación de Pennes, donde se considera una distribución uniforme de nano partículas. Esto se logra resolviendo las ecuaciones diferenciales de Bio-calor con el método de elemento finito, usando un programa de simulación COMSOL Multiphysics 5.2a.
2. Materiales y métodos
2.1. Modelo numérico de transferencia de calor
La absorción de energía en el tejido canceroso proporciona calor requerido para el aumento de la temperatura provocando la hipertermia. Entonces la ecuación de transferencia de calor es resuelta para reproducir la distribución de la temperatura en el tejido transformado y en tejido sano.
Donde la distribución de la temperatura T (r,t) en el tejido circundante a las nanopartículas será dada por la solución de la ecuación de bio calor en medios biológicos, esta es descrita como sigue:
donde T( r,t ),ρ, C, K: Temperatura, densidad, calor especifico y conductividad térmica del tejido respectivamente. Así como T α ( r,t ), μ b c b , ω b : Temperatura, densidad, calor especifico y coeficiente de perfusión de la sangre arterial respectivamente, finalmente q met ( r, t ) que es la tasa de calor generado por metabolismo y Q 0 es la densidad de potencia volumétrica generada por las nanopartículas.
2.2. Modelo numérico
Para estudiar la distribución de temperatura volumétrica requeridas para obtener resultados de calentamiento prácticos en un rango de temperatura comprendida entre 42 °C y 46 °C correspondiente a una dispersión homogénea de nanopartículas de Fe3O4, se usa el modelo numérico del Método de Elementos Finitos en el sofware COMSOL, donde la geometría del modo de la ecuación de bio-calor se realiza en 3D y esta consistió en nanopartículas esféricas de Fe3O4 recubiertas con poliamida PAI, suspendidas en un volumen esférico con propiedades termo físicas correspondientes a tejido con cáncer de colon y esta a su vez está inmersa en un volumen esférico que representa el tejido biológico sano de colon, esto se visualiza en la Fig.1, donde las propiedades termo físicas y eléctricas de estos tejidos fueron extraídos de una base de datos de la literatura [8] y estas son mostradas en las Tablas 1 y 2.

Fig.1 Ilustración geométrica del modelo 3D con su respectivo enmallado, este modelo consiste en: (a) esfera color azul que representa tejido sano conteniendo una esfera de color verde que representa tejido transformado y en su interior están (b) distribuidas un grupo de 8x8x8 nano-partículas de Fe3O4 distribuidas uniformemente, que a su vez cada nano-partícula se visualiza en (c) donde la línea de color naranja muestra el diámetro de las nano-partículas de Fe3O4 y la línea de color verde muestra el espesor del recubrimiento de poliamida PAI, todas se visualizan con su respectivo enmallado (Donde el tamaño mínimo de la malla tetraédrico se toma como referencia la mínima de las variables que se usan dentro del modelo)
Tabla 1 Propiedades termo físicas usadas en el modelo 3D, donde los tejidos transformados y sanos son del colon
| Propiedades termo físicas | ||||
|---|---|---|---|---|
| Fe3O4 | poliamida PAI |
Tejido transformado |
Tejido sano |
|
| Conductividad térmica K(W/mk) | 3.85 | 0.38 | 0.542 | 0.545 |
| Densidad ρ(Kg/m) | Comsol | 930 | 1088 | 1088 |
| Capacidad calorífica C(J/KgK) | Comsol | Comsol | 3655 | 3609 |
| Calor generado por metabolismo Q(W/m3) | -- | -- | 31872.5 | 6374.5 |
Tabla 2 Propiedades eléctricas para los materiales utilizados en el modelo 3D
| Propiedades eléctricas | ||||
|---|---|---|---|---|
| Fe3O4 | poliamida PAI |
Tejido transformado |
Tejido sano | |
| Conductividad eléctrica (S/m) | 4.85 | 5.29E-6 | 0.01 | 0.01 |
| Factor de frecuencia A(1/s) | -- | 1.03E56 | 1.8E36 | 1.03E38 |
| Energía de activación E(J/mol) | -- | 2.49E9 | 2.38E5 | 2.49E5 |
Se consideró la distribución uniforme de nanopartícula super paramagnéticas dentro del dominio esférico con radio de 1 mm. En el modelado se aplicó una densidad de potencia volumétrica constante de Q0=15E18 W/m3 en las nano-partículas, esto con el objetivo de generar un calentamiento que posteriormente involucrara a los constituyentes del tejido circundante a estas.
En la Fig.1 se muestra la geometría representativa del modelo descrito. Además, los materiales y tipos de dominios del modelo se muestran las tablas 1 y 2. Así por lo tanto la distribución de temperatura espacio-temporal dado por una distribución de nanopartículas de Fe3O4, se analizó usando el interfaz de Bio-calor en COMSOL Multiphysics, interfaz dedicada para análisis de transferencia de calor en el tejido vivo.
3. Resultados
El modelo corresponde a una dispersión uniforme de nanopartículas con diámetros de 10 nm, recubiertas con una capa de poliamida PAI de un grosor de 2.5nm. inicialmente todas las caras en el espacio del modelo se tratan como superficies de temperatura constantes a 37 °C correspondiente a la temperatura del cuerpo humano, para simular la ubicación de las nanopartículas de Fe3O4 por conveniencia se realiza la distribución uniforme de estas nanopartículas cubriendo la mayor parte del tejido canceroso con un desplazamiento de d=15E4 nm Fig.2 entre ellas ya que es esta la distancia óptima para mantener la temperatura deseada en áreas locales comprendidas entre 42 °C y 46 °C, el tejido transformado es representado por una esfera de radio 1mm inmerso en tejido sano representado por una esfera de radio 2mm. Todas están caracterizadas con las dimensiones del espacio del modelo.
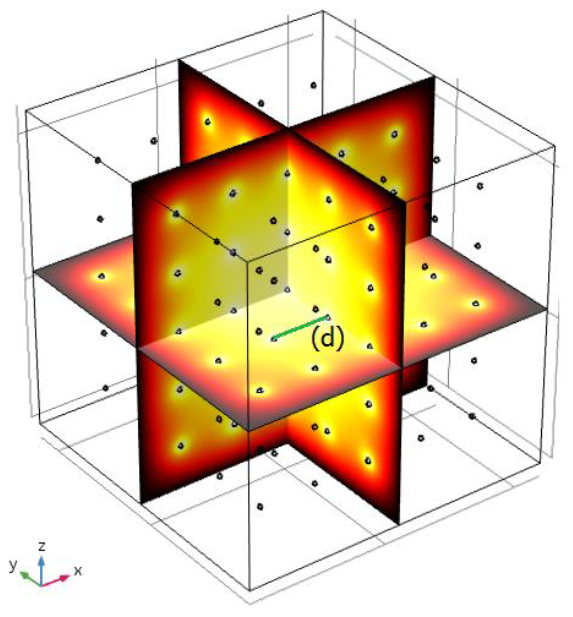
Fig. 2 Desplazamiento óptimo de d =15E4 nm entre nano-partículas de Fe3O4 para mantener la temperatura deseada en áreas locales comprendidas entre 42 °C y 48 °C
En este modelo se requiere de una densidad de potencia volumétrica que se consideró constante con un valor de Q0= 15E18 W/m3 para lograr un aumento de temperatura medible comprendida en el rango de temperatura deseada de 42 °C a 46 °C. Así bajo estas consideraciones en la Fig.3 se muestran los gradientes de temperatura para diferentes cantidades de nano-partículas indicadas en la misma.
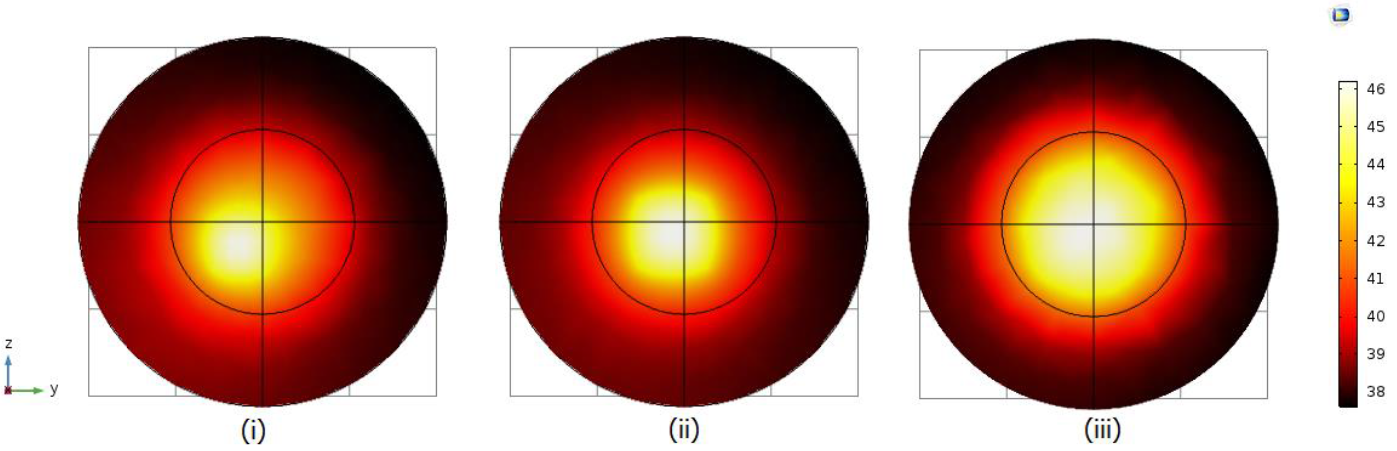
Fig. 3 Gradiente de temperatura para una (i) un grupo de 4x4x4, (ii) un grupo de 6x6x6 y (iii) un grupo de 8x8x8 nano-partículas de Fe3O4 distribuidas uniformemente con una distancia de separación de 15E4 nm entre ellas
Para poder analizar la evolución temporal de la temperatura en puntos de interés se colocan 3 sensores de temperatura uno ubicado en el recubrimiento de la nano-partícula y representada por un punto azul con coordenadas de (-6.5,-5E-6, -5E-6) nm, el segundo sensor es ubicado en la mitad de la distancia de separación entre nano-partículas d/2 representada por un punto verde con coordenadas de (-75000,-5E-6, -5E-6) nm y el tercer sensor se ubica en las coordenadas del espacion que se encuentra en el tejido sano esto con el objeto de verificar si se da el daño por necrosis todas estas se observan en la Fig.4.
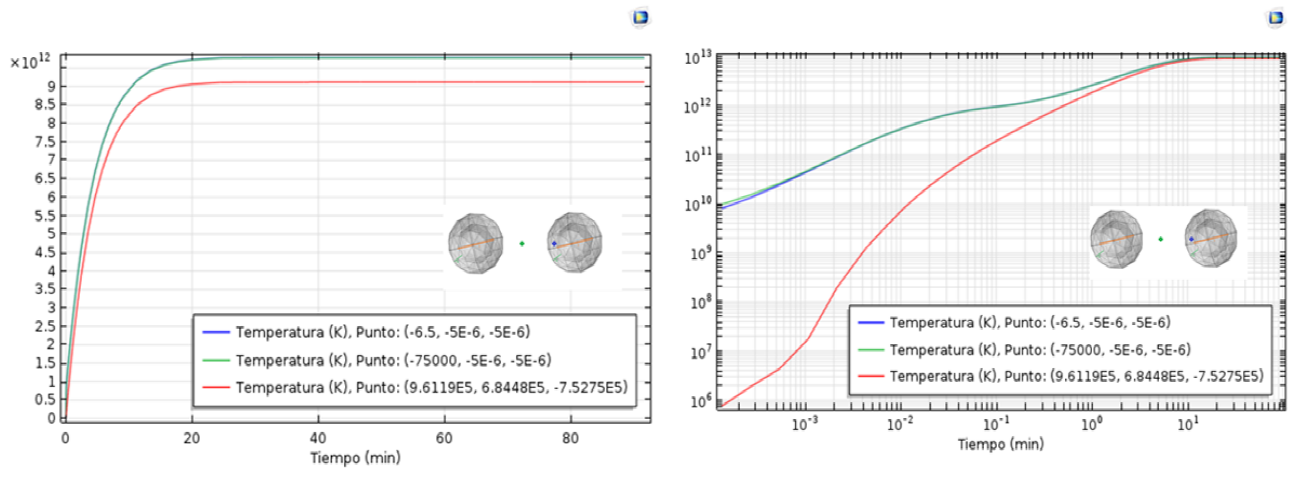
Fig. 4 Evolución temporal de las temperaturas en tres puntos de interés, el primer sensor ubicada en medio del recubrimiento de poliamida PAI , el segundo ubicada en el tejido transformado justamente en la mitad de la distancia de separación de dos nanoparticulas y el tercero ubicada en el tejido sano
La línea de color azul que corresponde al sensor ubicado entre el recubrimiento indica un crecimiento de temperatura hasta los 20 minutos y seguidamente se estabiliza a los 40 min, la línea verde que corresponde al sensor ubicado entre dos nano-partículas que por lo tanto se encuentra en el tejido transformado indica el mismo comportamiento que el primer sensor, indicando además que la temperatura en ese punto no es mayor a 46 °C ni menor de 42 °C con esto se cumple el objetivo de permanecer en el rango óptimo de temperatura para generar daño celular por apoptosis y no por necrosis y por último la línea roja indica la evolución temporal de la temperatura en el tejido sano desplazada con respecto a los dos primeros sensores ya mencionados.
En la Fig. 5 se demuestra por lo tanto que no hay daño por necrosis en un punto del espacio dentro del área de análisis ya que esta se da a temperaturas mayores de 46 °C comúnmente denominada ablación térmica.

Fig. 5 Fracción de tejido necrótico en función del tiempo en los puntos locales del tejido sano y del tejido transformado, esto nos muestra que el daño celular se está dando por apoptosis ya que se encuentran en el rango de 42 °C y 46 °C y por lo tanto no se da la necrosis en ninguno de los tejidos
Las densidades de alta potencia parecen lograrse experimentalmente mediante sistemas prácticos.
Por supuesto, las nano-dimensiones del modelo dominan todas las demás consideraciones, y la transferencia de calor es algo exagerada por el espacio del modelo numérico extremadamente pequeño al orden de nm.
Aunque esto puede ser una tarea exigente, es una herramienta de planificación para mejorar la calidad de tratamiento con un experimento virtual para modelado previamente, simular y optimizar la terapia con alta precisión a pesar que tenga una compleja estructura núcleo-envoltura, que requieren de mayor tiempo de computo causados por un incremento de nodos en la malla.
4. Discusión
En este estudio se desarrolla un sistema de simulación de la transferencia de calor para la optimación y planeación de la hipertermia magnética usando el software de simulación COMSOL multifisics, para tratamientos oncológicos.
Nuestros resultados han demostrado la gran importancia de la distribución de las nano partículas en el tejido transformado, ya que una mayor acumulación de nanopartículas ocasionara un incremento mayor y descontrolado de calor y por ende ocasionar incrementos de temperaturas no deseadas.
Además, se demuestra que el tejido canceroso se puede calentar suficientemente sin afectar negativamente a los tejidos normales. Este modelo es válido para la distribución uniforme de nano partículas en el tejido de análisis.











 nueva página del texto (beta)
nueva página del texto (beta)


