Introducción
En México, el género Pinus incluye las especies más utilizadas para producir planta para reforestación en viveros forestales de clima templado. En los viveros se realiza una fase importante en el proceso de producción de plantas, que debe garantizar la calidad y sanidad de los árboles, previa a su plantación (Solano y Brenes, 2012).
La Comisión Nacional Forestal (CONAFOR) restaurará un millón de hectáreas, de 2013 a 2018, con reforestación de 180 millones de plantas, en los ecosistemas de clima templado-frío, tropical, y árido-semiárido (CONAFOR, 2015). El problema fitosanitario mayor en los viveros es una enfermedad conocida como el complejo damping-off, mal del semillero, secadera de la planta, mal del talluelo, ahogamiento, chupadera y pudrición de raíces. La enfermedad de la secadera la produce un complejo de hongos del suelo, y destacan: Pythium spp., Phytophthora spp., Rhizoctonia spp., Botrytis spp. y Fusarium spp. (Salas, 2002; Benítez et al., 2004 y Ezziyyani et al., 2004).
La enfermedad de la secadera en pino en los viveros de México la causan principalmente especies de Fusarium, y disminuye la calidad de la planta, que ocasiona pérdidas de hasta 40 % en la producción (Cibrián et al., 2008). Se presenta en pre-emergencia, donde el hongo daña al embrión antes de germinar y hay necrosis de hipocótilo y cotiledones, o en post-emergencia, cuando el hongo causa estrangulamiento del tallo, a nivel del suelo, y muerte de la planta. El daño tardío se manifiesta durante el desarrollo de la planta, principalmente cuando el tallo aún no está lignificado, causa pudrición de raíz y doblamiento de la plántula, se manifiesta como un color rojizo en las acículas y en raíz presenta un color café (Peterson, 2008; Solano y Brenes, 2012).
La mayoría de los viveros usa envases plásticos rígidos y principalmente turba de musgo (peat moss), perlita y vermiculita, combinación conocida como mezcla estándar o mezcla base, como medio de crecimiento para la producción de las plantas (Sánchez-Córdoba et al., 2008). Una de las desventajas de esta mezcla es su costo alto para la producción de plantas en vivero. Además, por su contenido alto de materia orgánica y humedad puede dañar a la planta por el desarrollo de Fusarium. Como alternativa, para sustratos se usan aserrín y corteza de pino, por su costo menor (Maldonado-Benitez et al., 2011; Hernandez-Zarate et al., 2014).
En los viveros forestales de México la semilla usada para la producción de plantas se desinfecta solo algunas veces y la presencia de especies de Fusarium puede dañar la germinación y el desarrollo de las plantas. Los objetivos de este estudio fueron identificar morfológica y molecularmente la especie de Fusarium que causa secadera y pudrición de raíz en Pinus greggii Engelm., evaluar su efecto en la germinación de las semillas en tres sustratos y analizar la incidencia y patogenicidad en plántulas en desarrollo. La hipótesis fue que la incidencia de Fusarium aumenta con el contenido de turba en el sustrato.
Materiales y Métodos
Recolecta y manejo de material enfermo
El material enfermo de P. greggii se recolectó en el vivero Forestal Militar de Atlangatepec, Tlaxcala (19° 32’ 27.6” N, 98° 10’ 48” O y altitud de 2510 m). Trozos de raíz de 1 cm del material recolectado se lavaron con agua destilada estéril, hipoclorito de sodio al 2 % por 3 min y tres veces con agua destilada estéril. El material se secó con papel filtro estéril y se utilizó para sembrar, como lo señalan Martínez-Álvarez et al. (2012), en medio papa dextrosa agar con antibiótico (PDA+A) (sulfato de estreptomicina 0.05 g L-1 para prevenir el desarrollo de bacterias).
Identificación morfológica
Microscopia convencional
Para identificar Fusarium mediante su morfología se observó el tipo de crecimiento, aspecto del micelio, coloración de la colonia, formación de estructuras asexuales, presencia de clamidosporas y formación de esporodoquios; 100 mediciones de conidióforos, clamidosporas, micro y macroconidios se hicieron con base en estudios de Morales et al. (2007) y Pfenning et al. (2014). Para su desarrollo, crecimiento y esporulación se utilizaron medios de cultivo recomendados por Leslie y Summerell (2006), como papa dextrosa agar (PDA), agua agar con hoja de clavel (AAC) y el específico para Fusarium, conocido como spezieller nährstoffarmer agar (SNA).
Microscopia electrónica de barrido (MEB)
Plántulas enfermas con micelio se usaron para ver los microconidios, fialides y polifialides; para los macroconidios y estimular el desarrollo de esporodoquios se hicieron crecer en medio de cultivo agua agar con hoja de clavel (CMA). Trozos pequeños de tejido, con estructuras, se colocaron en una solución fijadora de gluteraldehído al 3 % por 24 h, luego se enjuagaron por 10 min, dos veces, con amortiguador de fosfato; las muestras se deshidrataron con etanol en concentraciones crecientes (30, 40, 50, 60, 70, 80, 90 %), por 40 min cada una, y dos repeticiones con etanol al 100 %. Después, las muestras se secaron a punto crítico, con CO2 en una secadora (Sandri-780ª, TOUSIMIS Research Corporation, USA). Las muestras deshidratadas se colocaron en portamuestras de latón, se fijaron con cinta adhesiva de cobre y se recubrieron con oro, durante 10 min, en una ionizadora de metales (Fine Coat JFC-1100, JEOL Ltd., Japón) y se observaron en un microscopio electrónico de barrido (JSM-6390, JEOL Ltd., Japón), operado a 20 kV, en la Unidad de Microscopía Electrónica del Colegio de Postgraduados, Campus Montecillo, en el Estado de México.
Identificación molecular
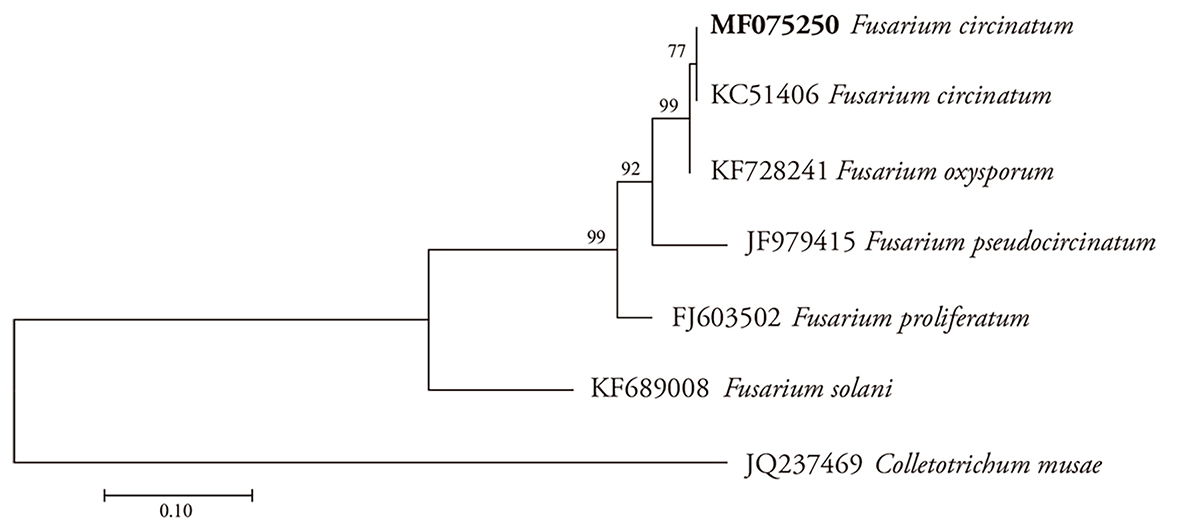
Un cultivo monoconidial con la clave PGAT de plántulas de P. greggii, del vivero forestal de Atlangatepec se utilizó para la identificación molecular. La extracción de ADN se realizó con el kit comercial DNeasy Plant mini kit (Quick-StartProtocol. Cat. Nos. 69104 and 69106, QIAGEN). Con 100 µL de ADN en solución se amplificó con el gen factor de elongación (TEF), que codifica para el factor de elongación 1α. Este es un componente del proceso de síntesis de proteínas en eucariotas y archae (O’Donnell et al., 1998 y Pfenning et al., 2014), con ATGGGTAAGGAGGACAAGAC (EF1) y GGAAGTACCAGTGATCATGTT (EF2) como iniciadores. El termociclador (Multigene Gradient) se utilizó con el programa: desnaturalización inicial 94 °C por 2 min, 35 ciclos a 94 °C 1 min, alineamiento a 53 °C por 1 min, extensión a 72 °C por 1 min y extensión final a 72 °C por 5 min (Geiser et al., 2005). El fragmento amplificado se verificó en un gel de agarosa al 1 % y se tiñó con gel red (Biotium, USA). La banda se visualizó en un sistema de fotodocumentación (Gel Logic 200, Kodak). El producto de PCR se purificó con el kit Wizard SV (Promega). La secuenciación se hizo en un ABI Autosequencer (Applied Biosystems, USA) en Macrogen. La secuencia se comparó con las reportadas en la base de datos del banco de genes NCBI y se realizó la construcción de un árbol filogenético.
Análisis filogenético
Las secuencias de ambas hebras de ADN se ensamblaron y editaron con BioEdit versión 7.0.5 (Hall, 1999), con el que se creó una secuencia consenso. Esta secuencia se compiló en un archivo Fasta y se alineó con Profile mode del Clustal W 1.8.1. (Thompson et al., 1994), del programa Mega 5.1 (Tamura et al., 2011) y analizó con el método de máxima parsimonia (Cuadro 1). Los valores de confianza de los agrupamientos dentro del árbol resultante se obtuvieron con análisis de bootstrap, con 1000 repeticiones (Felsenstein, 1985).
Cuadro 1 Especies y secuencias del GenBank para la construcción del árbol filogenético.

†Han, K. S., S. C. Lee, J. S. Lee, J. W. Soh, and M. J. Park. 2013. Analysis of taxonomic relationships of Fusarium oxysporum f. sp. Based on TEF gene región. Horticultural and Herbal Science. Unpublished. Siti J., and H. Nagao. 2013. Determination of race of Fusarium solani isolated from canker symptom on pumpkin and relationship among isolates from different origins. School of Biogical Sciences University Sains Malaysia. Unpublished. Nayaka, S. C., E. G. Wulff, U. A. C. Shankar, C. N. Mortensen S. R. Niranjana, and H. S. Prakash. 2008. Applied Botany and Biotechnology University of Mysore. India. Unpublished.
Inoculación de semilla de P. greggii con Fusarium
Las semillas se mantuvieron con peróxido de hidrógeno al 30 % por 1 h. Para la inoculación de Fusarium (F) tres cajas con micelio puro y desarrollo del hongo se trituraron en licuadora con 300 mL de agua destilada estéril; las semillas se impregnaron por 24 h con esta suspensión (7.9X104 esporas por mL). De las semillas no germinadas y de plántulas enfermas se hicieron reaislamientos para comprobar su patogenicidad.
Efecto de Fusarium en semilla P. greggii (pre-emergencia) en tres sustratos
El efecto de Fusarium se evaluó en un invernadero, de la División de Ciencias Forestales (DiCiFo), Universidad Autónoma Chapingo. Texcoco, Estado de México (19° 29’ 34” N y 98° 53’ 38” O).
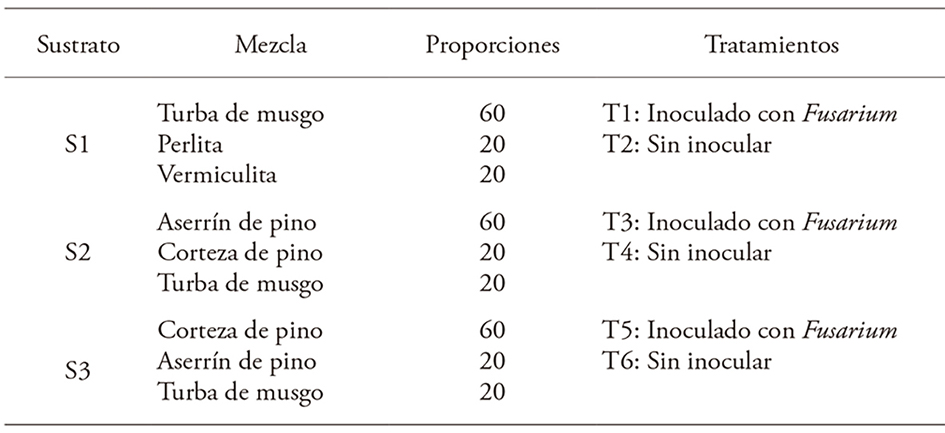
Tres sustratos se evaluaron: (S1) mezcla de turba de musgo (importada de Canadá), perlita y vermiculita, (S2) mezcla de aserrín de pino, corteza de pino y turba de musgo y (S3) mezcla de corteza de pino, aserrín de pino y turba de musgo; todos en proporción de 60:20:20 (Hernandez-Zarate et al., 2014). El aserrín de pino tenía menos de 15 d de aserrado y se obtuvo de un aserradero en Texcoco, Estado de México. La corteza compostada fue de P. douglasiana Martínez (empresa MASVI), de la región sur de Jalisco, México. A las mezclas de sustrato se agregó fertilizante de liberación controlada (Osmocote Plus® 8-9 M 15-9-12+ME; eveRRIS ILC Fertilizer Company, Dublin, OH, EE. UU.) en dosis de 7 g L-1 de sustrato (Aguilera-Rodríguez et al., 2016).
Mesas portatubetes con 42 cavidades, tubetes individuales de 170 mL y semilla de P. greggii, de la comunidad de Pueblo Nuevo, municipio de Chignahuapan, Puebla (19° 52’ 60” N y 98° 06’ 36” O) se utilizaron en el estudio. La siembra se hizo directa el 13 de febrero de 2015, con dos semillas por tubete. La germinación se evaluó en 40 semillas por repetición (160 semillas por tratamiento y 960 semillas totales). La afectación final por Fusarium se evaluó a los 5 meses de edad de la planta. El riego durante la germinación fue ligero y diario y luego cada tercer día.
Diseño experimental y análisis estadístico
El diseño experimental fue completamente al azar, con arreglo factorial 3 (sustratos)X 2 (con y sin Fusarium), seis tratamientos y cuatro repeticiones (Cuadro 2). En cada repetición se utilizó una mesa portatubetes y la unidad experimental fueron 20 plantas del centro (80 plántulas por tratamiento). Los resultados se analizaron con el procedimiento Mixto de SAS, versión 9.0 (SAS Institute, 2002) y comparación de medias de Duncan (p≤0.05).
Variables evaluadas
La germinación (emergencia) se evaluó durante febrero y marzo de 2015 y se registró por cuatro semanas para evaluar el efecto de los tratamientos en pre-emergencia. El porcentaje de semillas germinadas se transformaron con la función arcoseno para su análisis. Con el registro semanal de plántulas enfermas se evaluó la post-emergencia y el porcentaje acumulado de plantas con síntomas de secadera por Fusarium se cuantificó en 10 semanas, durante marzo, abril y mayo. Al final las plántulas enfermas se transfirieron a medio de cultivo PDA+A, para comprobar los postulados de Koch y obtener nuevamente la cepa inoculada del hongo.
Resultados y Discusión
Identificación morfológica y molecular
El hongo proveniente del vivero de Atlangatepec se identificó como Fusarium circinatum Nirenberg & O’Donnell y miembro del complejo Gibberella fujikuroi (CGF). Este patógeno infecta sólo árboles de Pinus spp. y causa la enfermedad del cancro resinoso en las plantaciones. Wingfield et al. (2008) y Gordon et al. (2015) lo reportaron como problema fitosanitario importante y amenaza para viveros y plantaciones en el mundo.
En la muestra evaluada se presentó micelio algodonoso, blanco y coloración con pigmentación violeta intensa en PDA (Figura 1A y B), microconidios ovales sin septos, de 8X3.5 µm (Figura 1H), microconidios agregados en falsas cabezas (Figura 1E), que surgen de monofiálides y polifiálides (Figura 1D y F). Fusarium circinatum puede diferenciarse de F. pseudocircinatum por la formación de los microconidios en cadenas cortas y no en falsas cabezas, como lo señalan Nirenberg y O’Donnell (1998). La especie detectada en SNA desarrolló circinas, que son hifas estériles tabicadas y curvadas (Figura 1I), otras especies que forman estas estructuras son F. pseudocircinatum y F. sterilihyphosum. Fusarium circinatum, no presenta clamidosporas, pero algunas cepas llegan a producir hifas hinchadas que pueden semejarse a clamidosporas o pseudoclamidosporas (Nirenberg y O’Donnell, 1998; Leslie y Summerell, 2006). Nelson et al. (1983) y Pfenning et al. (2014), reportan esporodoquios de color anaranjado pálido formados en agua agar con hoja de clavel, los macroconidios, generalmente de tres septos, miden 35X4 µm (Figura 1C y G), las células apicales son curvadas y las basales poco desarrolladas.
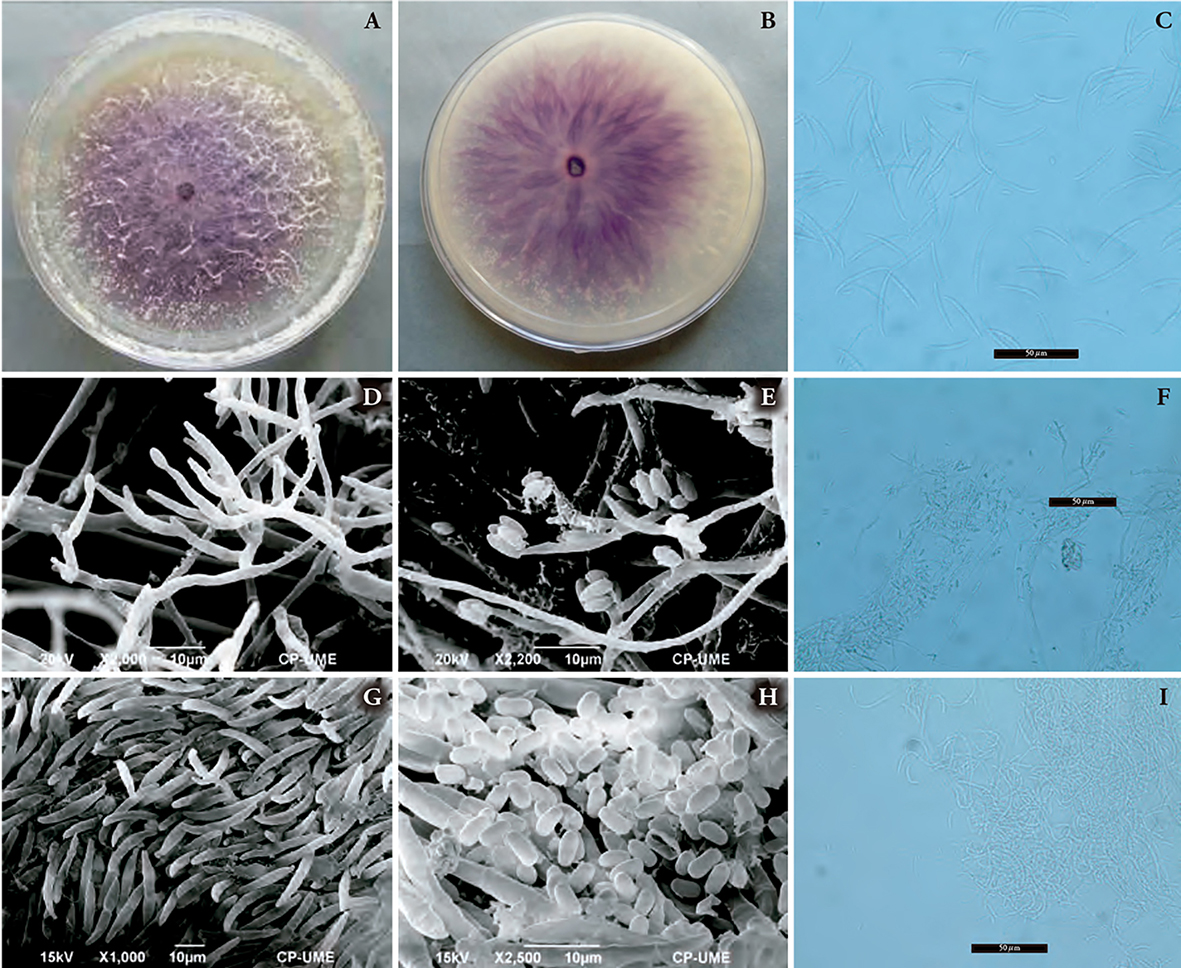
Figura 1 Características de Fusarium circinatum. A) Micelio de color blanco a violeta. B) Pigmento violeta en el medio de cultivo. C y G) Macroconidios alantoides. D y F) Monofiálides y polifiálides de los microconidios. E) Microconidios en falsas cabezas. H) Microconidios de forma ovalada. I) Circinas en medio SNA.
La identificación molecular de la cepa inoculada se depositó en el banco de genes (GenBank), con número de accesión MF075250 y se alineó en el clado de F. circinatum, aislada de la especie de P. greggii (Figura 2). Otros hospedantes de pinos afectados por este hongo e identificados molecularmente con iniciadores específicos se reportaron en P. taeda con los marcadores moleculares MAT1-1 y MAT1-2 (Pfenning et al., 2014), P. montezumae y P. patula con β-tubulin, histona H3 y otros (Kvas et al., 2009), y P. radiata con CIRC1A Y CIRC4A (Martínez-Álvarez et al., 2012).
Efecto de Fusarium circinatum en semilla (pre-emergencia)
Fusarium circinatum redujo 43 % (p≤0.01) la germinación de semillas de P. greggii. Por lo tanto, el porcentaje promedio de germinación pasó de 83 en ausencia del patógeno a 48 cuando la semilla se remojó con F. circinatum. La germinación menor (43 %) de los tratamientos inoculados con F. circinatum se presentó en el sustrato S2 y en S3 germinó 56 % de las semillas. Swett y Gordon (2015) caracterizaron la habilidad de F. circinatum (aislado de pino) para colonizar semilla de maíz (Zea mays) y observaron que hasta 98 % de ellas se infectó. En nuestro estudio, en los tratamientos que no tuvieron F. circinatum se obtuvo más de 80 % de germinación, sin diferencias significativas (p˃0.05) entre los sustratos (Cuadro 3).
Cuadro 3 Germinación de semilla de Pinus greggii en tres sustratos.

Valores promedio en una columna con diferente letra son estadísticamente diferentes con la prueba de Duncan (p≤0.05). S1: turba de musgo, perlita y vermiculita, S2: aserrín, corteza y turba de musgo y S3: corteza, aserrín y turba de musgo en proporción 60:20:20. DS: desviación estándar.
Este resultado coincidió con el señalamiento de que F. circinatum reduce la germinación en P. radiata (Martínez-Álvarez et al., 2012). Peterson (2008) indicó que Fusarium llega a los viveros forestales donde se producen coníferas, principalmente en la testa y en el interior de la semilla (Barrows-Broaddus y Dwinell, 1985; Storer et al., 1998), y que Fusarium invade el embrión y lo mata (Pfenning et al., 2014).
Las semillas en S1 y S2, en presencia de F. circinatum, tuvieron porcentaje de germinación relativamente menor que en S3. Esto coincidió con Hoitink et al. (1997) quien señaló que con una proporción elevada de turba de musgo aumenta la probabilidad de enfermedades y pudriciones de raíz.
Efecto de F. circinatum en plántulas de P. greggii (post-emergencia)
La enfermedad se manifestó después de 5 semanas de la inoculación con F. circinatum en post-emergencia (Figura 3A). La sintomatología correspondió a la observada en el vivero forestal militar de Atlangatepec (Figura 3B). En la etapa de “cerillo” se observó estrangulamiento en el ápice de la planta, con apariencia de deshidratación, después de unos días la plántula no se mantenía erecta y moría (Figura 3C). Peterson (2008) y Wingfield et al. (2008) también observaron que las coníferas son susceptibles a la enfermedad y el hongo en post-emergencia crece en el tejido vascular y causa marchitamiento y muerte de la planta.

Figura 3 Enfermedad de la secadera causada por Fusarium circinatum. A) Plantas enfermas con diferentes avances de síntomas. B) Plántulas de tres meses de edad del vivero de Atlangatepec, Tlaxcala. C) Síntomas en etapa de cerillo. D) Plantas enfermas con tres meses de edad, después de la inoculación. E) Colonias de F. circinatum, desarrolladas en PDA+A, con semilla inoculada. F) Reaislamientos de F. circinatum en plántulas de un mes.
Las plantas de 2 a 3 meses presentaron flacidez y flexión del brote principal, decoloración de acículas, de amarillo a rojizo pardo intenso, pudrición de la raíz primaria y algunas secundarias que adquirieron color café y desintegración de su tejido (Figura 3D). Estos síntomas coincidieron con los descritos por Herron et al. (2015) y Marín-Cruz et al. (2015) como marchitamiento, caída del brote terminal, decoloración y pérdida de acículas, en plántulas durante su primer año de edad.
Solano y Brenes (2012) observaron clorosis del follaje o marchitez del ápice del tallo; estos también son síntomas de la pudrición del sistema radicular (Vivas et al., 2009). Las plantas también desarrollan esporodoquios blancos o anaranjados pálidos en la base y a lo largo del tallo. Peterson (2008) observó el desarrollo del género Fusarium spp. con esporodoquios de color salmón a rosa-coral en la base del tallo, pudrición de raíz en post-emergencia y marchitamiento de plántulas; esto confirmó los síntomas de pudrición de raíz en este estudio, con P. greggii en post-emergencia y en la plántula.
Recuperación del patógeno
En medio PDA con antibiótico se recuperó 100 % de aislamientos, a partir de 249 semillas no germinadas (Figura 3E). De raíz de plántulas enfermas de P. greggii se obtuvieron 156 reaislamientos, de un total de 169 (93 %) (Figura 3F) de los tratamientos con F. circinatum. Con esto se comprobó la patogenicidad. En un estudio similar con F. circinatum en Pinus radiata, un muestreo del 10 % de plantas del experimento generó 100 % de aislamientos (Martínez-Álvarez et al., 2012). Marín-Cruz et al. (2015) lo aislaron de P. montezumae y Herron (2015), en plantas de P. patula, en vivero.
Incidencia de F. circinatum en plántulas de P. greggii creciendo en tres sustratos
En el análisis de los tres sustratos con inóculo de F. circinatum mostró incremento de la incidencia en P. greggii desde la semana uno hasta la semana 10 (Figura 4). La incidencia de F. circinatum, en las plantas en S1, en la semana uno fue 22 %; en contraste en S3 y S2 fue 8 % y 0 %. La incidencia en S2 fue la menor durante todo el período de evaluación y hasta después de cuatro semanas superó una cuarta parte de plantas enfermas (Figura 4).

Figura 4 Incidencia semanal de Fusarium circinatum en plantas de Pinus greggii creciendo en sustratos diferentes. S1: turba de musgo, perlita y vermiculita, S2: aserrín, corteza y turba de musgo y S3: corteza, aserrín y turba de musgo, con una proporción 60:20:20 en las tres mezclas.
En S1 desde la primera semana se observó el porcentaje mayor de planta enferma y en la semana cuatro se había acumulado 56 % (Figura 4). Esto indicó que el sustrato tradicional es el más propicio para el desarrollo de la enfermedad. En S3, con mayor proporción de corteza de pino, el porcentaje de plantas enfermas fue menor en las primeras seis semanas, pero luego igualó a S1.
S2, a base de aserrín, mostró incidencia menor de la enfermedad. En la primera semana no hubo plantas enfermas y en la semana cuatro la incidencia alcanzó solo 28 %, en contraste las plantas enfermas en S1 representaron 56 %. Aunque con S2 la incidencia de F. circinatum tardó en presentarse, a las 10 semanas igualó a S1 y S3 (Figura 4).
Conclusiones
Fusarium circinatum se identificó mediante morfología, evaluación molecular y pruebas de patogenicidad en semilla, como el agente causal de la secadera y pudrición de raíz en P. greggii. La presencia de este patógeno reduce significativamente la germinación de las semillas. El sustrato a base de aserrín retarda la incidencia de la enfermedad por F. circinatum en P. greggii.











 texto en
texto en