Introducción
as prácticas agrícolas y pecuarias inadecuadas, la mala utilización del agua, la agricultura intensiva, el incremento de enfermedades emergentes y reemergentes, y los cambios ambientales traen consecuencias locales y globales relacionadas con un aumento en la transmisión de patógenos (McMichael et al., 2004; Jones et al., 2013; Liverani et al., 2013). Así, las zoonosis emergentes y reemergentes, como la leptospirosis, evidencian una interacción entre la salud y la agricultura pues los factores asociados con la presentación de esta zoonosis reflejan puntos comunes para el desarrollo de una agricultura sostenible y una salud adecuada.
Dentro de los factores asociados se encuentra el cambio climático por el cual se reporta, desde 1998, alteraciones en los ecosistemas propiciando variaciones en la transmisión de infecciones zoonóticas, así como en la distribución y en los tipos de contaminación del ambiente (OMS, 1998; OMS, 2010; Vanasco et al., 2000). En este sentido, la Organización Mundial de la Salud (WHO, 2010), estableció el Grupo de Referencia de Epidemiología, de la Carga de la Leptospirosis (LERG) que, mediante indicadores de mortalidad y discapacidad, como los años de vida ajustados en función de la discapacidad (DALY), cuantifica y describe la carga de la enfermedad en diversas poblaciones, lo cual se puede usar para formular políticas, e implementar medidas de prevención y control. Por consiguiente, es importante realizar una actividad conjunta entre los sectores salud, agricultura, ambiente y educación, para desarrollar soluciones innovadoras, que contribuyan al vínculo entre la salud humana, animal y del ecosistema, debido a que la leptospirosis afecta a animales silvestres y domésticos que serán reservorios y fuentes de infección para las personas que habitan principalmente en zonas rurales y urbanas, con deficiencias sanitarias (Meites et al., 2004; Agudelo-Flórez et al., 2006; Escamilla et al., 2007). De esta forma se promoverá un trabajo intersectorial que permita transformar las políticas para la prevención primaria, de los problemas de salud y agropecuarios (Lilenbaum y Martins, 2014).
Por lo tanto, el propósito de este ensayo fue analizar las implicaciones de las prácticas agropecuarias urbanas y rurales sobre la transmisión de la leptospirosis. Para alcanzar este objetivo se realizó una revisión temática de artículos de investigación original, y de revisión, desde el 2000 al 2015 en PubMed, Scopus, Science Direct, SciELO, Redalyc y Latindex. Los descriptores en español e inglés fueron: “leptospirosis” “agricultura urbana y rural” “ganadería urbana y rural” “Una Salud”. Después de leer los resúmenes, se identificaron los artículos que permitieron analizar las limitantes de la salud en la agricultura tropical, y el efecto de las prácticas agropecuarias, urbanas y rurales sobre la leptospirosis. También se analizaron artículos relacionados con el impacto de la leptospirosis sobre la salud humana, animal y ecosistémica.
Limitantes de la salud en la agricultura tropical
Una agricultura productiva y un sistema de salud que proteja la mayor parte de la población son elementos esenciales para reducir la pobreza. Pero los conflictos sociales y políticos así como la desigualdad, hacen que la agricultura y los sistemas de salud tengan desafíos no resueltos. En la agricultura los desafíos son: limitación de recursos naturales, condiciones climáticas extremas, pestes agrícolas, globalización, deterioro ambiental, y falta de estrategias para mantener la producción agrícola en situaciones de conflicto; ellos constituyen problemas serios en el ámbito nacional, regional y continental, sin estrategias eficaces de solución (Hawkes y Ruel, 2006).
Según Hawkes y Ruel (2006), para los sistemas de salud aún se presentan desafíos antiguos como la malaria, la tuberculosis, las enfermedades diarreicas, las infecciones respiratorias y la desnutrición, que en el siglo XXI cobran muchas víctimas. Por el contrario, las enfermedades febriles, las crónicas, las transmisibles, y la resistencia a los medicamentos e insecticidas son desafíos nuevos en salud; esto, asociado a intervenciones poco eficaces aumentan los problemas agrícolas y de salud que se refleja desde lo local a lo mundial, por lo cual es necesario enfrentar las soluciones en las diferentes escalas (Grace, 2011).
Lo anterior se evidencia con la aparición de epidemias y brotes debido a factores climáticos, culturales y sociales. De 1999 a 2010 hubo brotes y epidemias de leptospirosis endémicas en países tropicales, y en China de 1991 a 2010, la incidencia anual promedio fue 0.70 casos por 100 000 habitantes. Durante esas dos décadas, tres grandes brotes de leptospirosis se produjeron debido a las lluvias e inundaciones (McMichael et al., 2004; Rodríguez et al., 2000; Zhang et al., 2012). En Centro y Sur América hay un aumento de las epidemias de leptospirosis después de desastres naturales (Zaki et al., 1996; Trevejo et al., 1998; Schneider et al., 2013). Por consiguiente, desde 1995 esta enfermedad se considera infecciosa emergente (Farmer, 2001). Esta zoonosis tiene importancia mundial, en particular en los países húmedos tropicales y subtropicales, donde las condiciones ambientales favorecen la supervivencia y crecimiento de la bacteria (Escamilla et al., 2007). En las zonas rurales y urbanas las deficiencias sanitarias, la exposición al contacto con roedores y las inundaciones, son factores asociados con la enfermedad, al igual que en personas cuyo trabajo implica contacto frecuente con animales o sus productos, en excursionistas y quienes practican deportes acuáticos (Meites et al., 2004; Escamilla et al., 2007).
A pesar de la amplia distribución, en la mayoría de los países los programas de vigilancia epidemiológica para la leptospirosis presentan limitaciones, y pocos cuentan con laboratorios de diagnóstico efectivo (Vanasco et al., 2000). Además, frente a catástrofes naturales se produce una alteración de las medidas de salud pública porque se vuelven ineficaces y difíciles de operar, haciendo más vulnerable la población humana a la infección (King, 2011).
Agricultura urbana y rural: Sus implicaciones sobre la transmisión de la leptospirosis
La agricultura urbana surge como un proceso de expansión territorial que sirve como mecanismo para albergar familias rurales que llegan a las ciudades buscando un mejor horizonte, o por condiciones precarias de seguridad en el campo. Esta migración promueve las prácticas agropecuarias en los espacios urbanos y periurbanos, y genera modificaciones en los ecosistemas (Méndez et al., 2005; Franco et al., 2008). En China están los niveles más altos de suministros urbanos y periurbanos de vegetales, y el 79 % de las frutas proviene de las áreas periurbanas (Lee-Smith y Prain, 2006). En Beijing y Shanghái, los vegetales se producen a menos de 10 kilómetros del punto de venta, en 85 % y en 76 %, respectivamente (Lee-Smith y Prain, 2006). La producción de frutas y de vegetales es 31 % para las zonas urbanas, y 64 % para las zonas periurbanas de Beijing (Lee-Smith y Prain, 2006). El 6 % de la tierra del área metropolitana de Manila se destina a la agricultura y 2 % de ésta a la piscicultura, que cubre dos tercios de la demanda de pescado (Hawkes y Ruel, 2006; FAO, 2012).
En las zonas urbanas de América Latina, el 12 % de la tierra se usa para la agricultura y da trabajo a 117 000 personas. En Lima (Perú), 70 % de algunas especies de los vegetales consumidos son aportados por este tipo de agricultura, y entre 15 % y 20 % de los hogares participan en la agricultura urbana y periurbana. Además, estas familias mantienen aves de corral y ganado menor (Hawkes y Ruel, 2006).
Manizales, Armenia y Pereira son los centros urbanos del eje cafetero colombiano, y en ellos la práctica urbana de la agricultura y la producción pecuaria son una expresión de cambio en el concepto dicotómico, entre la ruralidad y el urbanismo, porque municipios rurales a su alrededor concentran la infraestructura social que suministra alimentos a la región, y son el punto de vivienda y trabajo de la población desplazada del campo a la ciudad (Méndez et al., 2005). Bogotá depende de municipios cercanos para el suministro de hortalizas cosechadas en 27 548 ha, y Cundinamarca es el departamento con mayor influencia en la producción de hortalizas, con una participación nacional del 28 %. Ese departamento tiene 220 000 ha de suelo apto para cultivo con suficientes recursos hídricos, y 30 000 ha de tierra en diferentes pisos térmicos (Cámara de Comercio Bogotá, 2011). Además, en la cadena productiva del sector hortícola, de la Sabana de Bogotá, se vinculan pequeños y medianos productores como proveedores de centrales de abasto para todo el país (Miranda et al., 2008).
Estas estrategias agrícolas, que vinculan al campo con los entornos periféricos de las grandes metrópolis, son el resultado de la nueva ruralidad, que implica un cambio en el concepto de lo rural y de lo urbano. Lo rural se relaciona con lo agrícola, el poco desarrollo, y con la pobreza, y lo urbano con todo lo opuesto; sin embargo, en el contexto de la nueva ruralidad estas diferencias han perdido y pierden nitidez, y lo urbano se interpreta como un componente fundamental de la ruralidad y viceversa (Méndez et al., 2005; Ramírez et al., 2008).
El fenómeno de la agricultura urbana integra la actividad rural al entorno de la ciudad, caracterizado por la transformación, la industrialización y el uso improductivo del suelo; por lo tanto, la implementación en las ciudades o sus periferias de modelos primarios de producción agropecuaria, hace que la división entre la ruralidad y el urbanismo sea cada vez más limitada (Rodríguez et al., 2000). Lo anterior se explica, primero, por la implementación directa de prácticas rurales en la ciudad y en sus periferias; y luego, porque residentes citadinos participan de las actividades agropecuarias indirectamente por la venta de insumos, el transporte, el papel intermediador, la implementación de procesos y el comercio a menor y mayor escala (Mikkelsen, 2013).
El análisis de las prácticas agropecuarias en la ciudad y en el campo muestra que el soporte físico territorial para su establecimiento determina su diferencia principal. Así, el cultivo de plantas y la crianza de animales en áreas rurales, de acuerdo con procesos tradicionales, requieren una extensión de tierra amplia y adecuada. Pero esta práctica en el contexto urbano aprovecha cualquier espacio disponible, sea cubierto o no. Así, en la ciudad la producción vegetal se realiza directamente en el suelo o en recipientes de diversa índole, y la producción pecuaria se adapta, según la práctica a implementar, en terrazas, patios, traspatios, parques, zonas públicas o terrenos baldíos (Franco et al., 2008; Teubal et al., 2001).
En la agricultura rural los elementos principales son los espacios abiertos y extensos, adecuados para la producción agropecuaria, y la urbana se relaciona con espacios más cerrados y edificados donde el área disponible para la producción es restringida. Además, las prácticas agropecuarias urbanas, comparadas con las rurales, están próximas a grandes concentraciones humanas y propician oportunidades y riesgos (Teubal et al., 2001; Méndez et al., 2005).
De acuerdo con la FAO (2008), las oportunidades se relacionan con acceso a los mercados de consumo porque disminuye el envase, el almacenamiento y el transporte de alimentos. También existe un aumento en las posibilidades de empleos e ingresos agrícolas y una mayor consecución de alimentos por consumidores de escasos recursos. Pero se potencializan riesgos como las prácticas agrícolas y acuícolas inadecuadas, la reducción de la capacidad del ambiente para limitar la contaminación porque animales y humanos comparten recursos como suelo, aire y agua. Esta competencia limita los recursos, afecta la salud humana, animal y ambiental, y genera mayores posibilidades de transmisión de enfermedades que aumentan la prevalencia e incidencia de patologías, principalmente zoonóticas. Estas dificultades ambientales y de competencia por el uso de recursos derivados de la agricultura, también se presentan en las zonas rurales, pero la limitación de espacio y los asentamientos humanos amplían las posibilidades y riesgos en las zonas urbanas (Aguilar, 2014).
Las prácticas agrícolas y pecuarias en los centros urbanos propician cambios en la distribución de patógenos, y para una zoonosis como la leptospirosis se establecen factores de riesgo que pueden potencializar su presentación en las regiones tropicales y húmedas (Escamilla et al., 2007). El conocimiento de las prevalencias en una localidad, la determinación de sus huéspedes de mantenimiento y el monitoreo de la emergencia de nuevos serovares de Leptospira spp., son esenciales para comprender la epidemiologia de la enfermedad en una región y para enfocar las estrategias de control. Además, Leptospira spp., agente etiológico de la leptospirosis, puede sobrevivir en diferentes ambientes, por lo que el impacto de la enfermedad en la salud pública es evidente. La supervivencia de la bacteria en ambientes diversos se explica porque su reproducción y supervivencia se favorece en el suelo o en el agua con un pH neutro, o ligeramente alcalino y en zonas con un alto grado de humedad; además, puede resistir temperaturas entre 7 y 36 °C (OMS, 2008). Esto asociado con la diversidad de reservorios para la bacteria, como ratas, bovinos, perros, porcinos, equinos, cabras, conejos y murciélagos; los dos primeros son los más importantes y característicos en el contexto rural y en el urbano (Meites et al., 2004; Agudelo-Flórez et al., 2010). En los reservorios las leptospiras patógenas se establecen en los túbulos renales, se excretan con la orina y llegan al ambiente, alimentos y agua. Este mecanismo es fundamental en la trasmisión del patógeno, en la interfaz humano-animal-ambiente. Las condiciones de humedad, la presencia de charcos, lagunas y aguas estancadas que se contaminan fácilmente, se convierten en foco permanente de diseminación (Hernández-Rodríguez et al., 2011; Brihuega, 2008; Evangelista y Coburn, 2010; Hartskeerl et al., 2011).
La prevalencia de las infecciones por los diferentes serovares de Leptospira spp. en las explotaciones pecuarias de los países tropicales y subtropicales, no se conoce. De acuerdo con estudios relacionados con la leptospirosis, en la industria pecuaria de EUA la prevalencia es 35 a 50 %, y la mayoría de esas infecciones se debe probablemente al serovar Hardjo (Grooms, 2006). Además, es difícil determinar las pérdidas económicas, principalmente por las dificultades relacionadas con el diagnóstico de la enfermedad.
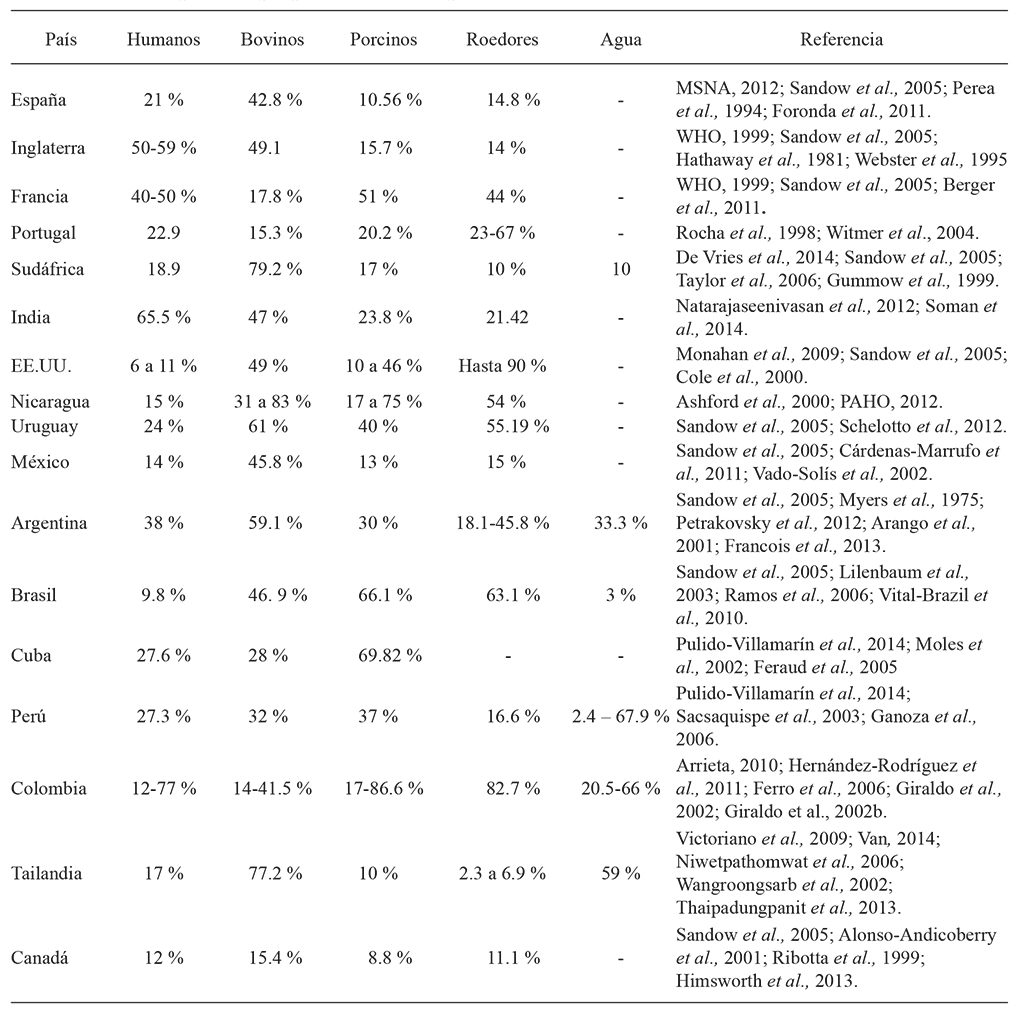
La prevalencia de la leptospirosis varía entre continentes, países, regiones, y entre especies animales en el mundo. La frecuencia de esta zoonosis aumenta por inundaciones causadas por factores naturales, y por el uso inadecuado de la tierra que generó brotes de leptospirosis entre 1995 y 2009. Algunos ejemplos: en Nicaragua (1995), Malasia (2000), Ecuador y Perú (1998), Orissia (1999), Bombay (2000, 2005), Yakarta (2002), y Filipinas (2009). Según la base de datos del HealthMap, entre 2007 y 2013 hubo 787 alertas globales de esta zoonosis: 63 % en América, en especial en Brasil, Nicaragua y Argentina, 15 % en el Pacífico Occidental; 14 % en el sureste de Asia; Europa 8 %; África 1 % y el Mediterráneo Oriental 0.5 % (Schneider et al., 2013. Estos factores naturales y los cambios asociados con las prácticas agropecuarias urbanas y rurales, han determinado prevalencias de infección en diferentes especies de importancia en Salud Pública y Producción Pecuaria (Cuadro 1).
En la región del caribe colombiano, para bovinos se reportó una positividad de 38.2 %, en el Pie de Monte Llanero 24.8 % y en la Región Andina 14.4 %, y para el país el promedio es 21.7 % (Monsalve et al., 2009). En el Departamento de Córdoba un estudio con una muestra de 600 porcinos, mostró 43.0 % de seropositividad para Leptospira spp, y es una de las más altas en el país, si se compara con seropositividades de 26.0 % para la zona andina, 23.0 % para el eje cafetero y 24.0 % para el Valle del Cauca. En Villavicencio la seropositividad fue 16.0 %, con una muestra de 358 porcinos (Monsalve et al., 2009).
De acuerdo con estudios epidemiológicos, con la información de los boletines de Sanidad Animal del Instituto Colombiano Agropecuario (ICA), y el déficit de estrategias de prevención y control, la leptospirosis bovina es una enfermedad común en el país y afecta la producción pecuaria (Orjuela et al., 2002). El impacto económico de la enfermedad en bovinos se evidencia por problemas reproductivos, tratamientos y vacunación ineficiente, así como por 5.0 % a 10 % de abortos en vacas infectadas y por la mortalidad embrionaria (Orjuela et al., 2002). Estos eventos causan pérdidas económicas, por morbilidad y disminución en la producción, y muestran el impacto económico de la enfermedad; entonces, la leptospirosis es una enfermedad que debe ser controlada (Faine et al., 1982; Adler y Moctezuma, 2010).
Respecto a la leptospirosis humana, la información de 2013, hasta la semana epidemiológica 52, muestra una notificación al Sivigila de 2 263 casos en Colombia, y comparado con 2012, el aumento es 13.94 % en la notificación del evento. La incidencia es 1.7 casos por 100 000 habitantes (INS, 2014). Además, según las estadísticas desde la semana 1 a la 14 del 2015, en Sivigila se reportaron 715 casos de leptospirosis, lo que es un aumento de 1.51 % en la notificación, respecto al año 2014, y se reportan 25 casos probables de muerte por leptospirosis en el país (INS, 2015).
Según datos del Instituto nacional de Salud, durante 2010 y 2011 aumentó el número de casos de leptospirosis, lo cual se relacionó con la temporada de lluvias e inundaciones. Esto explica la relevancia del agua como vehículo en la transmisión de Leptospira spp. a los seres humanos y a otras especies, y refleja la importancia de su estudio, así como su impacto en salud pública (Giraldo et al., 2002). Además, se resalta la adaptabilidad de la bacteria para sobrevivir en aguas dulces y en suelos adyacentes donde hay carencia de nutrientes, y se plantea la hipótesis de interacción con otros microorganismos del ambiente, e incluso con gérmenes de su especie, para el crecimiento. Un estudio realizado en Quito (Ecuador), mostró la viabilidad de Leptospira interrogans serovar Canicola, durante 98 d de incubación en agua destilada (UNESCO, 2003).
En cuanto al ciclo de mantenimiento de la bacteria, un determinante en la trasmisión es que diferentes serovares de Leptospira spp. pueden estar presentes en una misma especie y varias especies animales pueden portar un mismo serovar (Ramadass et al., 1990; Levett et al., 2010). Algunos animales están adaptados a serovares particulares de Leptospira spp., sirven como reservorios y eliminan la bacteria al ambiente durante años, sin manifestar signos clínicos de la enfermedad, lo que favorece la trasmisión humano-animal-ambiente; el suelo, y principalmente el agua, son factores importantes en la transmisión (Calderón et al., 2014). Las especies animales adaptadas a serovares de Leptospira son: equinos al serovar Bratislava (Bernard, 1993), caninos al serovar Canicola (Ortega-Pacheco et al., 2008), porcinos al serovar Pomona (Ellis et al., 1986), y bovinos al serovar Hardjo (Grooms, 2006). Así, la L. borgpetersenii serovar Hardjo (hardjo-bovis), es la causante más común de leptospirosis bovina en el mundo, y L. interrogans serovar Hardjo (hardjoprajitno) se ha aislado en regiones específicas, como en aislamientos en bovinos del Reino Unido (Grooms, 2006). Infecciones causadas por L. interrogans serovar Pomona y por L. interrogans serovar Grippotyphosa están asociadas con fallas reproductivas. Lo cual ocasiona pérdidas económicas notables (Kingscote y Wilson, 1986; Barr y Anderson, 1993).
La implementación de normas de bioseguridad en la cadena primaria de la industria pecuaria tiene una función importante en la prevención y el control de la leptospirosis, en particular los programas diseñados para el control de plagas como roedores y de aguas estancadas (Sanderson y Gnad, 2002). Diversos grupos de investigación centran sus esfuerzos en desarrollar vacunas que confieran una mayor protección en animales, y destacan las vacunas recombinantes (de proteínas de membrana externa, lipoproteínas y factores de virulencia), de lipopolisacáridos (LPS), inactivadas, atenuadas y de ADN. Sin embargo, los resultados de las pruebas clínicas para cuantificar la efectividad de estos biológicos son insatisfactorios (Wang et al., 2007; Murray et al., 2010). Por lo tanto, se requieren más estudios para caracterizar la enfermedad y entender los mecanismos moleculares de la fisiopatología de esta zoonosis.
De acuerdo con lo expuesto, es importante mejorar el diagnóstico y evaluar la salud humana, animal y ambiental para optimizar una verdadera vigilancia epidemiológica. En este sentido, es necesario abordar la leptospirosis desde el enfoque de una sola salud, porque se define como “una estrategia que busca la colaboración interdisciplinaria, y la comunicación, en todos los aspectos de la atención en salud para las personas, los animales y el medio ambiente” (Gibbs, 2014). Desde esta perspectiva, generar estrategias de prevención y control es fundamental, para lo cual es prioritario fortalecer los sistemas diagnósticos que permiten la identificación de este patógeno en las especies animales, en el ambiente y en los humanos infectados.
Zoonosis en el contexto de una salud: Leptospirosis como modelo
En humanos hay 1 461 enfermedades, de las cuales 60 % corresponde a patógenos que interactúan con diferentes especies, y 75 % de las enfermedades infecciosas emergentes son zoonóticas. Por lo tanto, el incremento en la interacción con animales y sus productos, y la relación del origen de las zoonosis con la agricultura, son factores críticos para la salud en la interfase humano-animal-ambiente (Taylor et al., 2001; Grace y Jones., 2011). Una problemática que enfrenta la salud pública es la falta de un control integrado de las enfermedades, en especial de las zoonosis, desde la articulación y el trabajo conjunto entre los sectores de salud humana, salud animal, y medio ambiente. Así, a mediados de 1999 se empezaron a explorar mecanismos de interacción entre la salud humana, animal y del ecosistema para generar un trabajo con beneficio conjunto. Así surgió la iniciativa One Health apoyada por la FAO, la Organización Mundial de la Salud (OMS), la Organización Mundial de Sanidad Animal (OIE), la UNICEF) y el Banco Mundial, lo cual permitió en 2008 la estructuración de una estrategia, para responder al incremento en el riesgo de enfermedades emergentes y reemergentes (Gibbs, 2014).
En Colombia, la limitada comunicación intersectorial y la poca disponibilidad de pruebas diagnósticas precisas en el sector de la salud y en la ganadería, han limitado los programas de vigilancia de la leptospirosis. Dechner (2014) reportó que 85 % de los estudios de leptospirosis realizados en Colombia se basan en la prueba MAT que presenta dificultades de manejo e interpretación, y concluyó que la prevalencia e incidencia de la enfermedad es desconocida. La implementación de medidas de control para esta zoonosis es difícil por la supervivencia prolongada de las leptospiras en el suelo y el agua, por la abundancia de reservorios animales, y por los más de 300 serovares (Bourhy et al., 2013; Picardeau, 2013). Además, las vacunas son serovar específicas, la protección conferida es de corta duración, y no proporciona inmunidad cruzada contra serovares heterólogos de Leptospira (Picardeau, 2013; Rajapakse et al., 2015).
Según Guerra (2013), en humanos la leptospirosis es reconocida como una enfermedad ocupacional que afecta a determinados grupos en riesgo, como trabajadores de arrozales y de otros cultivos agrícolas así como a mineros, y trabajadores en ambientes infectados, como el mantenimiento de alcantarillas, y soldados destacados en zonas selváticas. La leptospirosis afecta a operarios de granjas, centrales de abasto o rastros, procesadores de productos de origen animal y veterinarios. Además, el aumento de la población humana y la invasión de los hábitats de los animales silvestres aumentan las oportunidades de interacción, y por lo tanto, la transmisión de este patógeno en la interfaz humano-animal-ambiente. Entonces, es importante abordar esta enfermedad desde el concepto de Una Salud y de forma interdisciplinar, para entenderla e intensificar las medidas de control. Debido a las condiciones ambientales, sociales y económicas que caracterizan a la leptospirosis, es evidente la importancia de esta zoonosis en el mundo, y en especial en zonas tropicales. Por lo tanto, es necesario realizar un abordaje, que desde la intersectorialidad, permita fortalecer los sistemas de diagnóstico actuales haciéndolos más eficientes y accesibles, para lograr en el mediano plazo la disminución del subregistro, mejorar la vigilancia epidemiológica, y el conocimiento de las verdaderas tasas de prevalencia e incidencia de esta zoonosis en muchas regiones tropicales.
Entonces, se enfatiza la importancia de determinar el verdadero impacto de la enfermedad, de mejorar los sistemas de vigilancia y de diagnóstico en el mundo para disminuir el subregistro, conocer la distribución geográfica, la presencia de nuevos reservorios y, principalmente, la verdadera incidencia de la enfermedad. Además, se debe evaluar las intervenciones y estrategias de control, así como calcular en humanos, las pérdidas económicas por incapacidad de individuos en edad productiva, y los costos de tratamiento. En cuanto a la parte pecuaria, se debe establecer las pérdidas del sector productivo, por las alteraciones en la reproducción y en la producción, atribuibles a la infección por Leptospira (WHO, 2010).
Conclusiones
La implementación de nuevas formas de agricultura y de producción pecuaria en espacios urbanos y periurbanos, así como la demanda alimenticia familiar, han propiciado que la división entre lo urbano y lo rural sea cada vez menos evidente. Estas condiciones modifican la distribución de patógenos zoonóticos y propician un cambio de paradigma en el control y vigilancia de zoonosis, como la leptospirosis, que con una distribución mundial requieren un abordaje desde la intersectorialidad, que integre las acciones de los agentes públicos responsables de las políticas de salud, ambiente y agricultura.
Las limitantes de la salud en la agricultura tropical son puntos estratégicos que se pueden abordar desde la medicina humana y veterinaria, producción agropecuaria, epidemiología, microbiología y biología molecular, como estrategia de integración que lleve a una agricultura productiva, y a un sistema de salud que proteja y cobije a la mayor parte de la población, cuya consolidación se reflejará en una reducción de la pobreza, y en un beneficio para la población humana y animal, y también para los ecosistemas en los que estas poblaciones habitan.











 texto en
texto en