Introducción
Alrededor de 1900 especies de insectos se utilizan para la alimentación humana en el mundo (van Huis, 2013) y contribuyen significativamente a las economías locales (DeFoliart, 1999). En México hay 535 especies de insectos comestibles (Ramos-Elorduy et al., 2008) y entre ellas están Comadia redtenbacheri (Hammerschmidt), lepidóptero de la familia Cossidae, la única especie de esta familia citada para México (Brown, 1976) y una de las cuatro principales familias de barrenadores de la madera (Kalisch y Baxendale, 2010). Las principales especies hospedantes de C. redtenbacheri son los magueyes pulqueros Agave salmiana Otto ex Salm, A. mapisaga Trel. y A. atrovirens Karw. ex Salm (Camacho et al., 2003). Las hembras de C. redtenbacheri ovipositan masas de huevos en la base de las hojas del agave y el periodo de incubación es 30 a 35 d. Después de la eclosión, las larvas se establecen en el rizoma del agave donde completan su desarrollo (Granados, 1993) pasando a través de siete instares larvales (Hernández-Livera et al., 2005) en un periodo de cinco meses en invernadero y ocho en campo (Llanderal-Cázares et al., 2007). La larva de C. redtenbacheri, llamada gusano rojo del maguey, es apreciada para el consumo humano y en laboratorio el período de pupación es cinco meses, en un sustrato de una mezcla a partes iguales de suelo y vermiculita de 5 cm de profundidad (Miranda-Perkins et al., 2013). La longevidad de los adultos es sólo 3 a 5 d, porque su aparato bucal es atrofiado y no pueden alimentarse (Hernández-Livera et al., 2005; Llanderal-Cázares et al., 2007).
El gusano rojo del maguey en la zona turística de Otumba y Teotihuacán, Estado de México, tiene un precio en estado fresco de $500.00 kg-1 en temporada de recolección y $700.00 kg-1 en los meses de producción escasa (Miranda et al., 2011). Pero Camacho et al. (2005) reportan precios de $800.00 a $1000.00 kg-1.
La mayoría de los insectos comestibles se cosechan de poblaciones silvestres (van Huis, 2013) y del gusano rojo del maguey en temporada de lluvias de julio a septiembre, se aprovecha su comportamiento natural para la recolección, ya que el agua estimula a las larvas de último instar que están listas para pupar a salir del maguey. Pero el procedimiento típico de recolección es localizar las plantas infestadas y extraer las larvas aunque no hayan terminado su desarrollo, lo cual reduce la población silvestre (Granados, 1993; Miranda et al., 2011). Además, el procedimiento afecta las poblaciones del agave, ya que los daña y no hay prácticas de replantación (Ramos-Elorduy, 2006; Llanderal-Cázares et al., 2010).
Nolasco et al. (2002) y Camacho et al. (2005) intentaron establecer, en condiciones controladas, diferentes estados de desarrollo de C. redtenbacheri. Llanderal-Cázares et al. (2010) reportan el establecimiento y desarrollo de las fases larvarias de C. redtenbacheri hasta el estado de pupa en plantas de agave en invernadero. En laboratorio se obtuvieron los procesos de pupación, apareamiento, oviposición y eclosión (Miranda-Perkins y Llanderal-Cázares, 2013; Miranda-Perkins et al., 2016).
van Huis et al. (2013) opinan que la cría de insectos en condiciones controladas podría evitar su sobreexplotación en la naturaleza y proponen que en los trópicos el énfasis debe ser optimizar la productividad de los sistemas tradicionales, con el desarrollo de procedimientos para manejar el recurso en instalaciones de cría a pequeña escala.
Así, el objetivo de este estudio fue establecer condiciones de cultivo de C. redtenbacheri en macetas con plantas establecidas de agave A. salmiana, para evaluar el número de larvas liberadas por maceta que permita obtener los mayores porcentajes de pupación, emergencia de adultos y oviposición.
Materiales y Métodos
Material biológico
Recolección y establecimiento de plantas de A. salmiana
En Teotihuacán, Estado de México (19° 41’ 23” N y 98° 51’ 39” O, altitud 2272 m), se recolectaron 45 plantas de A. salmiana Otto ex Salm-Dyck, de una edad aproximada de tres años, que por lo general tienen infestación por larvas de C. redtenbacheri en el campo. Los agaves presentaban signos de debilidad como hojas pálidas, amarillentas o secas, que de acuerdo con Kalisch y Baxendale (2010) hacen que los barrenadores prefieran a un hospedero. Algunos de ellos también fueron elegidos por presentar algunas hojas periféricas en descomposición.
En febrero de 2014 se establecieron los agaves en un vivero en el Campus Montecillo del Colegio de Postgraduados, Estado de México, cubierto con malla de 40 % de sombreo. Los 45 agaves fueron replantados en nueve macetas de plástico de 122×122×30 cm, con suelo franco hasta una altura de 20 cm, procedente del mismo vivero, ya que Miranda-Perkins et al. (2013) compararon diferentes sustratos para la pupación y emergencia del gusano rojo del maguey, y observaron que las larvas tienen una alta capacidad para pupar en diversos tipos de sustratos. Las macetas fueron colocadas sobre mesas a 1.10 m de altura para mantenerlas alejadas de depredadores durante la experimentación. El riego se aplicó una vez por semana durante tres semanas para el establecimiento de las plantas, y se suspendió cuando se comprobó que los agaves comenzaban a enraizarse. Las plantas de maguey se mantuvieron ocho meses expuestas al ambiente hasta su utilización.
Obtención y selección de larvas de C. redtenbacheri
Larvas de Tulancingo, Hidalgo, se adquirieron el 26 de agosto y el 12 de septiembre de 2014. La muestra se catalogó como comercial lo que implica, según Miranda-Perkins et al. (2013), que los organismos fueron extraídos del rizoma del agave y manipulados durante el proceso de recolecta, acopio y distribución sin un cuidado especial. Las larvas seleccionadas tenían un peso >0.30 g (a partir del quinto instar) y, según Miranda-Perkins et al. (2013), logran pupar si se les proporciona un sustrato adecuado. Para este estudio se usaron larvas sanas, sin signos de parasitismo o daño por patógenos según los criterios de Zetina y Llanderal (2014), y se mantuvieron en el Laboratorio de Fisiología de Insectos del Colegio de Postgraduados, Campus Montecillo, en charolas con trozos de A. salmiana como alimento y se descartaron las que tuvieron comportamiento anormal y las muertas.
Pupación de larvas, emergencia de adultos y oviposición
En septiembre de 2014, las larvas de C. redtenbacheri seleccionadas se colocaron en las macetas que contenían los agaves, en densidades de 200, 400 y 600 organismos por maceta, con tres repeticiones distribuidas al azar, bajo el supuesto de que con mayor número de larvas inducidas a pupar, mayor será la emergencia de adultos. El suelo de la maceta fue removido de la superficie con una pala para facilitar el establecimiento de las larvas, que se distribuyeron sobre el suelo en grupos aproximados de 50 individuos hasta cubrir toda la superficie de la maceta. Una vez enterradas, se repetía el procedimiento hasta terminar con el número correspondiente a cada tratamiento. Después, la maceta se cubrió desde la base hasta una altura de 80 cm con una jaula de organza lisa como protección contra depredadores y se retiró cuando las larvas no salieron del suelo.
La pupación dura cinco meses en laboratorio (Miranda-Perkins et al. 2013), y después de ese tiempo, en febrero de 2015 se colocaron nuevamente las jaulas de organza para mantener en confinamiento a los adultos que emergieron, ovipositaron y ovipositaron sobre los agaves disponibles. En mayo de 2015, al término de la emergencia y cuando ningún adulto se observó con vida, se retiraron las jaulas y se evaluó la emergencia de los adultos mediante el conteo y el sexado de las exuvias pupales presentes en la superficie del suelo de cada maceta. Además se recolectaron las masas de huevos ovipositadas en la base de las hojas de los agaves elegidos por las hembras, se pesaron por unidad experimental y con base en el peso promedio por huevo se calculó el número de huevos en las masas ovipositadas. Este valor representa el número potencial de individuos para la siguiente generación. El suelo se tamizó para localizar a los individuos que permanecieron como larvas o pupas, para detectar el motivo de la no emergencia de adultos. El experimento se realizó a la intemperie, por lo que no hubo control de las condiciones ambientales.
El análisis estadístico se realizó con SAS for Windows 9.00 (2002). Para comparar el número de adultos emergidos se usó una regresión de Poisson estimando la máxima verosimilitud con el procedimiento GENMOD (p≤0.05). Los datos del peso de masas ovipositadas se analizaron con GLM y las se medias se compararon con la prueba de Tukey (p≤0.05).
Resultados y Discusión
El proceso de pupación de C. redtenbacheri en vivero comenzó en septiembre de 2014 y concluyó en marzo de 2015, con el inicio la emergencia de los adultos que se prolongó hasta mayo de ese año. Cuando se liberaron 600 larvas/maceta se obtuvo un promedio de emergencia de 15.9 % y fue la mejor condición (p≤0.001), porque con la densidad de 400 larvas/maceta el promedio fue 1.1% y 5.3 % con 200 individuos/maceta (Cuadro 1).
Cuadro 1 Número promedio de adultos emergidos por densidad larvaria de C. redtenbacheri, mediante la prueba de regresión Poisson.

Mediante el sexado de las exuvias pupales de los adultos emergidos poco más de la mitad fueron hembras para las tres densidades larvarias utilizadas: 48 hembras y 46 machos para 600, 2 hembras y 2 machos para 400 y 6 hembras y 4 machos para la densidad 200 larvas. Si se considera que cada hembra puede dar origen a 104 descendientes en promedio (Ramírez-Cruz y Llanderal-Cázares, 2015), las 48 hembras de la densidad de 600 larvas/maceta, podrían dar origen a 4992 larvas las cuales serían suficientes para infestar los agaves disponibles.
Camacho et al. (2003), en un estudio a la intemperie, colocaron larvas de C. redtenbacheri para la pupación y obtuvieron 15 % de emergencia e infieren que este bajo porcentaje pudo deberse a los cambios drásticos de luz y temperatura. En nuestro estudio, la baja emergencia se pudo deber al exceso de humedad en las macetas porque el agua retenida por el suelo debido a las lluvias durante el experimento, era difícil de drenar por el tamaño de las macetas y esto pudo inducir a las larvas que estaban dentro de su capullo a salir de nuevo en busca de otro sitio para la pupación. Miranda-Perkins et al. (2013) reportan que al no proporcionar humedad a las larvas de C. redtenbacheri la emergencia de adultos aumentó 50 %; pero otra causa de la baja emergencia pudo deberse al origen de las larvas que provenían de muestras comerciales, lo que reduce en 50 % la emergencia de los adultos. En crías de insectos la manipulación directa de las larvas debe ser mínima durante todo su desarrollo, porque les causa estrés (Madrigal 2001).
La presencia de entomopatógenos en el suelo usado como sustrato para la pupación, también pudo tener una función importante en el bajo porcentaje de emergencia. Del suelo tamizado de las nueve macetas se recuperaron 995 individuos en diferentes etapas de desarrollo desde larvas, prepupas en la gran mayoría y pupas a término. Así, es probable que el ataque de entomopatógenos impida que las larvas lleguen al estado de pupa y si se alcanza, eviten el desarrollo completo de los adultos. De individuos recuperados se analizaron 10 muestras y se encontraron hongos de los géneros Rhizopus, Penicillium y Aspergillus, que con frecuencia están como patógenos en crías de insectos (Shapiro, 1984). Rhyzopus stolonifer (Ehrenberg: Fries) Vuillemin es saprófito en el suelo y se ha encontrado en dietas para alimentación del gusano de seda Bombyx mori L. (Trivedy et al., 2011). Miranda-Perkins et al. (2013) registraron cerca de 40 % de larvas de C. redtenbacheri, depositadas en suelo para la pupación, infectadas por Beauveria spp., y Hernández-Flores et al. (2015) reportan asociación de larvas de C. redtenbacheri con varios géneros de bacterias.
Aunque la intensidad en la transmisión de las enfermedades en las poblaciones de insectos es proporcional al número de individuos susceptibles y al incremento del estrés asociado con altas densidades de población (Steinhaus, 1958, Vilaplana et al., 2008), hay ejemplos de insectos que muestran plasticidad fenotípica en respuesta a cambios en la densidad poblacional, lo cual se denomina profilaxis denso-dependiente (Simpson et al., 2001). Así, Schistocerca gregaria cuando se encuentra en altas densidades presenta mayor resistencia al hongo Metarhizium anisopliae que las langostas solitarias, debido a una actividad antimicrobiana potenciada en sus sistemas de defensa (Wilson et al., 2002). Esa característica pudo presentarse en el caso de C. redtenbacheri, ya que la mayor emergencia ocurrió cuando se usó la mayor densidad de 600 larvas por maceta.
Para el peso de masas de huevos ovipositadas el mejor tratamiento fue el establecido con la densidad de 600 larvas (p≤0.013) con respecto a las otras densidades evaluadas (Cuadro 2), y se obtuvo un promedio de 0.961 g; con base en el peso promedio calculado de cada huevo (0.00056 g) equivale a 1715 huevos. Esto se traduce al mismo número de larvas potenciales y se obtiene casi el total de las larvas utilizadas (95 %) para las tres repeticiones (1800 larvas). Bajo un sistema de manejo, aún si una tercera parte de los huevos no fuera fértil, si las larvas sobrevivientes se establecieran en los agaves y continuaran su desarrollo, en las generaciones siguientes los adultos podrían realizar una nueva infestación de los agaves disponibles en el área destinada para tal fin.
Cuadro 2 Peso promedio de las puestas ovipositadas por C. redtenbacheri, por densidad larvaria.
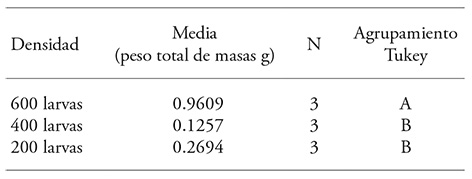
Valores con diferente letra son estadísticamente diferentes (Tukey; p≤0.05).
Debido a que los porcentajes más altos de emergencia de adultos y oviposición se observaron en el tratamiento con mayor número de larvas (600), es conveniente en otros experimentos aumentar la densidad de individuos para obtener una producción mayor en la misma superficie. Así el sistema sería más eficiente, además de usar larvas de origen no comercial.
Conclusiones
El establecimiento de C. redtenbacheri en vivero fue posible mediante la liberación de larvas en plantas de agave establecidas en macetas y a la intemperie. La pupación, emergencia de los adultos y oviposición sobre los agaves disponibles se logró con las densidades usadas, y el mejor resultado se obtuvo con la densidad de 600 larvas por maceta. En otros estudios la especie debiera continuar su desarrollo, para que en la siguiente generación las larvas que eclosionen de las masas de huevos puedan establecerse por sí mismas en las plantas de agave disponibles. El uso de altas densidades de larvas por unidad de superficie para la infestación inicial, podría resultar en mayor emergencia de adultos y oviposición.











 texto en
texto en 


