Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agrociencia
versión On-line ISSN 2521-9766versión impresa ISSN 1405-3195
Agrociencia vol.49 no.8 Texcoco nov./dic. 2015
Fitociencia
Biofertilización de vid en relación con fotosíntesis, rendimiento y calidad de frutos
Biofertilization of a vineyard and its relationship to photosynthesis, yield and fruit quality
Alejandro Zermeño-González1*, Gildardo Mendez-López1, Raúl Rodríguez-García1, Martin Cadena-Zapata1, José O. Cárdenas-Palomo2, Ernesto A. Catalán-Valencia3
1 Universidad Autónoma Agraria Antonio Narro. Calzada Antonio Narro 1923, Buenavista Saltillo, Coahuila. México.
2 Palau Bioquim S.A. de C.V. Salvador González Lobo 280 Altos, Republica Oriente, Saltillo Coahuila, México.
3 Centro Nacional de Investigación Disciplinaria en Relaciones Agua Suelo Planta Atmosfera (CENID RASPA). Instituto Nacional de Investigaciones Forestales Agrícolas y Pecuarias (INIFAP). Canal Sacramento Km 6.5, Gómez Palacio, Durango.
Recibido: enero, 2015.
Aprobado: junio, 2015.
Resumen
La aplicación al suelo y follaje de extractos de algas marinas, como biofertilizantes al suelo y follaje aumenta el rendimiento y la calidad de la cosecha de diversos cultivos, lo cual está relacionado con un aumento en la tasa de fotosíntesis de las plantas. Por tanto, el objetivo de este estudio fue evaluar el efecto de la aplicación de un biofertilizante a base de extractos de algas marinas al suelo y follaje de una plantación de vid (Vitis vinifera) cv. Shiraz, en la tasa de asimilación de bióxido de carbono (CO2), y su relación con el rendimiento y calidad de frutos. Para esto, se usaron dos plantaciones de vid cv. Shiraz de 5.2 ha, en la Vinícola San Lorenzo, Municipio de Parras, Coahuila, México. A una de estas, al inicio del ciclo de producción (15 de marzo del 2013), se aplicaron al suelo 2 L ha-1 del biofertilizante Algaenzims y el 3 de abril del 2013 se aplicaron vía foliar 0.5 L ha-1 del mismo producto. La tasa de asimilación de CO2 de cada plantación durante su ciclo productivo se evaluó instalando un sistema eddy con sus sensores correspondientes. Los tratamientos fueron con y sin aplicación del biofertilizante. La diferencia estática en la tasa de asimilación de CO2 entre tratamientos se evaluó con la prueba no paramétrica de Wilcoxon para poblaciones pareadas (p≤0.05), mientras que para las diferencias en rendimiento y calidad de frutos se usó un diseño completamente al azar y las medias se compararon con la prueba de Tukey (p≤ 0.05). Para evaluar el balance de energía en cada superficie, se midió la radiación neta, flujo de calor latente y sensible, y flujo de calor en el suelo. Con base en la prueba de Wilcoxon (p≤0.05), los resultados del estudio mostraron que la aplicación del biofertilizante aumentó en 7.72 % la tasa de asimilación de CO2, por lo cual el rendimiento de frutos fue 13.9 % mayor y el de grados Brix 3.04 % (Tukey, p≤ 0.05) en la plantación con el biofertilizante.
Palabras clave: Algas marinas, Vitis vinifera, intercambio neto de bióxido de carbono, balance de energía, covarianza eddy.
Abstract
Seaweeds extracts applied to soil and foliage as biofertilizers increase yield and quality of diverse crops. This is related to an increase in the rate of plant photosynthesis. Therefore, the objective of this study was to evaluate the effect of applying a seaweed-extract-based biofertilizer to the soil and foliage of a vineyard of cv. Shiraz grape (Vitis vinifera, L.), on the carbon dioxide (CO2) assimilation rate and its relationship to fruit yield and quality. For this purpose, two 5.2 ha sections of cv. Shiraz grape vineyards were delimited in the wine company San Lorenzo, Municipality of Parras, Coahuila, Mexico. One of the sections was fertilized with the biofertilizer Algaenzims at the beginning of the production cycle (March 15, 2013) at a dosage of 2 L ha-1 applied to the soil, and on April 3, 2013, it was applied to foliage at 0.5 L ha-1. Assimilation rate of CO2 for each section of vineyard was evaluated during its productive cycle by installing an eddy system with its corresponding sensors. The treatments were with and without application of the biofertilizer. Static differences in CO2 assimilation rate between treatments was assessed with the Wilcoxon non-parametric test for paired populations (p≤0.05), whereas for differences in fruit yield and quality a completely randomized design was utilized and treatments means were compared with the Tukey test (p≤0.05). To evaluate the energy balance over each surface, net radiation, latent and sensible heat flux and soil heat flux were measured. Based on the Wilcoxon test (p≤0.05), the results of the study showed that the application of the biofertilizer increased the CO2 assimilation rate by 7.72 %. Because of this, fruit yield was 13.9 % higher and °Brix was 3.04 % higher (Tukey, p≤0.05) in the plantation where the biofertilizer was applied.
Key words: Seaweed, Vitis vinifera, net carbon dioxide exchange, energy balance, eddy covariance.
INTRODUCCIÓN
Los biofertilizantes a base de extractos de algas marinas son materiales bioactivos naturales solubles en agua que promueven la germinación de semillas e incrementan el desarrollo y el rendimiento de cultivos (Norrie y Keathley, 2005). Los extractos de algas marinas se usan como suplementos nutricionales, bioestimulantes o biofertilizantes en la agricultura y horticultura (Hernández-Herrera et al., 2014). El uso de extractos de algas marinas como biofertilizantes permite la sustitución parcial de fertilizantes minerales convencionales (Sathya et al., 2010; Zodape et al., 2010), y también como extractos líquidos, aplicados en forma foliar o granular (polvo), como mejoradores del suelo y abono (Lingakumar et al., 2004; Thirumaran et al., 2009).
Los extractos de algas marinas contienen varias sustancias promotoras del crecimiento de plantas, como auxinas, citoquininas, betainas, giberelinas; y sustancias orgánicas como aminoácidos, macronutrientes y oligoelementos, los cuales mejoran el rendimiento y la calidad de cultivos (Khan et al., 2009; Sathya et al., 2010).
La aplicación de algas marinas al suelo y follaje induce una mayor absorción de nutrientes, aumenta el contenido de clorofila, y el tamaño de las hojas, por lo cual hay un mayor rendimiento y calidad de las cosechas (Kumari et al., 2011). La aplicación de extracto de algas marinas (Ascophyllum nodosum) aumentó el contenido de clorofila en las hojas de vid (Vitis vinífera), lo cual aumentó el rendimiento y la calidad de los frutos (Sabir et al., 2014). Según Selvam y Sivakumar (2014), la aplicación foliar de extractos líquidos de algas marinas rojas Hypnea musciformis (Wulfen) Lamouroux a una concentración de 2 %, aumentó el contenido de clorofila en hojas de las plantas de un cultivo de cacahuate (Arachis hypogaea L.), dando un mayor vigor y rendimiento.
La vid es un cultivo predominante en el hemisferio norte. Su importancia radica en la diversificación de los mercados: consumo en fresco (principalmente en el mercado nacional), y la industria de jugos; pero la industria vitivinícola tiene mayor oportunidad de crecimiento a corto plazo debido a la demanda nacional e internacional del vino de mesa (El Economista, 2013). En México, la producción de vid se concentra en Sonora, Zacatecas, Baja California, Aguascalientes y Coahuila, con 98.2 % de la producción anual (El Economista, 2013).
La aplicación de fertilizantes orgánicos derivados de algas marinas aumenta el vigor y contenido de clorofila de las hojas, y este efecto se debe reflejar en una mayor tasa de asimilación de bióxido de carbono (CO2). Por tanto, el objetivo de este estudio fue evaluar el efecto de la aplicación de un biofertilizante, formulado a base de extractos de algas marinas, a una plantación de vid cv. Shiraz, en la tasa de fotosíntesis del dosel, y su relación con el rendimiento y calidad de frutos.
MATERIALES Y MÉTODOS
Sitio de estudio
El estudio se realizó en la vinícola San Lorenzo, en Parras de la Fuente, Coahuila, México, a 25° 26' N, 102° 10' O y una altitud de 1500 m. El clima de la región es seco semicálido, con temperatura media anual de 20.2 °C, precipitación promedio de 374.2 mm y tasa de evaporación de 2 118 mm (CNA, 2015).
Esta investigación se realizó en dos plantaciones de vid cv. Shiraz de 5.2 ha cada una, (204 m E-O, por 256 m N-S). Las plantaciones tenían siete años de edad y una altura de 2 m en su máximo desarrollo foliar. El espacio es 1.5 m entre plantas y 2.5 m entre hileras, en un sistema de espaldera vertical de conducción en cordón bilateral con poda corta a pulgares, con una densidad de 2 620 plantas ha-1.
Manejo agronómico de la plantación y biofertilizante aplicado
Las plantaciones se riegan por goteo (0.75 m entre emisores), aplicando 2.0 L h-1 (4.0 L planta-1). El tiempo de riego a través del ciclo del cultivo fue 2 h d-1, que, para una cama de mojado de 0.90 m de ancho, correspondió a una lámina de 5.9 mm d-1. Cada superficie recibió el mismo manejo del cultivo (poda, riego, fertilización y control fitosanitario), de acuerdo con las normas establecidas por la vinícola San Lorenzo.
Al suelo de una de las plantaciones, al inicio del ciclo de producción (15 de marzo, 2013), se aplicó 2 L ha-1 del biofertilizante Algaenzims (formulado con extractos de algas marinas), y el 3 de abril del 2013 se aplicó vía foliar 0.5 L ha-1 (0.191 mL planta-1) del mismo producto, con una Aspersora Turmatic (DEFENDER OVER DP 81/3000). AlgaenzimsMR (Palau Bioquim S.A. de C.V.) es un biofertilizante elaborado a base de extractos de algas marinas (Sargassum spp.) y contiene un complejo de microorganismos marinos en estado viable (vivos) que son fijadores de nitrógeno del aire, halófilos, mohos y levaduras, y elementos mayores y menores en diferentes proporciones.
Mediciones realizadas
La tasa de fotosíntesis se determinó mediante el intercambio neto del (CO2) del ecosistema (NEE), el cual se obtuvo de mediciones de flujo de CO2 entre la plantación y la atmósfera. También se midió el flujo de calor latente y sensible en cada plantación. Para esto, en cada sección se instaló un sistema eddy con los sensores correspondientes. Las mediciones de flujo de calor sensible (H), calor latente (LE) y flujo de CO2 (FCO2) entre el dosel de la plantación y la atmosfera se obtuvieron aplicando el método de la covarianza eddy (Ham y Heilman, 2003), con las siguientes ecuaciones:
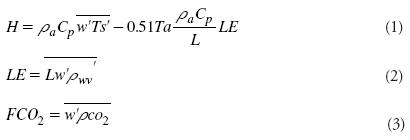
donde ρa, Cp y Ta son la densidad, capacidad calorífica y temperatura del aire, respectivamente; Ts es la temperatura sónica; ρwv es la densidad del vapor de agua en el aire; w es la velocidad vertical del viento; L es el calor de vaporización del agua; y ρco2 es la densidad de CO2. Las variables con símbolo de prima significan desviaciones respecto a la media y la barra horizontal sobre dos variables denota la covarianza entre las variables para un determinado segmento de tiempo (30 min).
La velocidad vertical del viento y la temperatura sónica se midieron con un anemómetro sónico tridimensional (CSI-CSAT3, Campbell, Scientific, Inc., Logan, Utah, USA); para obtener ρwv y ρco2 se usó un analizador infrarrojo de CO2 y vapor de agua de sendero abierto (Open Path CO2/H2O analyzer, LI-7500. LICOR, Lincoln, Nebraska, USA). La temperatura del aire (Ta) se midió a la misma altura que Ts, con un sensor de temperatura y humedad relativa (HP45C, Vaisala, Inc., Woburn, MA, USA). Los sensores se montaron en un poste a 3 m de altura (1.2 m sobre el dosel de la vegetación), instalado en la parte media del extremo oeste de cada plantación.
El anemómetro sónico tridimensional se orientó hacia el este para que el viento tuviera por lo menos 200 m de contacto con la superficie vegetal en la dirección este-oeste y 125 m en la dirección norte-sur, antes del contacto con los sensores. Los vientos provenientes del oeste se descartaron por impactar en la parte posterior de los sensores. La velocidad vertical del viento, temperatura sónica, temperatura del aire, y la densidad de vapor de agua y del bióxido de carbono se midieron a una frecuencia de 10 Hz, y las covarianzas correspondientes se calcularon cada 30 min con un datalogger CR1000 (Campbell, Cientific, Inc., Logan, Utah, USA).
Para evaluar la precisión de las mediciones de los flujos descritos, se determinó el balance de energía sobre la superficie vegetal con la siguiente relación:

donde Rn es la radiación neta, H flujo de calor sensible, LE flujo de calor latente (del cual se deriva la tasa de evapotranspiración), y G es el flujo de calor en la superficie del suelo; las unidades de todas las variables son W m-2.
La Rn se midió con un radiómetro neto (LITE, Keep and Zonen, Inc., Delft, Holanda) colocado a 1 m sobre el dosel de cada plantación; G se midió con dos transductores de calor (modelo HFT3, Campbell Scientific, Inc., Logan, Utah, USA), colocados 0.08 m bajo la superficie del suelo: uno al punto medio entre dos plantas de una hilera y el otro al centro de un pasillo. El flujo de calor en la superficie del suelo se obtuvo sumando al flujo medido a 0.08 m los cambios de temperatura sobre el transductor de calor (Kustas et al., 2000).
H y LE se corrigieron por efecto de diferencia de densidad entre las masas de aire ascendentes y descendentes (Webb et al., 1980). El flujo de CO2 se corrigió con el mismo factor (Ham y Heilman, 2003). La lámina de agua evapotranspirada en un determinado intervalo se obtuvo dividiendo el valor de LE integrado en dicho tiempo por el calor de vaporización del agua (2.44 MJ kg-1).
El intercambio neto de CO2 (NEE) entre el dosel de la plantación y la atmosfera (μmol CO2 m-2s-1) se obtuvo con la relación (Marterns et al., 2004):
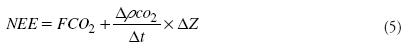
donde FCO2 es el flujo de CO2 medido con el método de la covarianza eddy (negativo hacia la superficie vegetal), ΔρCO2 es el cambio en la densidad de CO2 medido a la altura Δz, Δt es el tiempo (30 min), Δz es la altura sobre la superficie del suelo a la que se realizan las mediciones de flujo (3 m).
Los valores del NEE totales diurnos (08:00 a 19:00 h) se obtuvieron integrando los valores instantáneos (promedios de 30 min) a través del ciclo de crecimiento del cultivo.
El rendimiento de frutos por planta de cada plantación (con y sin aplicación del biofertilizante) se obtuvo cosechando y promediando los frutos de nueve plantas. Los grados Brix se determinaron (con un refractómetro Atago 053 PAL-1) del jugo de 40 frutos de las nueve plantas de cada sección. El índice de cosecha usado fue grados Brix, acidez total y pH.
Evaluación estadística
Las diferencias estadísticas del NEE entre las plantaciones con y sin aplicación del biofertilizante durante el ciclo de crecimiento de las plantas, se evaluaron con la prueba no paramétrica de Wilcoxon para poblaciones pareadas (p≤ 0.05).
Para evaluar el efecto de la aplicación del biofertilizante en el rendimiento de fruto se usó un diseño estadístico completamente al azar con dos tratamientos (con y sin aplicación del biofertilizante) y nueve repeticiones, donde cada planta representó una unidad experimental. La diferencia estadística en los grados Brix también se determinó con un diseño completamente al azar con dos tratamientos (con y sin aplicación del biofertilizante) y 12 repeticiones, y la unidad experimental fue el jugo de 40 frutos de los racimos de las nueve plantas de cada tratamiento. Las medias se compararon con la prueba de Tukey (p≤ 0.05).
RESULTADOS Y DISCUSIÓN
Variación diurna de los flujos de energía
La variación diurna de los flujos de energía: radiación neta (Rn), flujo de calor latente (LE) y sensible (H) y el flujo de calor en el suelo (G) fueron similares en la sección sin (testigo) y con (tratamiento) aplicación del biofertilizante (Figura 1). En promedio y en ambas secciones, Rn se disipó principalmente en LE (60 %), seguido por G (23 %) y H (11 %). Estos resultados son similares a los reportados para varios cultivos agrícolas bajo condiciones de riego y diferentes ecosistemas naturales en condiciones de humedad (Hao et al., 2008; Hammerle et al., 2008). Desde las 18:00 h y en ambas plantaciones de los días evaluados, el flujo de calor latente fue mayor que la radiación neta (Figura 1), lo cual indica la presencia de un flujo advectivo. Esto es similar a lo reportado por Li y Yu (2007) y Zermeño-González et al. (2010) para varios tipos de superficies agrícolas bajo riego en las zonas áridas.
Balance de energía de los flujos superficiales
La suma del flujo de calor sensible y latente (H+LE) fue 6.05 % menor que la energía disponible (Rn-G) en la sección con tratamiento y 9.44 % menor en la testigo (Figura 2). Este pequeño desbalance de energía está dentro del intervalo de aceptación para las mediciones de los flujos superficiales (H y LE) al usar el método de la covarianza eddy (Foken, 2008; Zermeño-González et al., 2012).
La energía disponible (Rn-G) fue mayor en la sección testigo (Figura 2), probablemente por un valor mayor de la Rn ocasionado por un menor índice de reflectividad a la radiación solar incidente del dosel de la plantación, debido a un mayor contenido de clorofila de las hojas por la aplicación del biofertilizante. Gitelson et. al. (2003) y Zhang et al. (2005) indican que una mayor concentración de clorofila en las hojas de las plantas aumenta la absorción (reduce la reflectancia) a ciertas longitudes de onda del espectro visible.
Tasa de intercambio neto de bióxido de carbono
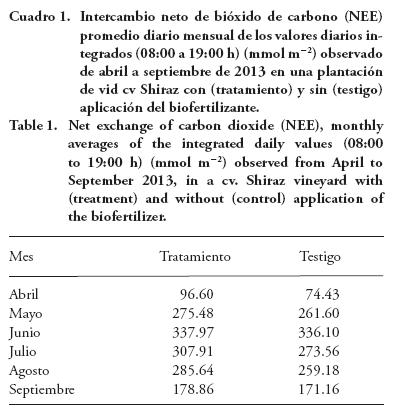
El intercambio neto del CO2 del ecosistema (NEE) a través del día (promedios de 30 min) fue mayor en la plantación con aplicación del biofertilizante (Wilcoxon; p≤0.05) (Figura 3). Esto probablemente se debió a un mayor contenido de clorofila de las hojas de las plantas (Jothinayagi y Anbazhagan, 2009; Erulan et al., 2009). La máxima tasa de NEE fue entre las 12:00 y las 14:00 h del día y se presentó el mismo patrón de cambio de NEE en las dos plantaciones. El máximo valor de NEE fue -12.7 μmol m-2s-1 en la plantación con aplicación, ocurrió el 28 de mayo del 2013 (Figura 3). Los máximos valores de intercambio neto de CO2 observados en este estudio fueron pequeños, comparados con cultivos de cobertura mayor, ya que las líneas de plantas solo cubrieron 47 % de la superficie total (2.5 m entre líneas y 0.80 m ancho del dosel). Los valores de NEE van desde -30 μmol m-2 s-1 en una huerta de nogal pecanero (Carya illinoinensis) (Wang et al., 2007), hasta 39 μmol m-2 s-1 en un cultivo de alfalfa (Medicago sativa) (Asseng y Hsiao, 2000) y -28 μmol m-2s-1 para una plantación de caña de azúcar (Saccharum officinarum L.) (Zermeño-González, et al., 2012). La aplicación del biofertilizante al suelo y follaje también aumentó el NEE integrado diario (08:00 a 19:00 h) del dosel de la plantación durante el ciclo de producción (Cuadro 1) (Wilcoxon; p≤ 0.05). Esto se debió a que el biofertilizante aumenta el contenido de clorofila de las hojas (Thirumaran et al, 2009; Latique et al., 2013) y ese mayor contenido está relacionado con una mayor tasa de fotosíntesis (Spinelli et al., 2009; Peng et al., 2011). La tasa de asimilación de CO2 promedio diaria durante el ciclo de producción (abril-septiembre) fue 247.08 mmol m-2 en la plantación con aplicación del biofertilizante, mientras que sin aplicación fue 229.34 mmol m-2, lo cual es un aumento de 7.73 %. La tasa de asimilación en ambas plantaciones mostró una tendencia creciente de abril a junio (debido al desarrollo foliar de las plantas) y decreciente de junio a septiembre; también, para cada mes la tasa de NEE fue mayor en la plantación donde se aplicó el biofertilizante (Cuadro 1). El contenido de clorofila de diferentes cultivos aumenta por efecto de la aplicación de extractos de algas marinas Spinelli et al. (2010) muestran un aumento de 11 % en el contenido de clorofila de las hojas de un cultivo de fresa (Fragaria x annanasa) por efecto de la aplicación de extractos de alga marinas, que resultó en un aumento de 27 % de la producción de frutos. De manera similar, Khan et al. (2012) reportan un aumento del contenido de clorofila de las hojas de un cultivo de vid (cv Perlette) por la aplicación foliar de extractos de algas marinas (Ascophyllum nodosum).
Rendimiento y calidad del fruto
La aplicación del biofertilizante al suelo y el follaje aumentó 13.9 % el rendimiento de frutos (Tukey; p≤ 0.05) (Cuadro 2). Esto probablemente se debió a una mayor tasa de asimilación de CO2 (Cuadro 1) en la plantación donde se aplicó el biofertilizante. Hay estudios acerca del efecto de la aplicación de extractos de algas marinas en el crecimiento y rendimiento de diferentes cultivos. Así, Kumar y Sahoo (2011) reportan un aumento de 11 % en rendimiento de grano de trigo (Triticum aestivum) cv. Pusa Gold con aplicación líquida a las semillas de extractos de algas marinas (Sargassum wightii). Mientras que Pramanick et al. (2014) reportaron un incremento de grano de arroz (Oryza sativa) de hasta 41.5 % con aplicación foliar de extractos de algas marinas (Kappaphycus alvareziiy Gracilaria sp.).

La aplicación del biofertilizante al suelo y el follaje aumentó 3.04 % los grados Brix del jugo de los frutos (Tukey; p≤ 0.05) (Cuadro 2). Este resultado es similar al reportado por Colapietra y Alexander (2005) de aumento hasta 17 °Brix en un cultivo de uva de mesa cv. Italia con aplicación foliar de extractos de algas marinas (Ascophyllum nodosum). Además, el incremento en azúcares totales para una plantación de vid (cv. Perlette) fue 28 %, por la aplicación foliar de extractos de algas marina (Ascophylum nodosum) (Khan et al., 2012).
CONCLUSIONES
El análisis de los resultados del estudio muestra que la aplicación del biofertilizante con base a extractos de algas marinas, al suelo y follaje de una plantación de vid cv. Shiraz aumentó la tasa de asimilación de bióxido de carbono, lo cual causó un mayor rendimiento y una mayor concentración de grados Brix en los frutos.
LITERATURA CITADA
Asseng, S., and T. C. Hsiao. 2000. Canopy CO2 assimilation, energy balance, and water use efficiency of an alfalfa crop before and after cutting. Field Crop Res. 67(3): 191-206. [ Links ]
Colapietra, M., and A. Alexander. 2005. Effect of foliar fertilization on yield and quality of table grapes. Acta Hortic. V International symposium on mineral nutrition of fruit plants 721(1): 213-218. [ Links ]
CNA. 2015. Comisión Nacional de Agua (www.smn.conagua.gob.mx) (Consulta: Enero 2015). [ Links ]
El Economista 2013. www.com.mx/columnas/agro-negocios-produccion-vid-alternativa-rentable-productor. (Consulta: Octubre de 2013). [ Links ]
Erulan, V., G. Thirumaran, P. Soundarapandian, and G. Ananthan. 2009. Studies on the effect of Sargassum polycystum (C. agardh, 1824) extract on the growth and biochemical composition of Cajanus Cajan (L.) Mill sp. American-Eurasian J. Agric. Environ. Sci. 6(4): 392-399. [ Links ]
Foken, T. 2008. The energy balance closure problem: an overview. Ecol. Appl. 18(6): 1351-1367. [ Links ]
Gitelson, A.A., Y. Gritz, and M.N Merzlyak. 2003. Relationships between leaf chlorophyll content and spectral reflectance and algorithms for non-destructive chlorophyll assessment in higher plant leaves. J. Plant Physiol. 160(3): 271-282. [ Links ]
Ham, J. M., and J. L. Heilman. 2003. Experimental test of density and energy-balance corrections on carbon dioxide flux as measured using open-path eddy covariance. Agron. J. 95(6): 1393-1403. [ Links ]
Hammerle, A., A. Haslwanter, U. Tappeiner, A. Cernusca, and G. Wohlfahrt. 2008. Leaf area controls on energy partitioning of a temperate mountain grassland. Biogeosciences 5(2): 421-431. [ Links ]
Hao, Y., Y. Wang, X. Mei, X. Huang, X. Cui, X. Zhou, and H. Niu. 2008. CO2, H2O and energy exchange of an Inner Mongolia steppe ecosystem during a dry and wet year. Acta Oecol. 33(2): 133-143. [ Links ]
Hernández-Herrera, R. M., F. Santacruz-Ruvalcaba, M. A. Ruiz-López, J. Norrie, and G. Hernández-Carmona. 2014. Effect of liquid seaweed extracts on growth of tomato seedlings (Solanum lycopersicum L.). J. Appl. Phycol. 26(1): 619-628. [ Links ]
Jothinayagi, N., and C. Anbazhagan. 2009. Effect of seaweed liquid fertilizer of Sargassum wightii on the growth and biochemical characteristics of Abelmoschus esculentus (L.) Medikus. Recent Res. Sci. Tech.. 1(4): 155-158. [ Links ]
Khan, W., U. P. Rayirath, S. Subramanian, M. N. Jithesh, P. Rayorath, D. M. Hodges, A. T. Critchley, J. S. Craigie, J. Norrie, and B. Prithiviraj. 2009. Seaweed extracts as biostimulants of plant growth and development. J. Plant Growth Regul. 28(4): 386-399. [ Links ]
Khan, A. S., B. Ahmad, M. J. Jaskani, R. Ahmad, and A. U. Malik. 2012. Foliar application of mixture of amino acids and seaweed (Ascophylum nodosum) extract improve growth and physicochemical properties of grapes. Int. J. Agric. Biol. 14(3): 383-388. [ Links ]
Kumar, G., and D. Sahoo. 2011. Effect of seaweed liquid extract on growth and yield of Triticum aestivum var. Pusa Gold. J. Appl. Phycol. 23:251-255. [ Links ]
Kumari, R., I. Kaur, and A. K. Bhatnagar. 2011. Effect of aqueous extract of Sargassum johnstonii Setchell & Gardner on growth, yield and quality of Lycopersicon esculentum Mill. J. Appl. Phycol. 23(3): 623-633. [ Links ]
Kustas, W. P., J. H. Prueger, and J. L. Hatfield. 2000. Variability in soil heat flux from a mesquite dune site. Agric. For. Meteorol. 103: 249-264. [ Links ]
Latique, S., H. Chernane, M. Mansori, and M. El Kaoua. 2013. Seaweed liquid fertilizer effect on physiological and biochemical parameters of bean plant (Phaesolus vulgaris variety Paulista) under hydroponic system. Eur. Sci. J. 9:1857-7881. [ Links ]
Li, L., and Q. Yu. 2007. Quantifying the effects of advection on canopy energy budgets and water use efficiency in an irrigated wheat field in the North China Plain. Agr. Water Manage. 89(1): 116-122. [ Links ]
Lingakumar, K., R. Jeyaprakash, C. Manimuthu, and A. Haribaskar. 2004. Influence of Sargassum sp. crude extract on vegetative growth and biochemical characteristics in Zea mays and Phaseolus mungo. Seaweed Res. Utilisation 26(1): 155-160. [ Links ]
Martens, C. S., T. J. Shay, H. P. Mendlovitz, D. M. Matross, S. R. Saleska, S. C. Wofsy, W. S. Woodward, M. C. Menton, J. M. S. De Moura, P. M. Crill, O. L. L. De Moraes, and R. L. Lima. 2004. Radon fluxes in tropical forest ecosystems of Brazilian Amazonia: night-time CO2 net ecosystem exchange derived from radon and eddy covariance methods. Global Change Biol. 10(5): 618-629. [ Links ]
Norrie, J., and J. P. Keathley. 2005. Benefits of Ascophyllum nodosum marine-plant extract applications to 'Thompson seedless' grape production. (Proceedings of the Xth International Symposium on Plant Bioregulators in Fruit Production). Acta Hortic. 727(1):243-248. [ Links ]
Peng, Y., A. A. Gitelson, G. Keydan, D. C. Rundquist, and W. Moses. 2011. Remote estimation of gross primary production in maize and support for a new paradigm based on total crop chlorophyll content. Remote. Sens. Environ. 15(4): 978-989. [ Links ]
Pramanick, B., K. Brahmachari, A. Ghosh, and S. T. Zodape. 2014. Effect of seaweed saps on growth and yield improvement of transplanted rice in old alluvial soil of West Bengal. Bangladesh J. Bot. 43(1): 53-58. [ Links ]
Sabir, A., K. Yazar, F. Sabir, Z. Kara, M. A. Yazici, and N. Goksu. 2014. Vine growth, yield, berry quality attributes and leaf nutrient content of grapevines as influenced by seaweed extract (Ascophyllum nodosum) and nanosize fertilizer pulverizations. Sci. Hort. 175(15): 1-8. [ Links ]
Sathya, B., H. Indu, R. Seenivasan, and S. Geetha. 2010. Influence of seaweed liquid fertilizer on the growth and biochemical composition of legum crop, Cajanus cajan I.) mill sp. J. Phytol. 2(5): 50-63. [ Links ]
Selvam, G. G., and K. Sivakumar. 2014. Influence of seaweed extract as an organic fertilizer on the growth and yield of Arachis hypogea L. and their elemental composition using SEM-Energy Dispersive Spectroscopic analysis. Asian Pacific J. Reprod. 3(1): 18-22. [ Links ]
Spinelli, F., G. Fiori, M. Noferini, M. Sprocatti, and G. Costa. 2009.Perspectives on the use of a seaweed extract to moderate the negative effects of alternate bearing in apple trees. J. Hort. Sci. Biot. 84(1): 131-137. [ Links ]
Spinelli, F., G. Fiori, M. Noferini, M. Sprocatti, and G. Costa. 2010.A novel type of seaweed extract as a natural alternative to the use of iron chelates in strawberry production. Sci. Hort. 125(3): 263-269. [ Links ]
Thirumaran, G., M. Arumugam, R. Arumugam, and P. Anantharaman. 2009. Effect of seaweed liquid fertilizer on growth and pigment concentration of Abelmoschus esculentus (I) Medikus. American-Eurasian J. Agron. 2(2): 57-66. [ Links ]
Wang, J. M., D. R. Miller, T. W. Sammis, V. P. Gutschick, L. J. Simmons, and A. A. Andales. 2007. Energy balance measurements and a simple model for estimating pecan water use efficiency. Agric. Water Manage. 91: 92-101. [ Links ]
Webb, E. K., G. I. Pearman, and R. Leuning. 1980. Correction of flux measurements for density effects due to heat and water vapor transfer. Quart. J. Roy. Meteorol. Soc. 106(447): 85-100. [ Links ]
Zermeño-González, A., J. A. Flores-Guerrero, J. P. Munguía-López, J. A. Gil-Marín, R. Rodríguez-García, E. A. Catalán-Valencia, L. Ibarra-Jiménez, y H. Zermeño-González. 2010. Evapotranspiración y su relación con la evapotranspiración a equilibrio de una huerta de nogal pecanero (Carya illinoensis) del norte de México. Agrociencia 44(8): 885-893. [ Links ]
Zermeño-González, A., S. Villatoro-Moreno, J. J. Cortés-Bracho, M. Cadena-Zapata, E. A. Catalán-Valencia, M. A. García-Delgado, y J. P. Munguía-López. 2012. Estimación del intercambio neto de CO2 en un cultivo de caña de azúcar durante el ciclo de plantilla. Agrociencia 46(6): 579-591. [ Links ]
Zhang, Q., X. Xiao, B. Braswell, E. Linder, F. Baret and B. Moore. 2005. Estimating light absorption by chlorophyll, leaf and canopy in a deciduous broadleaf forest using MODIS data and a radiative transfer model. Remote Sens. Environ. 99(3): 357-371. [ Links ]
Zodape, S.T., S. Mukhopadhyay, K. Eswaran, M. P. Reddy, and J. Chikara. 2010. Enhanced yield and nutritional quality in green gram (Phaseolus radiata L.) treated with seaweed (Kappaphycus alvarezii) extract. J. Sci. Ind. Res. 69(6): 468-471. [ Links ]














