Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Agrociencia
versión On-line ISSN 2521-9766versión impresa ISSN 1405-3195
Agrociencia vol.43 no.4 Texcoco may./jun. 2009
Fitociencia
La citocinina BAP promueve la acumulación de hexosas e incrementa la actividad de fosfoenolpiruvato carboxilasa y fosfoenlopiruvato carboxicinasa durante el retraso de la senescencia foliar de trigo
Cytokinin BAP promotes the accumulation of hexoses and increases the activity of phosphoenolpyruvate carboxylase and phosphoenolpyruvate carboxykinase during the delay of leaf senescence in wheat
Rosalinda González–Santos1, Adriana Delgado–Alvarado2*, H. Araceli Zavaleta–Mancera1, B. Edgar Herrera–Cabrera2
1 Botánica. Campus Montecillo. Colegio de Postgraduados. 56230. Montecillo, Estado de México.
2 Campus Puebla. Colegio de Postgraduados.72760. Carretera Federal México–Puebla, Santiago Momoxpan, Km 125.5. San Pedro Cholula, Puebla, México *Autor responsable: (adah@colpos.mx)
Recibido: Abril, 2008.
Aprobado: Febrero, 2009.
Resumen
Las citocininas disminuyen su concentración durante la senescencia foliar pero la aspersión de la citocinina bencilaminopurina (BAP) retrasa este proceso, lo cual puede tener aplicaciones en el control de la senescencia de pastos forrajeros, ornamentales de follaje y hortalizas verdes. El objetivo del presente trabajo fue investigar el efecto de la aplicación de BAP en el metabolismo primario durante la senescencia foliar de Triticum aestivum L. cv. Temporalera mediante el estudio del contenido de pigmentos fotosintéticos, proteínas solubles, Rubisco, carbohidratos, actividad enzimática de fosfoenolpiruvato carboxilasa (PEPC) y fosfoenolpiruvato carboxicinasa (PEPCK), componentes importantes del metabolismo primario vegetal. Plántulas de 21 d después de la siembra (DDS) fueron asperjadas con BAP 0.1 mM o agua (testigo). A los 41 DDS las hojas tratadas con BAP retrasaron su senescencia, conservaron 60 % de su clorofila y 44 % de sus proteínas solubles totales en particular de la Rubisco. En contraste las hojas testigo perdieron 92 % de su clorofila y más del 90 % de proteínas, en el mismo periodo. La BAP promovió la acumulación de hexosas. El análisis de los resultados indica que la BAP puede aumentar la actividad de las enzimas PEPC y PEPCK durante la senescencia y se discute la función de estas enzimas para regular el pH y la translocación de compuestos nitrogenados durante el retraso de la senescencia foliar.
Palabras clave: Triticum aestivum L., Citocininas, hexosas, fosfoenolpiruvato carboxicinasa PEPCK, fosfoenolpiruvato carboxilasa PEPC.
Abstract
Cytokinins reduce their concentration during leaf senescence; but spraying of the cytokinin bencylaminopurine (BAP) delays this process; this may have applications in the control of the senescence pasture, ornamental foliage and green vegetables. The objective of the present study was to investigate the effect of BAP application on primary metabolism during the leaf senescence of Triticum aestivum L. cv. Temporalera studying the photosynthetic pigments content, soluble proteins, Rubisco, carbohydrates, enzyme activity of phosphoenolpyruvate carboxylase (PEPC) and phosphoenolpyruvate carboxykinase (PEPCK), major components of plant primary metabolism. Seedlings 21 d after sowing (DAS) were sprayed with 0.1 mM BAP or water (control). After 41 DAS the leaves treated with BAP delayed their senescence; they retained 60 % of chlorophyll and 44 % of their initial total soluble proteins, especially Rubisco. In contrast, control leaves, senesced, loosing 92 % of chlorophyll and more than 90% of proteins in the same period. The BAP promoted the accumulation of hexoses. Results indicated that BAP can increase the activity of PEPC and PEPCK enzymes during senescence. It is discussed the function of these enzymes in the regulation of pH and the translocation of nitrogen compounds during the delay of leaf senescence.
Keywords: Triticum aestivum L., cytokinins, hexoses, phosphoenolpyruvate carboxykinase PEPCK, phosphoenolpyruvate carboxylase PEPC.
INTRODUCCIÓN
Durante la senescencia foliar, la asimilación de carbono se reemplaza por el catabolismo de clorofila y macromoléculas como proteínas, lípidos de membranas y ARN; el material acumulado se trasforma en nutrientes exportables para los órganos en desarrollo (Lim et al., 2007). Parte de la energía requerida para la removilización de los asimilados, se obtiene por el aumento de la respiración (Hopkins et al., 2007). Se propone que los azúcares y algunos reguladores de crecimiento inducen la senescencia (Jordi et al., 2000; Pourtau et al., 2006). Durante la senescencia los azúcares tienen las siguientes funciones: intervienen en el control de la fotosíntesis (Wingler et al., 1998), son elementos importantes en las relaciones fuente–demanda (Roitsch y Ehneâ, 2000) e inducen y regulan enzimas involucradas en la movilización de nitrógeno (Masclaux et al., 2000). Algunas de las enzimas del metabolismo de aminoácidos como la glutamina sintetasa citosólica y el glutamato deshidrogenasa, intervienen en la senescencia (Buchanan–Wollaston et al., 2005). Esas dos enzimas participan en la conversión de aminoácidos en compuestos que puedan ser exportados de la hoja, como la glutamina, principal aminoácido transportable durante la senescencia natural (Feller y Fischer 1994). Otras enzimas como la fosfoenolpiruvato carboxilasa (PEPC) y la fosfoenolpiruvato carboxicinasa (PEPCK) se han estudiado poco durante la senescencia y mucho menos en plantas C3. La importancia de estas enzimas durante la senescencia es su intervención en el metabolismo de lípidos, de nitrógeno y en la regulación del pH (Buchanan–Wollaston et al., 2005; Chen et al., 2000; Gregersen y Holm, 2007). Se menciona que las enzimas PEPC y PEPCK mantienen el floema activo para facilitar la exportación de los compuestos nitrogenados generados durante la senescencia (Chen et al., 2000). Además estas enzimas se encuentran en diferentes tejidos vegetales, especialmente en aquellos con un activo metabolismo de nitrógeno (Walker et al., 2001; Delgado–Alvarado et al., 2007).
Durante la senescencia disminuye la concentración de las citocininas, pero su aspersión o la sobre–expresión del gen ipt, que codifica la enzima isopenteniltransferasa (IPT) de Agrobacterium tumefaciens, bajo control del promotor específico de la senescencia SAG 12 (PSAG12–IPT), retrasan los cambios catabólicos de la senescencia foliar (McCabe et al., 2001; Lim et al., 2007). A pesar del notable efecto que tienen las citocininas para retardar la senescencia en plantas, el mecanismo de acción aun no es bien entendido. Se propone que durante la senescencia, las citocininas son percibidas por receptores asociados a histidinas cinasas y que la señal generada se traduce por medio de una cascada de fosforilaciones que finalmente estimulan genes blanco responsables del programa del retardo de la senescencia foliar, donde intervienen principalmente tres módulos: los receptores histidinacinasas (HK), las proteínas fosfotransferasas (HP) y los reguladores de respuesta (RR) (Lim et al., 2007). Al respecto, en Arabidopsis spp. uno de los tres receptores de las citocininas, la histidina cinasa 3 (AHK3), tiene una función primordial al controlar la longevidad de la hoja mediada por la fosforilación específica del regulador de respuesta ARR2 (Kim et al., 2006).
El uso de las citocininas para retrasar la senescencia foliar tiene uso potencial para aumentar la productividad de cultivos, para prolongar el almacenamiento postcosecha y aumentar la tolerancia al estrés (Lim et al., 2007). En cereales puede ser usado en la manipulación de la movilización de nutrientes para mejorar el rendimiento (Gregersen y Holm, 2007). Por tanto en el presente trabajo se estudia el efecto de la aplicación de la citocinina BAP en el metabolismo primario de trigo, durante el retraso de la senescencia foliar, con énfasis en la acumulación de azucares y la actividad de PEPC y de PEPCK.
MATERIALES Y MÉTODOS
Material biológico
Un promedio de 50 semillas de trigo (Triticum aestivum L. cv. Temporalera) se sembraron en charolas de plástico (33X28X 13cm), con una mezcla de peat–moss y agrolita estéril (3/1; v/v). Las charolas se distribuyeron en un diseño completamente aleatorio, con cuatro repeticiones para cada experimento. Los experimentos se realizaron en cámaras de crecimiento de ambiente controlado del Colegio de Postgraduados, Campus Montecillo, con las siguientes condiciones: temperatura 23/19 °C (día/noche), fotoperíodo de 13.5 h e intensidad luminosa de 210 µmol nTm–2 s–1. La fertilización fue con una solución completa de Steiner (1984) con KNO3 como fuente de nitrógeno.
Retraso de la senescencia
Plántulas de 20–21 d después de la siembra (DDS) que mostraron la segunda hoja madura (lámina completamente expandida y con lígula expuesta), se asperjaron (350 mL) con una solución de 0.1 mM de 6–bencilaminopurina (BAP; Sigma) con 0.02 % de dimetilsulfóxido (DMSO; Sigma) y 0.02 % de Tween 20 (Boehringer Mannheim GmbH) (Martínez–Gutiérrez et al., 2008). Las plántulas testigo se asperjaron con una solución preparada como la solución de BAP, pero sin el regulador de crecimiento. Las aspersiones se realizaron a las 11:00 h cada tercer día por 21 d. Se tomaron 3 cm de la parte media de la segunda hoja foliar, entre las 11:00 y 12:00 am. a los 21, 26, 31, 36 y 46 DDS y se determinaron las variables descritas a continuación.
Cuantificación de pigmentos fotosintéticos
Para determinar clorofila a (Chl a), clorofila b (Chl b), carotenoides y xantofilas (c+x), muestras de 150 mg de la parte media de la hoja se maceraron en 3 mL de acetona 80 % a 4 °C; el extracto se centrifugó 10 min a 840 g. El sobrenadante fue recuperado y ajustado a 4 mL con acetona 80 %. La concentración de cada pigmento se cuantificó con la fórmula de Lichtenthaler y Wellburn (1983) y se expresó en mg g–1 peso fresco (PF).
Proteínas solubles y contenido de la subunidad grande de Rubisco (EC 4. 1. 1. 39)
Muestras de 250 mg de la parte media de la hoja se maceraron con 1 mL de amortiguador de fosfato de sodio 50 mM pH 7.5 que incluyó 1 mM de DTT, 0.1 mM de EDTA y 12.5 % de glicerol. El extracto se centrifugó 10 min a 15000 g a 4 °C y el sobrenadante se usó para determinar proteínas solubles totales y para medir el contenido de la subunidad grande de Rubisco (LSU). El contenido de proteína total se determinó en 5 mL de los extractos por el método de Bradford (1976), usando albúmina de suero bovino como estándar. El extracto de proteína se separó mediante un gel de poliacrilamida con dodecil sulfato de sodio (SDS–PAGE), de acuerdo con Makino et al. (1986). También se corrió un extracto puro de Rubisco de espinaca (R8000, Sigma) y un marcador de peso molecular conocido de rango bajo (Bio–Rad). Las bandas de proteína de 55 kDa identificadas como LSU se evaluaron en unidades de densidad óptica (ODU mm–2), con el programa de análisis Quantity One 42 (Bio Rad), para comparar las intensidades relativas de las bandas entre tratamientos.
Cuantificación de azúcares solubles y almidón
Los azúcares se extrajeron con 4–6 incubaciones sucesivas de 10–min en etanol (80%, v/v, 70 °C) y se determinaron enzimáticamente como describe Scholes et al. (1994). Los extractos se evaporaron a 50 °C y se disolvieron en agua destilada. Glucosa, fructosa y sacarosa se evaluaron después de la adición secuencial de hexocinasa, fosfoglucosa–isomerasa e invertasa. El tejido remanente se homogenizó en 1mL de agua destilada, permaneció 30 min en autoclave y el contenido de almidón se determinó en esta mezcla incubando una alícuota de 100 µL con una solución de enzimas hidrolíticas (100 µL de MES–KOH 500 mM, pH 4.5, 50 µL de amiloglucosidasa 4 mg mL–1, y 50 µL de α–amilasa 90 mg mL–1) por 4.5 h a 37 °C y finalmente se determinó como glucosa (Scholes et al., 1994).
Actividad de fosfoenolpiruvato carboxicinasa (PEPCK–ATP: EC 4. 1. 1. 49)
Muestras de 200 mg de hojas frescas se homogeneizaron en 0.5 mL de bicina–KOH 200 mM (pH 9.0) que contenía 50 mM de DTT a 4 °C. La actividad se midió de acuerdo a Delgado–Alvarado et al. (2007). La mezcla de reacción incluyó: 100 mM de Hepes–KOH (pH 6.8), 100 mM de KCl (Merck), 0.1 mM de NADH (Sigma), 6 mM de MnCl2 (Merck), 6 mM de PEP (Sigma), 1 mM de ADP (Sigma), 90 mM de KHCO3 (Sigma), 6 U mL–1 de MDH (Sigma) y 30 µL de extracto enzimático. Una unidad de actividad de PEPCK corresponde a la producción de 1 µmol min–1 de oxalacetato a 25 °C.
Actividad de fosfoenolpiruvato carboxilasa (PEPC: EC 4. 1. 1. 31)
El análisis de la actividad de PEPC se realizó con el método propuesto por Aguilar–Becerril y Peña–Valdivia (2006). La composición del medio de reacción y el orden en que se agregaron fue: 975 µL de la solución amortiguadora (Tris–HCl 100 mM, pH 8.0), 20 mM de MgCl2 (Merck), 5 mM de NaHCO3 (Baker), 5 U mL1 de MDH (Sigma), 0.5 mM de NADH (Sigma), 3 mM de PEP (Sigma) y 30 µL de extracto crudo. Una unidad de actividad enzimática se definió como la cantidad de enzima capaz de transformar 1 µmol min–1 de fosfoenolpiruvato.
Liberación de electrolitos
La integridad relativa de la membrana plasmática se determinó indirectamente mediante la liberación de electrolitos con una adaptación de los métodos descritos por Prášil y Zámeènyìk (1998) y Sánchez–Urdaneta et al. (2004). Se midió la conductividad eléctrica (µS cm–1) con un conductímetro (Horiba b–173, Kyoto, Japón). Los resultados se expresaron en valores relativos (%).
Análisis estadístico
Se realizó un análisis de varianza con los datos y las medias se compararon con la prueba de Tukey (p<0.05) usando el paquete estadístico STATGRAPHICS Plus 4.
RESULTADOS Y DISCUSIÓN
La degradación de proteínas fue significativa a los 26 DDS, por el contrario, el tratamiento con BAP retrasó la degradación de proteínas solubles (Figura 1 A y B). Resultados similares fueron obtenidos con plantas de tabaco (Nicotiana tabacum L.) transformadas con el gen ipt que codifica la enzima isopenteniltransferasa (IPT), bajo control del promotor de un gen específico de la senescencia, SAG 12 (Jordi et al., 2000). Además, BAP indujo la acumulación de glucosa y fructosa a los 31 y 36 DDS (Figura 3 A y B). La acumulación de estos carbohidratos podría explicarse por la influencia de citocininas en el mantenimiento de la fijación de CO2 durante la senescencia de hojas de trigo (Wingler et al., 1998; Martínez– Gutiérrez et al., 2008).
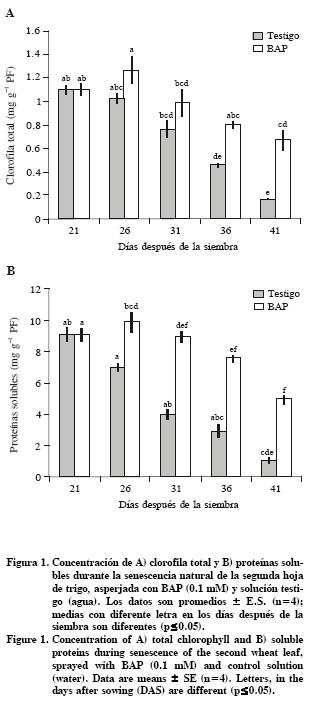
Pigmentos fotosintéticos
Una de las evidencias más notables del efecto benéfico de la aspersión de citocininas es el retraso del amarillamiento de la lámina en trigo. El tratamiento con BAP permitió conservar del 60 % de la clorofila total respecto al valor en las hojas presenescentes (21 DDS), mientras que el testigo conservó sólo 8 % (Figura 1A). Particularmente, en el testigo la cantidad de Chl a fue más afectada que la de Chl b, debido a que la razón Chl a: Chl b disminuyó de 3.7 a 1.3, en contraste, las hojas tratadas con BAP mantuvieron valores entre 3.0 y 3.7, es decir durante el retraso de la degradación de pigmentos, BAP mantuvo la proporción de chl a y chl b en forma similar que la hoja verde (Cuadro 1).
En el presente estudio se encontró que BAP indujo la síntesis de carotenoides+xantofilas (c+x) hasta los 26 DDS; luego los valores fueron constantes, pero significativamente más altos que en el testigo (Cuadro 1). Una tendencia similar fue reportada por Zavaleta–Mancera et al. (2007) en fragmentos de hojas de trigo incubados 6 d en BAP en oscuridad. Por el contrario, en invernadero con iluminación natural, los pigmentos accesorios (x+c) aumentaron durante la senescencia natural de trigo Martínez–Gutiérrez et al. (2008). En esta misma especie, con altas intensidades de luz los pigmentos accesorios aumentan su contenido Lu et al. (2001). Es probable que las citocininas incrementen la síntesis de pigmentos accesorios para proteger a los centros de reacción de la luz y el oxígeno (Wingler et al., 2004; Vlèková et al., 2006).
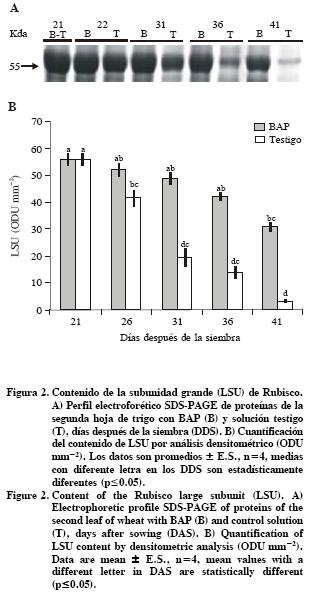
Contenido de niveles de la subunidad grande de Rubisco (LSU)
Las citocininas inducen la expresión de genes fotosintéticos, promueven la síntesis de proteínas y mantienen altos niveles de Rubisco durante la senescencia foliar (Ookawa et al., 2004). En plantas transgénicas PSAG12–IPT de tabaco (Nicotiana tabacum L.), se demostró que los niveles de proteínas solubles (30 %) se conservan mejor que los de Rubisco (15 %) en las hojas senescentes (Jordi et al., 2000). En contraste, en el presente estudio las hojas de trigo (Triticum aestivum L.) asperjadas con BAP conservaron un porcentaje mayor de LSU de Rubisco (50 %) que de proteínas solubles (44 %) a los 41 DDS respecto a los 21 DDS (Figura 1B y Figura 2). Lo anterior evidencia las diferencias en la degradación de macromoléculas entre especies y tratamientos. Al respecto, Buchanan–Wollaston et al. (2005) documentan los resultados en la expresión de genes y en las vías de señalización comparando la senescencia natural y la inducida con oscuridad, resultados que mostraron no solo similitudes sino también diferencias, e inclusive la presencia de vías diferentes en procesos catabólicos, particularmente en la movilización de nitrógeno y de carbohidratos.
Azúcares solubles y almidón
Los resultados de este trabajo indicaron aumento en los contenidos de hexosas y sacarosa del d 21 al d 36, pero después los azucares disminuyeron; sin embargo, en el testigo los niveles se mantuvieron similares hasta los 36 DDS (Figuras 3 A, B, C y D).
El testigo mantuvo similares concentraciones de almidón durante la senescencia (65.90 ± 1.00 µmol glucosa g–1 PF), en contraste las hojas con BAP aumentaron el contenido de almidón hasta el d 31 y luego disminuyó. Se encontraron diferencias (p<0.05) entre las hojas con BAP y el testigo, a los 26 y 31 DDS (Figura 3D). En Nicotiana tabacum, Zea mays y Arabidopsis, los azúcares solubles aumentan durante la senescencia natural (Wingler et al., 1998; Jongebloed et al., 2004; Pourtau et al., 2006). Aún no es claro qué origina la acumulación de hexosas en hojas senescentes a pesar de la disminución de la actividad fotosíntesintetica (Wingler et al., 2006) y tampoco se sabe en qué compartimentos celulares se acumulan las hexosas (Pourtau et al., 2006). El aumento en hexosas se atribuye al rompimiento de almidón o a la exportación preferencial de N2 (Wingler et al.,1998). Otro estudio menciona que el aumento de azucares en las hojas senescentes se debe a la aparición de tapones de calosa en los tubos cribosos (Jongebloed et al. (2004).
Otros autores señalan que el incremento de los azúcares está correlacionado con la degradación de Rubisco, debido a la expresión de la aminopeptidasa CND41 (Parrot et al., 2007). Los resultados del presente estudio no indican una relación entre la degradación de Rubisco y el aumento de azúcares en el testigo (senescente). Los mayores niveles de azúcares se observaron a los 31 DDS, mientras que los niveles de Rubisco disminuyeron significativamente 5 d antes (26 DDS). En contraste, a los 36 DDS las hojas con BAP acumularon azúcares y la cantidad de Rubisco disminuyó significativamente (25 %) comparado con las hojas presenescentes (21 DDS) (Figura 2 y Figuras 3A, B).
La aspersión externa de BAP promovió la acumulación de azúcares Al respecto, Wingler et al. (1998) y Jordi et al. (2000) señalan que el incremento de los azúcares se requiere para permitir el retraso de la senescencia en plantas transgénicas de tabaco (PSAG12–IPT). Se menciona que las citocininas regulan la expresión de ciertos genes implicados en el reparto de asimilados y en la regulación de la fuente–demanda como la expresión de la invertasa extracelular y de trasportadores de hexosas, que aumentan la utilización de los carbohidratos para impedir el inicio de los procesos catabólicos (Balibrera–Lara et al., 2004; Guivarc'h et al., 2005)).
Actividad de PEPCK y PEPC
En este trabajo se encontró actividad de PEPCK y PEPC durante la senescencia de hojas de trigo, gramínea con metabolismo C3. Las hojas tratadas con BAP tuvieron valores de actividad de PEPCK mayores (p<0.05) que el testigo, siendo mas marcada entre los 36 y 41 DDS (Figura 4A). Respecto a la actividad de PEPC, a pesar de que tuvo una tendencia a disminuir gradualmente, las hojas tratadas con BAP mantuvieron valores mayores que el testigo (Figura 4B).
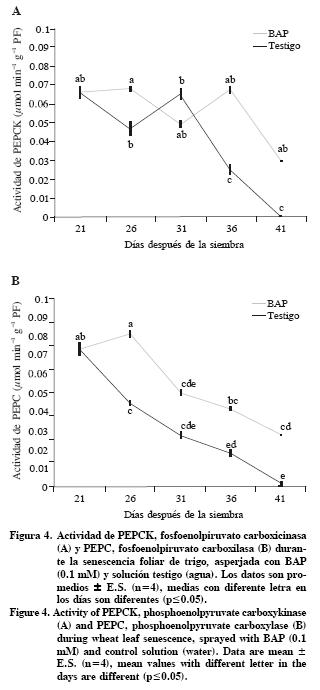
Algunas de las funciones principales de PEPCK están relacionadas con la descarboxilación del oxalacetato dentro de un subgrupo de las plantas C4 y su intervención en la gluconeogénesis durante la germinación de semillas. Sin embargo, PEPCK se ha localizado en diferentes tejidos de plantas, incluyendo aquellas del subgrupo de las NADP–ME de las plantas C4, frutos, tricomas, canales de resina, raíces, semillas en desarrollo, en haces vasculares y en hojas de plantas C3 como pepino (Cucumis sativus) y tabaco (Nicotiana tabacum) (Walker et al., 2001; Leegood y Walker, 2003). La PEPCK se encuentra presente en hojas senescentes de pepino (Cucumis sativus) (C3), distribuida principalmente en el floema y en los tricomas. La asociación de PEPCK a los haces vasculares, en esta especie, sugiere que está involucrada en el trasporte de aminoácidos, regulación del pH con una función cataplérotica para regular la presencia de oxalacetato en el ciclo de los ácidos tricarboxílicos (TCA) durante la síntesis de aminoácidos (Chen et al., 2000). Se propone que PEPCK, PEPC y el ciclo TCA, están involucrados en la síntesis de glutamina, principal aminoácido transportable en la senescencia foliar natural (Buchanan–Wollaston et al., 2005). También se señala que el reciclamiento de nitrógeno en las hojas senescentes de trigo involucra un sistema coordinado entre el citosol y peroxisomas, en donde intervienen diferentes enzimas, entre ellas PEPC, isocitrato deshidrogenasa, aconitato hidratasa y citrato sintetasa (Gregersen y Holm, 2007). La PEPC está presente también en hojas de las plantas C3 no senescentes y se le atribuyen funciones anapleróticas, porque proporciona los esqueletos carbonados para la biosíntesis de aminoácidos y regula el pH (Häusler et al., 2002). La estrecha relación de PEPC con el metabolismo de nitrógeno fue demostrada por Duff y Chollet (1995), quienes observaron que la actividad de PEPC aumentó en fragmentos de hojas de trigo incubados en N03– y luz. Es probable que el tratamiento con BAP promueva la actividad de PEPCK y PEPC para regular el pH debido a que las hojas disminuyen la translocación de compuestos nitrogenados (Jordi et al., 2000); pero requieren mantener un pH óptimo en las células para las reacciones bioquímicas y fisiológicas del metabolismo.
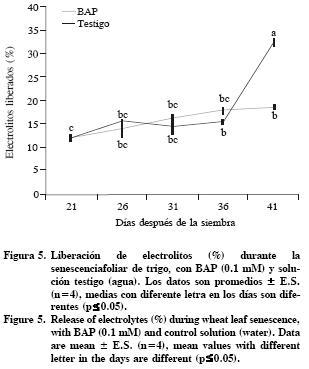
Permeabilidad de la membrana
Durante la senescencia foliar, la membrana plasmática y las membranas de otros organelos pierden su permeabilidad debido a las modificaciones moleculares de la bicapa de lípidos, promovida inicialmente por procesos oxidativos (Hopkins et al., 2007). Pero, las citocininas retrasan este proceso natural; al aumentar de la actividad de enzimas antioxidantes catalasa y ascorbato peroxidada, las membranas citoplasmatica y del cloroplasto se protegen a del daño oxidativo, evidenciado por la reducción en la pérdida de electrolitos y el mantenimiento de la estructura de las membranas cloroplásticas (Zavaleta–Mancera et al., 2007). En el reverdecimiento de Nicotiana rustica L, BAP promueve el reensamblaje de las membranas tilacoidales en cloroplastos envejecidos ó gerontoplastos (Zavaleta–Mancera et al., 1999). Los resultados del presente estudio indican que la liberación de electrolitos (17%) se mantuvo sin cambios (p<0.05) en las hojas con BAP y en el testigo del d 21 al d 36 (Figura 5). Pero a los 41 DDS aumentó la liberación de electrolitos en el testigo (32%), este valor indica daño a la membrana citoplasmática (Figura 5). En segmentos de hojas de Catharanthus roseus L. la liberación de electrolitos se mantuvo constante por 10 d, pero cuando fueron incubados en BAP, ocurriendo cambios significativos solo en los últimos días del tratamiento (Zhang et al., 2007).
CONCLUSIONES
La citocinina BAP, además de mantener por más tiempo las concentraciones de clorofila, proteínas solubles totales y la Rubisco, puede modificar la actividad enzimática de PEPC y PEPCK, conservando un alto contenido de azúcares y reduciendo la pérdida de electrolitos. El entendimiento del retraso de la senescencia foliar puede proporcionar información para implementar tecnologías en la manipulación de la senescencia de forrajes, hortalizas verdes y de ornamentales de follaje.
AGRADECIMIENTOS
Este trabajo fue parcialmente financiado por el Consejo Nacional de Ciencia y Tecnología, México (Proyecto SEP–CONACYT 43866/A–1).
LITERATURA CITADA
Aguilar–Becerril, G. y C. B. Peña–Valdivia. 2006. Alteraciones fisiológicas provocadas por sequía en nopal (Opuntia ficus–indica). Fitotec. Mex. 29: 231–237. [ Links ]
Balibrera–Lara, M. E., M. C González–García, F. Tahira, R. Ehneâ, T. K. Lee, R. Proles, W. Tanner, and T. Roitsch. 2004. Extracellular invertase in an essential component of cytokinin–mediated delay of senescence. The Plant Cell 16: 1276–1287. [ Links ]
Bradford, M. M. 1976. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein–dye binding. Ann. Biochem. 72: 248–59. [ Links ]
Buchanan–Wollaston, V., T. Page, E. Harrison, E. Breeze, P. O. Lim, H. G. Nam, J–F. Lin, S–H. Wu, J. Swidsinski, K. Ishizaki, and C. J. Leaver. 2005. Comparative transcriptome analysis reveals significant differences in gene expression and signaling pathways between developmental and dark/starvation–induced senescence in Arabidopsis. Plant J. 42: 567–585. [ Links ]
Chen, Z–H., R. P. Walker, R. M. Acheson, L. I. Técsi, A. Wingler, P. J. Lea, and R. C. Leegood. 2000. Phosphoenolpyruvate carboxykinase in cucumber plants is increase both by ammonium and by acidification, and is present in the phloem. Planta 219: 48–58. [ Links ]
Delgado–Alvarado, A., R. P. Walker, and R. C. Leegood. 2007. Phosphoenolpyruvate carboxykinase in developing pea seeds is associated with tissues involved in solute transport and is nitrogen–responsive. Plant Cell Environ. 30: 225–235. [ Links ]
Duff, M. G. and R. Chollet. 1995. In vivo regulation of wheat–leaf phosphoenolpyruvate carboxylase by reversible phosphorylation. Plant Physiol. 107: 775–782. [ Links ]
Guivarc'h, A., J. Rembur, M. Gotees, T. Roitsch, M. Noin, T. Schmülling, and D. Chriqui. 2005. Local expression of the ipt gene in transgenic tobacco (Nicotiana tabacum L.C. SR1) axillary buds establishes a role for cytokinins in tuberization and sink formation. J. Exp. Bot. 53: 621–629. [ Links ]
Häusler, R. E., H. J. Hirsch, F. Kreuzaler, and C. Peterhänsel. 2002. Over expression of C4– cycle enzymes in transgenic C3 plants: a biotechnological approach to improve C3– photosynthesis. J. Exp. Bot. 53: 591–607. [ Links ]
Hopkins, M., C. Taylor, Z. Liu, F. Ma, L. McNamara, T–W. Wang, and J. E. Thompson. 2007. Regulation and execution of molecular disassembly and catabolism during senescence. New Phytol. 175: 201–214. [ Links ]
Jongebloed, U., J. Szederkényi, K. Hartig, C. Schobert, and E. Komor. 2004. Sequence of morphological and physiological events during natural ageing of castor bean leaf: sieve tube occlusions and carbohydrate back–up precede chlorophyll degradation. Physiol. Plantarum 120: 338–346. [ Links ]
Jordi, W., A. Schapendonk, E. Davelaar, G. M. Stoopen, C. S. Pot, R. De Visser, J. A. Van Rhijn, S. Gan, and R. M. Amasino. 2000. Increased cytokinin levels in transgenic PSAG12–IPT tobacco plants have large direct and indirect effects on leaf senescence, photosynthesis and N partitioning. Plant Cell Environ. 23: 279–289. [ Links ]
Kim, H.J., H. Ryu, S. H. Hong, H. R. Woo, P. O. Lim, I. C. Lee, J. Sheen, H. G. Nam and I. Hwang. 2006. Cytokinin–mediated control of leaf longevity by AHK3 through phosphorylation of ARR2 in Arabidopsis. Proc. Natl. Acad. Sci. (USA) 103:814–19 [ Links ]
Leegood, R. C. and R. P. Walker. 2003. Regulation and roles of phosphoenolpyruvate carboxykinase in plants. Arch. Biochem. Biophy. 414: 204–210. [ Links ]
Lichtenthaler, H. K. and A. R. Wellburn. 1983. Determination of total carotenoids and chlorophylls a and b in leaf extracts in different solvents. Biochem. Soc. Trans. 11: 591–592. [ Links ]
Lim, P. O., H. J. Kim, and H. G. Nam. 2007. Leaf senescence. Annu. Rev. Plant Biol. 58: 115–136. [ Links ]
Lu, C., Q. Lu, A. J. Zhang, and T. Kuang. 2001. Characterization of photosynthetic pigment composition, photosystem II photochemistry and thermal energy dissipation during leaf senescence of wheat plants grow in the field. J. Exp. Bot. 52: 1805–1810. [ Links ]
Makino, A., M. Tadahiko, and O. Koji. 1986. Colorimetric measurement of protein stained with coomassie brilliant blue R on sodium dodecyl sulfate polyacrylamide gel electrophoresis by eluting with formamide. Agric. Biol. Chem. 50: 1911–1912. [ Links ]
Martínez–Gutiérrez, R., H. Zavaleta–Mancera, L. Ruíz–Posadas, A. Delgado–Alvarado y R. Vaca–Paulín. 2008. Intercambio de gases y relaciones hídricas durante el retraso de la senescencia foliar de trigo (Triticum aestivum L.) por la citocinina BAP. Interciencia 33: 140–145. [ Links ]
Masclaux, C., M. H. Valadier, N. Brugière, J. F. Morot–Gaudry, and B. Hirel. 2000. Characterization of the sink/source transitions in tobacco (Nicotiana tabacum L.) shoot in relation to nitrogen management and leaf senescence. Planta 211: 510–518. [ Links ]
McCabe, M., L. C. Garratt, F. Schepers, J. R. M. Jordi, G. M. Stoopen, E. Davelaar, J. H. van Rhijn, J. B. Power, and M. R. Davey. 2001. Effects of PSAG12–IPT gene expression on development and senescence in transgenic lettuce. Plant Physiol. 127: 505–516. [ Links ]
Ookawa, T., Y. Naruoka, A. Sayama, and T. Hirasawa. 2004. Cytokinin effects on ribulose 1–5 biphosphate carboxylase/ oxygenase and nitrogen partitioning in rice during ripening. Crop Sci. 44: 2107–2115. [ Links ]
Parrot, D. L., K. McInnerney, U. Feller, and A. M. Fisher. 2007. Steam–girdling of barley (Hordeum vulgare) leaves leads to carbohydrate accumulation and accelerated leaf senescence, facilitation transcriptomic analysis of senescence–associated genes. New Phytol. 176: 56–69. [ Links ]
Pourtau, N., R. Jennings, E. Pelzer, J. Pallas, and A. Wingler. 2006. Effect of sugar–induced senescence on gene expression and implications for the regulation of senescence in Arabidopsis. Planta 224: 556–568. [ Links ]
Prásil, I. and J. Zámeènýìk. 1998. The use of conductivity measurement method for assessing freezing injury. I. Influence of leakage time, segment number, size and shape in a sample on evaluation of the degree on injury. Environ. Exp. Bot. 40: 1–10. [ Links ]
Roitsch, T. and R. Ehneâ. 2000. Regulation of source/sink relations by cytokinins. Plant Growth Reg. 32: 359–367. [ Links ]
Sánchez–Urdaneta, A. B., C. B. Peña–Valdivia, J. R. Aguirre, y R. C. Trejo. 2004. Efectos del potencial de agua en el crecimiento radical de plántulas de Agave salmiana Otto. Interciencia 29: 626–631. [ Links ]
Sholes, J. D., P. J. Lee, P. Horton, and D. H. Lewis. 1994. Invertase: understanding changes in the photosynthetic and carbohydrate metabolism of barley leaves infected with powdery mildew. New Phytol. 126: 213–222. [ Links ]
Steiner, A. A. 1984. The universal nutrient solution. Sixth Int. Congr. On Soilless Culture. ISOSC Proceeding. The Netherlands. pp: 663–649. [ Links ]
Vlèková , A., M. Spundová, E. Kotabovà, R. Novotný, K. Dole al, and J. Naus. 2006. Protective cytokinin action switches to damaging during senescence of detached wheat leaves in continuous light. Physiol. Plantarum 126: 257–267. [ Links ]
Walker, R. P., Z–H. Chen, K. E. Johnson, F. Famiani, L. Tecsi, and R. C. Leegood. 2001. Using immunohistochemistry to study plant metabolism: the examples of its use in the localization of amino acids in plant tissues, and of phosphoenolpyruvate carboxykinase and its possible role in pH regulation. J. Exp. Bot. 52: 565–576. [ Links ]
Wingler, A., A. von Schaewen, R. C. Leegood, P. J. Lea, and W. P. Quick. 1998. Regulation of leaf senescence by cytokinin, sugar, and light. Effects on NADH–depend hydroxypyruvate reductase. Plant Physiol. 116: 329–335. [ Links ]
Wingler, A., M. Marès, and N. Pourtau. 2004. Spatial patterns and metabolic regulation of photosynthetic parameters during leaf senescence. J. Exp. Bot. 57: 391–399. [ Links ]
Wingler, A., S. Purdy, J. A. MacLean, and N. Pourtau. 2006. The role of sugar in integrating environmental signals during the regulation of leaf senescence. J. Exp. Bot. 57: 391–399. [ Links ]
Zavaleta–Mancera, H. A, H. López–Delgado, H. Loza–Tavera, M. Mora–Herrera, C. Trevilla–García, M. Vargas–Suárez, and H. Ougham. 2007. Cytokinin promotes catalase and ascorbate peroxidase activities and preserves the chloroplast integrity during dark–senescence. J. Plant Physiol. 164: 1572–1582. [ Links ]
Zavaleta–Mancera, H. A., B. J. Thomas, H. Thomas, and I. M. Scott. 1999. Regreening of senescent Nicotiana leaves. II. Redifferentation of plastids. J. Exp. Bot. 50: 1683–1689. [ Links ]
Zhang, L., D. Xiang, J. Wang, and L. Li. 2007. Rapid and non–invasive detection of plants senescence using a delayed fluorescence technique. Photochem. Photobiol. Sci. 6: 635–641. [ Links ]














