Introducción
Si en la naturaleza los animales son los equivalentes de los vehículos y las máquinas, las plantas son seguramente los equivalentes de las estructuras de ingeniería civil. En este sentido, en todos ellos la estructura principal sujeta otra parte por encima del suelo. Por ejemplo, en una planta, el tallo, las ramas y las raíces tienen la tarea de levantar las hojas por encima de plantas competidoras, ya que estas hojas deben aprovechar la luz solar para obtener la energía necesaria para su crecimiento y su reproducción (Ennos, 2005; Thomas, 2014). De esta forma, los árboles están en competencia permanente entre ellos y a su vez con otras plantas para captar la mayor cantidad de luz solar posible.
La principal ventaja que poseen es su gran altura; gracias a ella logran ubicar a sus unidades de fotosíntesis (las hojas) en lugares privilegiados. Para conseguir esta ventaja competitiva, las plantas arborescentes tienen que transportar el agua a lo largo de grandes distancias, por efecto de las fuerzas de cohesión debidas a la tensión superficial, en contra de la gravedad, y además, tienen que hacer frente a cargas mecánicas considerables: su propio peso, la carga del viento, el peso de la nieve, entre otras. Para cumplir con estos requisitos mecánicos, los árboles cuentan con un sofisticado diseño estructural y tienen un material de ingeniería único: la madera. Así, combinan la resistencia, la flexibilidad y la rigidez, e incluso pueden responder a su entorno y, por tanto, cambiar su diseño. Ello les permite desplegar sus hojas usando un mínimo de material estructural (Ennos, 2016). En tal sentido, los tallos son una de las más impresionantes construcciones mecánicas de la naturaleza, y hacen de los árboles, los seres vivos más grandes que han poblado la Tierra.
Debido a la estructura jerárquica y a su multifuncionalidad, los árboles pueden crecer más de 100 m de altura (Speck y Burgert, 2011), tener masas de varios cientos de toneladas y alcanzar edades de varios miles de años (Eder, Rüggeberg y Burgert, 2009). Los árboles pueden soportar grandes tensiones sin romperse, ya que la relación entre su resistencia mecánica y las tensiones de servicio es de hasta 4,5 veces; este resultado coincide con los valores del factor de seguridad que presentan los huesos de los mamíferos, entre tres y cuatro (Mattheck, Bethge y Schäfer, 1993). Las diferentes familias de plantas arborescentes experimentan cargas mecánicas similares y cada familia posee estrategias de crecimiento, anatomía y morfología diferentes (Eder et al., 2009).
Así, este artículo busca unir dos áreas de conocimiento complementarias, la botánica y la ingeniería, para explicar conceptos mecánicos presentes en las especies arborescentes, ilustrar las principales estrategias estructurales de los árboles, y sugerir posibles desarrollos tecnológicos tomándolos como referentes estructurales y morfológicos.
Arquitectura vegetal
En 1790 Goethe, el poeta, novelista y dramaturgo alemán, definió el término morfología vegetal (Goethe, 1790), actualmente conocido como arquitectura vegetal, y desde entonces se acepta que las plantas son organismos modulares que se desarrollan por la repetición de entidades botánicas elementales cuyas características morfológicas, dimensionales, funcionales y anatómicas cambian durante su desarrollo (Conn, Pedmale, Chory, Stevens y Navlakha, 2017). La arquitectura vegetal trata de la forma y estructura de la planta y de sus cambios temporales y topológicos durante la ontogenia e incluso la filogenia (Barthélémy y Caraglio, 2007; Hellström, Carlsson, Falster, Westoby y Brännström, 2018). La arquitectura de una planta depende de su naturaleza y de la disposición de cada una de sus partes; es decir, del equilibrio entre los procesos de crecimiento endógeno y las restricciones exógenas ejercidas por el medio ambiente. Así, el objetivo del análisis arquitectónico es identificar estos procesos endógenos y separarlos de las influencias externas por medio de la observación y la experimentación. Considerando una planta como un todo, desde su germinación hasta su muerte, el análisis arquitectónico es un enfoque global, multinivel y dinámico sobre el desarrollo de la planta (Barthélémy y Caraglio, 2007).
En este sentido, la forma de una planta se determina por la forma del espacio que ocupa gracias a un programa genético de desarrollo heredado (Horn, 1971), que suele implicar la adición reiterativa de una serie de subunidades estructuralmente equivalentes (ramas, ejes, brotes, hojas, etc.), que confieren a las plantas una naturaleza modular; dicho programa es el resultado de la evolución de la planta bajo algunas restricciones biomecánicas generales (Barthélémy y Caraglio, 2007). Por ejemplo, considerando la forma de la copa de un árbol, el coste de las ramas horizontales es mayor que el de las ramas verticales (Mattheck, 1991).
La unidad arquitectónica
Los acontecimientos que se presentan en el transcurso de la vida de los árboles indican que cada especie tiene un «plan de acción» para su desarrollo. Estos «planes», o unidades arquitectónicas, representan una secuencia de desarrollo particular con un número finito de categorías de ramificación (Raghavendra, 1991) y se agrupan en alguno de los múltiples modelos (del orden de unos treinta) (Hallé y Oldeman, 1970; Hallé, Oldeman y Tomlinson, 1978) que se utilizan para describir las plantas, ya sean tropicales o boreales, árboles o hierbas, fósiles o existentes (Hallé, 2001).
Los árboles pueden ser unitarios o convertirse en colonias. Los unitarios crecen según un único modelo y, por lo tanto, un árbol unitario antiguo es isomórfico con un árbol joven (p. ej. la araucaria, Fig. 1A). Sin embargo, la mayoría de los árboles no son unitarios; por el contrario, son colonias de unidades arquitectónicas que crecen unas sobre otras (Fig. 1B). A este proceso, a través del cual un árbol duplica su arquitectura produciendo nuevas copias de su unidad arquitectónica, se le llama reiteración. La reiteración es un tipo especial de ramificación que ofrece no una rama sino un "árbol nuevo" que crece sobre el anterior (Hallé, 2001).
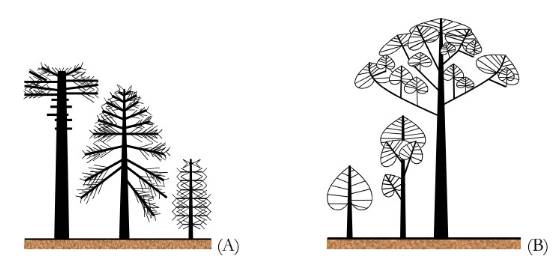
(A) Ejemplo de árbol unitario (Araucaria araucana). (B) Proceso de reiteración en un árbol colonial (Dipterocarpus). Adaptado de Hallé (2001).
Figura 1. Las tres etapas de crecimiento en los árboles unitarios o coloniales.
De esta manera, un modelo arquitectónico representa la estrategia básica de crecimiento de una planta. Así, para una planta determinada, la expresión específica de su modelo se ha denominado su «unidad arquitectónica». La arquitectura de una planta también puede verse como un sistema jerárquico ramificado en el que los ejes pueden agruparse en categorías según sus características morfológicas, anatómicas o funcionales. La estructura y la función de cada categoría pueden describirse según las características que definen las unidades arquitectónicas de cada planta (Barthélémy y Caraglio, 2007).
Limitaciones y funciones biomecánicas
Las plantas vasculares terrestres, como los árboles, tienen múltiples funciones y limitaciones que influyen en su diseño (Pearcy, Muraoka y Valladares, 2005), y deben combinar requisitos funcionales (conducción de agua, intercambio de gas) con problemas estructurales y con la captación de luz. A lo largo de la evolución de la planta se han encontrado diferentes soluciones a estos problemas, habitualmente opuestos (Valladares y Niinemets, 2007). El análisis arquitectónico aplicable a cualquier tipo de planta ha demostrado ser uno de los medios más eficaces para el estudio de la organización de plantas arborescentes complejas. Los conceptos arquitectónicos son de particular interés para entender cómo se desarrolla la copa de los árboles. La idea del concepto del análisis arquitectónico es entender el porqué de la estructura y desarrollo de los árboles y, establecer un marco conceptual y metodológico para el análisis y la comprensión de su morfología (Barthélémy y Caraglio, 2007).
La ramificación
Otro aspecto biomecánico importante es el patrón de ramificación de la copa (Peyhardi et al., 2017). Para lograr un crecimiento óptimo de las plantas, los ángulos de ramificación deberían minimizar tanto los costes estructurales como la superposición de hojas (Valladares y Niinemets, 2007). Sin embargo, estas dos características son mutuamente excluyentes ya que los patrones de ramificación y la disposición de las hojas que reducen la superposición requieren a menudo una mayor inversión en los tejidos estructurales (Givnish, 1995). En general, las estrategias mecánicas de los árboles se concentran en un buen diseño estructural solo si la captación de luz es justificada (Mattheck, 1991; Mattheck, 1995).
Sol y sombra
El entorno umbófilo (sombreado) y el entorno con iluminación imponen restricciones muy diferentes en el rendimiento fotosintético de las plantas. En tal sentido, la arquitectura es un tema clave en la biomecánica de las plantas para conseguir una máxima captación de luz (fotosíntesis) en sotobosques sombreados y una mínima exposición al exceso de radiación en entornos abiertos de alta incidencia solar. La disposición de las hojas dentro de la copa de un árbol es uno de los parámetros básicos que afectan la captación de luz y la ganancia de carbono fotosintético. Idealmente, las hojas en entornos sombreados de sotobosque deberían estar dispuestas horizontalmente para conseguir una superposición mínima en el plano horizontal, minimizando así el autosombreado.
En realidad, la mayoría de las copas, incluso en el sotobosque, están bajo un intenso sombreado y una distribución desigual de la luz entre las hojas. En ambientes de alta incidencia solar, para el evitar la radiación excesiva, las copas presentan características arquitectónicas determinadas (ángulo de las hojas, el empaquetamiento del follaje) que aumentan el autosombreado. Si las copas están tanto en sol como en sombra, un entorno luminoso altamente heterogéneo tiene una gran influencia en las funciones del árbol, como son la fotosíntesis, la transpiración y el flujo de agua (Pearcy et al., 2005).
En el sotobosque, el crecimiento de los árboles aumenta verticalmente porque la luz aumenta exponencialmente hacia la superficie del dosel forestal (región superior de las copas), mientras que el aumento del coste de los tejidos estructurales no es tan pronunciado con la altura de la planta. La naturaleza dinámica del dosel forestal, con numerosas aberturas causadas por las caídas de árboles, contribuye a la coexistencia de muchas especies de árboles con diferentes morfologías (Fig. 2). Los bosques están estratificados verticalmente, desde los árboles emergentes hasta las hierbas en el suelo del bosque, y cada estrato posee distintas especies de plantas adaptadas a las condiciones de cada nivel particular, principalmente a las condiciones de luz (Valladares y Niinemets, 2007). Algunas especies de árboles detienen su crecimiento cuando alcanzan una altura determinada, a diferencia de las especies de dosel que siguen una trayectoria ascendente hasta que alcanzan el cielo abierto o mueren. De esta forma, vale la pena preguntarse si hay una altura óptima para un árbol intermedio ubicado en el sotobosque (Valladares y Niinemets, 2007).
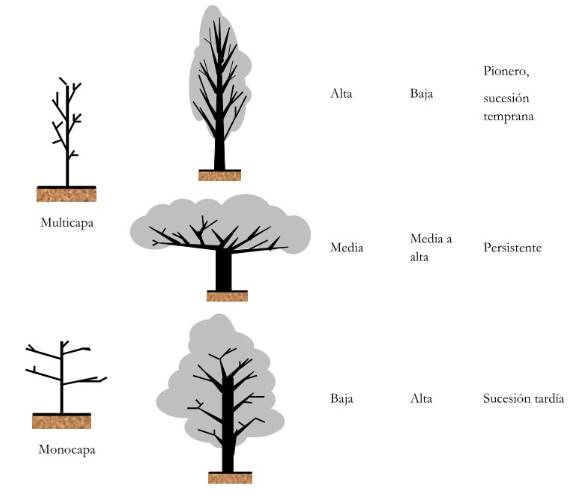
Figura 2 Forma de la copa y características generales de árboles con diferentes estatus de sucesión. Adaptado de (Horn, 1971).
A este respecto hay una explicación (Terborgh, 1992), teniendo en cuenta cómo pasa la luz directa del sol a través de los espacios del dosel forestal hacia las capas inferiores y finalmente al suelo del bosque. A medida que la luz solar penetra hacia el bosque a través de una abertura, forma un área triangular en el sotobosque (Fig. 3A). En las partes superiores del triángulo el número de horas de luz es mayor que en las partes inferiores. Estos triángulos de luz directa se pueden superponer en áreas de aberturas adyacentes, debido a que algunos puntos reciben luz directa dos veces al día (intersección de dos áreas), y otros más bajos reciben luz de un mayor número de aberturas, aunque por períodos cortos, lo que causa un campo de iluminación uniforme cerca del suelo (Fig. 3B). De esta forma, un árbol intermedio debería crecer hasta el límite superior de este campo, pues por encima del límite no recibiría suficiente luz para compensar el coste de producción (crecimiento); así, las tareas de mantenimiento del árbol se incrementarían a expensas de otras funciones como la reproductiva (Terborgh, 1992).
La forma de la copa también determina el tamaño del triángulo de luz bajo una abertura (Fig. 4) y varía con la latitud (Fig. 3), como los árboles «hongo» en los trópicos, con amplios rayos de luz y copas cónicas en regiones boreales, que ofrecen muy poca luz solar en el suelo (Fig. 4). Así, en los trópicos hay muchas plantas de sotobosque (Fig. 5), mientras que en las regiones templadas hay menos (Fig. 6). Otra consecuencia de la estratificación vertical es que la forma de la copa cambia con respecto a la posición, siendo en los bosques tropicales donde los árboles emergentes presentan copas más anchas que profundas y los árboles inferiores son más profundos que anchos (Valladares y Niinemets, 2007).
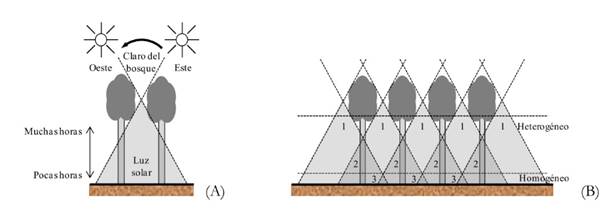
(A) Área triangular de luz solar directa. (B) Intersección de varias áreas de radiación directa; el campo luminoso es más uniforme a medida que aumenta el número de intersecciones (cerca del suelo). Adaptado de (Terborgh, 1992).
Figura 3. Paso de la luz hacia las capas inferiores del bosque a través de los espacios del dosel forestal.
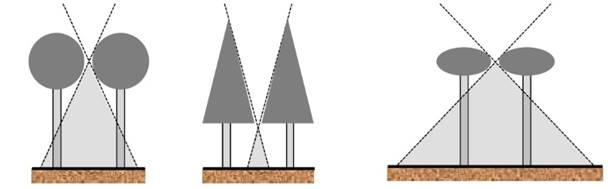
Adaptado de(Terborgh, 1992)
Figura 4. Influencia de la forma de la copa en el tamaño del área de luz solar directa en el sotobosque.

Foto: G. Vargas-Silva (2017).
Figura 5 En los trópicos abundan las plantas de sotobosque: selva amazónica colombiana.
Ventajas de ser alto
Si bien la arquitectura vegetal es el resultado de muchos condicionantes selectivos, la morfología y las propiedades mecánicas están limitadas por principios estructurales conocidos (McMahon y Kronauer, 1976; Niklas, 1992). Como las zonas aéreas de las plantas deben soportar la acción de la gravedad y del viento, una parte de la biomasa debe dedicarse a tareas estructurales. Puesto que las estructuras mecánicas isomorfas se vuelven cada vez más ineficientes con el aumento de tamaño (Galilei, 1638), la parte estructural de la planta debe aumentar considerablemente con su tamaño. Para una planta, los costes estructurales asociados con la geometría de su copa deben estar equilibrados con los beneficios fotosintéticos (Valladares y Niinemets, 2007).
La altura a la que una planta debe crecer depende del entorno y de la altura de las plantas vecinas, ya que el objetivo no es crecer lo más alto posible sino crecer más que los demás (Crawley, 1986; King, 1990). Mientras más alta sea una planta, más luz necesitará para soportar la biomasa preexistente y para continuar creciendo. Aunque las plantas pequeñas tienen menores costes de mantenimiento por unidad de luz absorbida que las plantas grandes (Götmark, Götmark, y Jensen, 2016), un crecimiento más alto implica un mayor acceso a la luz (Valladares y Niinemets, 2007). Por lo tanto, lo que la planta invierte para crecer en altura se recupera energéticamente, especialmente en situaciones de alta competencia lumínica. Por supuesto, ser alto requiere mayores irradiancias debido a los costes de mantenimiento asociados (Givnish, 1988).
Por otro lado, la estabilidad mecánica requiere una cantidad mínima de tejido necesario para soportar la planta. El modo de falla más probable para un fuste (tallo o tronco) es el pandeo elástico, en lugar de una falla por resistencia bajo el peso de la copa. En tal sentido, el tallo está diseñado para prevenir el pandeo, pero no la falla por compresión (McMahon, 1973). Por lo tanto, para mantener un factor de seguridad contra el pandeo, las plantas relacionan su altura con el diámetro del tronco (Niklas, 1994). Cuando los árboles crecen a cielo abierto con poca competencia, su altura es conservadora, llegando solo a 25% de su valor teórico de pandeo (McMahon, 1975; McMahon y Kronauer, 1976). Sin embargo, cuando la competencia es mayor, los árboles no pueden permitirse grandes factores de seguridad (Givnish, 1995).
La gravedad
En una planta, la gravedad genera una carga estática estacionaria basada en el peso. Los árboles minimizan las tensiones reduciendo la longitud de la palanca, como se esquematiza en la figura 7. La reducción de la longitud se puede conseguir de forma activa mediante un autoflexionado de las partes rígidas, formando madera de reacción, o de forma pasiva generando partes flexibles. La dominancia apical y el geotropismo negativo se equilibran continuamente para ajustar el ángulo óptimo entre la rama y el tallo. La necesidad de enderezamiento de los brotes potenciales se ve suprimida por el brote principal, siempre y cuando este siga intacto. Después de la pérdida del brote principal, la rama que se extiende lateralmente se endereza para tomar el lugar de su predecesor. Además, en la mayoría de los casos, esta rama (no necesariamente la rama superior) impone la dominancia apical y suprime el resto de los brotes potenciales (Mattheck y Kübler, 1997).

(A) Minimización de la carga de flexión que actúa sobre la rama y sobre el tronco. Adaptado de (Mattheck y Kübler, 1997). (B) Enderezamiento del tronco de una conífera, especie con dominancia apical, en San Sebastián, País Vasco. Foto: N.Galarza.
Figura 7 Enderezamiento de una rama lateral después de la pérdida del brote principal.
La madera de alta densidad, que se consigue en especies de larga vida con regeneración lenta del tejido, proporciona resistencia frente al fallo mecánico y contra el ataque de hongos e insectos (King, 1986); pero representa un aumento del peso del tallo (o rama). Así, las ventajas biomecánicas de un material más resistente, y más denso, son neutralizadas por una carga muerta adicional. Los costes estructurales se minimizan al generar madera de baja densidad; por ello, las maderas coníferas crecen más rápido que las frondosas (Horn, 1971). De esta forma, los árboles pioneros tienen madera ligera, producida con poca energía, mientras que los árboles de sucesión tardía tienen madera densa y muy lignificada (Givnish, 1995; Horn, 1971). Las diferencias entre las copas de las especies de maderas frondosas y coníferas pueden ser significativas en función de la frecuencia de las tormentas, la estabilidad de los sustratos, la competencia por la luz o la disponibilidad de agua y nutrientes (Valladares y Niinemets, 2007).
El viento
El viento induce en las plantas una carga dinámica transitoria (Grace, 1988; King, 1986; Speck, Spatz, y Vogellehner, 1990). Esta carga produce modificaciones permanentes en la forma general de las plantas y afecta tanto la anatomía como la densidad de la madera, generando cambios biomecánicos a nivel arquitectónico (Fagerstedt, 1996; Ennos, 1997). Por ejemplo, frente una carga de viento la copa de un árbol se reconfigura dinámicamente (cambia de forma) para reducir el arrastre. Así, en entornos de mucho viento, la reducción del arrastre es típica de ramas flexibles (Vogel, 2003) o de hojas pinnadas o lobuladas, debido al alto grado de reconfiguración de estas hojas en comparación con las hojas simples (Vogel, 1989). De este modo, existen dos estrategias en relación con el viento como factor ecológico (Ennos, 1997; Vogel, 1989):
Árboles pioneros con ramas flexibles y con hojas pinnadas o lobuladas: reducen la resistencia aerodinámica.
Árboles de sucesión tardía o de especies en sitios protegidos con hojas simples y ramas rígidas: mantienen una óptima captación solar.
Algo similar sucede con los árboles que habitan a lo largo de las orillas de los ríos: ramas flexibles y hojas estrechas, como las del sauce, que se pueden adaptar a la corriente ya que reducen la presión de arrastre durante las inundaciones (Vogel, 2003).
Materiales naturales vegetales
Los materiales biológicos están en todo lo que nos rodea, son los principales constituyentes de los organismos vegetales y animales y tienen una amplia diversidad de funciones. Una de estas funciones es el comportamiento mecánico que ofrece protección y estructura para el individuo (Fratzl y Weinkamer, 2007). La destacable eficiencia mecánica de los sistemas biológicos en los árboles se debe en gran parte a las estrategias que usa la naturaleza para conseguir materiales con un excelente comportamiento estructural. Dichas estrategias tienen que ver con la organización jerárquica de los materiales biológicos (Lakes, 1993), y a que en la mayoría de los casos se tratan de materiales compuestos reforzados con fibras (Mayer y Sarikaya, 2002), materiales celulares (Gibson y Ashby, 1999), o ambos. Muchos tejidos biológicos como la madera y los huesos son sólidos celulares reforzados con fibras que presentan una estructura jerárquica. Sus excepcionales propiedades mecánicas se deben a una adaptación funcional de la estructura a todos los niveles de dicha jerarquía (Fratzl y Weinkamer, 2007).
Estructura jerárquica
Los tejidos biológicos, como la madera, los huesos o los dientes, están estructurados jerárquicamente para proporcionar la máxima resistencia con un mínimo de material. Muchos de estos materiales son sólidos celulares (hueso esponjoso o madera) o materiales con función gradiente (dentina). En el nivel más bajo de la jerarquía, es decir, en el intervalo de nanómetros, los materiales biológicos son generalmente compuestos (a veces llamados “composites” en la literatura en español) reforzados con fibras. Debido a esta estructura jerárquica, hay una amplia variedad de diseños posibles, cambiando la disposición de los componentes a los diferentes niveles de tamaño (Fratzl, 2005).
En el caso particular de los árboles, el diámetro representativo de las diferentes subestructuras cubre un intervalo desde 101 m (el tronco de una secuoya) hasta 10-8 m (el diámetro de una protofibrilla de celulosa), es decir, diez órdenes de magnitud con ocho niveles jerárquicos: órgano (tronco), tejido (madera), célula de madera, paredes celulares laminadas, paredes individuales, fibras de celulosa, microfibrillas y protofibrillas (Jeronimidis, 2008), como se presenta de forma esquemática en la figura 8. En tal sentido, las paredes celulares de las plantas están hechas de cuatro elementos básicos: celulosa, hemicelulosa, lignina y pectina.

Figura 8 Estructura de la pared celular de la madera: lamela media (ML), pared primaria (P), paredes secundarias (S1, S2, S3), microfibrillas, estructuras cristalinas (Vargas et al., 2015).
La microestructura de las paredes celulares vegetales varía en los diferentes tipos de plantas; en términos generales, las fibras de celulosa refuerzan una matriz de hemicelulosa y, o bien lignina o pectina, dispuesta en una o varias capas. El contenido en volumen de fibra de celulosa y su orientación varían entre una capa y otra, así como la estructura geométrica de las células vegetales. (Holmberg, Persson y Petersson, 1999; Davalos-Sotelo, 2005). De este modo, se tienen desde células prismáticas en disposición de nido de abeja (en el caso de la madera) y células poliédricas de parénquima con forma de espuma con celdas cerradas rellenas de líquido (en el caso de las manzanas y las patatas), hasta materiales compuestos de estas dos estructuras celulares, como en el caso de los tallos de palmeras arborescentes. La disposición de los cuatro elementos básicos en la pared celular de las plantas y las variaciones en la estructura celular ofrecen una amplia variedad de propiedades mecánicas, con módulos de Young (o módulos de elasticidad) que varían desde 0,3 MPa en el parénquima hasta 30 GPa en las palmeras más densas (100 000 veces mayor), y resistencias a compresión de 0,3 MPa en el parénquima contra 300 MPa en palmeras de alta densidad (1000 veces mayor). Lo interesante es que hay plantas que tienen materiales vegetales con módulos elásticos y resistencias que abarcan casi todo este intervalo de valores (Gibson, 2012).
Materiales compuestos reforzados con fibras
La mayoría de los tejidos biológicos están constituidos por fibras poliméricas. Dos de las fibras más abundantes en la naturaleza son la celulosa y el colágeno. La celulosa se encuentra predominantemente en las plantas, aunque también es producida por algunas bacterias, y es uno de los principales constituyentes de la pared celular vegetal. La celulosa es la sustancia orgánica más abundante en la naturaleza, es la principal fibra estructural del reino vegetal, y puede ser sintetizada por plantas terrestres, algunos animales (los tunicados), algas y un gran número de microorganismos. Esta sustancia es un polisacárido que, gracias a los enlaces (-(1→4) entre las unidades de glucosa (Vargas et al., 2015), produce una estructura lineal en forma de cinta que es muy rígida y que forma fibras estables, lo cual le confiere rigidez al cuerpo de la planta (Fratzl, 2003; Fratzl, 2005). Para ser un polímero, la celulosa tiene unas excelentes propiedades mecánicas: su módulo de Young en dirección axial es mayor a 130 GPa (Davalos-Sotelo, 2005) y su resistencia a tracción es cerca de 1000 MPa. Las propiedades de la hemicelulosa y de la lignina, por el contrario, son similares a las de los polímeros de ingeniería comunes: la lignina, en condición húmeda, por ejemplo, tiene un módulo de unos 3 GPa (Davalos-Sotelo, 2005) y una resistencia de aproximadamente 50 MPa (Vargas et al., 2015).
Las principales características de la macromolécula de celulosa son: su carácter renovable, su estructura regular, su alto peso molecular y sus grupos hidroxilo reactivos. Estas particularidades han contribuido a la utilización de la celulosa como material de refuerzo potencial, debido a la combinación de sus propiedades: alta área superficial, alta relación de aspecto y propiedades mecánicas específicas excepcionales (Vargas et al., 2015). En cuanto a las propiedades mecánicas, la molécula de celulosa tiene un módulo de Young teórico de 250 GPa, pero el mayor valor que se ha obtenido experimentalmente es de aproximadamente 130 GPa. La densidad de la celulosa nativa de las plantas superiores tiene un valor entre 1,582 g/cm3 y 1,599 g/cm3 (VanderHart y Atalla, 1984), de modo que es posible comparar su comportamiento mecánico (resistencia y rigidez) con el de otros materiales de ingeniería. En conclusión, la celulosa es un material de alto rendimiento, comparable con las mejores fibras producidas tecnológicamente (Vincent, 1999).
Materiales celulares
Los materiales con una estructura celular abundan en la naturaleza e incluyen los que tienen celdas prismáticas con disposición de nido de abeja, como la madera y el corcho, o los que cuentan con celdas poliédricas, como los núcleos de tallos de plantas y los huesos esponjosos. También están las estructuras tipo sándwich naturales con núcleos ligeros, como las hojas largas y estrechas de las iridáceas, y como los huesos tipo cáscara (el cráneo). Las estructuras tubulares naturales, como los tallos de bambú, tienen con frecuencia un núcleo tipo nido de abeja o un núcleo esponjoso que está envuelto en una cáscara cilíndrica externa más densa, aumentando así la resistencia de la cáscara a fallas por pandeo local (en los tallos de las plantas). Desde un punto de vista mecánico, estos materiales naturales celulares son eficientes: la microestructura en forma de panel de abeja de la madera, por ejemplo, ofrece un comportamiento mecánico excepcionalmente alto para resistir flexión y pandeo (Gibson, 2005).
Las características microestructurales de los sólidos celulares que afectan su comportamiento mecánico se pueden observar con mayor facilidad en las estructuras artificiales tipo nido de abeja o en las espumas artificiales. Las estructuras tipo nido de abeja, con sus celdas prismáticas, se denominan sólidos celulares bidimensionales, mientras que las espumas, con sus celdas poliédricas, son sólidos celulares tridimensionales. La densidad relativa es la densidad del sólido celular dividida por la densidad del sólido del que está hecho, y es equivalente a la fracción en volumen del sólido. Las espumas pueden ser abiertas (con material sólido únicamente en los bordes de los poliedros) o cerradas (con membranas sólidas sobre las caras de los poliedros). Las propiedades de una espuma dependen de las del sólido que constituye el material celular; en el caso de materiales como la madera, las paredes celulares son a su vez materiales compuestos laminados reforzados con fibras (Gibson, 2005).
Por otro lado, la madera también tiene una desventaja estructural: como sus células son alargadas y tienen forma de tubos de pared delgada, tienen una propensión a pandearse cuando están bajo la acción de cargas de compresión. Esto hace que la madera sea aproximadamente la mitad de resistente a compresión que a tracción (Ennos, 2016; Gordon, 1978).
Estrategias estructurales de las plantas lignificadas
Diseño mecánico adaptativo
En biología, el diseño mecánico adaptativo tiene que ver con la salida de diseño resultante de un conjunto de entradas proveniente de la evolución o crecimiento de un órgano o de un organismo. Las entradas pueden ser cargas externas o internas, cambios medioambientales, entre otros, que se superponen en la información genética disponible. Como la escala de tiempo evolutiva es muy larga, lo que observamos ahora es el resultado de todas estas entradas durante largos periodos de tiempo (Jeronimidis, 2008).
Los mejores ejemplos de diseños mecánicos «adaptativos» son los huesos (Huiskes, 2000) y los árboles (Thibaut, Gril, y Fournier, 2001). En los árboles, cuando las circunstancias mecánicas lo requieren, se produce un tipo especial de madera en los anillos anuales sucesivos, con diferente orientación de microfibrillas de celulosa y estructura celular (Jeronimidis, 2008). Otros dos tipos de diseño mecánico adaptativo que ocurren en una escala de tiempo más corta (y por ello, son más observables), y que tiene que ver con individuos más que con especies, son la tigmomorfogénesis; por ejemplo, cambios en la forma, la estructura, o las propiedades del material, como resultado de cambios transitorios en las condiciones del entorno (Vogel, 2009), y las distintas formas de tropismo, como el heliotropismo en los girasoles y la reestructuración en los huesos, mencionado anteriormente.
Estos efectos están íntimamente relacionados con el crecimiento y son buenos ejemplos de modificaciones en el diseño con el fin de resolver un conjunto específico de condiciones de servicio. La formación de la madera de reacción en los árboles, necesaria para enderezar el tronco hacia la vertical o para compensar las cargas en direcciones específicas (vientos predominantes, crecimiento inclinado) y el mecanismo de reestructuración en los huesos son quizás los ejemplos más conocidos y los mejor documentados. Lo que muestran estos ejemplos de diseño mecánico adaptativo es que, durante el crecimiento, la flexibilidad de diseño intrínseca debida a la combinación de los materiales reforzados con fibras, la organización en diferentes niveles de jerarquía y la interacción entre ellos, convergen hacia una solución específica necesaria para la situación concreta en la que se ha desarrollado (Jeronimidis, 2008). Así, a nivel celular se puede modificar la densidad del tejido y a nivel bioquímico se pueden modificar los ángulos de microfibrillas de celulosa y se puede conseguir una lignificación suficiente, con el fin de adaptar la solución de diseño, aunque sea de manera temporal, según los cambios en las condiciones circundantes (Eder et al., 2009). De este modo, durante su crecimiento, los árboles están en adaptación que, aunque lenta, es permanente y altamente eficiente. Esta alta flexibilidad estructural y geométrica de los árboles, combinada con una estrategia de transporte de agua de alta eficiencia, son las razones por las que los árboles puedan alcanzar alturas espectaculares, como las secuoyas gigantes (Secuoia sempervirens (D.Don) Endl) de hasta 115 m en California, Estados Unidos.
Madera de reacción
La madera de reacción, RW (en inglés, reaction wood), se forma generalmente como respuesta a una orientación no vertical del tronco, causada por vientos predominantes, nieve, pendientes inclinadas o perfiles asimétricos en el follaje. Este tipo anormal de madera se forma como parte de un proceso de desarrollo cuyo objetivo es reorientar la inclinación de un tronco, o de una rama, para que el árbol pueda encontrar una posición más favorable, como en el caso que se aprecia en la figura 9. Tanto en las especies de angiospermas como en las de gimnospermas, el tejido de la madera de reacción se asocia frecuentemente con el crecimiento radial excéntrico del tronco (Wilson y Archer, 1979). Por un lado, en el caso de las gimnospermas a la madera de reacción se le suele llamar madera de compresión, CW (en inglés, compression wood) ya que suele aparecer en zonas localizadas del árbol sometidas a tensiones de compresión, en la parte inferior de los tallos inclinados, como se presenta en la figura 10A. Por otro lado, en las especies de angiospermas a la madera de reacción se le llama madera de tensión, TW (en inglés, tension wood) porque aparece en las zonas del árbol sometidas a tensiones de tracción, en la parte superior de los tallos inclinados (Fig. 10B) (Plomion, Leprovost y Stokes, 2001).

Foto: G. Vargas-Silva (2017).
Figura 9 Formación de madera de reacción en un tronco para reorientar su inclinación, en busca de una posición vertical más favorable.

(A) Madera de compresión en gimnospermas. (B) Madera de tracción en angiospermas. Adaptado de (Mattheck, 1991).
Figura 10 Enderezamiento de un tronco inclinado mediante la generación de madera de reacción, por acción combinada de las partes superior e inferior del tejido.
Pretensionado longitudinal
Los troncos de los árboles deben soportar su propio peso, lo que origina tensiones de compresión. Sin embargo, en la práctica, las tensiones producidas por los esfuerzos a flexión, debidas a las cargas de viento son siempre mayores y más importantes que las de compresión. Algo similar sucede con los mástiles de los barcos que soportan tensiones de compresión cuando se tensan los aparejos (Gordon, 2006). De hecho, tradicionalmente los armadores de barcos preferían usar troncos únicos enteros para construir los mástiles de los barcos, intentando utilizar el árbol en su estado más natural, tanto como fuera posible. Curiosamente, durante muchos años los ingenieros despreciaron este conocimiento tradicional; de hecho, lo primero que hacen los ingenieros con un árbol es cortarlo en pedazos pequeños para después volver a encolarlos entre sí con el fin de obtener algún tipo de sección hueca (Gordon, 1978).
En este sentido, para resolver este problema estructural los árboles emplean un compromiso de diseño, donde las ventajas de tener un material celular para una alta rigidez a flexión específica originan una baja resistencia a compresión, debido a las propiedades tanto de la fibra como de la estructura celular (Jeronimidis, 2008). Sin embargo, este compromiso se puede compensar mediante un crecimiento diferenciado de las distintas partes del tronco, de manera que este queda pretensionado con las capas más externas sometidas a tensiones de tracción para compensar las relativamente bajas propiedades a compresión de la madera (Archer, 1987), como se muestra esquemáticamente en la figura 11.
A este gradiente de tensiones mecánicas en el tronco, con el exterior a tracción y el interior a compresión, se le llama tensiones de crecimiento y puede ser altamente perjudicial para la calidad de la madera, originando deformaciones de flexión y de torsión de tablas y tablones (Plomion et al., 2001) así como agrietamiento transversal de troncos que han sido cortados. En la figura 12 se puede apreciar el uso de grapas transversales y anillos circunferenciales para prevenir el agrietamiento, posterior al corte del tronco, debido a las tensiones de crecimiento.

(A) Árbol bajo la acción del viento sin madera pretensada (distribución lineal de tensiones). (B) Árbol pretensado sin carga de viento (el exterior del tronco a tracción, T, y el interior a compresión), (C) Árbol pretensado bajo la acción del viento: superposición de tensiones de (A) y (B). Adaptado de Gordon (1978)
Figura 11 Pretensión axial de los troncos de los árboles.

Foto: G. Vargas-Silva (2017)
Figura 12 Sistema para prevenir el agrietamiento transversal debido a la liberación de tensiones de crecimiento, mediante el uso de grapas metálicas.
Conclusiones
El presente trabajo trata sobre las principales estrategias estructurales de los árboles, a la luz de la arquitectura vegetal y de las características de crecimiento, anatomía y morfología. Dichas estrategias son las responsables de que, con respecto a otras plantas, los árboles tengan una ventaja competitiva anatómica, morfológica y estructural para aprovechar la energía solar que garantice su crecimiento y su reproducción. Asimismo, los árboles disponen de la madera, que está estructurada jerárquicamente para proporcionar la máxima resistencia con un mínimo de material, que a su vez está reforzado con fibras y material celular (formado por celdas prismáticas). Así, en este trabajo se presenta un compendio de conceptos generales relacionados con las principales estrategias estructurales de los árboles, haciendo énfasis en aspectos asociados con la arquitectura vegetal, la estabilidad mecánica y la disposición del material; así como en las características de crecimiento, anatomía y morfología según las diferentes familias analizadas.











 nueva página del texto (beta)
nueva página del texto (beta)



