Antecedentes
Los insulinomas pertenecen a un grupo heterogéneo de neoplasias denominadas tumores neuroendocrinos (TNE), los cuales derivan embriológicamente de la cresta neural y residen en diversos sitios de los sistemas digestivo y broncopulmonar.1
Estos tumores sintetizan y secretan un gran número de péptidos y aminas, las cuales pueden manifestarse clínicamente en una amplia variedad de síndromes derivados de una sobreproducción de hormas determinadas por la estirpe celular que conforma al tumor; la hipoglucemia es la característica clásica de los insulinomas. Por otra parte, una gran cantidad de pacientes pueden permanecer asintomáticos (tumores no funcionales) y manifestarse clínicamente hasta que el volumen tumoral aumenta y aparecen datos de compresión.1
La incidencia aproximada de los insulinomas es de 1.8 a cinco casos/1,000,000 de habitantes y conforman entre el uno y 2% de todas las neoplasias del páncreas.1-3 Aunque el pico de incidencia ocurre entre los 40 y 69 años de edad, un significativo número de pacientes son diagnosticados antes de los 35 años.4,5 Son también los tumores neuroendocrinos asociados al mejor pronóstico, con porcentajes de supervivencia reportados hasta de 97% a cinco años cuando se trata de lesiones benignas (90% de los insulinomas lo son) y del 30% cuando se trata de lesiones malignas.1,6
Material y métodos
Estudio retrospectivo, observacional, descriptivo y longitudinal, en el cual se analizaron todos los casos de pacientes diagnosticados con tumores neuroendocrinos del páncreas de tipo insulinoma referidos a la Clínica de Cirugía Hepatopancreatobiliar del Hospital General de México en un periodo de seis años, que comprendió desde marzo de 2009 hasta junio de 2015, con un seguimiento de los casos en un rango de entre 12 y 72 meses, con una media de 32.
Resultados
Se encontraron en total siete casos de insulinoma pancreático, todos ellos sometidos a tratamiento quirúrgico con intención curativa.
Características de los pacientes: Se encontró una mayor incidencia en el género femenino, con cinco pacientes, que representaron un 71.5% del total de la muestra. La edad media fue de 40 años, con una mínima de 18 y una máxima de 74. Tres pacientes (42.8%) presentaron comorbilidades al momento del diagnóstico; en todos los casos fue hipertensión arterial sistémica y ninguno de DM2 previa al manejo quirúrgico. Una paciente cursaba con un embarazo de 19.3 semanas de gestación.
Manifestaciones clínicas: El 100% de los pacientes presentaron tumores funcionales con manifestaciones clínicas derivadas de hiperinsulinismo, lo cual orientó al diagnóstico en todos los casos; no hubo ningún diagnóstico incidental por imagenología. Los siete pacientes presentaron la tríada de Whipple de hipoglucemia; los síntomas asociados fueron, en orden de frecuencia, astenia, somnolencia, diaforesis, convulsiones y palpitaciones (Cuadro I).
Cuadro I: Cuadro clínico.
| Astenia | Tríada de Whipple | Somnolencia | Diaforesis | Convulsiones | Palpitaciones | |
|---|---|---|---|---|---|---|
| Pacientes | 7 | 7 | 6 | 5 | 5 | 1 |
| Proporción | 100% | 100% | 85.7% | 71.5% | 71.5% | 14.2% |
Tríada de Whipple: signos clínicos de hipoglucemia que remiten tras la administración de glucosa.
Diagnóstico: A todos los pacientes se les realizó un test bioquímico que incluyó niveles séricos de insulina, glucosa y péptido C, para posteriormente calcularse el índice insulina/glucosa (Cuadro II). Se les hizo también una tomografía de abdomen, donde se logró identificar el tumor primario. En el 100% de los casos se integró el diagnóstico de insulinoma antes del tratamiento quirúrgico. Existió una correlación del 100% entre el diagnóstico preoperatorio de insulinoma y el sitio anatómico del tumor con el resultado del estudio histopatológico posterior a la resección.
Cuadro II: Laboratorios preoperatorios.
| Insulina mcU/ml |
Glucosa mg/dl |
Insulina/glucosa mcU/ml – mg/dl |
Péptido C ng/ml |
|
|---|---|---|---|---|
| Media | 24.7 | 38 | 0.81 | 5.02 |
| Mínima | 5.7 | 32 | 0.7 | 3.4 |
| Máxima | 41.4 | 50 | 1.63 | 10.3 |
| Fuera de rango normal | 5 | 7 | 2 | 7 |
| 71.5% | 100% | 28.5% | 100% |
La localización anatómica del tumor fue, en orden de frecuencia: tres casos en la cola del páncreas (42.8%), dos en la cabeza (28.5%), uno en el cuello (14.2%) y uno en el cuerpo (14.2%) (Cuadro III).
Cuadro III: Cirugías.
| Sitio | Cirugía realizada | Esplenectomía | Tumor | Abordaje | 2a cirugía | Complicaciones | Sangrado | Tiempo | |
|---|---|---|---|---|---|---|---|---|---|
| 1 | Cabeza | Whipple | No | 1.5 cm | Ab | No | No | 730 ml | 9 h |
| 2 | Cola | 1. Enucleación laparoscópica 2. Pancreatectomía distal 60% |
Sí | 2.0 cm | Ab | Sí, por R1 | No | 50 ml | 3 h 5 h |
| 3 | Cuerpo | Pancreatectomía distal | Sí | 1.9 cm | Ab | No | No | 150 ml | 4 h |
| 4 | Cabeza | Enucleación | No | 2.6 cm | Ab | No | No | 30 ml | 4 h |
| 5 | Cola | Pancreatectomía distal | Sí | 2.2 cm | Conv | No | No | 100 ml | 5 h |
| 6 | Cuello | Enucleación | No | 1.6 cm | Lap | No | No | 30 ml | 3 h |
| 7 | Cola | Pancreatectomía distal | Sí | 2.6 cm | Lap | No | No | 145 ml | 5 h |
Ab = cirugía abierta; Lap = cirugía laparoscópica; Conv = laparoscópica convertida a abierta; R1 = enfermedad residual microscópica.
Tratamiento: Tres casos (42.8%) fueron tratados mediante enucleación, con tumores ubicados en distintos segmentos del páncreas (uno en cabeza, uno en cuello y uno en cola), tomándose como criterio de selección una localización periférica (distante al conducto de Wirsung); la enucleación fue exitosa en un 66.6% de los casos (dos pacientes), ya que un paciente requirió posterior pancreatectomía distal por enfermedad residual (Cuadro III).
La cirugía de resección se realizó en cinco pacientes; en cuatro de ellos, como primera intención terapéutica, y en uno, posterior a una enucleación con enfermedad residual R1. El tipo de cirugía se determinó con base en la localización anatómica del tumor, de tal forma que se realizaron cuatro pancreatectomías distales y un procedimiento de Whipple. Se llevó a cabo esplenectomía en cuatro pacientes (57.1%), siendo el criterio para realizarla la localización del tumor (en cuerpo y cola), con compromiso de los vasos esplénicos.
El abordaje fue laparoscópico en tres casos (42.8%); se requirió conversión en uno. No hubo complicaciones transoperatorias. El tiempo quirúrgico promedio fue de 4.7 horas, con un rango de tres a nueve. El sangrado promedio fue de 176 ml, con un mínima de 30 y un máximo de 730 (Cuadro III).
El resultado del estudio histopatológico confirmó el diagnóstico de insulinoma en todas las muestras, con márgenes libres en el 100% (en un caso, inicialmente se reportó R1, por lo que se reintervino en el mismo internamiento; en la segunda pieza quirúrgica se consiguió R0). No se reportó invasión linfovascular en ningún paciente. Se realizó inmunohistoquímica en cinco casos, con un Ki-67 < 2% en cuatro de ellos (G1) y Ki-67 de 6% (G2) en un paciente con tumor < 2 cm, sin invasión linfovascular. Con los datos disponibles, todos los casos se catalogaron como tumores neuroendocrinos bien diferenciados (OMS).
Evolución: Durante el seguimiento intrahospitalario, tres pacientes precisaron observación en el área de terapia intensiva, con una estancia promedio de 4.3 días, con un rango de tres a siete; las causas fueron neumonía (un caso), control metabólico (un caso) y embarazo (un caso). Se presentaron complicaciones postquirúrgicas en un solo paciente (14.3%) debido a infección del sitio quirúrgico, la cual fue resuelta satisfactoriamente con manejo conservador. La media de estancia intrahospitalaria fue de 12 días, con un rango de cinco a 35.
El seguimiento a largo plazo se realizó en un periodo de entre 12 y 72 meses, con una media de 32; en cada consulta se interrogó al paciente y eventualmente se solicitaron controles serológicos y radiológicos. No hubo ninguna defunción y ningún paciente ha presentado datos de recurrencia sintomática, serológica o radiológica. La resolución de los síntomas iniciales de hipoglucemia fue del 100%. Dos casos (28.5%) desarrollaron datos de falla exocrina del páncreas (diabetes mellitus) (Cuadro IV).
Cuadro IV: Evolución.
| Ingreso a UCI | Defunciones | Complicaciones | Reoperaciones* | DM postquirúrgica | Corrección de la hipoglucemia | Recurrencias | |
|---|---|---|---|---|---|---|---|
| Total | 3 | 0 | 1 | 1 | 2 | 7 | 0 |
| Proporción | 42.8% | 0 | 14.2% | 14.2% | 28.5% | 100% | 0 |
* Por enfermedad residual R1.
Discusión
Clasificación y estadificación
En relación con la estirpe histológica, los insulinomas son los TNE pancreáticos más comunes: representan alrededor del 70%, mientras que 15% corresponden a glucagonomas y 10% a gastrinomas, somatostatinomas y, con menor frecuencia, VIPomas.7
Las nuevas clasificaciones proporcionan un gran énfasis al grado de diferenciación histológica del fenotipo neoplásico, reconociéndose tres grados: bajo (G1), intermedio (G2) y alto (G3), de tal forma que con base en el grado del tumor se puede establecer la probabilidad de malignidad (Cuadro V).2,8,9
Cuadro V: Sistema de estratificación tumoral propuesta por la Sociedad Europea de Tumores Neuroendocrinos.
|
Índices |
Grados | ||
|---|---|---|---|
| G1 (grado bajo) | G2 (grado intermedio) | G3 (grado alto) | |
| Mitótico | < 2 mitosis* | 2-20 mitosis | > 20 mitosis |
| Ki-67 | < 2% | 3-20% | ˃ 20% |
* Número de mitosis en 10 campos de alto poder. Ki-67 = índice de proliferación celular.
En el año 2000, la OMS propuso una clasificación basada en el índice mitótico, el tamaño del tumor y la invasión vascular; con base en estas características, se puede predecir el comportamiento del tumor (Cuadro VI):2,8,9
Cuadro VI: Clasificación de los TNE según la OMS 2010.
| Tumor neuroendocrino bien diferenciado | Carcinoma neuroendocrino bien diferenciado | Carcinoma neuroendocrino mal diferenciado | ||
|---|---|---|---|---|
| Comportamiento benigno | Comportamiento incierto | |||
| Tumor | < 2 cm | > 2 cm | Invasión local | Células pequeñas |
| Mitosis | < 2 mitosis* | > 2 mitosis | > 10 mitosis | > 20 mitosis |
| Ki-67 | < 2% | > 2% | > 5% | >15% |
| Invasión vascular | Sin invasión vascular | Invasión vascular | Invasión vascular y metástasis | Invasión vascular y perineural |
* Número de mitosis en 10 campos de alto poder. Ki-67 = índice de proliferación celular.
Tumor neuroendocrino bien diferenciado de comportamiento benigno.
Tumor neuroendocrino bien diferenciado de comportamiento incierto.
Carcinoma neuroendocrino bien diferenciado (tumor carcinoide típico).
Carcinoma neuroendocrino mal diferenciado (tumor carcinoide atípico).
En la actualidad se ha adoptado el sistema TNM para la clasificación de los TNE gastrointestinales por estadios con base en el tamaño e invasividad del tumor, el compromiso linfático y la presencia de metástasis.2
Diagnóstico
La sospecha diagnóstica varía con base en la funcionalidad del tumor; los tumores funcionales se manifiestan con hipoglucemia derivada del hiperinsulinismo endógeno, mientras que los tumores no funcionales se diagnostican, por lo general, de forma incidental mediante estudios de imagen o por compresión biliar y/o al tubo digestivo secundaria al volumen de la lesión.
La insulina sérica, proinsulina y el péptido C deben solicitarse en todos los casos.10 Niveles de insulina mayores a 6 mcIU/ml, péptido C mayor a 0.6 ng/ml, proinsulina mayor a 5 mcIU/l, glucosa capilar menor a 55 mg/dl y una relación insulina/glucosa < 0.3 sugieren fuertemente la presencia de estos tumores.10
Una vez sospechado el diagnóstico por serología, se debe buscar la lesión primaria, para lo cual se sugiere realizar en todos los pacientes una tomografía axial computarizada (TAC) del abdomen con cortes finos, simple y contrastada (Figura 1), o en su defecto, una resonancia magnética (RM). La centellografía con somatostatina (CS) y el ultrasonido endoscópico (UE) (Figura 2) pueden ser apropiados en casos de duda diagnóstica, con una sensibilidad del 82 al 90% para este último método de imagen.11
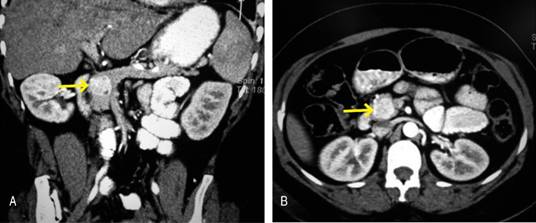
Figura 1: A y B. Tomografía axial contrastada en la cual se observa una tumoración en la cabeza del páncreas con dimensiones de 2.6 x 2.4 cm, de morfología redondeada y bordes regulares, interfaces conservadas y con realce heterogéneo tras la administración del medio de contraste.

Figura 2: Ultrasonido endoscópico pancreático en el cual se observa un tumor correspondiente a insulinoma, con dimensiones de 2.2 x 2.1 cm, con relación estrecha hacia la vena porta.
En pacientes con lesiones recurrentes o cuando otros métodos de localización han sido equívocos, se puede realizar una inyección selectiva de calcio en las arterias pancreáticas, y posteriormente, medir los niveles de insulina en la vena hepática derecha o izquierda (procedimiento de Imamura-Doppman).12
A raíz del consenso de la ENETS (European Neuroendocrine Tumor Society),13 se sugiere que ante hallazgos por imagen sospechosos de un TNE en pacientes asintomáticos, se realice un test de sinaptofisina, polipéptido pancreático y cromogranina A.2 Esta última se ha utilizado como un marcador diagnóstico y pronóstico, ya que se eleva en un 60% de los casos de insulinomas;14,15 cifras mayores al doble de lo normal se asocian a una pobre supervivencia16 y mala respuesta al manejo con everolimus.17
En todos los pacientes se debe realizar un interrogatorio personal y familiar intencionado para búsqueda de neoplasia endocrina múltiple (NEM) 1,18 por un 5% de asociación a este síndrome.
Tratamiento
Con independencia del grado histológico y potencial maligno, prácticamente todos los insulinomas deben ser resecados debido a las complicaciones metabólicas que suelen acompañarlos.2
Con base en el hecho de que, por lo general, tienen un comportamiento benigno, el tratamiento de elección para los tumores primarios de localización periférica sin sospecha de malignidad y menores a dos centímetros es la enucleación, siempre y cuando se encuentren a una distancia prudente del conducto pancreático principal (Figura 3).2 Este procedimiento puede ser realizado por laparoscopia o por cirugía abierta para tumores únicos y localizados. Si la enucleación no es posible, se deberá llevar a cabo una resección quirúrgica, la cual consistirá en una duodenopancreatectomía cefálica (procedimiento de Whipple) para tumores localizados en la cabeza o cuello del páncreas, o bien, una pancreatectomía distal para tumores de cuerpo y cola (Figura 4).
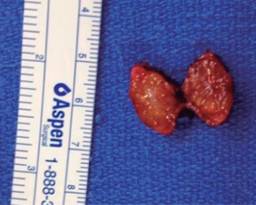
Figura 3: Pieza quirúrgica posterior a la enucleación por insulinoma, de color pardo rojizo y con bordes bien delimitados.
Cuando se sospeche de una lesión benigna, se deberá procurar conservar el bazo; en cambio, si la lesión sugiere malignidad o el tumor compromete los vasos esplénicos, se habrá de realizar una esplenectomía.
En los casos de “incidentalomas” (tumores no funcionales diagnosticados incidentalmente por estudios de imagen), se puede optar por un manejo conservador y vigilancia en casos seleccionados,19 teniendo como criterio un volumen tumoral en un rango de entre uno y tres centímetros, según diferentes autores;20 ante esta ambigüedad, las guías del NCCN2 (National Comprehensive Cancer Network) sugieren, con un bajo nivel de evidencia, que el tamaño máximo debe ser de un centímetro. Ante tumores entre uno y dos centímetros, recomiendan ya sea la enucleación o la resección quirúrgica asegurando márgenes negativos, y ante tumores de dos centímetros o mayores, realizar, además una linfadenectomía por un pequeño pero real riesgo de metástasis.2
En caso de enfermedad metastásica limitada al hígado, una resección quirúrgica del tumor primario y una metastasectomía pueden ser consideradas con intenciones curativas en pacientes seleccionados, ya sea en cirugía de uno o dos tiempos,2 con una supervivencia reportada en un rango entre 41 y 100%.21 Una cirugía citorreductora no curativa puede, además, ser contemplada para algunos pacientes a fin de reducir la producción de hormonas y paliar los síntomas.2
El trasplante hepático se ha realizado en pacientes con metástasis no resecables y confinadas al hígado,22 aunque la mayoría de ellos finalmente desarrolló recurrencias;23 la evidencia actual no permite recomendarlo como una conducta estandarizada.2
Para los casos de tumores no candidatos a resección, se podrá considerar el uso de terapia sistémica, para la cual se dispone de análogos de la somatostatina (octreotide de acción prolongada y lanreotide), quimioterapia (5 fluorouracilo, capecitabine, dacarbazine, oxaliplatino, estreptozocina y temozolomide), terapia blanco (everolimus y sunitinib), interferones, entre otras opciones.2
Seguimiento
La duración óptima de la vigilancia es desconocida, pero se sabe que la mayoría de las recurrencias se aprecian en los primeros dos años, y todas las que se han reportado han sido en un periodo máximo de 10 años.24 Tampoco se ha logrado determinar el intervalo ideal entre revisiones; se sugieren rangos de entre tres y 12 meses en función del estado del paciente y del estatus -benigno o maligno- de la enfermedad.2 El seguimiento requiere de marcadores séricos en todos los casos y eventuales estudios de imagen (TAC o RM).
Conclusiones
Los insulinomas son los tumores neuroendocrinos del páncreas más frecuentes y los que se asocian a un mejor pronóstico. La expresión clínica de estas lesiones es resultado de la sobreproducción de insulina, la cual se traduce en hipoglucemia. Un diámetro mayor a dos centímetros y un alto índice de mitosis son los mayores indicadores de enfermedad maligna. La mayoría de los insulinomas deberán ser tratados con intención curativa, incluso en lesiones sugerentemente benignas; esto por los desórdenes hormonales que con frecuencia acompañan a estos tumores. La enucleación deberá ser la primera opción a considerar, aunque no todos los pacientes son candidatos a ella, seguida de resecciones quirúrgicas, cuya extensión estará en función de la localización del tumor. Otras opciones de manejo incluyen cirugías citorreductoras, metastasectomías, uso de quimioterapia, terapia blanco y análogos de la somatostatina.











 nueva página del texto (beta)
nueva página del texto (beta)



