Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
Compartir
Revista Chapingo. Serie horticultura
versión On-line ISSN 2007-4034versión impresa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.29 no.2 Chapingo may./ago. 2023 Epub 04-Dic-2023
https://doi.org/10.5154/r.rchsh.2022.05.008
Artículos científicos
Hongos micorrízicos y fertilización fosfatada en la preparación de plántulas de portainjertos de vid ‘IAC-766’ Campinas
1 Federal University of Paraná, Post-Graduate Program in Agronomy-Plant Production, Dept. of Crop Production, Rua dos Funcionários, 1540 Bairro, Juvevê, Curitiba, Paraná, C. P. 80210-170, BRAZIL.
2 Tuiuti University of Paraná, Program in Agronomy. Rua Sydnei Antonio Rangel Santos, 238 - Santo Inacio, Curitiba, Paraná, C. P. 82010-330, BRAZIL.
3 Nacional Agraria La Molina, Faculty of Agronomy. Av. La Universidad s/n, La Molina, Apartado 456, Lima, C. P. 12, PERÚ.
Los hongos micorrícicos arbusculares (HMA) son microorganismos benéficos que forman simbiosis con la vid, al mostrar mejoras favorables en el crecimiento y nutrición de las plántulas tras su enraizamiento. El objetivo de este trabajo fue evaluar los efectos de la inoculación de especies de HMA y de la fertilización fosfatada sobre estacas enraizadas de portainjertos de vid en invernadero. Se prepararon estacas leñosas de portainjertos de vid ‘IAC-766’ Campinas para promover el enraizamiento. Después de 45 días, las estacas se trasplantaron y se sometieron a diferentes tratamientos que consistieron en la inoculación de especies de HMA y la fertilización con dos dosis de fósforo (superfosfato simple), más el testigo. Los tratamientos se distribuyeron de acuerdo con un diseño completamente al azar con ocho repeticiones por cada tratamiento. Después de 90 días, se evaluaron los parámetros de crecimiento, el contenido de macro- y micronutrientes (brote y raíz), la colonización de las raíces y el efecto micorrícico de los nutrientes extraídos. La inoculación con especies de HMA influyó en los parámetros de crecimiento, la colonización radicular, y la extracción de macro- y micronutrientes de las estacas de portainjertos ‘IAC-766’, especialmente la inoculación con especies del género Acaulospora, ya sea individualmente o asociadas. La fertilización fosfatada afectó a los parámetros de crecimiento y a la extracción de macro- y micronutrientes, pero en menor medida que la observada con la inoculación de especies de HMA.
Palabras clave: varetas; microorganismos; inoculación; nutrientes; crecimiento
Arbuscular mycorrhizal fungi (AMF) are beneficial microorganisms that form symbioses with vines, showing improvements favorably in the growth and nutrition of seedlings after rooting them. This work aimed to evaluate the effects of AMF species inoculation and phosphate fertilization on rooted cuttings of vine rootstocks in a greenhouse. Woody rootstock cuttings from ‘IAC 766’ Campinas vines were prepared to promote rooting. After 45 days, the cuttings were transplanted and subjected to treatments that consisted of the inoculation of different species of AMF and fertilization with two doses of phosphorus (simple superphosphate) plus the control. The treatments were randomly assigned following a completely randomized design with eight replications for each treatment. After 90 days, growth parameters, macro and micronutrient content (shoot and root), root colonization and mycorrhizal effect of the extracted nutrients were evaluated. The inoculation with AMF species influenced the growth parameters, root colonization and extraction of macro and micronutrients from the cuttings of the 'IAC 766' rootstock, highlighting the inoculation with species of the genus Acaulospora, either individually or associated. Phosphorous fertilization affected growth parameters and extraction of macro and micronutrients, but these were to a lesser degree compared to that verified by the inoculation of AMF species.
Keywords: cuttings; microorganisms; inoculation; nutrients; growth
Introducción
La vid forma simbiosis con microorganismos conocidos como hongos micorrícicos arbusculares (HMA) (Eftekhari, Alizadeh, Mashayekhi, Asghari, & Kamkar, 2010; Trouvelot et al., 2015), que son benéficos para el desarrollo y la salud de las plantas (Bhat et al., 2017). Estos microorganismos favorecen la absorción de agua y nutrientes minerales del suelo por parte de la planta y esto, a su vez, les proporciona carbono y otras sustancias esenciales (Ortas, Rowell, & Harris, 2004; Rouphael et al., 2015; Begum et al., 2019).
En la viticultura brasileña, el portainjertos ‘IAC-766’ (Ripária do Traviú x Vitis caribaea), también conocido como ‘Campinas’, es el más utilizado, ya que se adapta a diferentes condiciones ambientales, es resistente a plagas y enfermedades, tiene buena tasa de cuajado de fruto y alto vigor vegetativo (Souza, Mota, Cardozo, Pimentel, & Regina, 2015; Silva et al., 2019; Cardoso-Campos et al., 2020), además de presentar excelente rendimiento y calidad de la uva (Nuzzo & Mathews, 2006).
En años recientes, ha incrementado notablemente el método de propagación de portainjertos de vid mediante estacas leñosas en contenedores, para obtener plántulas injertadas en menor tiempo para su posterior trasplante en campo definitivo (Ollat et al., 2016; Grohs, Almança, Fajardo, Halleen, & Miele, 2017).
El portainjertos influye, en gran medida, en el estado nutricional de la vid en relación con factores como la estructura del suelo y las necesidades nutricionales (Trouvelot et al., 2015; Zhang, Marguerit-Jacob, Rossdeutsch, Ollat, & Gambetta, 2016); además, afecta la alta capacidad de absorción y la posibilidad de reducir la aplicación de nutrientes (Keller, Kummer, & Vasconcelos, 2001). En este sentido, la colonización de las raíces de plantas en pleno crecimiento con HMA, principalmente en suelos con bajos niveles de fertilidad, favorece significativamente la absorción de nutrientes como el fósforo (P) (Smith & Read, 2008; Chatterjee & Franzen, 2020). De igual manera, es importante inocular con HMA al inicio de la preparación de plántulas, para asegurar los beneficios de la simbiosis en esta etapa y durante el periodo de aclimatación (Silva, Melo, & Yano-Melo, 2017; Begum et al., 2019; Diagne et al., 2020). Asimismo, los suelos con presencia significativa de P pueden favorecer la cantidad y diversidad de especies de HMA (Mahecha-Vásqueza, Sierrab, & Posada, 2007; Vilcatoma-Medina et al., 2021).
La preparación de portainjertos inoculados con HMA, aunado a una fertilización equilibrada con P en invernadero, puede ser una alternativa viable y rentable para la producción de plántulas de vid de buena calidad. Por lo tanto, el objetivo de este estudio fue evaluar el efecto de la inoculación de especies de HMA y la fertilización con fósforo en estacas enraizadas de portainjertos de vid ‘IAC-766’ en invernadero.
Materiales y métodos
El estudio se realizó en un invernadero ubicado en el Sector de Ciencias Agrícolas de la Universidad Federal de Paraná - UFPR, Curitiba-PR (25° 25’ 47’’ S y 49° 16’ 19’’ O, a 950 m s. n. m.).
El 15 de noviembre de 2018 se recolectaron estacas leñosas de 15 a 20 cm de longitud y 5.8 mm de diámetro, a partir de portainjertos de vid ‘IAC-766’ Campinas de cuatro años, en el Centro Experimental Estación Canguiri de la UFPR (Pinhais -PR) (25° 23’ 42’’ S y 49° 08’ 12’’ O, a 950 m s. n. m.). Las estacas se colocaron en tubos de plástico de 133 cm3, los cuales contenían un sustrato de vermiculita de textura media para promover el enraizamiento. Los portainjertos se mantuvieron durante 45 días en invernadero con riego manual cada 24 h. Tras el enraizamiento, los portainjertos se trasplantaron a bolsas de plástico de 3 L que contenían una mezcla de sustrato comercial basado en corteza de pino bioestabilizada (Mecplant Brasil) + arena lavada (1:1), para la aplicación de los tratamientos.
Se utilizó un diseño completamente al azar con ocho repeticiones por tratamiento, lo cual dio un total de 80 bolsas de plástico. Los tratamientos consistieron en incorporar y mezclar 30 g de material con diferentes especies de HMA (Gigaspora margarita, Gigaspora margarita + Dentiscutata heterogama, Dentiscutata heterogama, Rhizophagus intraradices, Acaulospora colombiana, Acaulospora colombiana + Acaulospora scrobiculata y Acaulospora scrobiculata), dos dosis de fertilización fosfatada (12.5 y 25 mg·kg-1 de P2O5, superfosfato comercial simple) y el testigo.
Se multiplicaron inóculos de especies de HMA sobre Brachiaria (Brachiaria decumbens) en macetas de 5 L, bajo las condiciones del invernadero DFF y con riego manual cada 48 h. El sustrato utilizado fue una mezcla de arena lavada y vermiculita de textura media (1:1), previamente esterilizada en autoclave a 120 °C durante dos periodos de 1 h, con un intervalo de 24 h.
Después de 90 días de inoculación y fertilización de las estacas de portainjertos, se evaluó la altura de la plántula (A), el diámetro del tallo basal a 5 cm de la superficie del sustrato (D), la longitud de la raíz más grande (LR), el peso fresco de brotes (PFB) y raíces (PFR), y el peso seco de brotes (PSB) y raíces (PSR).
El análisis de macro- y micronutrientes se realizó en el Laboratorio de Nutrición Vegetal, en el Departamento de Suelos e Ingeniería Agrícola de la UFPR, conforme a la metodología adaptada de Martins y Reissmann (2007). Se utilizaron aproximadamente 0.5 g de material y se incineraron en crisoles de porcelana en una mufla a 500 °C durante 4 h. Posteriormente, se añadieron 10 mL de HCl 3 mol·L-1 y los crisoles se dejaron durante 10 min en una parrilla a 70 °C. Transcurrido este tiempo, las soluciones de digestión se pasaron por un papel filtro (con diámetro de poro de 8 µm) y los extractos se recogieron en matraces de 50 mL. Para aforar los matraces se utilizó agua desionizada. En los extractos obtenidos se determinó P, K, Ca, Mg, Fe, Cu, Mn y Zn, mediante un espectrofotómetro de emisión óptica de plasma acoplado inductivamente (ICP-OES, por sus siglas en inglés) (720-ES, Varian, EUA).
Para evaluar la colonización micorrícica, se seleccionaron las raíces más delgadas y se mantuvieron en KOH al 10 % durante 24 h, después de ser tratadas en baño María a 80 °C durante 1 h. Posteriormente, se blanquearon añadiendo H2O2, se lavaron y se tiñeron con tinta de bolígrafo azul y se mantuvieron de nuevo en un baño María durante 5 min más, momento en el que se aplicó lactoglicerol. Para el recuento de la colonización micorrícica, las raíces se colocaron en una placa cuadrada de 1x1 cm con ayuda de un microscopio estereoscópico, según la metodología descrita por Giovanetti y Mosse (1980).
Las variables evaluadas (parámetros de crecimiento, macro- y micronutrientes, y el porcentaje de colonización radicular) se sometieron a un análisis de varianza y, cuando hubo un efecto significativo, una comparación de medias de Tukey (P ≤ 0.05). Estas variables explicativas también se sometieron a análisis de correlación y de componentes principales (ACP), mediante el programa estadístico R (R Core Team, 2018).
Resultados y discusión
De acuerdo con los resultados del Cuadro 1, la mayoría de los parámetros de crecimiento del portainjertos ‘IAC-766’ mostraron diferencias significativas cuando las raíces se inocularon con HMA y se fertilizaron con P2O5. Únicamente el diámetro del tallo no se vio influido por los tratamientos.
Cuadro 1 Parámetros de crecimiento de estacas enraizadas de portainjertos de vid ‘IAC-766’ inoculadas con hongos micorrícicos arbusculares (HMA) o fertilización fosfatada (Curitiba, Brasil).
| Tratamientos | Altura | Longitud de raíz | Diámetro (mm) | Peso fresco | Peso seco | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| Brote | Raíz | Brote | Raíz | |||||||
| cm | g·plántula-1 | |||||||||
| G. margarita | 59.8 efz | 43.0 cd | 3.0 ns | 27.8 gh | 26.3 e | 7.3f g | 7.0 ef | |||
| G. margarita + D. heterogama | 67.0 de | 44.6 cd | 3.5 | 29.9 efg | 27.9 de | 7.7 ef | 7.6 d | |||
| D. heterogama | 61.2 ef | 44.0 cd | 3.5 | 28.4 fgh | 27.6 de | 7.4 f | 7.4 de | |||
| R. intraradices | 72.6 cd | 45.0 bcd | 3.1 | 30.9 def | 28.5 cde | 8.0 def | 7.6 d | |||
| A. colombiana | 87.4 ab | 49.8 b | 3.4 | 35.3 bc | 30.7 bc | 8.9 c | 8.2 c | |||
| A. colombiana + A. scrobiculata | 89.4 a | 56.6 a | 3.5 | 36.8 b | 32.2 ab | 11.5 b | 8.6 b | |||
| A. scrobiculata | 96.0 a | 58.8 a | 3.6 | 41.5 a | 34.0 a | 13.7 a | 9.1 a | |||
| 12.5 P2O5 | 79.4 bc | 46.2 bc | 3.6 | 33.0 cd | 28.7 cd | 8.7 cd | 7.7 d | |||
| 25 P2O5 | 80.6 bc | 46.6 bc | 3.3 | 32.7 cde | 28.2 de | 8.2 cde | 7.6 d | |||
| Testigo | 57.8 f | 40.6 d | 3.2 | 26.1 h | 26.2 e | 6.6 g | 6.8 f | |||
zMedias con la misma letra dentro de cada columna no difieren estadísticamente (Tukey, P ≤ 0.05). ns = no significativa.
La altura presentó diferencias significativas entre los tratamientos, donde sobresalieron los tratamientos con A. scrobiculata (96.0 cm) y A. colombiana + A. scrobiculata (89.4 cm), aunque sin diferencias respecto a A. colombiana. Asimismo, la LR mostró diferencias significativas con las mismas especies, A. scrobiculata (58.8 cm) y A. colombiana + A. scrobiculata (56.6 cm). En cuanto al PF y PS, del brote (B) y la raíz (R), el tratamiento con A. scrobiculata presentó los valores más altos, excepto para PFR, donde la misma especie (34.0 g) no difirió significativamente de A. colombiana + A. scrobiculata (32.2 g) (Cuadro 1).
La inoculación de especies de HMA y la fertilización fosfatada favorecieron el crecimiento de las estacas enraizadas del portainjertos ‘IAC-766’, diferenciándose del testigo en cuanto a parámetros de crecimiento, presencia de macro- y micronutrientes, y colonización de las raíces. Además de los resultados positivos obtenidos en el presente estudio, los efectos benéficos de la inoculación de HMA en la preparación de plántulas de vid vigorosas y sanas fueron destacados previamente por varios investigadores (Aguín, Mansilla, Vilariño, & Sainz, 2004; Caglar & Bayram, 2006; Camprubí et al., 2008; Ozdemir et al., 2010; Ambrosini et al., 2015).
En el presente estudio, y en términos generales, las especies del género Acaulospora destacaron, tanto individualmente como en combinación, en las evaluaciones realizadas en comparación con el resto de los tratamientos. El efecto positivo de la inoculación de especies de este género fue confirmado por Meyer, Botha, Valentine, Archer y Louw (2005), y Ambrosini et al. (2015). Dichos autores reportan mejoras en la colonización radicular en plantaciones comerciales con diferentes portainjertos en el cultivar Merlot y en vides jóvenes sometidas a altos niveles de Cu, respectivamente.
De acuerdo con los resultados obtenidos, otra especie de micorriza que merece ser destacada en el presente trabajo es Rizophagus intraradices, la cual promovió un efecto benefico en el crecimiento y el porcentaje de colonización en los portainjertos. Esta respuesta es similar a la observada por Ambrosini et al. (2015) y Rosa et al. (2016), con especies de R. clarus sometidas a altos niveles de Cu sobre portainjertos ‘Paulsen 1103’, y Rosa et al. (2020) con R. irregularis sobre portainjertos norteamericanos en sustrato comercial (arcilla expandida). Los resultados obtenidos muestran que las especies de dicho género interactúan favorablemente en los diferentes portainjertos y obtienen una amplia adaptabilidad a diferentes condiciones ambientales, por lo que se han producido comercialmente por más de dos décadas (Hijri, 2016; Fracasso, Telò, Lanfranco, Bonfante, & Amaducci, 2020).
En general, la inoculación de especies de HMA en portainjertos ‘IAC-766’ mejoró la A, LR, PF y PS, tanto en brotes como en raíces. Los resultados del presente estudio coinciden con los obtenidos por Agostini y Souza (2003), y Anzanello, Souza y Casamali (2011), con inoculaciones de especies de los géneros Glomus y Scutellopora sobre portainjertos de vides Paulsen 1103, 101-14, SO4 y 043-43. Se han reportado respuestas similares con portainjertos de otros cultivos, como durazno y cítricos, con inoculaciones de Glomus clarum, Glomus etunicatum y Acaulospora sp. (Nunes, Souza, Marodin, & Fachinello, 2008; Back, Reith, Giuliani, & Souza, 2017).
Las diferencias muestran que los HMA contribuyeron al aumento de la arquitectura del sistema radicular, como la LR, con lo cual se aceleró el crecimiento en altura y área foliar de los portainjertos, lo que permite mayores áreas fotosintéticas y, en consecuencia, un mayor nivel de producción de fotoasimilados y acumulación de biomasa (Wu, Zou, Liu, & Lu, 2012; Wu, Zou, & Huang, 2013; Wright, Scholes, & Read, 1998). El comportamiento entre los actores se interpreta como especificidad funcional, ya que existe compatibilidad entre los simbiontes (Lindermann & Davis, 2001; Locatelli & Lovato, 2002; Silveira, Souza, & Koller, 2002).
En general, en el Cuadro 2 se observan diferencias significativas en las concentraciones de macro- y micronutrientes en los portainjertos después de 90 días de la inoculación con HMA y la fertilización fosfatada. Cuando se inoculó con el género Acaulospora, el mayor valor medio de P se obtuvo en el brote (16.6 mg·kg-1), mientras que en la raíz la presencia de este elemento fue mayor cuando se fertilizó con la dosis más alta de P2O5 (20.9 mg·kg-1), seguida de la dosis más baja de fósforo aplicada. Entre las especies inoculadas, la mayor concentración de dicho nutriente en raíz se obtuvo con D. heterogama, sin diferencias significativas con A. scrobiculata. Para el K, los promedios más altos, tanto en brotes como en raíces, se obtuvieron con la inoculación de A. scrobiculata y R. intraradices, respectivamente. Por último, el Ca y el Mg presentaron medias más altas, tanto en brote como en raíz, cuando se inoculó con especies del género Gigaspora y se fertilizó con la dosis más baja de P.
Cuadro 2 Macronutrientes y micronutrientes presentes en brotes y raíces de estacas enraizadas de portainjertos de vid ‘IAC-766’ inoculados con hongos micorrícicos arbusculares (HMA) o fertilización fosfatada (Curitiba, Brasil).
| Tratamientos | P | K | Ca | Mg | Fe | Cu | Mn | Zn | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| mg·kg-1 | ||||||||||||||||
| Brote | Raíz | Brote | Raíz | Brote | Raíz | Brote | Raíz | Brote | Raíz | Brote | Raíz | Brote | Raíz | Brote | Raíz | |
| G. margarita | 6.2 fz | 14.7 f | 4.6 g | 4.1 f | 2.7 c | 1.3 b | 1.3 a | 2.0 a | 30.0 a | 56.5 f | 1.4 de | 3.6 b | 6.5 e | 10.5 d | 4.1 e | 7.6 b |
| G. margarita + D. heterogama | 5.0 g | 16.3 de | 5.1 ef | 6.1 cd | 3.4 a | 0.9 cd | 1.3 a | 2.0 a | 19.9 e | 63.1 d | 1.3 ef | 2.6 cd | 8.1 b | 9.2 e | 5.1 cd | 5.3 e |
| D. heterogama | 7.7 e | 16.8 c | 5.0 ef | 6.3 c | 2.5 c | 0.9 cd | 1.0 bc | 1.8 ab | 22.4 c | 73.2 a | 1.6 cd | 1.8 f | 5.1 g | 9.4 e | 4.3 e | 5.0 ef |
| R. intraradices | 7.9 e | 14.6 f | 4.9 fg | 8.0 a | 3.2 ab | 0.8 d | 1.2 ab | 1.6 bc | 17.2 f | 45.7 i | 1.6 cd | 1.9 ef | 6.3 e | 6.5 g | 4.3 e | 9.1 a |
| A. colombiana | 11.0 d | 13.5 g | 7.0 c | 6.7 b | 2.6 c | 0.8 cd | 0.8 c | 1.2 d | 21.9 d | 27.1 j | 1.8 c | 3.7 b | 3.9 h | 4.4 h | 5.1 d | 7.3 b |
| A. colombiana + A. scrobiculata | 16.6 a | 15.9 e | 5.3 e | 5.9 d | 2.7 c | 1.0 bcd | 1.2 ab | 1.4 cd | 23.2 b | 51.9 h | 4.1 a | 2.1 ef | 8.6 a | 8.1 f | 6.6 a | 4.9 f |
| A. scrobiculata | 16.3 ab | 16.6 cd | 10.0 a | 4.2 f | 2.6 c | 1.2 bc | 1.2 ab | 1.9 ab | 23.1 b | 64.5 c | 2.9 b | 4.4 a | 6.3 e | 8.3 f | 5.4 c | 6.4 d |
| 12.5 P2O5 | 15.8 b | 18.6 b | 7.6 b | 2.5 g | 1.5 e | 1.9 a | 1.4 a | 1.9 ab | 13.9 i | 58.8 e | 1.0 f | 2.9 c | 7.3 c | 21.1 b | 6.0 b | 6.8 c |
| 25 P2O5 | 13.6 c | 20.9 a | 6.3 d | 4.2 f | 1.9 d | 1.4 b | 0.9 c | 2.1 a | 15.8 g | 53.6 g | 2.6 b | 2.2 de | 5.7 f | 25.9 a | 4.0 e | 4.5 g |
| Testigo | 4.8 g | 12.1 h | 7.7 b | 5.0 e | 3.0 b | 1.9 a | 1.2 ab | 2.0 a | 14.3 h | 71.9 b | 1.0 f | 3.5 b | 6.9 d | 16.1 c | 3.6 f | 6.2 d |
zMedias con la misma letra dentro de cada columna no difieren estadísticamente (Tukey, P ≤ 0.05).
En cuanto a los micronutrientes, la mayor presencia de Fe en el brote ocurrió con G. margarita, y en la raíz, con D. heterogama. Para el Cu, los promedios más altos, tanto en el brote como en la raíz, fueron los tratamientos con Acaulospora. En el caso del Mn, el promedio más alto en el brote se obtuvo cuando se inoculó con una mezcla de especies del género Acaulospora, y en la raíz fue cuando se fertilizó con la dosis más alta de P. Finalmente, también se detectaron concentraciones más altas de Zn en el brote cuando se inoculó con una mezcla de especies del género Acaulospora, y en la raíz cuando se inoculó con R. intraradices.
El tiempo que duró el experimento fue suficiente para demostrar el incremento de macro- y micronutrientes en los brotes y las raíces de portainjertos ‘IAC-766’ en presencia de especies de HMA, que es similar a lo ocurrido en las estacas de vid del cultivar Cabernet Sauvignon inoculadas con Claroideoglomus etunicatum y Entrophospora infrequens (Coutinho, Silva, & Yano-Melo, 2017). En los estudios realizados por Alarcón, González-Chávez, Ferrera-Cerrato y Villegas-Monter (2001), y Anzanello et al. (2011), con el doble de duración del presente experimento, se reportó un aumento significativo en la absorción de macro- y micronutrientes en diferentes portainjertos inoculados con Glomus fasciculatum, G. etunicatum y Scutellospora heterogama, respectivamente. De acuerdo con Agostini y Souza (2003), el efecto de los HMA sobre los portainjertos de vid en un periodo breve no les permite expresar todo su potencial.
En la Figura 1, se puede observar que el porcentaje de colonización radicular del portainjertos ‘IAC-766’ se favoreció con la inoculación de las cinco especies de HMA, y el valor más alto de esta variable (53 %) se obtuvo cuando se asociaron las especies del género Acaulospora (AC + ASC).
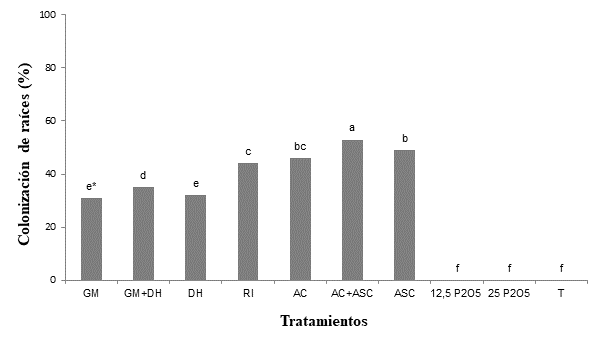
Figura 1 Colonización de estacas de portainjertos de vid ‘IAC-766’ enraizadas e inoculadas con hongos micorrícicos arbusculares (HMA) o fertilización fosfatada (Curitiba, Brasil). GM = Gigaspora margarita; DH = Dentiscutata heterogama; RI = Rizophagus intraradices; AC = Acaulospora colombiana; ASC = Acaulospora scrobiculata; 12.5 P2O5 = 12.5 mg·kg-1 P2O5; 25 P2O5 = 25 mg·kg-1 P2O5; T = testigo. *Barras con la misma letra no difieren estadísticamente (Tukey, P ≤ 0.05).
Los hongos colonizaron las raíces de los portainjertos ‘IAC-766’; sin embargo, las especies del mismo género tuvieron comportamientos diferentes al ser inoculadas individualmente o mezcladas. Respuestas similares fueron observadas por Alarcón et al. (2001), Agostini y Souza (2003), y Rosa et al. (2016), quienes, al evaluar diferentes portainjertos, obtuvieron una alta colonización de raíces. Por otro lado, Nunes et al. (2008) y Back et al. (2017), al evaluar portainjertos de otros cultivos, reportaron una colonización radicular de casi 100 %. Dichas diferencias en la intensidad de colonización radicular también fueron descritas por Silveira et al. (2002), como consecuencia del grado de afinidad entre las plántulas y las especies de HMA.
La Figura 2 muestra la matriz de correlaciones que existen entre las medias de los tratamientos sobre el porcentaje de colonización, los parámetros de crecimiento, y el contenido de macro- y micronutrientes en los portainjertos enraizados hasta los 90 días. Se comprobó que existe una correlación positiva entre LR, PFB, PSB, PFR, PSR y A. Asimismo, los micronutrientes Zn y Cu del brote tuvieron una correlación positiva con la mayoría de los parámetros de crecimiento; mientras que el porcentaje de colonización radicular (% Col) tuvo una correlación positiva alta con el Fe en el brote (FeB).

Figura 2 Matriz de correlación de las medias de los tratamientos en el porcentaje de colonización de la raíz, los parámetros de crecimiento, la presencia de macro- y micronutrientes en estacas enraizadas de portainjertos ‘IAC-766’ inoculadas con especies de hongos micorrícicos arbusculares (HMA) o fertilizados con fósforo (Curitiba, Brasil).
Como se observó en los resultados, los HMA confieren mayor vigor a los portainjertos ‘IAC-766’, lo cual se reflejó positivamente en la correlación de los parámetros de crecimiento. Por lo tanto, se podría decir que los portainjertos mostraron una dependencia micorrícica moderada, ya que los microorganismos facilitaron la absorción de los nutrientes que contenía el sustrato utilizado en el experimento. Esto fue demostrado por Schreiner (2003), quien evaluó diferentes portainjertos injertados con un clon de Pinot Noir en campo definitivo y obtuvo rendimientos altos en cultivos con dosis moderadas de nutrientes, especialmente P. El crecimiento de la vid depende fuertemente de los HMA en determinados tipos de suelos, y el incremento en los parámetros de crecimiento se debe, principalmente, a una mayor absorción de P y otros nutrientes (Schreiner, 2007). Asimismo, Nogueira y Nogueira-Cardoso (2006), y Miranda, Mello y Kupper (2018) obtuvieron resultados similares al inocular especies del género Glomus en portainjertos de limón Rangpur (Citrus limonia) con bajas concentraciones de P en los sustratos.
Los resultados del ACP, basado en el orden entre parámetros de crecimiento, la presencia de macro- y micronutrientes, y el porcentaje de colonización de las estacas enraizadas con las especies inoculadas con HMA y fertilización fosfatada hasta 90 días, se muestran en la Figura 3. Los ejes perpendiculares 1 y 2 indican la separación de la mayoría de los tratamientos en relación con los parámetros evaluados.
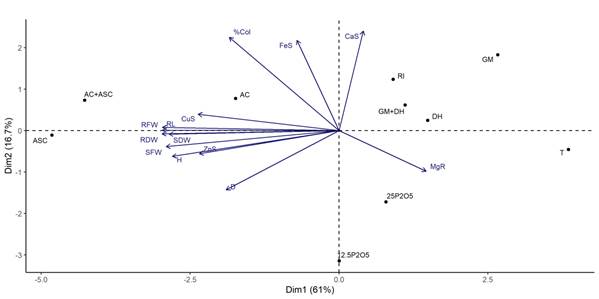
Figura 3 Diagrama de análisis de componentes principales (ACP) de portainjertos ‘IAC 766’ inoculados con especies de hongos micorrícicos arbusculares (HMA) o fertilizados con fósforo (Curitiba, Brasil). Incluye parámetros de crecimiento, macro- y micronutrientes, y porcentaje de colonización de raíz (% Col). GM = Gigaspora margarita; DH = Dentiscutata heterogama; RI = Rizophagus intraradices; AC = Acaulospora Colombiana; ASC = Acaulospora scrobiculata; 12.5 P2O5 = 12.5 mg·kg-1 P2O5; 25 P2O5 = 25 mg·kg-1 P2O5; T = testigo; A = altura; D = diámetro; LR = longitud de raíz; PFB = peso fresco de brotes; PSB = peso seco de brotes; PFR = peso fresco de raíces; PSR = peso seco de raíces; CaB = calcio en brotes; MgR = magnesio en raíces; FeB = hierro en brotes; CuB = cobre en brotes; ZnB = zinc en brotes.
Los ejes representaron el 61.0 y el 16.7 % de la variabilidad de los datos, lo cual explica el 77.7 % de la variabilidad total acumulada. Los parámetros de crecimiento (LR, PSB, PFB, PFR, PSR, A y D), el porcentaje de colonización radicular (% Col) y la concentración de los micronutrientes Cu y Zn de los brotes se ven favorecidos por la presencia de las especies del género Acaulospora, individualmente o en combinación. Por otra parte, aunque los resultados de la fertilización con P y el testigo fueron diferentes, estuvieron muy alejados.
La eficiencia demostrada por los HMA en los portainjertos ocurrió principalmente con la presencia de las especies del género Acaulospora, como se observó en el ACP, donde las especies mencionadas tuvieron una influencia favorable sobre la colonización de las raíces, los parámetros de crecimiento y la absorción de micronutrientes del brote. Resultados similares fueron observados por Schreiner y Mihara (2009), y Chatzistathis, Orfanoudakis, Alifragis y Therios (2013) en plantaciones del cultivar ‘Pinot Noir’ y olivo (Olea europaea), en suelos con diferentes niveles de fertilidad.
En el presente estudio, se observaron bajos niveles de P en el portainjertos ‘IAC-766’, el cual interactúa favorablemente en el crecimiento y la formación de raíces, como se verificó en diferentes portainjertos al ser injertados con cultivares viníferos en suelo con una disponibilidad de 8 mg·kg-1 de P (Grant & Matthews, 1996). Estos resultados concuerdan con lo reportado por Simões-Neto et al. (2009), Veneklaas et al. (2012), y Tecchio, Teixeira, Terra, Moura y Paioli-Pires (2011), quienes recomiendan la aplicación de pequeñas concentraciones de fósforo para mejorar la eficiencia de su uso, además de optimizar la capacidad de absorción del portainjertos y servir de base para futuras fertilizaciones de viñedos en campo definitivo.
Los resultados favorables de diversas investigaciones confirman la adaptabilidad del portainjertos ‘IAC-766’ en suelos brasileños con baja presencia de P, lo cual ofrece vides con mayor vigor y crecimiento (Cardoso-Campos et al., 2020). Asimismo, Tofanelli et al. (2011), Bruna y Back (2015), Souza et al. (2015), y Dias et al. (2017) obtuvieron vides con productividad alta al ser injertadas con los cultivares ‘Niágara Rosada’, ‘Cabernet Sauvignon’ y ‘Syrah’. Mientras que, en Chile, bajo condiciones de híper-aridez, los trabajos de Ibacache y Sierra (2009) y Verdugo-Vásquez et al. (2021) demostraron la influencia que pueden tener diferentes portainjertos sobre la composición nutricional de cultivares de vid en la producción de uva de mesa y pisco, en presencia de 60 mg·kg-1 de P y otros macronutrientes.
Conclusión
La inoculación de especies de HMA genera respuestas favorables sobre los parámetros de crecimiento, la colonización de la raíz y la extracción de macro- y micronutrientes en estacas del portainjertos ‘IAC-766’. Esto, especialmente, al inocular con especies del género Acaulospora, ya sea individualmente o en asociación.
La fertilización con fósforo también influye sobre los parámetros de crecimiento y la extracción de macro- y micronutrientes, pero a un menor grado que lo encontrado mediante inoculación con especies HMA.
References
Agostini, S., & Souza, P. V. (2003). Desenvolvimento vegetativo e conteúdo em reservas de porta-enxertos de videira inoculados com fungos micorrízicos arbusculares. Pesquisa Agropecuária Gaúcha, 9(1-2), 93-99. Retrieved from http://www.fepagro.rs.gov.br/upload/1398800227_art11.pdf [ Links ]
Aguín, O., Mansilla, J. P., Vilariño, A., & Sainz, M. J. (2004). Effects of mycorrhizal inoculation on root morphology and nursery production of three grapevine rootstocks. American Journal of Enology and Viticulture, 55(1), 108-111. Retrieved from https://www.ajevonline.org/content/55/1/108 [ Links ]
Alarcón, A., González-Chávez, M. C., Ferrera-Cerrato, R., & Villegas-Monter, A. (2001). Efectividad de Glomus fasciculatum y Glomus etunicatum en el crecimiento de plántulas de Vitis vinifera L. obtenidas por micropropagación. Terra Latinoamericana, 19(1), 29-35. Retrieved from https://www.redalyc.org/pdf/573/57319104.pdf [ Links ]
Ambrosini, V.G., Voges, J. G., Canton, L., Couto, R. R., Ferreira, P. A., Comin, J. J., Melo, G. W., Brunetto, G., & Soares, C. R. (2015). Effect of arbuscular mycorrhizal fungi on young vines in copper-contaminated soil. Brazilian Journal of Microbioly, 46(4), 1045-1052. doi: 10.1590/S1517-838246420140622 [ Links ]
Anzanello, R., Souza, P. V., & Casamali, B. (2011). Fungos micorrízicos arbusculares (FMA) em porta-enxertos micropropagados de videira. Bragantina, 70(2), 409-415. doi: 10.1590/S0006-87052011000200023 [ Links ]
Back, M. M., Reith, S., Giuliani, J. C., & Souza, P. V. (2017). Interação entre porta-enxertos de citrose fungos micorrízicos arbusculares. Iheringia, Série Botânica, 72(2), 277-282. Retrieved from https://isb.emnuvens.com.br/iheringia/article/view/409 [ Links ]
Begum, N., Qin, C., Ahanger, M. A., Raza, S., Khan, M. I., Ashraf, M., Ahmed, N., & Zhang, L. (2019). Role of arbuscular mycorrhizal fungi in plant growth regulation: implications in abiotic stress tolerance. Frontiers in Plant Science, 10, 1068. doi: 10.3389/fpls.2019.01068 [ Links ]
Bhat, R.A., Dervash, M. A., Mehmood, M. A., Skinder, B. M., Rashid, A., Bhat, J. I., Singh, D. V., & Lone, R. (2017). Mycorrhizae: A sustainable industry for plant and soil environment. In: Varma A., Prasad R., & Tuteja N. (Eds), Mycorrhiza - nutrient uptake, biocontrol, ecorestoration. USA: Springer. doi: 10.1007/978-3-319-68867-1_25 [ Links ]
Bruna, E. D., & Back, A. J. (2015). Comportamento da cultivar Niágara Rosada sobre diferentes porta-enxertos no sul de Santa Catarina, Brasil. Revista Brasileira de Fruticultura, 37(4), 924-933. Doi: 10.1590/0100-2945-245/14 [ Links ]
Caglar, S., & Bayram, A. (2006). Effects of vesicular-arbuscular mycorrhizal (VAM) fungi on the leaf nutritional status of four grapevine rootstocks. European Journal of Horticultural Science, 71(3), 109-113. Retrieved from https://pubmed.ncbi.nlm.nih.gov/17402238/ [ Links ]
Camprubí, A., Estaún, V., Nogales, A., García-Figueres, F., Pitet, M., & Calvet, C. (2008). Response of the grapevine rootstock richter 110 to inoculation with native and selected arbuscular mycorrhizal fungi and growth performance in a replant vineyard. Mycorrhiza, 18(4), 211-216. doi: 10.1007/s00572-008-0168-3 [ Links ]
Cardoso-Campos, L. F., Pradi-Vendruscolo, E., Correia, S. R., Abreu-Campos, C. M., Teramoto, A., Moura, M. F., & Seleguini, A. (2020). Vegetative development of vine rootstock cultivars in brazilian cerrado conditions. Colloquium Agrariae, 16(4), 121-129. doi: 10.5747/ca.2020.v16.n4.a389 [ Links ]
Chatterjee, A., & Franzen, D. W. (2020). Do we need to apply additional phosphorus for corn succeeding sugarbeet?. Agronomy Journal, 112(5), 4492-4497. doi: 10.1002/agj2.20330 [ Links ]
Chatzistathis, T., Orfanoudakis, M., Alifragis, D., & Therios, I. (2013). Colonization of Greek olive cultivars’ root system by arbuscular mycorrhiza fungus: root morphology, growth, and mineral nutrition of olive plants. Scientia Agricola, 70(3), 185-194. doi: 10.1590/S0103-90162013000300007 [ Links ]
Coutinho, F. P., Silva, E. M., & Yano-Melo, A. M. (2017). Inoculação de fungos micorrízicos arbusculares e solubilizadores de fosfato na rizosfera de videira (Vitis vinifera L. cv. Cabernet Sauvignon). Revista Biociências, 23(2), 46-53. Retrieved from http://periodicos.unitau.br/ojs/index.php/biociencias/article/view/2327 [ Links ]
Diagne, N., Ngom, M., Djighaly, P. I., Fall, D., Hocher, V., & Svistoonoff, S. (2020). Roles of arbuscular mycorrhizal fungi on plant growth and performance: importance in biotic and abiotic stressed regulation. Diversity, 12(10), 370. doi: 10.3390/d12100370 [ Links ]
Dias, F. A., Mota, R. V., Souza, C. R., Pimentel, R. M., Souza, L. C., Souza, A. L., & Regina, M. A. (2017). Rootstock on vine performance and wine quality of ‘syrah’ under double pruning management. Scientia Agricola, 74(2), 134-141. doi: 10.1590/1678-992X-2015-0384 [ Links ]
Eftekhari, M., Alizadeh, M., Mashayekhi, K., Asghari, H., & Kamkar, B. (2010). Integration of arbuscular mycorrhizal fungi to grape vine (Vitis vinifera L.) in nursery stage. Journal of Advanced Laboratory Research in Biology, 1(2), 79-85. Retrieved from https://www.neliti.com/publications/278939/integration-of-arbuscular-mycorrhizal-fungi-to-grape-vine-vitis-vinifera-l-in-nu [ Links ]
Fracasso, A., Telò, L., Lanfranco, L., Bonfante, P., & Amaducci, S. (2020). Physiological beneficial effect of Rhizophagus intraradices inoculation on tomato plant yield under water deficit conditions. Agronomy, 10(1), 71-90. doi: 10.3390/agronomy10010071 [ Links ]
Giovanetti, M., & Mosse, B. (1980). An evaluation of techniques for measuring vesicular arbuscular mycorrhizal infection in roots. New Phytologist, 84(3), 489-500. doi: 10.1111/j.1469-8137.1980.tb04556.x [ Links ]
Grant, R. S., & Matthews, M. A. (1996). The influence of phosphorus availability and rootstock on root system characteristics, phosphorus uptake, phosphorus partitioning, and growth efficiency. American Journal of Enology and Viticulture, 47(4), 403-409. doi: 10.5344/ajev.1996.47.4.403 [ Links ]
Grohs, D. S., Almança, M. A., Fajardo, T. V., Halleen, F., & Miele, A. (2017). Advances in propagation of grapevine in the world. Revista Brasileira de Fruticultura, 39(4), 760. doi: 10.1590/0100-29452017760 [ Links ]
Hijri, M. (2016). Analysis of a large dataset of mycorrhiza inoculation field trials on potato shows highly significant increases in yield. Mycorrhiza, 26(3), 209-214. doi: 10.1007/s00572-015-0661-4 [ Links ]
Ibacache, G. A., & Sierra, B. C. (2009). influence of rootstocks on nitrogen, phosphorus and potassium content in petioles of four table grape varieties. Chilean Journal of Agricultural Research, 69(4), 503-508. doi: 10.4067/S0718-58392009000400004 [ Links ]
Keller, M., Kummer, M., & Vasconcelos, M. C. (2001). Soil nitrogen utilization for growth and gas exchange by grapevines in response to nitrogen supply and rootstock. Australian Journal of Grape and Wine Research, 7(1), 2-11. doi: 10.1111/j.1755-0238.2001.tb00187.x [ Links ]
Lindermann, R. G., & Davis, A. (2001). Comparative response of selected grapevine rootstocks and cultivars to inoculation with different mycorrhizal fungi. American Journal of Enology and Viticulture, 52(1), 8-11. doi: 10.5344/ajev.2001.52.1.8 [ Links ]
Locatelli, L. M., & Lovato, P. M. (2002). Inoculação micorrízica e aclimatização de dois porta-enxertos de macieira micropropagados. Pesquisa Agropecuária Brasileira, 37(2), 177-184. doi: 10.1590/S0100-204X2002000200009 [ Links ]
Mahecha-Vásqueza, G., Sierrab, S., & Posada, R. (2017). Diversity indices using arbuscular mycorrhizal fungi to evaluate the soil state in banana crops in Colombia. Applied Soil Ecology, 109, 32-39. doi: 10.1016/j.apsoil.2016.09.017 [ Links ]
Martins, A. P., & Reissmann, C. B. (2007). Material vegetal e as rotinas laboratoriais nos procedimentos químico analíticos. Scientia Agraria, 8(1), 1-17. doi: 10.5380/rsa.v8i1.8336 [ Links ]
Meyer, A. H., Botha, A., Valentine, A. J., Archer, E., & Louw, P. J. (2005). The occurrence and infectivity of arbuscular mycorrhizal fungi in inoculated and uninoculated rhizosphere soils of two-year-old commercial grapevines. South African Journal of Enology and Viticulture, 26(2), 90-94. doi: 10.21548/26-2-2123 [ Links ]
Miranda, P. B., Mello, A. H., & Kupper, K. C. (2018). Mycorrhizal dependence of citrus rootstock. Revista Brasileira de Fruticultura, 40(3), 1-9. doi: 10.1590/0100-29452018762 [ Links ]
Nogueira, M. A., & Nogueira-Cardoso, E. J. (2006). Plant growth and phosphorus uptake in mycorrhizal rangpur lime seedlings under different levels of phosphorus. Pesquisa Agropecuária Brasileira, 41(1), 93-99. doi: 10.1590/S0100-204X2006000100013 [ Links ]
Nunes, J. L., Souza, P. V., Marodin, G. A., & Fachinello, J. C. (2008). Inoculação de fungos micorrízicos arbusculares em porta-enxerto de pessegueiro cv Okinawa. Revista Brasileira de Fruticultura, 30(4), 223-231. doi: 10.1590/S0100-29452008000400042 [ Links ]
Nuzzo, V., & Mathews, M. A. (2006). Response of fruit growth and ripening to crop level in dry-farmed Cabernet sauvignon on four rootstocks. American Journal of Enology and Viticulture, 57(3), 314-324. doi: 10.5344/ajev.2006.57.3.314 [ Links ]
Ollat, N., Peccoux, A., Papura, D., Esmenjaud, D., Marguerit, E., Tandonnet, J. P., Bordenave, L., Cookson, S. J., Barrieu, F., Rossdeutsch, L., Lecourt, J., Lauvergeat, V., Vivin, P., Bert, P. F., & Delrot, S. (2016). Rootstocks as a component of adaptation to environment. In: Gerós, H. (Ed.), Grapevine in a changing environment: a molecular and ecophysiological perspective (pp. 68-108). Oxford, UK: Wiley. doi: 10.1002/9781118735985.ch4 [ Links ]
Ortas, I., Rowell, D. L., & Harris, P. J. (2004). Effect of mycorrhizae and pH change at the root-soil interface on phosphorus uptake by sorghum using a rhizocylinder technique. Communications in Soil Science and Plant Analysis, 35(7-8), 1061-1080. doi: 10.1081/CSS-120030587 [ Links ]
Ozdemir, G., Akpinar, C., Sabir, A., Bilir, H., Tangolar, S., & Ortaş, İ. (2010). Effect of inoculation with mycorrhizal fungi on growth and nutrient uptake of grapevine genotypes (Vitis spp.). European Journal of Horticultural Science, 75(3), 103-110. Retrieved from https://www.pubhort.org/ejhs/2010/file_1591092.pdf [ Links ]
R Core Team. (2018). R: A language and environment for statistical computing. r foundation for statistical computing. Vienna, Austria: R Foundation. Retrieved from https://www.R-project.org/ [ Links ]
Rosa, D. J., Ambrosini, V. G., Brunetto, G., Soares, C. R., Borghezan, M., & Pescador, R. (2016). Parâmetros fisiológicos em videiras ‘Paulsen 1103’ (Vitis berlandieri x Vitis rupestris) inoculadas com fungos micorrízicos arbusculares em solo contaminado com cobre. Ciência e Técnica Vitivinícola, 31(1), 14-23. doi: 10.1051/ctv/20163101014 [ Links ]
Rosa, D., Pogiatzis, A., Bowen, P., Kokkoris, V., Richards, A., Holland, T., & Hart, M. (2020). Performance and establishment of a commercial mycorrhizal inoculant in viticulture. Agriculture, 10(11), 539. doi: 10.3390/agriculture10110539 [ Links ]
Rouphael, Y., Franken, P., Schneider, C., Schwarz, D., Giovannetti, M., & Agnolucci, M. (2015). Arbuscular mycorrhizal fungi act as biostimulants in horticultural crops. Scientia Horticulturae, 196, 91-108. doi: 10.1016/j.scienta.2015.09.002 [ Links ]
Schreiner, R. P. (2003). Mycorrhizal colonization of grapevine rootstocks under field conditions. American Journal of Enology and Viticulture, 54(3), 143-149. doi: 10.5344/ajev.2003.54.3.143 [ Links ]
Schreiner, R. P. (2007). Effects of native and nonnative arbuscular mycorrhizal fungi on growth and nutrient uptake of ‘Pinot noir’ (Vitis vinifera L.) in two soils with contrasting levels of phosphorus. Applied Soil Ecology, 36(2-3), 205-215. doi: 10.1016/j.apsoil.2007.03.002 [ Links ]
Schreiner, R. P., & Mihara, K. L. (2009). The diversity of arbuscular mycorrhizal fungi amplified from grapevine roots (Vitis vinifera L.) in Oregon vineyards is seasonally stable and influenced by soil and vine age. Mycologia, 101(5), 599-611. doi: 10.3852/08-169 [ Links ]
Silva, A. R., Melo, N. F, & Yano-Melo, A. M. (2017). Acclimatization of micropropagated plants of Etlingera elatior (Jack) R.M.Sm. inoculated with arbuscular mycorrhizal fungi. South African Journal of Botany, 113, 164-169. doi: 10.1016/j.sajb. 2017.08.014 [ Links ]
Silva, M. J., Padilha, C. V., Lima, M. S., Pereira, G. E., Venturini, W. G., Moura, M. F., & Tecchio, M. A. (2019). Grape juices produced from new hybrid varieties grown on Brazilian rootstocks - Bioactive compounds, organic acids and antioxidant capacity. Food Chemistry, 289, 714-722. doi: 10.1016/j.foodchem.2019.03.060 [ Links ]
Silveira, S. V., Souza, P. V., & Koller, O. C. (2002). Influência de fungos micorrízicos arbusculares sobre o desenvolvimento vegetativo de porta-enxertos de abacateiro. Pesquisa Agropecuária Brasileira, 37(3), 303-309. doi: 10.1590/S0100-204X2002000300011 [ Links ]
Simões-Neto, D. E., Oliveira, A. C., Freire, F. J., Freire, M. B., Nascimento, C. W., & Rocha, A. T. (2009). Extração de fósforo em solos cultivados com cana de-açúcar e suas relações com a capacidade tampão. Revista Brasileira de Engenharia Agrícola e Ambiental, 13, 840-848. doi: 10.1590/S1415-43662009000700005 [ Links ]
Smith, S. E., & Read, D. J. (2008). Mycorrhizal symbiosis. UK: Academic Press. doi: 10.1016/B978-0-12-370526-6.X5001-6 [ Links ]
Souza, C. R., Mota, R. V., Cardozo, D. V., Pimentel, R. M., & Regina, M. A. (2015). Cabernet Sauvignon grapevine grafted onto rootstocks during the autumn-winter season in southeastern Brazilian. Scientia Agricola, 72(2), 138-146. doi: 10.1590/0103-9016-2014-0031 [ Links ]
Tecchio, M. A., Teixeira, L. A., Terra, M. M., Moura, M. F., & Paioli-Pires, E. J. (2011). Extração de nutrientes pela videira 'Niagara Rosada' enxertada em diferentes porta-enxertos. Revista Brasileira de Fruticultura, 33(1), 736-742. doi: 10.1590/S0100-29452011000500103 [ Links ]
Tofanelli, M. B., Botelho, R, Pires, E. J., Vilela, L. A., & Ribeiro, D. O. (2011). Phenology of “Niagara Rosada” grapevines grafted on different rootstocks grown on Cerrado (Brazilian savanna) of Goiás State, Brazil. African Journal of Biotechnology, 10(17), 3387-3392. doi: 10.5897/AJB09.1950 [ Links ]
Trouvelot, S., Bonneau, L., Redecker, D., Tuinen, D. V., Adrian, M., & Wipf, D. (2015). Arbuscular mycorrhiza symbiosis in viticulture: a review. Agronomy for Sustainable Development, 35, 1449-1467. doi: 10.1007/s13593-015-0329-7 [ Links ]
Veneklaas, E. J., Lambers, H., Bragg, J., Finnegan, P. M., Lovelock, C. E., Plaxton, W. C., Price, C. A., Scheible, W. R., Shane, M. W., White, P. J., & Raven, J. A. (2012). Opportunities for improving phosphorus-use efficiency in crop plants. New Phytologist, 195(2), 306-320. doi: 10.1111/j.1469-8137.2012.04190.x [ Links ]
Verdugo-Vásquez, N., Gutiérrez-Gamboa, G., Villalobos-Soublett, E., & Zurita-Silva, A. (2021). Effects of rootstocks on blade nutritional content of two minority grapevine varieties cultivated under hyper-arid conditions in Northern Chile. Agronomy, 11(2), 327. doi: 10.3390/agronomy11020327 [ Links ]
Vilcatoma-Medina, C., Dolinski, M. A., Mendoza-Cortez, J. W., Kaschuk, G., Constantino, V., Stürmer, S., & F. Zanette, F. (2021). Micorrhyzal colonisation on araucaria seedling with different doses of nitrogen, phosphorus and potassium. Agriculture and Forestry, 67(2), 163-177. doi: 10.17707/AgricultForest.67.2.12 [ Links ]
Wright, D. P., Scholes, J. D., & Read, D. J. (1998). Effects of VA mycorrhizal colonization on photosynthesis and biomass production of Trifolium repens L. Plant, Cell & Environmet, 21(2), 209-216. doi: 10.1046/j.1365-3040.1998.00280.x [ Links ]
Wu, Q. S., Zou, Y. N., Liu, C. Y., & Lu, T. (2012). Interacted effect of arbuscular mycorrhizal fungi and polyamines on root system architecture of Citrus seedlings. Journal of Integrative Agriculture, 11(10), 1675-1681. doi: 10.1016/S2095-3119(12)60170-1 [ Links ]
Wu, Q. S., Zou, Y. N., & Huang, Y. M. (2013). The arbuscular mycorrhizal fungus Diversispora spurca ameliorates effects of waterlogging on growth, root system, architecture and antioxidant enzyme activities of Citrus seedlings. Fungal Ecololgy, 6(1), 37-43. doi: 10.1016/j.funeco.2012.09.002 [ Links ]
Zhang, L., Marguerit-Jacob, E., Rossdeutsch, L., Ollat, N., & Gambetta, G. (2016). The influence of grapevine rootstocks on scion growth and drought resistance. Theoretical and Experimental Plant Physiology, 28(2), 143-157.doi: 10.1007/s40626-016-0070-x [ Links ]
Recibido: 26 de Marzo de 2022; Aprobado: 24 de Marzo de 2023











 texto en
texto en 



