Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Chapingo. Serie horticultura
versión On-line ISSN 2007-4034versión impresa ISSN 1027-152X
Rev. Chapingo Ser.Hortic vol.18 no.1 Chapingo ene./abr. 2012
Cambios en la composición de almidón, pectinas y hemicelulosas durante la maduración de mango (Mangifera indica cv. Kent)
Changes in the composition of starch, pectins and hemicelluloses during the ripening stage of mango (Mangifera indica cv. Kent)
Wendy Guadalupe Cárdenas-Coronel; Rosabel Velez-de la Rocha; Jorge Humberto Siller-Cepeda; Tomás Osuna-Enciso; María Dolores Muy-Rangel; J. Adriana Sañudo-Barajas*
Centro de Investigación en Alimentación y Desarrollo, A.C. Coordinación Culiacán. Apartado postal 32–A, Culiacán, Sinaloa. MÉXICO. C. P. 80129. Correo–e: adriana@ciad.edu.mx (*Autor para correspondencia)
Recibido: 23 de septiembre, 2010.
Aceptado: 16 de diciembre, 2011.
Resumen
En este estudio se evaluaron los cambios en algunos polisacáridos durante la maduración poscosecha de mango 'Kent'. Se almacenaron frutos en madurez fisiológica a condiciones simuladas de mercadeo (20 ± 2 °C, 85 % de humedad relativa), hasta alcanzar los estados de madurez 2, 3, 4 y 5 (de acuerdo a la norma de Empacadoras de Mango de Exportación, A. C.). Se determinaron los cambios en firmeza, almidón, pectinas, hemicelulosas y celulosa. Los polisacáridos se obtuvieron a partir de la fracción insoluble en alcohol (FIA) de la pulpa. Los frutos presentaron una pérdida total del 93 % de la firmeza desde la madurez 2 a la 5, la cual se redujo progresivamente en 40, 44 y 9 % al alcanzar la madurez 3, 4 y 5, respectivamente. En ese orden, el grado de ablandamiento se definió como inicial, intermedio y tardío. Durante el ablandamiento inicial de los frutos se redujo el contenido de almidón en un 90 % y el contenido de azúcares totales en un 44 %, mientras que los ácidos urónicos totales aumentaron en un 39 %. La concentración total de arabinosa no mostró cambios significativos y se mantuvo en valores cercanos a los 250 mg·100 g–1 peso fresco (pf) en los distintos estados de madurez; sin embargo, la disminución de glucosa y galactosa fue de 50 % durante el ablandamiento inicial. La fracción péctica predominante fue la hidrosoluble, que presentó una relación urónicos:azúcares cercana a 2:1, y el azúcar neutro de mayor concentración fue arabinosa. Durante el ablandamiento de los frutos de mango 'Kent', se presentaron cambios en la solubilidad y grado de polimerización de polisacáridos pécticos y hemicelulósicos.
Palabras claves: Ablandamiento, solubilización, despolimerización, azúcares neutros.
Abstract
Changes in some polysaccharides during postharvest ripening of 'Kent' mangoes were evaluated in the present study. Fruit at physiological maturity stage were stored to simulate marketing conditions (20 ± 2 °C, 85 % relative humidity) until reaching the ripening stages 2, 3, 4 and 5 (according to the standards of Empacadoras de Mango de Exportación, A. C.). Changes in firmness, starch, pectin, hemicellulose and cellulose were determined. Polysaccharides were obtained from the alcohol–insoluble fraction of the mango flesh. Fruit showed a total firmness loss of 93 % from the ripening stage 2 to 5, which was progressively reduced in 40, 44 and 9 % when the fruit reached the stages 3, 4, and 5, respectively. In that order, the rate of softening was defined as initial, intermediate, and late. During the initial fruit softening, the content of starch was reduced by 90 % and the total sugars by 44 %, while the total uronic acids increased by 39 %. The total concentration of arabinose was maintained without significant changes in the different ripening stages at levels of 250 mg·100 g–1 fresh weight; however, a reduction of 50 % in glucose and galactose occurred during the initial softening. The water soluble–fraction was the prevalent pectin fraction with a composition near to 2:1 in the uronide:sugar ratio. During the softening of 'Kent' mangoes, changes in solubility and polymerization degree of pectin and hemicellulosic polysaccharides were observed.
Keywords: Softening, solubilization, depolymerization, neutral sugars.
INTRODUCCIÓN
El mango (Mangifera indica) es considerado un fruto tropical de importancia comercial por su alta demanda mundial como producto fresco y procesado (Tharanathan et al., 2006). México es el mayor exportador de mango en el mundo y concentra la mayor producción en los estados de Guerrero, Sinaloa, Veracruz, Nayarit y Chiapas. Entre las variedades de mango cultivadas en Sinaloa, el cultivar Kent se considera el mejor del grupo de maduración intermedia, en parte por su alta productividad y su amplia aceptación en mercados nacionales e internacionales (Ireta y Guzmán, 2002).
La maduración del mango se caracteriza por un ablandamiento de la pulpa, el cual se asocia con cambios progresivos en la composición de hemicelulosas, pectinas, celulosa y almidón (Muda et al., 1995; Yashoda et al., 2006). En frutos climatéricos, la pérdida de interconexión de pectinas y hemicelulosas por efectos de solubilización y despolimerización enzimática conduce a una interconversión de polisacáridos altamente interconectados a estructuras de baja asociación fibrilar (Prasanna et al., 2003; Brummell, 2006). Para definir los cambios en solubilidad, los polisacáridos se extraen secuencialmente con agentes químicos. El agua extrae pectinas ligadas o débilmente asociadas a la matriz fibrilar; agentes quelantes como el EDTA solubilizan pectinas quelatadas o ligadas mediante enlace iónico; el Na2CO3 extrae pectinas unidas covalentemente; y las soluciones concentradas de álcalis se usan para extraer hemicelulosas de bajo y alto grado de asociación con la celulosa (Brummell y Harpster, 2001). En mangos de diversas variedades se reporta la conversión de protopectina a pectina soluble en agua, así como cambios en la composición de azúcares neutros, solubilización y despolimerización de pectinas y hemicelulosas (Roe y Bruemmer, 1981; Mitcham y McDonald, 1992; Muda et al., 1995; Ollé et al., 1996; Varanyanond et al., 1999; Yashoda et al., 2006). Sin embargo, dichos reportes difieren en el patrón y magnitud de cambios en la pared celular entre variedades de mango, algunas veces por la presencia de gran proporción de almidón en el fruto (Muda et al., 1995; Ollé et al., 1996). En mango 'Keitt' y 'Tommy Atkins' se reportó una reducción en residuos de arabinosa, galactosa, xilosa y ramnosa, lo cual sugiere la participación de hidrolasas como la β–galactosidasa y β–xilosidasa (Mitcham y McDonald, 1992; Muda et al., 1995). Posteriormente, la β–galactosidasa en mango 'Harumanis' y 'Alfonso' se consideró asociada a la degradación de galactanos en las fracciones pécticas (Ali et al., 1995; Prasanna et al., 2005).
El mango 'Alfonso', cultivar de la India catalogado como de alta calidad, ha sido el mayormente explorado en aspectos de la pared celular. Yashoda et al. (2006) han estudiado las implicaciones del metabolismo de pectinas y almidón sobre los cambios ultraestructurales del fruto, así como la asociación de la reducción en la concentración de celulosa, hemicelulosa, pectina y almidón durante la maduración. Sin embargo, en la variedad Kent, que ha sido referida como aceptable por su exquisito sabor, olor y su bajo contenido de fibras (Galán–Saúco, 1999), los reportes son más limitados. En la presente investigación el objetivo fue evaluar los cambios en la composición de algunos polisacáridos durante la maduración de frutos de mango 'Kent'.
MATERIALES Y MÉTODOS
Material de estudio
Se cosecharon frutos de mango 'Kent' en estado de madurez fisiológica en un huerto de San Pedro, Navolato, Sinaloa. Se seleccionaron frutos sin daño aparente y se almacenaron a condiciones simuladas de mercadeo (20 ± 2 °C y 80 ± 5 % de humedad relativa).
Firmeza
En cuatro puntos de la zona ecuatorial de cada uno de tres frutos, sin cáscara, se registró la fuerza de oposición del tejido a la penetración de un punzón de 8 mm de diámetro, el cual se insertó a una profundidad de 1.5 cm a velocidad de 5.3 mm·s–1. Esta variable se evaluó cada tres días con un penetrómetro digital marca Chatillón, modelo DFGS–100, adaptado a una base automática modelo TCD 200.
Obtención de la fracción insoluble en alcohol (FIA)
Se obtuvieron secciones longitudinales de la pulpa de cuatro frutos; se retiró la cáscara y se agruparon las secciones de pulpa en una sola unidad experimental de 100 g para cada estado de madurez. La pulpa se picó finamente y se hirvió por 30 min en 250 ml de etanol al 80 %; se homogeneizó durante 40 s a 13,500 rpm con un procesador Ultraturrax (modelo T25); se realizaron filtraciones con papel de fibra de vidrio (GF/A) y lavados consecutivos durante 20 min en agitación magnética con etanol al 80 % (dos veces), metanol–cloroformo (1:1) y acetona hasta obtener un polvo de color blanco (Rose et al., 1998). El residuo se secó a peso constante en una estufa a 40 °C, se registró el peso, se redujo el tamaño de partícula a malla 40 (molino Thomas Scientific, modelo 3383–L10) y se almacenó en desecador. Dicho residuo constituyó la FIA y se utilizó para las evaluaciones posteriores.
Contenido de ácidos urónicos, azúcares totales y almidón
El contenido total de ácidos urónicos y azúcares totales en los frutos de mango se determinó a partir de la hidrólisis de 2 mg de FIA con H2SO4 concentrado. Se colocaron los tubos con la FIA y se adicionó 1 ml de H2SO4; a intervalos de 10 min se añadió 1 mL de H2SO4, 1 ml de H2O y finalmente 7 ml de H2O. La hidrólisis se condujo en condiciones de agitación constante y baño de hielo. Los ácidos urónicos totales se determinaron por el método simplificado de Ahmed y Labavitch (1977), que consistió en lo siguiente: a 200 µL del hidrolizado se adicionaron 1.2 ml de borato de sodio (12.5 mM) en H2SO4 concentrado, y la mezcla se mantuvo por 5 min en baño de agua a 100 °C. La coloración se produjo al añadir 20 µL de m–fenil fenol (0.15 %) en NaOH (0.5 %), y la absorbancia se registró a 520 nm con un espectrofotómetro Cary UV–Vis 1–E (Varian Inc.). Se utilizó ácido galacturónico como patrón de calibración. Los azúcares totales se determinaron por el método de antrona (Yemm y Willis, 1954), de la siguiente manera. A 100 µL del hidrolizado se añadieron 400 µL de H2O destilada y 1 ml de antrona (0.2 %) en H2SO4 concentrado; se calentó por 10 min en baño de agua a 100 °C; se enfrió y se midió la absorbancia a 620 nm con un espectrofotómetro Cary UV–Vis 1–E (Varian Inc.). La concentración se calculó a partir de una curva de calibración con glucosa. Los estándares utilizados fueron de la marca SIGMA®.
El almidón total digerible se determinó en 250 mg de FIA, a los cuales se añadieron 300 U de α–amilasa termostable y 3 ml de amortiguador MOPS (50 mM, pH 7.0) y se hidrolizaron durante 45 min en baño de agua a ebullición. Posteriormente, se agregaron 100 U de amiloglucosidasa y 4 ml de acetato de sodio (200 mM, pH 4.5); la mezcla se incubó durante 45 min a 50 °C, se enfrió y se centrifugó hasta sedimentación de los sólidos insolubles. Se tomaron alícuotas de 0.1 ml del sobrenadante por triplicado y se mezclaron con el reactivo enzimático glucosa oxidasa/ peroxidasa; se incubó por 10 min a 50 °C y se midió la absorbancia a 510 nm en un espectrofotómetro Cary 1E–UV. Los cálculos de concentración se realizaron a partir del estándar de glucosa. Todos los reactivos fueron del kit enzimático comercial Megazyme®.
Cambio en la composición de azúcares neutros y celulosa
Los azúcares neutros se hidrolizaron a monosacáridos y se derivatizaron a acetatos de alditol para su análisis por cromatografía de gases (Albersheim et al., 1967). Dos mg de la FIA se hidrolizaron con 500 µL de ácido trifluoroacético (2 N conteniendo 200 µg de mio–inositol como estándar interno) durante 1 h a 121 °C. La mezcla se separó por centrifugación y el residuo se consideró celulosa; el sobrenadante se sometió a una reducción con 150 µL de NaBH4 (20 mg·ml-1 en NH4OH 1N) y una posterior acetilación con 200 µL de anhídrido acético y 20 µL de 1–metilimidazol como catalizador. El material derivatizado se resuspendió en 2 ml de agua y 3 ml de cloroformo. Se recuperó la fase clorofórmica; se evaporó, y los acetatos de alditol se resuspendieron en acetona para su inyección en un cromatógrafo de gases Varian CP–3800 con detector FID (250 °C), con columna capilar DB–23 de 30 m x 0.25 mm (210 °C) y helio como gas acarreador (flujo constante de 3 ml·min–1). La integración de áreas se realizó con el software MS Workstation (Varian Inc.) versión 6.5 (SP1), y los cálculos se realizaron a partir de curvas de estándares de ramnosa, fucosa, arabinosa, xilosa, manosa, galactosa y glucosa. Los estándares utilizados fueron de la marca SIGMA®. La celulosa se hidrolizó durante 4 h con H2SO4 (67 %), y se determinó el contenido de azúcares totales por el método de Yemm y Willis (1954) descrito previamente.
Solubilidad de pectinas y hemicelulosas
Se realizó por triplicado la extracción química secuencial de pectinas y hemicelulosas a partir de la FIA, siguiendo la metodología de Rose et al. (1998). La FIA hidrolizada para almidón se mezcló con cuatro volúmenes de etanol; se dejó reposar toda la noche y el sedimento se lavó cuatro veces con etanol. Los polisacáridos pécticos y hemicelulósicos se obtuvieron secuencialmente solubilizando el sedimento en H2O, EDTA (50 mM en acetato de sodio 50 mM, pH 6.5), Na2CO3 (50 mM), KOH 4 % y KOH 24 %; a las tres últimas soluciones se les añadió el agente reductor NaBH4 (20 mM), y la fracción KOH al 4 % se descartó por baja recuperación. Cada fracción se obtuvo mediante la agitación del sedimento por 12 h a temperatura ambiente, primero de un volumen de 20 ml de la solución extractora, seguido de la separación del material solubilizado (sobrenadante) por centrifugación (8,500 x g) y una segunda extracción con 10 ml. Los sobrenadantes se mezclaron y la pastilla (sedimento) se utilizó para las subsiguientes extracciones siguiendo el mismo procedimiento. Finalmente, todas las fracciones, excepto la soluble en agua, se neutralizaron con ácido acético y se dializaron con membrana de celulosa de corte molecular en 6000 – 8000 Daltons (Sigma®) contra agua destilada. Las fracciones dializadas se filtraron con papel de fibra de vidrio (GF/A) y se almacenaron hasta su uso en la determinación de ácidos urónicos, azúcares totales, azúcares neutros y masa molecular aparente.
Despolimerización de pectinas y hemicelulosas
La masa molecular aparente, pectinas y hemicelulosas se determinaron por cromatografía de exclusión molecular (CEM) con la metodología de Rose et al. (1998), con algunas modificaciones. Se inyectó una cantidad equivalente a 1 mg de ácidos urónicos en una columna (60 x 1.5 cm) de agarosa CL–6B. La muestra se eluyó a flujo constante (33.3 ml·h–1) con acetato de amonio 0.2 M (pH de 5.2). El volumen eluido se colectó en un fraccionador BioRad (modelo 2110) a volúmenes de 1.9 ml y se determinó el contenido de ácidos urónicos (Ahmed y Labavitch, 1977) de cada fracción para obtener el perfil de elución y dispersión. El volumen muerto y volumen total de elución de la columna se determinaron inyectando glucosa y un dextrano de 2'000,000 Daltones (Sigma®).
Análisis de datos
Se utilizó un diseño completamente al azar, considerando como tratamientos los niveles del estado de madurez descritos más adelante. En las variables de composición y firmeza de los frutos se realizaron análisis de varianza (Minitab versión 15); en caso de valores P<0.05, se hizo una comparación múltiple de medias por la prueba de Tukey (P<0.05). El tamaño molecular se presenta en perfiles de elución y se compara subjetivamente con base en la distribución de urónidos o azúcares.
Los estados de madurez en que se realizaron las evaluaciones de las variables de respuesta, se determinaron de manera subjetiva (Baez, 1998). Los frutos se cortaron longitudinalmente de ambos lados cuidando seguir la trayectoria del hueso desde el ápice hasta el área de inserción del pedúnculo. Se estimó el porcentaje de desarrollo de color (de crema a naranja) sobre la superficie total de la pulpa y se asignaron los estados de madurez según se indica en el Cuadro 1.

RESULTADOS Y DISCUSIÓN
Firmeza
La reducción total de la firmeza (Figura 1) se distribuyó en un 40 % en la maduración de estado de madurez 2 al 3 (ablandamiento inicial); un 44 % en el cambio del estado de madurez 3 al 4 (ablandamiento intermedio); y, finalmente, de un 9 % entre el estado de madurez 4 y el 5 (ablandamiento final). La maduración progresiva y el ablandamiento de la pulpa indicaron una maduración distintiva en los frutos de mango 'Kent' (Siller–Cepeda et al., 2009). Para los fines de esta investigación, el periodo de ablandamiento se definió como etapa inicial (de la madurez 2 a 3), intermedia (de madurez 3 a 4) y tardía (de madurez 4 a 5), encontrando la mayor velocidad de pérdida de firmeza en los tres primeros estados de madurez.
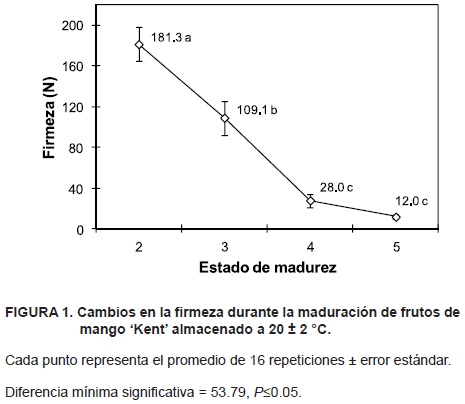
Contenido de ácidos urónicos, azúcares totales, almidón y celulosa
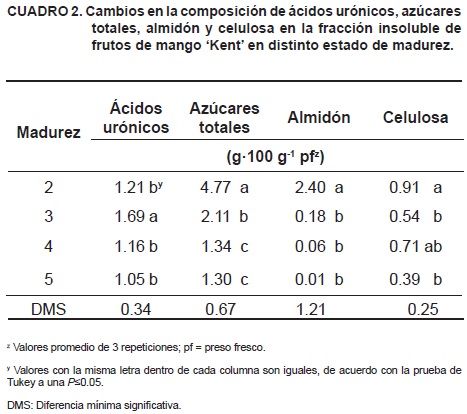
Los frutos de mango presentaron variaciones significativas en los contenidos de ácidos urónicos, azúcares totales, almidón y celulosa (Cuadro 2). La concentración de almidón se redujo en un 99.1 % del estado 2 al 5, evento que ocurrió principalmente en el periodo de ablandamiento inicial, donde se degradó el 90 % de este polisacárido. El almidón fue el polisacárido de mayor abundancia en los frutos en madurez 2, y su reducción significativa durante la fase inicial del ablandamiento sugiere una posible contribución en esa etapa; sin embargo, en las etapas intermedia y tardía, la concentración de almidón fue baja y no presentó cambios significativos. La acumulación de ácidos urónicos en la etapa de ablandamiento inicial coincide con lo reportado en mango 'Tommy Atkins' (Muda et al., 1995), y sugiere una síntesis de pectinas posiblemente a partir de la interconversión de azúcares de reserva. La reducción en azúcares totales, almidón y celulosa durante la maduración de los frutos de mango 'Kent' indicó cambios cuantitativos en los polímeros insolubles en alcohol, mismos que son convertidos a oligosacáridos y monosacáridos que imparten las características de textura y sabor del fruto (Yashoda et al., 2006). Dicha conversión se induce mediante el estímulo hormonal del etileno, el cual activa la expresión génica de hidrolasas de carbohidratos estructurales y de reserva, entre otros genes de la maduración (Roe y Bruemmer, 1981; Sen et al., 1985; Prasanna et al., 2003).
Cambio en la composición de azúcares neutros totales
La glucosa representó el 82.5 % del total de azúcares neutros de la FIA y se perdieron cerca de 1,500 mg·100 g–1 peso fresco (pf) entre las etapas de madurez 2 y 3 (Cuadro 3). En el estado 4 se perdieron 1,234 mg·100 g–1 pf, y los contenidos de glucosa en los estados 4 y 5 no fueron significativamente diferentes. Después de la glucosa, la galactosa y la arabinosa fueron los segundos en abundancia con una proporción cercana al 7 % cada uno. La galactosa redujo en un 49 % su concentración en el cambio de la madurez 2 a la 3, mientras que la arabinosa no presentó cambios significativos. El resto de los azúcares mantuvieron valores bajos y relativamente constantes. El ablandamiento inicial se caracterizó por una reducción en el contenido de glucosa y galactosa; mientras que, durante el ablandamiento intermedio y final, la pérdida de ambos monosacáridos fue progresiva, pero en menor grado. El incremento en las concentraciones de ramnosa y xilosa en la madurez 3, coincidió con el aumento en ácidos urónicos.
Solubilidad de pectinas y hemicelulosas
La extracción química secuencial de los polisacáridos de la pared celular reveló cambios importantes tanto en la matriz péctica como en la hemicelulósica. Los rendimientos en azúcares totales y en ácidos urónicos de las pectinas solubilizadas en H2O, CDTA y Na2CO3, se muestran en el Cuadro 4. La fracción H2O representó más del 80 % de los ácidos urónicos extraídos, seguida de la fracción EDTA.
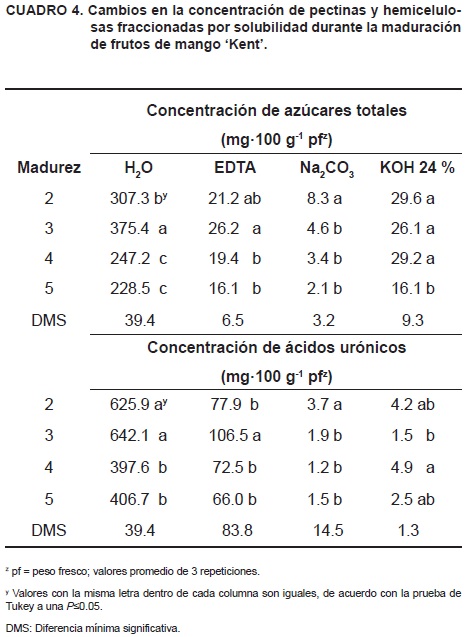
El análisis de los cambios en azúcares neutros de las fracciones pécticas se muestran en el Cuadro 5. La acumulación de azúcares totales en las pectinas solubles en H2O en la madurez 3 coincidió con un aumento significativo en el contenido de arabinosa, la cual representó más del 65 % de esa fracción. La ramnosa, aunque presente en bajas concentraciones, también aumentó significativamente en la madurez 3, en contraste con la reducción que presentaron los residuos de glucosa, manosa, xilosa y fucosa. La acumulación de ácidos urónicos totales en los frutos de mango 'Kent' en estado de madurez 3 coincidió con el aumento de urónicos en la fracción EDTA, lo cual sugiere la posible acumulación de pectinas con asociación tipo iónica; sin embargo, en la fracción péctica hidrosoluble también se presentó un ligero aumento en urónicos, aunque éste no fue significativo.
Además, las pectinas hidrosolubles presentaron en la madurez 3 una acumulación significativa de azúcares totales que cromatográficamente se identificó en la concentración de arabinosa. Simultáneo al comportamiento anterior, en las pectinas unidas covalentemente se redujo el contenido de arabinosa, lo cual sugiere un posible desmantelamiento de esas estructuras. La acumulación de pectinas solubles en agua ha sido reportada durante la maduración temprana de mango 'Tommy Atkins' y 'Keitt' (Mitcham y MacDonald, 1992; Muda et al., 1995). La glucosa, xilosa, manosa y fucosa en las pectinas solubles en agua redujeron progresivamente su concentración por efecto de la maduración de los frutos; sin embargo, la glucosa también puede estar asociada a la presencia de dextrinas de mediano y alto peso molecular (derivadas de la hidrólisis incompleta de almidón), las cuales son solubles en agua (Sen et al., 1985). En todas las fracciones pécticas, el contenido de arabinosa fue representativo y presentó una reducción progresiva hacia los estados 4 y 5. El alto contenido de arabinosa en las fracciones pécticas y su pérdida a través de la maduración fue reportada en frutos de mango 'Keitt', 'Tommy Atkins' y 'Alfonso' (Mitcham y MacDonald, 1992; Muda et al., 1995; Yashoda et al., 2006). Prasanna et al. (2003, 2005) reportaron el aislamiento y caracterización de arabinogalactanos en mango 'Alfonso', los cuales presentaron una proporción 1:3 en el contenido de arabinosa:galactosa, y redujeron extensivamente la masa molecular con la maduración del fruto posiblemente por la acción de tres isoformas de β–galactosidasas. Sin embargo, en el presente estudio se muestra que la relación de arabinosa con respecto a galactosa fue mayor en todas las fracciones pécticas, lo cual indica la presencia de polisacáridos pécticos con alta ramificación de arabinosa. Es importante mencionar que las estructuras de arabinanos y arabinogalactanos se relacionan con funciones de restricción de la hidrólisis enzimática de pectinas a través de obstrucciones en la formación de enlaces iónicos entre homogalacturonanos, llegando incluso a influir en la capacidad de retención de agua en el apoplasto (Jones et al., 2003; Moore et al., 2008). En la fracción hemicelulósica, la reducción más significativa de glucosa ocurrió en la etapa tardía del ablandamiento; además, la concentración glucosa:xilosa se presentó en una proporción 1.6:1 en la madurez 2 y se modificó gradualmente hasta 1.1:1 en la madurez 5. Lo anterior sugiere un metabolismo activo sobre polisacáridos del tipo xiloglucano, en los cuales la estructura central de β–D (1–4)–glucano es similar a la celulosa, pero con sustituciones de α–D–xilosa a intervalos regulares de 3 residuos de glucosa (Brummell y Harpster, 2001).
Despolimerización de pectinas y hemicelulosas
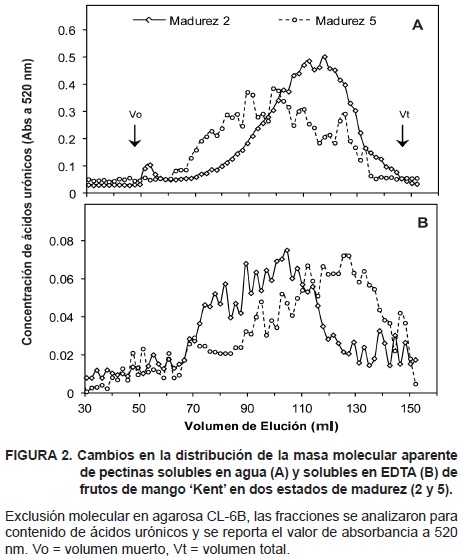
La distribución de la masa molecular aparente de las pectinas solubles en H2O y EDTA de los frutos en madurez 2 y 5, se muestra en la Figura 2. En la madurez 5, las pectinas hidrosolubles eluyeron en un perfil de mayor polidispersión en comparación con el perfil de la madurez 2 (Figura 2A). El perfil de elución de las pectinas solubles en EDTA presentó un cambio en la distribución de la concentración de urónicos, el cual es característico de la despolimerización de pectinas (Figura 2B); en la madurez 2, la mayor concentración eluyó entre los 70 y 120 ml; mientras que, en la madurez 5 la concentración de poliurónidos se desplazó hacia el rango de 90 a 150 ml de elución.
Los polisacáridos hemicelulósicos de la fracción KOH 24 % presentaron un tamaño molecular mayor al de las pectinas solubles en H2O y EDTA (Figura 3). Aunque la distribución molecular de las hemicelulosas estuvo repartida en la totalidad del volumen de elución, la mayor proporción se colectó entre los 50 y 80 ml. Los frutos en madurez presentaron un patrón de despolimerización de hemicelulosas, ya que los polisacáridos se concentraron entre los 60 y 110 ml, donde eluyen compuestos de menor tamaño.
El tamaño molecular de las pectinas quelatadas fue mayor que las pectinas hidrosolubles. El cambio en la distribución del tamaño de las pectinas solubles en agua por efecto de la maduración de los frutos se considera atipico, ya que muestra una acumulación de pectinas de mayor tamaño. No obstante, el patrón de polidispersión y la reducción de los urónicos cercanos al volumen muerto de las pectinas hidrosolubles de los frutos en madurez 5, indicaron la posible acción despolimerizante de pectinasas (Yashoda et al., 2006). Esta reducción en grado de polimerización ha sido asociada al ablandamiento de frutos de mango 'Tommy Atkins' y 'Kaew' (Roe y Bruemmer, 1981; Mitcham y McDonald, 1992; Muda et al., 1995; Varanyanond et al., 1999). La reducción de la masa molecular de las fracciones EDTA y KOH 24 % fue evidente en la madurez 5, lo que indicó que la despolimerización de pectinas de la lámina media (quelatadas) y hemicelulosas de alto grado de asociación a microfibrillas de celulosa, son factores que también contribuyen al ablandamiento del fruto.
CONCLUSIONES
El ablandamiento de los frutos de mango 'Kent' se encuentra diferencialmente asociado con la degradación de los polisacáridos de la lámina media y de la pared celular primaria. La degradación de almidón se asoció con el ablandamiento temprano de los frutos; sin embargo, los cambios en la composición de la pared celular contribuyeron al ablandamiento tardío de los frutos.
AGRADECIMIENTOS
A la colaboración técnica de Manuel A. Báez Sañudo, Laura Contreras Angulo y Rosalba Contreras Martínez. Al Fondo Mixto del estado de Sinaloa por el apoyo financiero (Proyecto clave Sin–2008–C01–98642).
LITERATURA CITADA
AHMED, A. E. R.; LABAVITCH, J. M. 1977. A simplified method for accurate determination of cell wall uronide content. Food Biochemistry 1: 361–365. [ Links ]
ALBERSHEIM, P.; NEVINS, D. J.; ENGLISH, P. D.; KARR, A. 1967. A method for the analysis of sugars in plant cell–wall polysaccharides by gas–liquid chromatography. Carbohydrate Research 5: 340–345. [ Links ]
ALI, Z. M.; ARMUGAM, S.; LAZAN, H. 1995. β–Galactosidase and its significance in ripening mango fruit. Phytochemistry 38: 1109–1114. [ Links ]
BÁEZ S., R. 1998. Norma mexicana de calidad para mango fresco de exportación. Comité Técnico Científico de Empacadores de Mango de Exportación, A. C. (EMEX, A. C.). Guadalajara, Jalisco. México. 4 p. [ Links ]
BRUMMELL, D. A. 2006. Cell wall disassembly in ripening fruit. Functional Plant Biology 33: 103–119. [ Links ]
BRUMMELL, D. A.; HARPSTER, M. H. 2001. Cell wall metabolism in fruit softening and quality and its manipulation in transgenic plants. Plant Molecular Biology 47: 311–340. [ Links ]
GALÁN–SAÚCO V. 1999. El Cultivo del Mango. Ed. Mundi–Prensa. Malaga, Madrid. 298 p. [ Links ]
IRETA, A.; GUZMAN, C. 2002. Guía técnica para la producción de mango en Sinaloa. Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias. Folleto Técnico 22. Culiacán, Sinaloa. 152 p. [ Links ]
JONES, L.; MILNE, J. L.; ASHFORD, D.; MCQUEEN–MASON, S. J. 2003. Cell wall arabinan is essential for guard cell function. Plant Biology 100: 11783–11788. [ Links ]
MITCHAM, E. J.; MCDONALD, R. E. 1992. Cell wall modification during ripening of 'Keitt' and 'Tommy Atkins' mango fruit. Journal of American Society for Horticultural Science 117: 919–924. [ Links ]
MOORE, J. P.; FARRANT, J. M.; DRIOUICH, A. 2008. A role for pectin–associated arabinans in maintaining the flexibility of the plant cell wall during water deficit stress. Plant Signaling & Behavior 3(2): 102–104. [ Links ]
MUDA, P.; SEYMOUR, G. B.; ERRINGTON, N.; TUCKER, G. A. 1995. Compositional changes in cell wall polymers during mango fruit ripening. Carbohydrate Polymers 26: 255–260. [ Links ]
OLLÉ, D.; LOZANO, Y. F.; BRILLOUET, J. 1996. Isolation and characterization of soluble polysaccharides and insoluble cell wall material of the pulp from four mango (Mangifera indica L.) cultivars. Journal of Agricultural and Food Chemistry 44: 2658–2662. [ Links ]
PRASANNA, V.; PRABHA, T. N.; THARANATHAN, R. N. 2005. Multiple forms of β–galactosidase from mango (Mangifera indica L. 'Alphonso') fruit pulp. Journal of the Science of Food and Agriculture 85: 797–803. [ Links ]
PRASANNA, V.; YASHODA, H. M.; PRABHA, T. N.; THARA–NATHAN, R. N. 2003. Pectic polysaccharides during ripening of mango (Mangifera indica L). Journal of the Science of Food and Agriculture 83: 1182–1186. [ Links ]
ROE, B.; BRUEMMER, J. H. 1981. Changes in pectic substances and enzymes during ripening and storage of 'Keitt' mangoes. Journal of Food Science 46: 186–189. [ Links ]
ROSE, J. K. C.; HADFIELD, K. A.; LABAVITCH, J. M.; BENETT, A. B. 1998. Temporal sequence of cell wall disassembly in rapidly ripening melon fruit. Plant Physiology 117: 345–361. [ Links ]
SEN, S.; CHATTERJEE, B. K.; ROY, H. B. 1985. Amylase activity in ripening mango (Mangifera indica L.) fruit. Indian Biology 17: 25–28. [ Links ]
SILLER–CEPEDA, J.; MUY–RANGEL, D.; BÁEZ–SAÑUDO, M.; ARAIZA–LIZARDE, E.; IRETA–OJEDA, A. 2009. Calidad poscosecha de variedades de mango de maduración temprana, intermedia y tardía. Revista Fitotecnia Mexicana 32: 45–52. [ Links ]
THARANATHAN, R. N.; YASHODA H. M.; PRABHA, T. N. 2006. Mango (Mangifera indica L.), "The King of Fruits"—An Overview. Food Reviews International 22: 95–123. [ Links ]
VARANYANOND, W.; NAOHARA, J.; WONGKRAJANG, K.; MANABE, M. 1999 Changes in pectin content and average molecular weight of pectin during maturation of the mango 'Kaew'. Food Science Technology Research 5: 362–364. [ Links ]
YASHODA, H.M.; PRABHA, T.N.; THARANATHAN, R. N. 2006. Mango ripening: changes in cell wall constituents in relation to textural softening. Journal of the Science of Food and Agriculture 86: 713–721. [ Links ]
YEMM, E.W.; WILLIS, A. J. 1954. The estimation of carbohydrates in plant extracts by anthrone. Biochemistry Journal 57: 508–514. [ Links ]














