Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.48 no.4 Ciudad de México oct./dic. 2004
Investigación
Síntesis y evaluación fotocromática de compuestos espirobenzopiránicos
Aída E. García,* Luis E. Elizalde, Lourdes Guillén, Gladys de los Santos y Diana I. Medellín
Centro de Investigación en Química Aplicada, Boulevard Enrique Reyna #140, Saltillo, Coahuila, México. C.P. 25100, Tel.(844)4-38-98-30, Fax (844)4-38-98-39. E-mail: aegarcia@ciqa.mx
Recibido el 14 de julio del 2004.
Aceptado el 12 de noviembre del 2004.
Resumen
En el presente trabajo se describe la preparación de compuestos derivados de 1',3',3',-trimetilespiro-[2H-1]-benzopiran-2,2'-indolina con sustituyentes H, Br, I, y NO2 en las posiciones 6 y 8 del anillo benzopiránico. Estos compuestos fueron obtenidos mediante una reacción de condensación entre la 2-metilen-1,3,3-trimetilindolina y un 2-hidroxibenzaldehido substituido en la posición 5 con diferentes grupos electro atractores. La evaluación espectrofotométrica de los espirobenzopiranos preparados permitió seleccionar al 6-nitro-espirobenzopiranindolina como el compuesto de mayor actividad fotocromática. Se logró establecer que en el estado excitado, la absorción en la porción visible del espectro de este compuesto, es independiente de la polaridad del solvente. Sin embargo, la estabilidad de la forma colorida es mayor a mayor polaridad del solvente.
Palabras clave: síntesis, espirobenzopirano, evaluación fotocromática.
Abstract
The synthesis of 1', 3', 3'-trimethylspiro[2H-1]-benzopyran-2,2'-indoline derivatives with H, Br, I and NO2 sustituents at the 6 and 8 positions of the benzopyran ring are reported. These compounds were obtained by condensation of 1,3,3-trimethyl-2-metilenindoline with 2-hydroxybenzaldehyde substituted in five position with several electrowithdrawing groups. The 6-nitro-spirobenzopyranindoline showed the best photochromatic activity. With the spectroscopic evaluation of this compound in the excited state it can be established that the absorption in the visible region of spectrum is independent of solvent polarity; however, the extent of stability of the colored form is greater by the increase of solvent polarity.
Key words: synthesis, spirobenzopyran, photochromic evaluation.
Introducción
El fotocromismo [1,2] es un fenómeno que se presenta en un grupo de moléculas las cuales experimentan una transformación reversible de color, inducida en una ó en ambas direcciones por una radiación electromagnética (ultravioleta, visible, infrarroja, etc.). El cambio producido en la estructura química de la especie, le permite absorber en su estado excitado (colorido) en otra región del espectro, generalmente en la región del visible, regresando a su estado basal (incoloro) en presencia de una segunda radiación, generalmente en el espectro visible o mediante vía térmica [3,4].
Haciendo referencia a la propiedad de coloración-decoloración [5], resulta una aplicación novedosa de estos compuestos en el diseño y manufactura de materiales ópticos de trasmisión variable [6-9].
Resultados y discusión
Síntesis de espirobenzopiranos: espirobenzopirano (1), 6-nitro-espirobenzopirano (2), 6,8-diyodo-espirobenzopirano (3), 6,8-dibromo-espirobenzopirano (4)
El primer paso para el desarrollo de este trabajo consistió en la obtención de un material fotocromático altamente sensible a la radiación UV, con las propiedades ópticas requeridas. Para ello se sintetizaron cuatro compuestos espirobenzopiránicos mediante una reacción de condensación del 2-hidroxibenzaldehído sustituido y la 2-metilen-1,3,3-trimetilindolina, empleando etanol como disolvente [10], (Fig. 1).
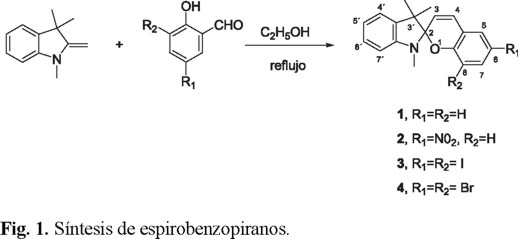
Los productos fotocromáticos obtenidos se purificaron mediante cristalización de metanol. De los cuatro compuestos fotocromáticos, se obtuvieron altos rendimientos (tabla 1), el espirobenzopirano con sustituyente nitro en la posición 6 presentó el valor más alto.
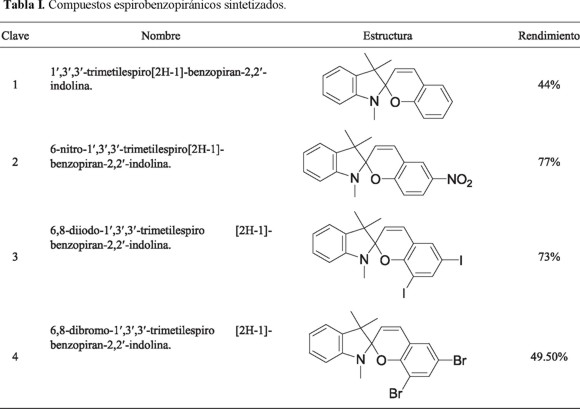
Caracterización de los compuestos espirobenzopiranos sintetizados
Los productos espirobenzopiránicos preparados (1-4) fueron caracterizados mediante espectrometría de masas y espectroscopia de RMN 1H, RMN 13C y FT-IR. Para el compuesto 1, su espectro de masas muestra un ion de 277 m/z y un ion padre en 159 m/z, generado por la formación de indolina durante el proceso de ionización [11]. En la mayoría de los casos es posible observar el ion másico (322 m/z para el compuesto 2 y 528 m/z para 3). Para el compuesto 4, aunque con muy baja abundancia, es posible observar las contribuciones isotópicas [M+2] y [M+4] características para un compuesto dibromado. En los espectros de masas para estos tres compuestos, se puede apreciar el mismo comportamiento, es decir la formación de indolina (159 m/z) durante el proceso de ionización-fragmentación.
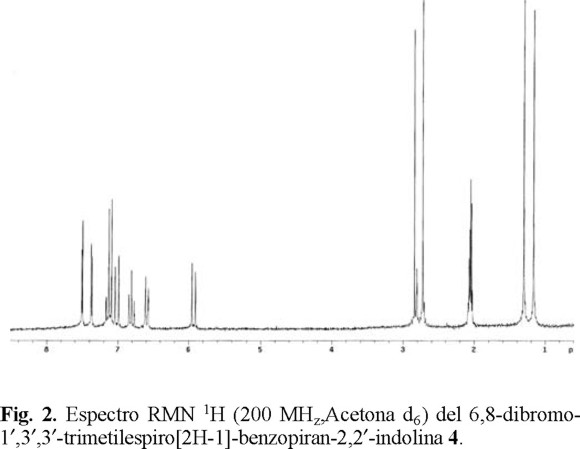
La caracterización de todos los compuestos se complementa por medio de RMN 1H, lo cual implica la presencia del sistema AB de los hidrógenos con isomería Z en las posiciones 3 y 4 del sistema benzopirano. La señal se obtiene aproximadamente en δ 5.95 ppm para el hidrógeno en posición 3 y δ 7.05 para el hidrógeno en posición 4 con constante de acoplamiento de 10 Hz, característica para este sistema. Cabe mencionar que este sistema vinílico, es el que resulta de la condensación del aldehído aromático con la enamina, haciendo notar, además, la ausencia de las señales en δ 12 y δ 10.0 correspondientes a los hidrógenos del grupo 2-hidroxi y aldehídico correspondientemente. Los hidrógenos del los metilos sustituyentes en las posiciones 3' aparecen en δ 1.20, 1.40, debido a que poseen diferentes ambientes magnéticos como resultado de que la fracción de la indolina y el benzopirano se encuentran unidos por el espiro carbono 2, en planos ortogonales.
Se logró establecer la presencia del espiro carbono característico para este tipo de compuestos (carbono 2 en la figura 1), con ayuda de RMN 13C, en donde se puede apreciar una señal en δ 107 para todos los compuestos (1-4), en este mismo espectro se pudo corroborar la presencia de las señales correspondientes a los protones metílicos y aromáticos que identificaron plenamente las estructuras de los compuestos.
Una vez preparados, purificados y caracterizados los cuatro derivados espirobenzopiránicos, se lleva a cabo su evaluación fotocromática en disolución, mediante un estudio espectrofométrico de UV-Vis para determinar su posible aplicación como material óptico.
Evaluación de los derivados espirobenzopiránicos 1-4 mediante espectroscopia ultravioleta.
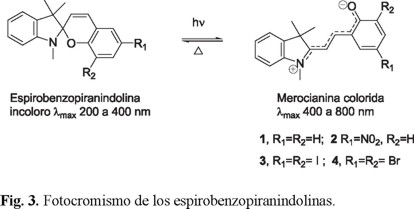
Para demostrar la eficiencia de los compuesto fotocromáticos, se evaluó la estabilidad de la fotomerocianina (forma abierta colorida) y su reversión a su forma cerrada (incolora) según se muestra en la reacción de isomerización (Fig. 3, Esquema 1).
Con el fin de evitar el solvatocromismo [12], la evaluación se realizó en dimetilsulfóxido (DMSO) como disolvente a concentraciones de 10-5 M de los compuestos sintetizados mediante espectroscopia UV. La determinación de los valores de las longitudes de onda de máxima absorción (λmax) se realizaron tanto en su estado basal incoloro, como en el estado excitado. El estado colorido de los compuestos en solución se alcanzó después de ser irradiados por medio de una lámpara ultravioleta en celdas de cuarzo durante 2 min a temperatura ambiente.
Los resultados se encuentran registrados en la Tabla 2. Los derivados espirobenzopiránicos 1, 3 y 4 no presentan variación significativa en los valores registrados de λmax, tanto en el estado basal (forma cerrada), como en el estado excitado (forma abierta); ambos valores se encuentran en la región ultravioleta del espectro (262-296 nm), corroborando estos resultados con la ausencia de color en la solución aunque hayan sido expuestas a radiación ultravioleta.
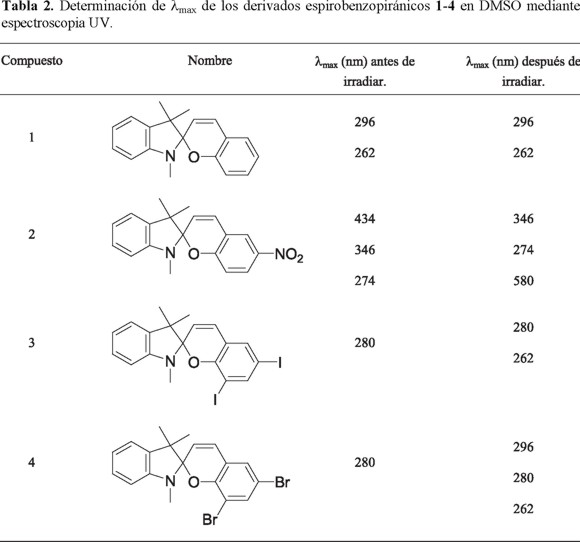
Después de la irradiación ultravioleta, el compuesto 2, el cual se encuentra sustituido con un grupo nitro en la posición 6, presenta una nueva banda de absorción a una longitud de onda con un máximo en 580 nm (Fig. 4), observando una coloración morada. El elevado carácter electroatractor del grupo nitro permite una mayor conjugación en la molécula en la forma abierta de la espirobenzopiranindolina, lo que le permite desplazar la banda de absorción hacia la región visible del espectro electromagnético. Este cambio es totalmente reversible mediante una segunda radiación en la región visible (luz blanca) o en ausencia de la fuente de radiación (vía térmica).
La utilidad de estos compuestos es variable, siendo favorecidos aquellos cuyas longitudes de máxima absorción se desplazan hacia el rojo, presentando así las mejores propiedades fotocromáticas.
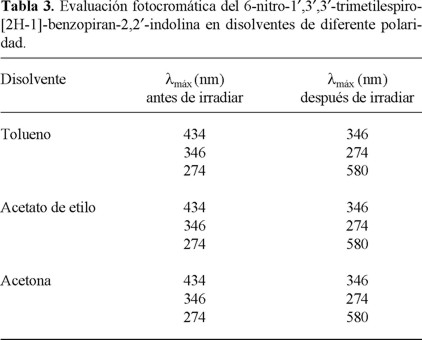
El efecto de la polaridad del solvente sobre las propiedades fotocromáticas del compuesto nitroespirobenzopiránico 2 se determinó espectrofotométricamente al emplear disoluciones 10-5 M de éste en tolueno, acetona y acetato de etilo, obteniendo resultados similares a los ya obtenidos en DMSO (tabla 3); sin embargo, al momento de realizar las disoluciones del compuesto en forma cerrada (antes de la irradiación), se observó el desarrollo de una ligera coloración en la solución, lo que indica cierto grado de solvatación; a mayor polaridad, mayor solvatación del compuesto 2.
Una vez definidas las longitudes de onda de máxima absorción para 2 en el estado excitado, se evaluó la estabilidad de la merocianina al determinar las constantes cinéticas de velocidad para la reacción de reversión térmica (figura 3). Para ello se tomó una solución de 2 a una concentración 10-5 M en los 4 disolventes empleados, en una celda de cuarzo de 10 mm de ancho y 3 mL de capacidad, la cual fue irradiada por medio de una lámpara que emite radiación ultravioleta por 5 min a temperatura ambiente, asumiendo que con este tratamiento, todas las moléculas fotoactivas alcanzan la forma abierta colorida. Suponiendo que la reacción de reversión es exclusivamente intramolecular, se consideró un modelo cinético de primer orden, calculando la constante de velocidad al graficar Ln(A0/A) vs t, donde A0 es la absorbancia inicial a 580 nm y A el valor de la absorbancia al tiempo t en ese mismo valor de longitud de onda. La linearidad para las cuatro gráficas, se constató al observar valores mayores a 0.98 en el factor de correlación. También se calculó la energía de activación para la reacción de reversión térmica a partir de los valores de las constantes cinéticas a diferentes temperaturas, los resultados se muestran en la tabla 4.
Es evidente el efecto que tiene la temperatura sobre la estabilidad de la merocianina según se observa en la tabla 4, presentándose un aumento en la constante de velocidad de reversión al estado incoloro al incrementarse la temperatura, independientemente de la polaridad del solvente, obteniendo las velocidades mas altas a 308 K.
Un dato importante a considerar, es la estabilidad de la merocianina, que es más alta en disolventes polares. Si se compara las constantes de velocidad del tolueno contra la de la acetona, a cualquier temperatura, la constante de velocidad es más alta para el solvente con menor constante dieléctrica, esta diferencia es más marcada al aumentar la temperatura. Esto se puede atribuir a que la merocianina puede tomar diversas conformaciones en el estado excitado (figura 3), como isomería E-Z, en el sistema vinílico, lo que podría favorecer que el anión fenolato se aleje o se acerque al carbono con menor densidad electrónica. En el caso de los disolventes polares, estos favorecen la solvatación de la merocianina, que se encuentra en forma iónica, haciendo menos probable la reacción de reversión, esto está acorde con las energías de activación calculadas, ya que es más probable la reversión para la reacción en tolueno que cuando se realiza en acetona.
Conclusiones
De los compuestos fotocromáticos derivados de la espirobenzopiranindolina sintetizados, el compuesto con un sustituyente nitro en la posición 6, fue el que presentó mayor actividad frente a la irradiación ultravioleta, logrando generar un foto-aducto que tiene una absorbancia en la región visible en 580 nm. La merocianina derivada de este compuesto presentó una estabilidad más alta en disolventes polares, debido a sus constantes de velocidades de reversión así como a la energía de activación.
Parte Experimental
Los reactivos utilizados son Aldrich y fueron empleados sin previa purificación. La caracterización de los compuestos sintetizados se realizó mediante espectroscopia FT-IR, utilizando un equipo Nicolet Magna 500 FT-IR, para la espectroscopia de RMN 1H y RMN 13C, se empleó un equipo NMR Varian Gemini 2000 (200 MHz), cromatografía de gases-espectrometría de masas, mediante el empleo de cromatógrafo de gases marca Thermo Finnigan modelo TRACE 2000, provisto de un detector de masas marca Finnigan modelo DSQ. Los compuestos en solución fueron irradiados con una lámpara de luz ultravioleta de vapor de mercurio de baja presión que emite en un rango de 250 a 380 nm con una intensidad de 95 mW/cm2, la evaluación fotocromática de los compuestos se llevó a cabo en un espectrofotómetro de UV-Vis HP 8452.
Síntesis general para la preparación de los compuestos: espirobenzopirano (1), 6-nitro-espirobenzopirano (2), 6,8-diiodo-espirobenzopirano (3), 6,8-dibromo-espirobenzopirano (4).
En un matraz redondo de 3 bocas provisto de agitador magnético se colocaron 11.5 mmol de 1,3,3-trimetil-2-metilenindolina y 11.5 mmoles del aldehído correspondiente, salicilaldehído, nitro-salicilaldehído, 3,5-diyodosalicilaldehído, 3,5-dibromosalicilaldehído en 40 mL de etanol calentando a ebullición durante 4 h. Terminado el tiempo de reacción se obtiene un producto sólido cristalino que fue purificado por cristalización de metanol.
Espirobenzopirano (1). Cristales blancos, p.f 106-110°C, rendimiento 44%;. RMN 1 H (CDCl3 , 200 MHz) δ 7.25 (m, 2H), 7.15 (m, 2H), 6.95 (3H, m), 6.85 (1H, d, J=8 Hz), 6.55 (1H, d, 8Hz), 5.75 (1H, d, J=10.5Hz), 2.78 (3H, s), 1.25 (3H, s), 1.21 (3H, s); RMN13C (CDCl3 50.28 MHz) δ 154.66 (C10), 148.42 (C9'), 136.97 (C4'), 129.57 (C8), 127.76 (C7'), 126.83 (C5'), 121.68 (C3), 120.17 (C4), 119.54(C6'), 118.97 (C5), 115.18(C9), 119.28 (C7), 106.96 (C8'), 104.34 (C2), 51.90 (C3'), 29.12 (N(1')-CH3, 20.39(C3'-CH3); IR (película) νmax 3100, 1000, 1480, 920, 740 cm-1; EMIE m/z (int.rel.): 277[M]+ (10), 202 (5),159 (100).
6-nitro-espirobenzopirano (2). Cristales amarillos, 77% de rendimiento, p.f. 158°C, RMN 1 H (CDCl3 , 200 MHz) δ 8.10 (m, 2H), 7.15 (m, 2H), 6.93 (1H, d, J=12 Hz), 6.91 (1H, d, J=8 Hz), 6.79 (1H, J= 8 Hz), 6.25 (1H, d, J=8 Hz), 5.89 (1H, d, J=12 Hz s), 2.95 (3H, s), 1.25 (3H, s), (1.15(3H, s); RMN13C (CDCl3, 50.28 MHz) δ 159.9 (C10), 147.8 (C9'), 141.0 (C7'), 136.2 (C4'), 128.4 (C5'), 127.9 (C7'), 125.0 (C6), 122.8 (C8), 121.7 (C3), 121.6 (C4), 119.8 (C5), 115.6 (C9), 107.2 (C6'), 106.5 (C2), 52.4 (C3'), 28.9 (N(1')-CH3, 20.0 (C3'-CH3); IR (película) νmax 3100, 1600, 1480, 720, 740 cm-1; EMIE m/z (int.rel.): 322[M]+ (1), 307 (4),157 (100).
6,8-diyodo-espirobenzopirano (3). Cristales beige, p.f 130-132°C, rendimiento 73.0%. RMN 1 H (C3D6O , 200 MHz) δ 7.85 (1H, d, J=1.96 Hz), 7.54 (1H, d, J=1.96 Hz), 7.57 (2H, m), 6.95 (1H, d, 10.8 Hz), 6.85 (1H, dd, J5'-6'=6.83 Hz, J5-7' =0.98 Hz), 6.61(1H, dd, J8'-7, 6.8 Hz, J8'-6'= 0.97Hz), 5.89 (1H, d, J=10.8 Hz), 2.65(3H,s), 1.30 (3H, s), 1.28 (3H,s); RMN13C (C3D6O, 50.28 MHz) δ 154 (C10), 149 (C9'), 146.19 (C8'), 136 (C6), 136.9 (C4'), 128.85 (C5'), 128.18 (C7'), 122.63(C5), 122.69(C3), 122.15 (C3), 121.96 (C4), 120.13 (C6'), 107.76 (C2), 107.67 (C8'), 84.72 (C7), 82.5 (9'), 52.5 (3'), 26.0 (N-CH3), 20.4 (C3'-CH3); IR (película) νmax 3100, 1600, 1480, 854, 720, 704 cm-1; EMIE m/z (int.rel.): 528[M]+ (1), 402(1), 159(100).
6,8-dibromo-espirobenzopirano (4). Cristales blancos, p.f 105-110°C, rendimiento 49.50%. RMN 1 H (C3D6O , 200 MHz) δ 7.55 (1H, d, J=2.4 Hz), 7.38 (1H, d, J=2.4), 7.15 (2H, m), 7.05 (1H, d, J=9.8 Hz), 6.82 (1H, dd, J6-5=13.3 Hz, J5-7 1.22 Hz), 6.58 (1H, dd, J7-8= 7.3 Hz, J8-6=1.2 Hz),), 5.9 (1H, d, J=9.76 Hz), 2.65 (3H, s), 1.25 (3H, s), 1.18 (3H,s); RMN13C (C3 D6O, 50.28 MHz) δ 150 (C9'), 148 (C10), 136 (C4'), 134 (C6), 129 (C8¨), 129.32 (C5'), 128.76 (C7'), 122.94 (C5), 122.69 (C3), 122.01 (C4), 120.13 (C6'), 112.12 (C7), 110(C9), 107 (C1),107.62(8'), 52.65(3'),26.085, 20.37(C3'(CH3); IR (película) νmax 3051, 1631, 1440, 854, 704 cm-1; EMIE m/z (int.rel.): 433[M]+ 435(1), 437(0.4), 159 (100).
Evaluación de las propiedades fotocromáticas de los compuestos espirobenzopiránicos mediante espectroscopia ultravioleta
Se prepararon soluciones de espirobenzopiranos BIPS 10-5M empleando DMSO como disolvente y en seguida se determinaron los valores de λmáx de los espiropiranos en su estado basal (forma cerrada) antes de ser expuestos a la radiación ultravioleta a una longitud de onda de 580 nm.
Para analizar la forma cerrada de los espirobenzopiranos se toma una muestra de 2 mL de cada una de las soluciones de concentración 10-5 M y se coloca en una celda de cuarzo 10 mm × 3 mL de capacidad, la cual es depositada en el portacelda termostato del espectrofotómetro ultravioleta a una temperatura de 25°C. De esta manera se determina la energía de activación y los valores de λmáx y absorbancia para cada una de las soluciones de espirobenzopirano.
El análisis de los espirobenzopiranos en su estado excitado (forma abierta), se realiza irradiando cada una de las soluciones de los espirobenzopiranos preparados 1-4 en concentración 10-5 M, contenidas en la celda de cuarzo 10 mm × 3 mL de capacidad con una lámpara de luz ultravioleta por 5 min. En este período se observa un cambio de color en la solución acompañado de la aparición de una banda de absorción en la región del visible a longitud de onda de 580 nm, monitoreando la desaparición de esta banda cada segundo por medio de un espectrofotómetro ultravioleta y una celda termostatada que garantiza una variación de temperatura de +/- 0.25°C. De esta forma se mide la cinética de reversión al estado incoloro en los diferentes disolventes tolueno, acetato de etilo y acetona a temperaturas de 15, 25 y 35°C. Los resultados de la evaluación fotocromática para cada uno de los compuestos sintetizados en disolventes polares y no polares se registraron en la Tabla 4.
Agradecimientos
Se agradece el apoyo financiero para la realización de este proyecto por parte del CONACyT mediante el proyecto 35485 E.
Referencias
1. Dürr, H. General Introduction, Photochromism Molecules and systems, Dürr H, Bouas-Laurent Editores, Elsevier: Amsterdam Holanda. 1990, p.1. [ Links ]
2. McArdle, C.B. Optical applications of organic photochromic polymer systems, Applied Photochromic Polymer Systems, McArdle C.B. Editor, Blackie Londres R.U: 1992, p1. [ Links ]
3. Berkovic, G.; Krongauz, V.; Weiss,V. Chem. Rev. 2000, 100, 1741-1753. [ Links ]
4. Samat, A; Lokshim, V. Thermochromism of Organic Compounds, Organic Photochromic and Thermochromic Compounds; Crano, J.C; Guglielmetti; R.J. Edit. Plenum Publishing: New York, 1999. Vol. 2, p 415-466. [ Links ]
5. Irie, M. Chem. Rev. 2000, 100, 1685-1716. [ Links ]
6. Nakanishi, M; Iwasaki, T. U.S. Patent. N° 5017225, Mayo 21. 1991, [ Links ] Thioeberger, G. U.S. Patent N° 6,786, 595, Septiembre 7, 2004, [ Links ] Hirabayashi, K; Amano Ch. U.S. Patent, N° 6,766, 082, Julio de 2004. [ Links ]
7. Lecomte, S.; Gubler, U.; Jager, M.; Bosshard, Ch.; Montemezzani, G.; Gunther, P.; Gobbi, L.; Diederich, F. Appl. Phys. Lett. 2000, 77, 921-923. [ Links ]
8. Kawata, K.; Kamata, Y. Chem. Rev, 2000, 100, 1777-1788. [ Links ]
9. Dvornikov, A.S; Rentzepis, P.M. Mol.Cryst. Liq. Cryst. Section A, Proceedings of 1st International Symposium on Organic Photocrhomism, Iles des Embiez, France September 12-16, 1994, Guglielmetti, R.; Samat, A. Edit. Gordon and Breach Science Publishers, p 379-388. [ Links ]
10. Keum, S.R.; Hur, M.S.; Kazmaier, P.M.; Buncel, E. Can. Chem. 1991, 69, 1940-1947. [ Links ]
11. de los Santos, G. Síntesis de Derivados del 1,3,3-trimetilespiro-[2H-1]benzopirano-6-benziloxo-2,2'-indolina y su Aplicación Como Compuestos Fotocromáticos, Tesis de Maestría en Ciencias , ITESM Monterrey 1997. [ Links ]
12. Liptay, W. Angew. Chem. Int. Edit. 1969, 8, 177-187. [ Links ]














