Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.46 no.2 Ciudad de México abr./jun. 2002
Investigación
Control de las propiedades texturales de ZrO2-TiO2 Sol-Gel. Efecto de parámetros de síntesis
María C. Barrera,*1 Margarita Viniegra,1 José Escobar3 y José A. de Los Reyes2
1 Departamento de Química y
2 Área de Ingeniería Química, UAM-Iztapalapa. Av. San Rafael Atlixco No. 186, Col. Vicentina, Iztapalapa, México 09340, D. F.; Tel: 5804-4648; Fax: 5804-4900. E-mail: mcbd@xanum.uam.mx
3 Instituto Mexicano del Petróleo, Tratamiento de Crudo Maya. Eje Central Lázaro Cárdenas 152. San Bartolo Atepehuacan. México 07730, D.F.
Recibido el 1 de noviembre del 2001.
Aceptado el 30 de enero del 2002.
Resumen
Se sintetizó ZrO2-TiO2 a varias composiciones por sol-gel a baja temperatura con HNO3, NH4OH o CH3COOH como aditivos. Los alcogeles se calcinaron (300-700 °C) y caracterizaron por fisisorción de N2, DRX y ATG-ATD. Al estudiarse diferentes composiciones, relaciones H2O / alcóxido, aditivo / alcóxido y tipos de aditivo fue posible modular las propiedades texturales de los óxidos preparados. El máximo en el área específica se obtuvo en contenidos cercanos al equimolar (muestras calcinadas a 500 °C). La formulación rica en TiO2 (85 % peso) fue la que presentó poros mayores (5-8 nm).
Palabras clave: ZrO2-TiO2, síntesis, texturas.
Abstract
ZrO2-TiO2 at different compositions was prepared by low temperature sol-gel method with HNO3, NH4OH and CH3COOH as additives. The alcogels were calcined (300-700 °C) and characterized by N2 physisorption, XRD and TGA-DTA. By varying the composition, the H2O / alkoxide and additive/alkoxide ratios and the type of additive it was possible to modulate the textural properties of the prepared oxides. The TiO2-rich formulation (85 w %) was the one with larger pores (5-8 nm). The maximum in surface area was found for samples of composition near the equimolar (samples calcined at 500 °C).
Keywords: ZrO2-TiO2, synthesis, textures.
Introducción
En años recientes se ha incrementado el interés por el estudio de nuevos materiales catalíticos aplicables al hidrotratamiento (HDT) de fracciones derivadas del petróleo. El motivo principal consiste en que las formulaciones actuales probablemente no podrán llevar a cabo la remoción de compuestos indeseables en las cargas a tratar hasta la concentración que fijarán las normas para el control de emisiones contaminantes que entrarán en vigor en el futuro próximo. Éstas restringirán severamente el contenido de azufre y compuestos aromáticos en los combustibles de uso industrial y automotriz para que, sin perderse sus propiedades, las emisiones nocivas al ser humano se reduzcan al mínimo [1]. La problemática se complica al considerar que para la obtención de combustibles actualmente se procesan crudos cada vez más pesados, y por ende, con mayor contenido de las especies que se requiere remover. Los materiales catalíticos que más comúnmente se utilizan a escala industrial para efectuar el HDT de cortes petroleros son el Co-Mo y NiMo sulfurados soportados en alúmina [2]. Sin embargo, sus propiedades intrínsecas hacen que difícilmente puedan ser utilizados en los esquemas de hidrodesulfuración profunda, cuya puesta a punto será necesaria a la brevedad posible. Las normas de calidad establecidas para combustibles diesel indican la necesidad de nuevos catalizadores con alto poder hidrogenante y gran resistencia al envenenamiento por azufre. A este respecto se han propuesto diversas formulaciones de metales nobles tales como el Pt o el Pd [3]. También se han buscado alternativas en lo referente a nuevos soportes con mejores propiedades que el Al2O3 tradicionalmente utilizado. En este sentido, se han estudiado materiales tales como TiO2 [4], ZrO2 [5] y algunos tipos de zeolitas [6]. Otros materiales con propiedades promisorias para su aplicación en esquemas de HDT son los óxidos mixtos de Al2O3-TiO2 [7] y ZrO2-TiO2 [5], entre otros. Aunque este último sistema presenta propiedades interesantes como soporte de catalizadores para el hidrotratamiento de gasóleo [5], los principales inconvenientes que presenta son volumen poroso (Vp) reducido y distribución de tamaño de poros (DTP) estrecha, situándose generalmente el máximo en el intervalo de 3-5 nm [8]. Se ha reportado [9] que debido al diámetro cinético de heterocompuestos de S presentes típicamente en cortes petroleros intermedios, se requiere de catalizadores con el máximo de la DTP en el intervalo 5 nm < Øp< 10 nm (Øp, diámetro de poro). Por ello, deben investigarse diversas metodologías que permitan la preparación de óxidos mixtos ZrO2-TiO2 con mayores valores de área específica (Sg), porosidad y diámetro de poros, características que harían posible la aplicación exitosa de estos materiales en el HDT de destilados medios (diesel).
En este trabajo se investiga el efecto del contenido de TiO2, del tipo de aditivo de síntesis y de las relaciones molares H2O / alcóxido y aditivo / alcóxido sobre las propiedades texturales de soportes de ZrO2-TiO2. Los materiales fueron caracterizados por fisisorción de N2, difracción de rayos X y análisis térmico.
Parte experimental
Materiales. Los alcóxidos precursores fueron tetraisopropóxido de titanio (98 % peso) y propóxido de circonio (70 % peso) (solución en 1-propanol) (Aldrich). Se empleó isopropanol 99.9 % (Baker) como disolvente y agua desionizada mediante un sistema Milli-Q (Millipore Corp.). Como aditivos de síntesis se utilizaron HNO3 (66 %), NH4OH (30 %) y CH3COOH (99.7 %) (Baker).
Síntesis de Soportes. Se prepararon soportes de ZrO2 (Z), TiO2 (T) y de sus correspondientes óxidos mixtos (ZTxy, x: % peso de ZrO2, y: % peso de TiO2) por técnica sol-gel a baja temperatura de acuerdo a [10]. Se disolvieron los alcóxidos de Ti y/o Zr en isopropanol y se enfriaron a la temperatura de síntesis (~ 0 °C) utilizando un baño frío Cole-Parmer Polystat. Posteriormente se adicionó la mezcla de hidrólisis (aditivo + H2O). Se emplearon 3 distintos aditivos: HNO3 (A) como catalizador de hidrólisis, NH4OH (B) como catalizador de condensación y CH3COOH (C) como agente complejante. Las relaciones molares utilizadas fueron: 2-propanol / alcóxido = 65, H2O / alcóxido = 20 y 30, aditivo / alcóxido = 0.05 y 0.2. Estas dos últimas relaciones se designaron h y a, respectivamente. Al término de la adición, los geles se dejaron madurar durante 24 h a la temperatura de síntesis. Los alcogeles se secaron a vacío y temperatura ambiente y luego se trataron en mufla bajo el siguiente programa: de temperatura ambiente a 120 °C, manteniéndose estas condiciones por 2 h para luego llegar a la temperatura final de calcinación (300, 500, 600 o 700 °C) a la que se permaneció por 4 h. Para ambas etapas se empleó una rampa de calentamiento de 3 °C min-1. De acuerdo a la nomenclatura utilizada, la última letra de cada clave representa el tipo de aditivo utilizado. Por ejemplo, el óxido mixto con 60 % peso de ZrO2 preparado con HNO3 se designa como: ZT6040A.
Caracterización de Soportes. La caracterización textural de los diferentes óxidos se realizó por fisisorción de N2 a -196 °C utilizando un aparato AUTOSORB-1 (QUANTACHROME) determinándose los parámetros de área específica (Sg) por el método BET [11], la distribución de poros (DTP) por el método BJH [12] y el volumen poroso (Vp) con el valor máximo de volumen adsorbido. La identificación de fases cristalinas para los óxidos calcinados a distintas temperaturas se efectuó por difracción de rayos X empleando un aparato Siemens D-500 Kristalloflex. La radiación utilizada fue la CuKa con λ = 0.15406 nm. Los termogramas (Análisis Termogravimétrico, TG y Análisis Térmico Diferencial, ATD) correspondientes a las muestras secas a vacío y sin calcinar se determinaron con un equipo Netzch Thermische Analize, STA 409 EP bajo atmósfera estática de aire.
Resultados y discusión
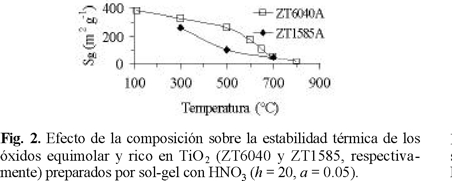
Fisisorción de N2. En acuerdo con reportes previos [8], el área específica del ZrO2-TiO2 es función de la composición (Fig. 1), con un máximo para el sólido ZT4060A (materiales con h = 20, a = 0.05, preparados con HNO3 y calcinados a 500 °C). Para este óxido, la técnica sol-gel permite obtener mayor área específica, en comparación con otras metodologías utilizadas por otros autores [13, 14]. El Sgde las formulaciones mixtas llega a ser 3 veces mayor que las de los óxidos simples. El incremento es especialmente notable para óxidos con contenido cercano al equimolar (ZT6040). La adición de diferentes agentes (HNO3, NH4OH, CH3COOH) no afecta el Sgde este material. Para sólidos preparados con ácido nítrico (A), la estabilidad térmica del material equimolar es mayor que la del rico en TiO2 (ZT1585A), ya que su pérdida de área específica en el intervalo de temperaturas estudiado es menor (Fig. 2). El sinterizado del material es completo luego del tratamiento a 900 °C (Sg= 15 m2 g-1, Vp= 0.14 cm 3 g-1).

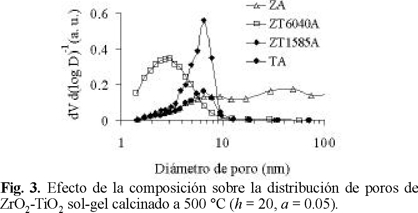
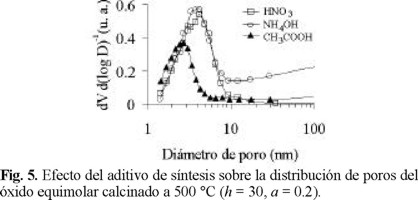
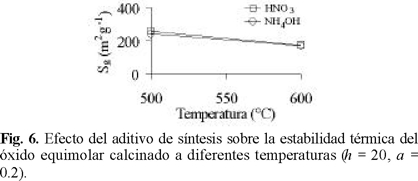
La distribución de poros muestra un máximo en la frontera micromesoporosa (Fig. 3) para el material equimolar preparado con HNO3 (ZT6040A). Este hecho y su alta Sgindican que se favorece la formación de partículas más pequeñas que las del resto de los materiales preparados. La formulación ZT1585A fue la que presentó poros de mayores dimensiones con un máximo en el intervalo de 5-8 nm. Tal como se aprecia en la Fig. 3, la presencia de ZrO2 en concentración moderada (15 % peso) produce un incremento notable en la cantidad de poros que presenta el TiO2, sin afectar su tamaño. Por su parte, el perfil de la DTP del ZrO2 sugiere una distribución amplia de tamaño de partículas. El aumento en la relación H2O / alcóxido (h) de 20 a 30 produce una mayor cantidad de mesoporos, desplazándose el máximo de la DTP del óxido equimolar desde 2-4 nm (Fig. 3) a 3-6 nm (Fig. 4). En cuanto al efecto de los distintos aditivos sobre la DTP de la misma muestra (Fig. 5), se observa que el agente básico promueve un aumento notable en el volumen poroso debido a una alta proporción de poros de gran tamaño (Øp>10 nm). Efectos similares originados en el uso de aditivo alcalino (NH4OH) han sido previamente reportados para otros sistemas de óxidos mixtos [10]. La utilización de CH3COOH (agente complejante) durante la síntesis de sólidos equimolares resulta en la formación de partículas pequeñas de distribución de tamaños estrecha, reflejándose ésto en el perfil de su DTP, Fig. 5. A diferencia de lo observado para óxidos mixtos Al2O3-TiO2 preparados vía sol-gel [10], la estabilidad térmica del sistema ZrO2-TiO2 en el intervalo de 500 a 600 °C no mejora por la adición del agente básico, Fig. 6. En la Fig. 7 se aprecia que el aditivo básico promueve una distribución de poros bimodal para el material ZT1585B. El máximo que se observa para este óxido en la región de poros de diámetro pequeño (10 nm < Øp) es más estrecho y se desplaza a menores diámetros, en comparación con el del sólido preparado con aditivo ácido. El segundo máximo aparece en el intervalo de 20-40 nm. Estos resultados pueden explicarse considerando que mientras que el HNO3 acelera la hidrólisis, el NH4OH lo hace con la condensación [15]. En medio alcalino, el crecimiento de las cadenas poliméricas durante esta etapa se orienta a la parte media, produciéndose geles con alto grado de entrecruzamiento [15] dando como resultado partículas voluminosas con grandes espacios interpartícula que aumentan el volumen poroso. Por otra parte, la complejación entre los acetatos y los átomos metálicos (Ti y Zr) modifica la funcionalidad de los alcóxidos precursores, definida ésta como el número de ligandos susceptibles a ser removidos durante el proceso de formación del gel [15]. La alta estabilidad de los enlaces entre los ligandos acetoxi terminales y los átomos metálicos impide el crecimiento de grandes micelas, formándose cadenas cortas que resultan en partículas pequeñas y de distribución de tamaño homogénea [16]. La morfología de estas partículas propiciaría la distribución de poros estrecha y desplazada a diámetros pequeños tal, como se observa en la Fig. 5.


Los cambios en la textura de los óxidos mixtos obtenidos al variar diversos parámetros de síntesis se resumen en la Tabla 1. Aunque el uso del agente básico promueve mayor volumen poroso para las formulaciones ricas en titania (ZT1585, Filas 12-14) su área específica prácticamente no se altera en función del aditivo empleado. Caso contrario, para el óxido equimolar (ZT6040) al utilizarse el catalizador de condensación (NH4OH) en lugar del de hidrólisis (muestras con a = 0.2 y h = 30) el área específica aumenta ligeramente (~ 10%) en tanto que el volumen poroso se duplica (Filas 5 y 8). Asimismo, el incremento en la relación HNO3 / alcóxido de 0.05 a 0.2 provoca una pequeña disminución en el área específica de dicha formulación y un decremento importante en su Vp(Filas 4 y 5). Un inconveniente de aumentar la cantidad de agente ácido radica en que se pueden alcanzar condiciones explosivas durante la calcinación de los alcogeles, probablemente debido a la presión generada por la eventual vaporización del disolvente ocluido en la matriz sólida. En esta línea, se han reportado [17] fenómenos de esa naturaleza durante la síntesis de ZrO2 sol-gel, atribuyéndose este fenómeno a que la condensación en medio ácido de los precursores alcóxido parcialmente hidrolizados podría conducir a la formación de porosidad cerrada en donde el disolvente se acumularía. En nuestro caso, al emplearse cantidades menores de ácido nítrico, se evitaron los problemas ya mencionados, quizá debido a la formación de una matriz sólida más abierta y porosa (Filas 4 y 5, Tabla 1). El incremento en la relación NH4OH / alcóxido de 0.05 a 0.2 (muestras con h = 30) resulta en un aumento de 30% en el Sgy el Vpse duplica (Filas 7 y 8). Este último valor de volumen poroso (0.56 cm3 g-1) es similar al valor máximo reportado para este parámetro [18], para sólidos de composición y área específica semejante preparados por precipitación a pH constante.
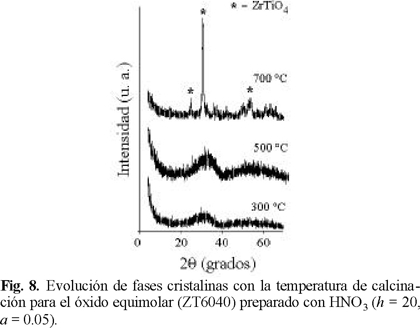
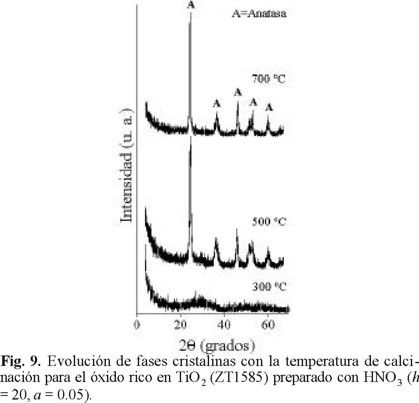
Difracción de rayos X. En la Fig. 8 se observa la evolución térmica del sólido equimolar preparado con HNO3 (ZT6040A, h = 20, a = 0.05), calcinado a diferentes temperaturas. A 300 y 500 °C se observa microcristalinidad, no registrándose señales propias de TiO2 (anatasa o rutilo). La cristalización a ZrTiO4 (JCPDD: 7-0290), se lleva a cabo a 700 °C. La transformación desde una matriz amorfa a una cristalina produce una drástica pérdida en propiedades texturales (Fig. 2), indicando que el aumento en las dimensiones de los cristales redunda en un mayor tamaño de partículas. Por su parte, el patrón del óxido ZT1585A tratado a 300 °C muestra amorficidad para luego transformarse al correspondiente a la fase anatasa (JCPDD: 21-1272), luego de la calcinación a 500 °C, Fig. 9. Al incrementarse la severidad del tratamiento (700 °C) la estructura (y la textura) permanecen prácticamente sin cambios. Esto difiere de lo observado para el TiO2 sol-gel preparado a condiciones similares, el cual bajo condiciones severas se transforma a rutilo, o a una mezcla anatasa-rutilo con alta proporción del último [19]. Este impedimento al cambio de fase sugiere una fuerte interacción entre los óxidos componentes. la cual limitaría la difusión en estado sólido a través de la cual se daría el crecimiento de los cristales. En la misma línea, Weissman y col. [5] consideran que la resistencia al sinterizado de los sistemas mixtos ZrO2-TiO2 se relaciona a la presencia de heteroenlaces Zr-O-Ti formados durante la condensación de precursores alcóxido parcialmente hidrolizados.
Análisis Térmico. En los análisis térmicos diferenciales de las muestras preparadas con HNO3, a = 0.05 y h = 20 (Fig. 10) se observan endotermicidades centradas a ~160 °C confirmando la remoción de especies fisisorbidas (agua y/o disolvente). Todas las muestras presentan señales exotérmicas tanto de combustión de residuos orgánicos como de cristalización a distintas fases. Para el TiO2 se registra un pico correspondiente a cristalización a anatasa a 400 °C [19], transformación que se desplaza a mayores temperaturas por la adición de un 15 % de ZrO2 (muestra ZT1585A), tal como se observó por difracción de rayos X (Fig. 9). Por su parte, el óxido de circonio cristaliza, probablemente a un arreglo tetragonal [20] a 420 °C. Esta cristalización se retarda en la muestra ZT85 15A por la presencia del segundo óxido (titania), efectuándose en este caso a 600 °C.
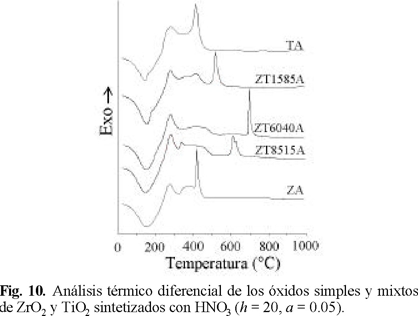
Para el material equimolar (ZT6040A), la obtención de una fase mixta retardaría la cristalización del ZrO2 y del TiO2, con lo cual se evita el sinterizado a baja temperatura. La cristalización a ZrTiO4 (observada en la Fig. 8) se registra a 700 °C, identificándose con una intensa exotermicidad. Este fenómeno coincide con la drástica pérdida de Sg, la cual disminuye en un 80% en el intervalo de 500-700 °C (Fig. 2) y además sugiere un alto grado de interacción entre los óxidos componentes [21]. La evolución térmica del sólido ZT4060A fue similar a la propia del equimolar por lo que no se le incluyó en la Fig. 10.
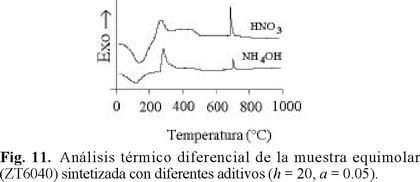
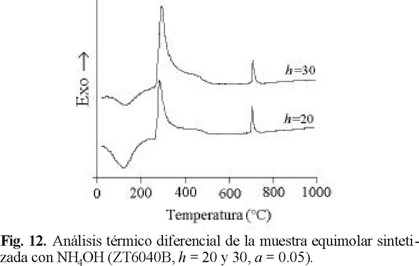
Se estudió el efecto del aditivo de síntesis y de la relación molar H2O / alcóxido (h) sobre la evolución térmica del óxido mixto equimolar. Los resultados se muestran en las Figs. 11 y 12. La menor intensidad de la señal exotérmica observada a ~700 °C para la muestra sintetizada con NH4OH sugiere composición más homogénea que la de la muestra preparada con aditivo ácido, debido a que la cristalización a ZrTiO4 implica una menor evolución de energía. Por tanto, la estructura del óxido amorfo debe ser muy similar a la de la fase titanato. El desplazamiento a menor temperatura de la señal en cuestión al disminuir h de 30 a 20 (Fig. 12) también es indicio de la formación de una matriz mixta de composición más homogénea. Considerando que la cristalización al titanato se relaciona al sinterizado masivo del material en cuestión (Fig. 2), nuestros sólidos poseen mayor estabilidad térmica que preparaciones de composición similar preparados por coprecipitación con urea [22], en donde la formación del ZrTiO4 ha sido identificada a temperaturas menores (654 °C).
Conclusiones
A través del control de diversos parámetros de síntesis, la vía sol-gel permite adecuar la textura de sistemas mixtos ZrO2TiO2 para su potencial aplicación en el hidrotratamiento de cortes intermedios (diesel).
En función de su composición, los sistemas mixtos ZrO2-TiO2 exhiben notables mejoras en sus propiedades texturales, con relación a las de sus óxidos componentes. Este efecto es especialmente notable para formulaciones con composiciones cercanas a la equimolar. El máximo en la DTP de los sólidos equimolares preparados con aditivo ácido se desplaza a mayores diámetros al aumentar la relación molar H2O / alcóxido de 20 a 30, incluyendo mesoporos en el intervalo 3 nm < Øp<6 nm. En presencia de un catalizador de condensación (NH4OH) se obtienen muestras de volumen poroso incrementado. Por otro lado, el aditivo complejante (CH3COOH) promueve una disminución en el tamaño de las partículas formadas, con lo que las dimensiones de los espacios interpartícula se reducen.
Referencias
1. Delmon B. en: Actas del XIII Simposio Iberoamericano de Catálisis, Vol. 1. Segovia, España, 1992, 1-25. [ Links ]
2. Satterfield C. N. Heterogeneous Catalysis in Industrial Practice. McGraw-Hill Book Company, USA, 1980. [ Links ]
3. Qian, W.; Yoda, Y.; Hirai, Y.; Ishihara, A.; Kabe, T. App. Catal A: General 1999, 184, 81-88. [ Links ]
4. Ramírez J.; Fuentes S.; Díaz G.; Vrinat M.; Breysse M.; Lacroix M. App. Catal. 1989, 52, 211-224. [ Links ]
5. Weissman, J. G.; Ko, E. I.; Kaytal, S. App. Catal. 1993, 94, 45-59. [ Links ]
6. Cid, R.; Neira, J.; Godoy, J.; Palacios, J. M.; López Agudo, A. Appl. Catal. A. General, 1995, 125, 169-183. [ Links ]
7. Ramírez, J.; Ruíz Ramírez, L.; Cedeño, L.; Harle, V.; Vrinat, M.; Breysse, M. App. Catal. A: General, 1993, 93, 163-180. [ Links ]
8. Lahousse, C.; Aboulayt, A.; Maugé, F.; Bachelier, J.; Lavalley, J. C. J. Molec. Catal. 1993, 94, 283-297. [ Links ]
9. Klimova T.; Ramírez J.; Cuevas R.; González H., en: Studies in Surface Science and Catalysis, Vol. 130. (Corma A., Melo F. V., Mendioroz S., Fierro J. L. G., Ed.), Elsevier, The Netherlands. 2000, 2801-2805. [ Links ]
10. Escobar, J.; De Los Reyes, J. A.; Viveros, T. Ind. Eng. Chem. Res. 2000, 39, 666-672. [ Links ]
11. Brunauer, S.; Emmet, P. H.; Teller, E. J. Am. Chem. Soc. 1938, 60, 309-311. [ Links ]
12. Barrett, E. P.; Joyner, L. G.; Halenda, P. H. J. Am. Chem. Soc. 1951, 73, 373-375. [ Links ]
13. Maity, S. K.; Rana, M. S.; Bej, S. K.; Ancheyta, J.; Murali Dhar G.; Prasada Rao T. S. R. Cat. Lett. 2001, 72 (1-2), 115-119. [ Links ]
14. Daturi, M.; Cremona, A.; Milella, F.; Busca, G.; Vogna, E. J. Eur. Cer. Soc. 1998, 18, 1079-1087. [ Links ]
15. Brinker, C. J.; Scherer, G. W. Sol Gel Science. Academic Press. USA, 1990. [ Links ]
16. Livage J. Mat. Sci. Forum 1994, 152-153, 43. [ Links ]
17. Xu Q; Anderson M. A. J. Am. Ceram. Soc. 1994, 77, 1939-1945. [ Links ]
18. Daly F. P. J. Catal. 1989, 116, 600-603. [ Links ]
19. Escobar J. "Síntesis, Caracterización y Propiedades Catalíticas Hidrogenantes de Sistemas a Base de Ni Soportado en Al2O3TiO2 Sol-Gel", Tesis Doctoral. UAM-Iztapalapa, México, 2001. [ Links ]
20. Wang, J. A.; Valenzuela, M. A.; Salmones, J.; Vázquez, A.; García Ruiz, A.; Bokhimi, X. Cat. Today 2001, 68, 21-30. [ Links ]
21. Hirashima, Y.; Tsuiki, H.; Ueno, A.; Tohji, K.; Udagawa, Y. J. Catal. 1986, 102, 249-251. [ Links ]
22. Daly, F. P.; Ando, H.; Schmitt, J. L.; Sturm, E. A. J. Catal. 1987, 108, 401-408. [ Links ]














