Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista de la Sociedad Química de México
versión impresa ISSN 0583-7693
Rev. Soc. Quím. Méx vol.44 no.2 Ciudad de México abr./jun. 2000
Investigación
Síntesis de BOP (acoplador de péptidos) en fase sólida
Ignacio A. Rivero* y Rosalva Aceves
Centro de Graduados e Investigación del Instituto Tecnológico de Tijuana, Blvd. Industrial S/N, Mesa de Otay. Tijuana, B. C. México. Apdo. Postal 1166, 22000. Tel: (66) 233762, Fax: (66) 234043. e-mail: irivero@tectijuana.mx
Recibido el 15 de diciembre de 1999.
Aceptado el 17 de febrero del 2000.
Resumen
En este trabajo se reporta la síntesis de BOP en fase sólida (Resina-BOP), a través de la unión covalente de HMPA a la resina de Merrifield. Este proceso tiene como fin eliminar la contaminación causada por la HMPA cuando el reactivo acoplador BOP es usado en solución. La resina se trato con clorhidrato de metilamina para generar una metilaminoresina; ésta se hizo reaccionar con una solución de PCl3 para dar lugar a la resina 5 que a su vez se hizo reaccionar con dimetilamina para obtener la resina activa 6. Esta última resina se trató con TPA para formar a Bis-(dimetilamino)-metilamino-resindiclorofosfato 7. Esta se hizo reaccionar con hidroxibenzotriazol para generar 8 y por último se intercambió el anión cloruro por el hexafluorofosfato con KPF6, sintetizándose de esta manera el BOP soportado en la resina de Merrifield. La resina-BOP (2) fue empleada posteriormente para la síntesis de éster metílico de N'-1,2,3,4-tetrahidro-2,4-dioxoquinazolin-3N-ilacetil triptofano (10).
Palabras clave: Péptidos, BOP, fase sólida, Merrifield.
Abstract
This work describes the solid-phase synthesis of BOP (BOP-resin). Synthesis of BOP-resin initially requiered covalent attachment of HMPA to the Merrifield's resin. This process will avoid the release of the highly carcinogenic reagent HMPA as happens when BOP is used in solution. The Merrifield's resin was consecutively treated with methylamine, triphosgene, hydroxybenzotriazole and potassium hexafluorophosphate to give rise to BOP supported on the Merrifield's resin. BOP-resin (2) was used in the preparation of N'-1,2,3,4-tetrahydro-2,4-dioxoquinazolin-3N-ylacetyl tryptophan methyl ester (10).
Key Words: Peptides, BOP, solid phase, Merrifield.
Dedicado a la memoria del Dr. Jacobo Gómez-Lara
Introducción
La síntesis orgánica en fase sólida fue desarrollada originalmente para la preparación de péptidos por R. B. Merrifield [1]; esta técnica se basa en el uso de una resina de poliestireno que se emplea en forma de pequeñas esferas y es insoluble en casi todos los solventes. Mientras que la síntesis orgánica en solución involucra procesos laboriosos de purificación y aislamiento (extracción, cromatografía y cristalización) que requieren mucho tiempo, la síntesis en fase sólida permite que las reacciones sean cuantitativas en cada etapa a través del uso en exceso de uno de los reactivos, el cual después de reaccionar es eliminado por procesos simples de lavado y filtración.
La síntesis de péptidos ha mantenido un gran interés en el desarrollo de nuevos métodos de preparación en vista de que muchas hormonas y toxinas son de origen peptídico. El hexafluorofosfato de benzotriazoliloxitris[dimetilamino]fosfonio (BOP) es un reactivo ampliamente conocido como excelente activador de ácidos carboxílicos, produciendo ésteres activos que podrán reaccionar con nucleófilos para producir péptidos, ésteres, etc.
El BOP, al emplearse en la síntesis de péptidos, genera a la hexametilfosforamida (HMPA) como sub-producto, compuesto ampliamente conocido por sus propiedades carcinogénicas [2,3] y dado que es altamente soluble en agua, es un agente contaminante de difícil eliminación en las aguas de desecho del proceso.
Dos rutas de síntesis de BOP bastante económicas fueron reportadas por Castro y colaboradores, la primera, utiliza una solución comercialmente disponible de fosgeno en tolueno al 20%/HMPA [4] y la segunda utiliza al oxitricloruro de fósforo (POC13)/HMPA [5].
Recientemente, en este laboratorio, se desarrolló la síntesis de BOP [6] por medio del uso de trifosgeno (TPA) e hidroxibenzotriazol. Dicha síntesis consistió en hacer reaccionar el TPA y HMPA a 0°C por dos horas. Posteriormente se hizo reaccionar con hidroxibenzotriazol monohidratado para generar el cloruro de benzotriazoliloxitris[dimetilamino] clorofosfonio (BOP-Cl) y por último se intercambió el anión cloruro por el hexafluorofosfato con KPF6, para obtener al reactivo BOP.
En el presente trabajo se reporta a la síntesis de BOP en fase sólida (Resina-BOP), planteando enlazar covalentemente la HMPA a una fase sólida, para impedir su liberación en agua.
Resultados y discusión
La síntesis de la resina-BOP se llevó a cabo siguiendo el esquema propuesto en la Fig. 1 que consiste en el uso de la resina de Merrifield seleccionada por su alta estabilidad en medio ácido. En el primer paso la resina se expandió con DMF y se sometió a una reacción con el clorhidrato de metilamina en presencia de carbonato de potasio para formar la metilaminoresina 4.
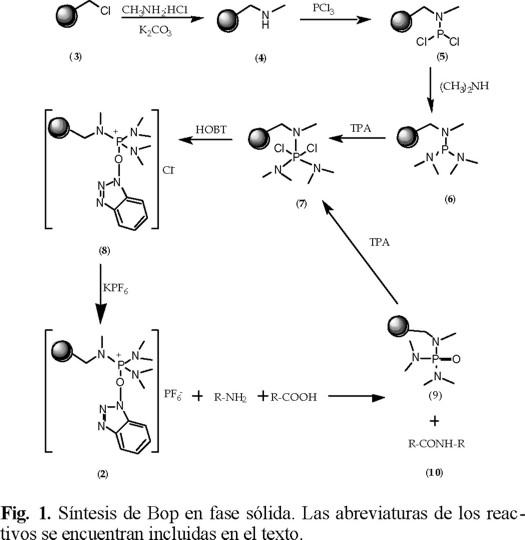
Al establecer las condiciones óptimas para la primera etapa, se agregó a la resina una solución de tricloruro de fósforo (PCl3) en éter anhidro, en atmósfera inerte, manteniendo la temperatura a 0°C, por 2 horas, la resina 5 así obtenida fue lavada con éter anhidro para eliminar el exceso de reactivo. La resina 5 prelavada se suspendió en éter anhidro y se le burbujeó dimetilamina por espacio de 5 minutos, controlando la presión en un flujo no mayor de 20 mL/min. La bis (dimetil-amino)-metilamino-resinfosfina 6 obtenida se hizo reaccionar con TPA para formar la resina 7. Posteriormente, se le agregó una solución de hidroxibenzotriazol en DMF como solvente y por ú1timo se intercambió al anión cloruro por el de hexafluorofosfato con KPF6 sintetizando de esta manera la resina-BOP 2. Se comprobó la eficiencia del intercambio del anión cloruro por el de hexafluorofosfato al utilizar como solvente a la DMF. Al utilizar agua como solvente se encontró un menor rendimiento (~64%) y esto es debido a que el intercambio del anión es mas lento ya que el agua no permite que la resina se expanda adecuadamente y compite con el anión hexafluorofosfato produciendo hidrólisis de la resina-BOP-Cl (8).
La evolución de las reacciones fueron determinadas por espectroscopía de infrarrojo (FT-IR), permitiendo establecer las condiciones óptimas. En todas las etapas se utilizó el método de Volhard para establecer la presencia del anión cloruro, ya que este es proporcional al grado de conversión de la resina.
La resina-BOP 2 se utilizó para sintetizar un dipéptido-quinazolinediona (10) [7] (Fig. 2). Esta sustancia pertenece a un grupo de compuestos que actualmente están siendo sometidos a pruebas biológicas por presentar actividad antihipertensiva.
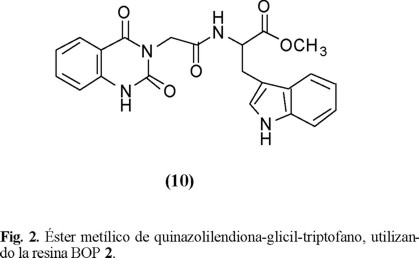
Se comprobó la eficiencia de la resina-BOP (2) al producir el péptido (10) con un 94% de recuperación y se analizó la mezcla de reacción corroborándose que no existía la presencia de HMPA.
Parte experimental
El punto de fusión fue obtenido empleando un equipo Electrothermal 88629 y el análisis elemental de carbono e hidrógeno fue realizado por Galbraith Laboratories, Incorporated (Knoxyville, TN). Los espectros de infrarojo (IR) no corregidos se registraron con un espectrofotómetro FT-IR Perkin Elmer 1605. Para la obtención de los espectros de resonancia magnética nuclear de protón y carbono-13, se empleó un espectrómetro Varian Gemini 2000, 200 MHz, utilizando como estándar interno TMS en CDCl3. El espectro de masas fue obtenido empleando un espectrómetro Hewlett-Packard 5989 A, por inserción directa y con electroionización a 70 eV. El espectro de masas de alta resolución fueron realizados en la universidad de California (Mass Spectra Facility, Riverside), en un equipo VG 7070. La pureza de la amida 10 fue evaluada en un cromatógrafo líquido de alta resolución (Hewlett-Packard SII-1090) con un detector de arreglo de diodos.
Cuantificación de cloro por el método de Volhard
Se colocaron 200 mg de la resina en un tubo de ensaye junto con 3 mL de piridina y se calentó en baño María por dos horas. La mezcla fue transferida a un matraz erlenmeyer de 125 mL usando 30 mL de AcOH al 50 % y después se agregaron 5 mL de HNO3 concentrado (agitando manualmente), posteriormente se agregó con una bureta 5 mL de solución AgNO3 0.1 N, y 25 mL de agua desionizada y 20 mL de tolueno. Se agitó por 5 minutos con un agitador magnético. Se agregaron tres gotas de indicador [NH4Fe(SO4)2] y se tituló con una solución de NH4SCN 0.1 N.
Resina-N-Metilamina (4)
En un matraz de fondo redondo de 250 mL de boca esmerilada 24/40 se agregó la resina Merrifield (1.00 g, 1.080 meq) y se expandió en DMF (10 mL) con agitación vigorosa durante 20 min. Después de este periódo se adicionó clorhidrato de metilamina (0.36 g, 5.4 mmol) en presencia de carbonato de potasio K2CO3 (0.75g, 5.5 mmol), se dejó en agitación constante durante 20 horas en atmósfera inerte a temperatura ambiente. La mezcla se filtró y se le hicieron lavados con los siguientes solventes: 1) DMSO (3 ´ 30 mL); 2) CH3OH (3 ´ 30 mL); 3) H2O (3 ´ 30 mL); 4) CH3OH (3 ´ 30 mL) y 5) CH2Cl2 (3 ´ 30 mL). Por último la resina se secó a vacío obteniéndose 0.96 g de resina; se determinó al porcentaje de conversión igual a 98 % en base al método de Volhard. IR (KBr): 3354 (NH); 2954 (CH alifático); 1601(C=C); 1589; 1446; 1343 (CH fuera del plano); 757 (CH balanceo) cm−1.
Resina-N-metilaminodiclorofosfito (5)
La resina-N-metilamina (0.61g, 0.650 meq) se colocó en un matraz de fondo redondo y se expandió en éter etílico (20 mL) durante 20 min con agitación constante, en atmósfera inerte, a temperatura de 0°C. Una solución de tricloruro de fósforo PCl3, (3 mL) y éter etílico (10 mL) fue adicionada gota a gota, en un tiempo aproximado de 10 min. La suspensión se dejo reaccionar en un baño de hielo con agitación constante durante media hora y se continuó una hora más a temperatura ambiente. La resina se filtró y se lavó con éter etílico (6 ´ 30 mL). Por último se secó a vacío (80 °C) obteniéndose 0.63 g de resina con un grado de conversión igual a 98 %. IR (KBr): 3025 (C-H Aromático); 2954 (C-H alifático); 1600(C=C); 1589; 1446; 1369 (C-H fuera del plano); 1026 (C-N); 759 (C-H balanceo); 657 (P-Cl) cm−1.
Bis-(dimetilamino)-metilamino-resinfosfina (6)
En un matraz de tres bocas (fondo redondo) se colocó la resina N-metildiclorofosfito (0.25 g, 0.270 meq) y se expandió en éter etílico (10 mL). El matraz se colocó en un baño de hielo y se burbujeó dimetilamina por una de sus bocas durante 5 min, controlando la presión mediante una válvula de aceite con un flujo de 20 mL/min. La reacción se llevó a cabo bajo atmósfera inerte. La resina se filtró y se lavó con; éter etílico (3 ´ 30 mL), DMF (3 ´ 30 mL), CH3OH (3 ´ 30 mL), H2O (3 ´ 30 mL), CH3OH (3 ´ 30 mL) y CH2Cl2 (3 ´ 30 mL). Por último, se secó a alto vacío donde se obtuvieron 0.24 g de resina con un grado de conversión igual a 98 %. IR (KBr): 3025 (C-H Aromático); 2964 (C-H alifático); 1598(C=C); 1489; 1423; (C-H fuera del plano); 1023 (C-N); 754 (C-H balanceo) cm−1.
Bis-(dimetilamino)-metilamino-resindiclorofosfato (7)
Se colocó la resina 6 (0.30 g, 0.327 meq) en un matraz de fondo plano y se expandió en diclorometano CH2Cl2 (10 mL) en atmósfera inerte con agitación vigorosa durante 20 min; posteriormente se adicionó TPA (0.30 g, 1.01 mmol) y se dejó reaccionar por espacio de 12 horas. La resina se filtró y lavó con CH2Cl2 (6 ´ 30 mL), por último se secó a vacío obteniéndose 0.30 g de la resina con un grado de conversión igual a 98 %. IR (KBr): 3025 (C-H Aromático); 2954 (C-H alifático); 1595(C=C); 1487; 1446; 1359 (C-H fuera del plano); 1180; 1072; 1026 (C-N); 749 (C-H balanceo); 657 (P-Cl) cm−1.
Resina-BOP-Cl (8)
Se expandió la resina 7 (0.38 g, 0.400 meq) en CH2Cl2 (10 mL) durante 20 min. La mezcla se transfirió a un matraz de fondo redondo de 25 mL (24/40); donde se adicionó hidroxibenzotriazol (0.30 g, 2.22 mmol), la solución se enfrió en baño de hielo durante 11/2 hora. Posteriormente se adicionó trietilamina (0.5 mL) y se dejó reaccionar bajo atmósfera inerte por espacio de 12 horas. Por ú1timo la resina se filtró, se lavó con; DMF (3 ´ 30 mL), CH2Cl2 (3 ´ 30 mL) y con éter etílico (3 ´ 30 mL). Se secó a vacío obteniéndose 0.40 g de resina con un grado de conversión igual a 95 %. IR (KBr): 3030 (C-H Aromático); 2964 (C-H alifático); 1600(C=C); 1441; 1369 (C-H fuera del plano); 1267; 1159; 1026 (C-N); 753 (C-H balanceo); 657 (P-Cl) cm−1.
Resina-BOP (2)
En esta última parte de la reacción se expandió la resina-BOP-Cl (0.13g, 0.138 meq) con dioxano (5 mL), en un matraz de fondo redondo, con agitación vigorosa durante 20 min. Después de este lapso se adicionó una solución saturada de hexafluorofosfato de potasio en DMF (10 mL) y se dejó reaccionando por espacio de 3 horas; la reacción se llevó a cabo bajo atmósfera inerte. Por último se filtró la resina y se lavó con los siguientes solventes: H2O (3 ´ 20 mL); dioxano (3 ´ 20 mL); CH3OH (3 ´ 20 mL) y CH2Cl2 (3 ´ 20 mL). Por ú1timo la resina se secó a alto vacío obteniéndose 0.12 g de resina con un grado de conversión igual a 98 %. IR (KBr): 3026 (C-H Aromático); 2913 (C-H alifático); 1595(C=C); 1487; 1446; 1364 (C-H fuera del plano); 1026 (C-N); 846 (P-F); 754 (C-H balanceo) cm−1.
Ester metílico de N'-1,2,3,4-tetrahidro-2,4-dioxoquinazolin-3N-ilacetil triptofano (10). En un matraz de fondo redondo de 250 mL de una boca esmerilada 24/40 y con un desecador de cloruro de calcio, se colocó el ácido quinazolinediona-N-glicina (0.05 g, 0.226 mmol) en DMF anhidro (10 mL). Se agregó la resina-BOP (2) (0.10 g, 0.226 meq), el éster metílico de L-triptofano (0.08 g, 0.226 mmol) y la trietilamina (0.05 g, 0.480 mmol). La mezcla se mantuvo a temperatura ambiente con agitación constante por 3 horas. La suspención se lavó con agua (10 mL) y acetato de etilo (3 ´ 10 mL). Al filtrado se le agregó HCl diluído (5%, 10 mL), separando la fase orgánica que fue lavada con NaHCO3 (5%, 10 mL) y por último con agua (10 mL). La fase orgánica fue secada con Na2SO4 anhidro y el exceso de solvente fue eliminado por presión reducida. El producto obtenido fue un sólido blanco cristalino que no requirió otro proceso de purificación (95 mg, 94%). Se evaluó la pureza del producto con HPLC (~cuant.). Punto de fusión 156-158°C. IR (KBr): 3383(NH), 1736(COCH3), 1639 (NHCO) cm−1. 1H RMN (200MHz, CDCl3): d 11.02 (sa, 1H, CO-NH); 9.83(sa, 1H, CO-NH); 7.99(d, 1H, J = 8.0 Hz, Ar-H); 7.65-7.05(m, 8H, Ar-H); 5.07(m, 1H, N-CH-C0); 4.74 (dd, 2H, J1 = J2 = 15.9 Hz, CH2-N); 3.60(s, 3H, O-CH3); 3.28(d, 2H, J = 5.8 Hz, CH2-indol). 13C RMN (50MHz, CDCl3): d 172.56 (C=O), 167.38 (C=O), 151.06 (C=O), 139.86 (C=O), 136.57, 135.17, 128.24, 124.20, 122.95, 121.68, 119.28, 118.56, 115.79, 111.76, 109.34, 53.59, 52.59, 43.41, 28.05 ppm. 13C RMN (DEPT, 50MHz, CDCl3): d 136.57, 135.17, 128.24, 124.20, 122.95, 121.68, 119.28, 118.56,115.79, 111.76, 53.59(CH); 43.41, 28.05 (CH2); 52.59(CH3). EM (m/e): : 420 (M+), 219, 201, 130. EM de alta resolución m/z: encontrado 420.1425; calculado para C22H20N4O5 420.1435. Análisis calculado para C22H20N4O5 (1/2H2O): C, 61.53; H, 4.89. Encontrado: C, 61.93; H, 5.21%.
Agradecimientos
Los autores agradecen por el financiamiento de los proyectos No. 28488E a CONACyT y No. 664.99-P al COSNET. Asimismo, Rosalva Aceves agradece a CONACyT por la beca de maestría otorgada.
Referencias
1. (a) Merrifield, R .B. Angew Chem. 1985, 97, 801; [ Links ] Angew, Chem. Int. Ed. Engl., 1985, 24, 799. [ Links ] (b) Merrifield, R. B. Advan. Enzymol. 1969, 32, 221. [ Links ] (c) Merrifield, R. B. J. Am. Chem. Soc., 1963, 85, 2149. [ Links ] (d) Barany, G.; Merrifield, R. B. The peptides, Vol 3, Gross, E. and Meienhofer, J., Ed. Academic Press, Nueva York, 1979. [ Links ]
2. Lloydd, J. W. J. Am. Ind. Hyg. Assoc. 1975, 25, 662. [ Links ]
3. Shott, L. D.; Borkovee, A. B.; Knapp, W. A. J. Toxicol. Appl. Pharmacol, 1971, 18, 499-502. [ Links ]
4. Castro, B.; Evin, G.; Selve, C.; Seyer, R. Synthesis, 1977, 413. [ Links ]
5. Castro, B.; Dormoy, J. R.; Dourtouglou, B.; Evin, G.; Selve, C.; Ziegler, J. C. Synthesis, 1976, 751. [ Links ]
6. Rivero, I. A.; Somanathan R.; Hellberg, L. H. Synthetic Commun., 1995, 25, 2185-2188. [ Links ]
7. Rivero, I. A.; Somanathan R.; Hellberg, L. H. Synthetic Commun., 1998, 28, 2077-2086. [ Links ]














