Introducción
Según la Asociación Internacional para el Estudio del Dolor (IASP por sus siglas en inglés) el dolor se define como «… una experiencia sensorial o emocional desagradable asociada a un daño real o potencial en un tejido, o descrito en términos de dicho daño»1. Este síntoma es uno de los más frecuentes en personas con cáncer y difiere en sus características con el que experimentan personas sin cáncer2.
El dolor impacta en todos los aspectos de la vida de una persona, no sólo interfiriendo con su actividad sino también con sus emociones, motivaciones, relaciones interpersonales y calidad de vida en general3. Existe suficiente evidencia que demuestra la relación entre supervivencia y control del dolor2; de allí la importancia de controlar el dolor a través de intervenciones efectivas.
Para lograr el control de dolor en los pacientes con cáncer, es necesario que el personal de salud se familiarice con la patogénesis de dolor oncológico, las técnicas de evaluación, el tratamiento farmacológico y no farmacológico y las barreras que se presentan para brindar una adecuada analgesia2.
La escalera analgésica de la Organización Mundial de la Salud (OMS) es el algoritmo más usado para el tratamiento de dolor oncológico; sin embargo, esta aproximación no es suficiente para lograr los objetivos en esta población4. El objetivo de este estudio fue describir recomendaciones basadas en la evidencia para el manejo integral del dolor oncológico, teniendo en cuenta la complejidad que implica el tratamiento de estos pacientes; el documento incluye aspectos relacionados con el manejo de analgésicos no opioides, titulación, rotación, escalonamiento y manejo de efectos adversos de opioides y otras estrategias de tratamiento.
Metodología
Revisión temática basada en una búsqueda de literatura de guías de práctica clínica (GPC) para el manejo integral del dolor oncológico. Esta búsqueda se llevó a cabo en agosto de 2017 en organismos desarrolladores de GPC como NGC (National Guideline Clearinghouse), G-I-N (Guideline International Network), CISMeF (Catalogage et l’Indexation des Sites Médicaux), German Agency for Quality in Medicine, NZGG (New Zealand Guidelines Group), NICE (National Institute for Clinical Excellence) y SIGN (Scottish Intercollegiate Network). Se utilizaron términos de búsqueda como pain management AND cancer pain, y se incluyeron estudios en idioma inglés y español y publicaciones completas entre 2012 a 2017. De los estudios incluidos se recolectó información relacionada con la evaluación, clasificación, indicaciones de tratamiento, principios de manejo farmacológico y no farmacológico.
Resultados
Se incluyeron 12 estudios para el manejo del dolor oncológico, después de la eliminación de duplicados. A continuación, se presentan los aspectos más relevantes de la información identificada en la presente revisión.
El dolor se presenta en aproximadamente 25% de los pacientes recién diagnosticados con una neoplasia, 33% de los pacientes en tratamiento antineoplásico y 75% de los pacientes con enfermedad avanzada2. Los cánceres con más alta prevalencia de dolor, son el pancreático (44%) y el cáncer de cabeza y cuello (40%)5.
A pesar de ser uno de los síntomas a los que más temor se tiene, muchos pacientes con cáncer que sufren de dolor no reciben un manejo adecuado para su control, incluso en países desarrollados6. En estudios conducidos en Europa se encontró que el dolor puede estar presente en cualquier etapa de la enfermedad y que no es adecuadamente tratado en el 56 a 82.3% de los pacientes5. Incluso en centros especializados en cáncer y manejo del dolor, un 9.8 a 55.3% de los casos están inadecuadamente tratados5,7. Así, el dolor oncológico inadecuadamente tratado constituye un problema de salud pública, si se tiene en cuenta que la incidencia de cáncer sigue en aumento pasando de 12,667,470 casos nuevos en 2008 a más de 15 millones de casos para 2020, según proyecciones6.
Evaluación
La evaluación exhaustiva del dolor es esencial para asegurar un manejo adecuado, se debe realizar desde el momento del diagnóstico, con seguimiento a intervalos regulares y cuando se inicie un nuevo tratamiento. En la medida de lo posible, la intensidad del dolor debe ser cuantificada por el paciente usando una escala numérica de 0 a 10, o una escala pictórica5,7,8. La escala de dolor con caras (Figura 1) puede ser útil en pacientes que presenten dificultades con otras escalas, como niños o adultos mayores y pacientes que no hablen español o con otras barreras de comunicación.
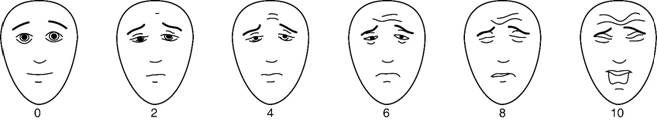
Fuente: Hicks CL, von Baeyer CL, Spafford PA, van Korlaar I, Goodenough B. The Faces Pain Scale-Revised: toward a common metric in pediatric pain measurement. Pain. 2001;93:173-183.
Bieri D, Reeve RA, Champion GD, Addicoat L, Ziegler JB. The Faces Pain Scale for the self-assessment of the severity of pain experienced by children: development, initial validation, and preliminary investigation for ratio scale properties. Pain. 1990;41:139-150.
Figura 1: Escala de dolor con caras revisada (FPS-R).
Si el paciente no puede comunicar verbalmente el dolor, se debe buscar un método alternativo para evaluarlo como una escala no verbal2. Cuando el déficit cognitivo es severo, la observación de signos de dolor (expresión facial, movimientos corporales, verbalización o vocalización, cambios en la interacción personal o cambios en la rutina) es una estrategia para identificar la presencia de este síntoma5. También debe interrogarse a familiares o cuidadores al respecto3,7,8.
Cuando en la primera evaluación el paciente no presenta dolor, debe evaluarse en cada visita8 o cuando el paciente lo requiera. Por el contrario, si la evaluación cuantitativa del dolor arroja un valor superior a 0, se debe iniciar una evaluación exhaustiva. La evaluación exhaustiva debe enfocarse en el tipo, las características, tiempo de evolución, intensidad, localización e irradiación del dolor. Se debe interrogar acerca de factores que exacerban o alivian, tratamiento analgésico actual, respuesta al tratamiento, tratamientos anteriores, episodios agudos de dolor o crisis no controladas con el tratamiento actual, factores psicosociales asociados (estrés, red de apoyo, historia psiquiátrica, etc.) y otras características relacionadas con el dolor (significado del dolor para el paciente y su familia, creencias y actitudes culturales hacia el dolor, expresión del dolor, consideraciones espirituales o religiosas, etc.)4-6,8. Es importante también, conocer las metas y expectativas del paciente y su familia respecto al manejo del dolor, incluyendo nivel de confort y funcionalidad2,8.
También es necesario descartar la presencia de causas del dolor que requieran tratamiento específico, esto a través de la realización de un examen físico completo y revisión de paraclínicos7. Se recomienda evaluar riesgo de abuso y desviación de opioides, que puede ser identificado desde la primera consulta usando herramientas de screening como SOAPP-R (Screener and Opioid Assessment for Patients with Pain-Revised)9 u ORT (Opioid Risk Tool)10, que buscan predecir qué pacientes, candidatos para uso de opioides a largo plazo, pueden presentar abuso en el futuro y requieren un seguimiento más frecuente.
Finalmente, la evaluación permitirá diagnosticar el origen fisiopatológico del dolor (somático, visceral o neuropático) para, con toda la información previa, determinar una estrategia de tratamiento individualizada basada en circunstancias clínicas y deseos del paciente, siempre teniendo como meta el mejoramiento de la calidad de vida con la mayor funcionalidad2,6.
Clasificación
La estrategia terapéutica por elegir depende de la fisiopatología del dolor, la cual se determina tras la evaluación del paciente. El dolor tiene dos mecanismos predominantes:
1. El dolor nociceptivo resulta del daño directo a estructuras somáticas y viscerales que activa los nociceptores presentes en piel, vísceras, músculos y tejido conectivo. El dolor nociceptivo puede dividirse en somático y visceral5. El dolor somático por lo general se produce después de procedimientos quirúrgicos o por metástasis óseas y se caracteriza por ser tipo peso, bien localizado, palpitante y tipo presión. El dolor visceral es, en la mayoría de los casos, secundario a compresión, infiltración o distensión de una víscera abdominal o torácica y se describe como difuso, tipo cólico2.
2. El dolor neuropático, por su parte, resulta del daño al sistema nervioso central o periférico. Se caracteriza por ser urente o punzante, puede presentarse por compresión de estructuras nerviosas, efectos adversos de quimioterapia (p.e. vincristina) o radioterapia o por lesión nerviosa directa en cirugía2.
Principios de manejo del dolor oncológico
Según las guías de práctica clínica de la NCCN (National Comprehensive Cancer Network) los principios de manejo del dolor oncológico son:
El manejo del dolor es esencial para maximizar los resultados en los pacientes, la evidencia disponible muestra que la supervivencia está ligada al control efectivo del dolor.
A todos los pacientes se les debe indagar acerca de dolor en cada contacto con el servicio de salud y se debe realizar una evaluación exhaustiva en caso de que el paciente manifieste la existencia de éste.
La meta es mejorar la calidad de vida del paciente y maximizar su funcionalidad.
La mayoría de los pacientes tienen diferentes tipos fisiopatológicos de dolor.
Al administrar la terapia analgésica se debe tener en cuenta los otros síntomas que presente el paciente y el manejo farmacológico que se esté brindando.
Las cualidades del dolor descritas por el paciente y la cuantificación de la intensidad deben tenerse en cuenta para guiar la terapéutica.
La reevaluación de la intensidad del dolor debe realizarse a intervalos específicos para asegurar que la terapia seleccionada está brindando el máximo beneficio con la mayor seguridad posible.
El dolor oncológico persistente, con frecuencia requiere tratamiento con analgésicos en horarios regulares con dosis de rescate de acuerdo con la necesidad, en casos de crisis.
El manejo del dolor debe realizarse por un equipo multidisciplinario.
Dada la naturaleza multifacética del dolor oncológico, el uso de intervenciones integrativas, incluso modalidades físicas y cognitivas deben ser optimizadas.
Debe haber disponibilidad de soporte psicosocial.
Debe brindarse material educativo específico para pacientes, familia y cuidadores.
La experiencia del dolor se asocia con sufrimiento. El impacto multidimensional del sufrimiento en pacientes y sus familias debe ser tenido en cuenta y ser abordado respetando las creencias y cultura de las personas.
En las guías de la Sociedad Europea de Oncología (ESMO por sus siglas en inglés)5 se recomienda:
Involucrar al paciente y que éste tenga un papel activo en el manejo de su dolor.
Para prevenir la aparición de dolor, es importante el uso de analgésicos por horario, teniendo en cuenta la vida media, la biodisponibilidad y la duración de la acción de los diferentes medicamentos.
Prescribir una terapia que pueda ser administrada de manera sencilla y sea de fácil manejo para el paciente y su familia, especialmente cuando éste está en casa. Así, si el paciente tolera la vía oral, ésta es la mejor vía de administración.
Metas en el manejo del dolor oncológico
Las metas en el manejo del dolor involucran lograr una disminución del dolor en un 30 al 50% del inicial, prevención y tratamiento de los efectos adversos del tratamiento, maximizar la funcionalidad y mejorar la calidad de vida del paciente2,8.
Para lograrlo, es necesario reconocer que el dolor es multidimensional y no sólo afecta la esfera física, también la sociológica, psicológica y cultural. Las personas con dolor sufren, así como su familia, cuidadores e incluso profesionales tratantes8.
Tratamiento
• Pacientes con dolor leve
Se recomienda que los pacientes con dolor leve (puntaje de 1 a 3) que no hayan sido tratados con opioides previamente, sean tratados con acetaminofén o AINEs, ya que estos medicamentos han demostrado ser efectivos para el control del dolor en este tipo de pacientes2,5,6,8. El tipo de analgésico no opioide debe ser elegido de manera personalizada teniendo en cuenta comorbilidades, efectividad y tolerabilidad individual6. Algunas guías sugieren el uso de opioides débiles como el tramadol, la codeína y la hidrocodona en combinación con analgésicos no opioides5,8. En Colombia, la codeína y la hidrocodona sólo se encuentran disponibles en combinación con analgésicos no opioides.
En el caso que se ofrezca tratamiento con AINEs, se debe definir un tiempo limitado de uso e iniciar protección gástrica con inhibidores de la bomba de protones, anti-H2 o análogos de prostaglandinas6. Si no hay respuesta a los analgésicos no opioides, se recomienda tratar como pacientes con dolor moderado a severo6.
• Pacientes con dolor moderado a severo
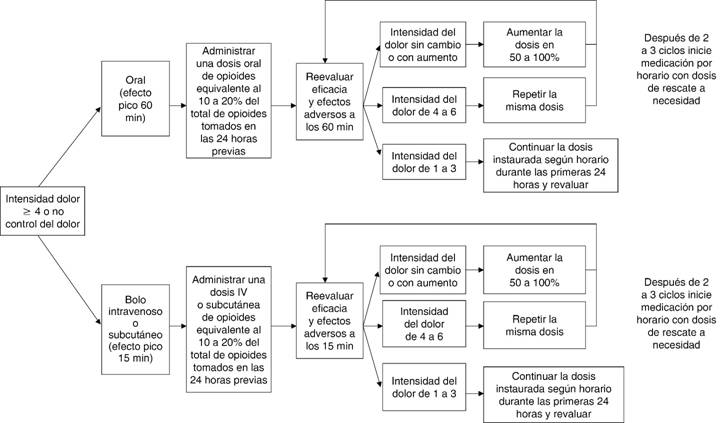
Para pacientes con dolor leve que no responden a no opioides y para pacientes con intensidad del dolor mayor o igual a cuatro, se recomiendan opioides de corta acción2,6-8, que tienen la ventaja de un rápido inicio del efecto analgésico (Figura 2). Aunque la evidencia disponible no muestra diferencias significativas entre morfina, oxicodona y fentanilo, respecto a la eficacia6, se recomienda iniciar con clorhidrato de morfina de corta acción, de 5 a 15 mg vía oral7,11. La hidromorfona y oxicodona, en sus formulaciones de liberación inmediata o liberación modificada para administración oral son alternativas efectivas a la morfina5. En ningún caso se recomienda el uso de meperidina. En caso de dolor intenso que requiere alivio inmediato, se recomiendan opioides parenterales (intravenosos o subcutáneos), 2 a 5 mg intravenosos de clorhidrato de morfina, la dosis equivalente es un tercio de la dosis oral2,5.
Adaptado de: Swarm RA, Abernethy AP, Anghelescu DL, Benedetti C, Buga S, Cleeland C, et al. Adult cancer pain. J Natl Compr Canc Netw. 2013;11:992-1022.
Figura 2: Manejo de dolor moderado a severo en pacientes sin consumo previo de opioides.
El fentanyl y la buprenorfina de administración transdérmica están reservados para pacientes con requerimientos estables de opioides. Generalmente se usan en pacientes con dificultad para la deglución, aquellos con pobre tolerancia a la morfina y pacientes con mala adherencia5,7.
Opioides
La titulación es el proceso en el cual la dosis de opioide es rápidamente modificada para encontrar la dosis que brinda balance entre control del dolor y efectos adversos del medicamento, tanto en pacientes que están recibiendo opioides como en pacientes que van a iniciar manejo del dolor con opioides8. La morfina tiene una vida media corta y está indicada durante la fase de titulación, para tratar episodios de exacerbación y para tratar episodios predecibles de dolor agudo en pacientes con analgesia regular (la administración debe realizarse 20 a 30 minutos antes del episodio predecible de dolor agudo)5,7. También pueden ser usadas para titulación, la oxicodona y la hidromorfona7. Todos los pacientes deben recibir dosificación continua (morfina cada cuatro horas) con provisión de una dosis de rescate para manejar exacerbaciones transitorias de dolor. La dosis de rescate es usualmente equivalente a 10 a 15% del total de la dosis diaria. Los opioides de inicio de acción rápida y corta duración son los preferidos para usar como medicamentos de rescate5. Si se requieren más de cuatro dosis de rescate al día, se debe adaptar la dosis horaria prescrita de opioides. Después del período de titulación, se recomienda usar opioides de liberación lenta y la dosis se ajustará teniendo en cuenta la cantidad de morfina de rescate usada5.
Así para la formulación de la dosis necesaria de opioides se debe tener en cuenta la dosis usada durante las 24 horas previas. Las dosis de morfina oral en pacientes sin consumo previo de opioides están alrededor de 5 a 10 mg cada cuatro horas en pacientes jóvenes y adultos y de 2.5 a 5 mg en adultos mayores. Se recomienda iniciar con una formulación de liberación inmediata de opioides, con la que se logra más rápidamente el control del dolor. Esto también permite realizar una medición y titulación tempranamente. Un ejemplo de titulación de opioides se presenta en el Cuadro I 3. Es necesario estar alerta a las interacciones medicamentosas al decidir el plan de tratamiento2.
Cuadro I: Ejemplo de titulación de opioides.
| Dosis regular de opioides | Frecuencia de la dosis | Dosis de rescate | Frecuencia de opioides para crisis de dolor | Total de opioides en 24 horas | Nueva dosis titulada |
|---|---|---|---|---|---|
| Jóvenes y adultos: 5 mg de clorhidrato de morfina | Cada 4 horas | 3 mg de clorhidrato de morfina | Tres veces al día | (5 x 6) + (3 x 3) = 39 mg | 6 mg de clorhidrato de morfina cada 4 horas |
| Adultos mayores: 2.5 mg de clorhidrato de morfina | Cada 4 horas | 1.5 mg de clorhidrato de morfina | Tres veces al día | (2.5 x 6) + (1.5 x 3) = 19.5 mg | 3 mg de clorhidrato de morfina cada 4 horas |
Adaptado de: Scottish Intercollegiate Guidelines Network. SIGN 106 Control of pain in adults with cancer.
• Administración de opioides
Se recomienda usar la ruta menos invasiva, más fácil y segura con la que se pueda lograr una analgesia adecuada2,6. La vía oral es la preferida para administración de terapia crónica y es la primera que debe ser considerada, a menos que se requiera un inicio rápido de acción o el paciente haya experimentado eventos adversos con la administración por esta vía2.
La infusión parenteral continua, la administración intravenosa o subcutánea se recomienda en pacientes que no pueden digerir o absorber opioides por vía enteral, cuando se requiera un rápido inicio de acción o cuando hay un inadecuado control del dolor con administración oral o transdérmica6,7. Por esta vía, los opioides alcanzan rápidamente concentraciones plasmáticas efectivas (15 minutos por vía intravenosa y 30 minutos por vía subcutánea) comparadas con la vía oral o transdérmica (60 minutos)2.
La vía subcutánea debe ser la primera opción en pacientes a quien no se les puede administrar el opioide por vía oral o transdérmica; si la vía subcutánea está contraindicada (por edema periférico, desórdenes de coagulación, mala circulación periférica y necesidad de altos volúmenes o dosis) se debe usar la vía intravenosa7. En pacientes con dolor oncológico con dificultades para la deglución o en caso de estreñimiento severo, la vía transdérmica es una opción no invasiva y efectiva de analgesia. La administración rectal de opioides sólo debe considerarse como segunda opción, debido a que con frecuencia no está disponible y no es aceptada por muchos pacientes7.
• Rotación de los opioides
Ningún opioide es óptimo para todos los pacientes. Si no se logra un adecuado control del dolor, si se pierde la vía de administración o si los efectos adversos son significativos, se debe cambiar el opioide en una dosis equivalente, con el fin de alcanzar control del dolor con efectos adversos tolerables, esto es lo que se conoce como rotación8. Para esto se deben tener en cuenta los radios de equianalgesia, para evitar la sobredosificación o subdosificación2. Cuando un opioide es cambiado por analgesia insatisfactoria, efectos adversos intolerables, o ambos, la dosis de inicio debe ser menor a la dosis calculada (25 a 50% de reducción) a partir de los radios equianalgésicos. En todos los casos, las dosis necesitan ser tituladas de acuerdo a la respuesta clínica4,7,8.
Cuando se cambie de morfina oral a subcutánea o intravenosa, la potencia analgésica relativa es de 2:1 y 3:1 (Cuadro II)7.
Cuadro II: Potencia analgésica relativa.
| Morfina oral a oxicodona | 2:1 |
| Morfina oral a hidromorfona | 5:1 |
| Morfina oral a metadona* | 10:1 |
| Morfina oral a buprenorfina TD | 75:1 |
| Morfina oral a fentanyl TD | 150:1 |
TD = transdérmico, ejemplo: 60 mg de morfina oral a 0.8 mg de buprenorfina TD por 24 horas (35 μg/h). 90 mg de morfina oral a 0.6 mg de fentanyl por 24 horas (25 μg/h).
*La metadona es un opioide de tercera línea y de uso exclusivo del especialista.
Adaptado de: German Guideline Program in Oncology. Guideline Palliative Care Short Version [Internet]. 2015.
• Prevención y tratamiento de los efectos adversos relacionados con la administración de opioides
El uso de opioides se relaciona con efectos adversos como constipación, náuseas/vómito, retención urinaria, prurito y toxicidad del sistema nervioso central (somnolencia, alteraciones cognitivas, confusión, alucinaciones, mioclonías, depresión respiratoria y raramente hiperalgesia o alodinia). Una forma de disminuir su incidencia o severidad es a través de la reducción en la dosis de opioides, lo que puede lograrse usando un analgésico coadyuvante u otra alternativa analgésica5.
También se pueden emplear estrategias específicas para controlar los síntomas, como antieméticos (metoclopramida y antidopaminérgicos) para las náuseas, laxantes (polietilenglicol con 8 onzas de agua dos veces al día) y consumo adecuado de líquidos para la constipación, antihistamínicos para el prurito, tranquilizantes para la confusión y estimulantes para la somnolencia2,5,7,11.
Algunos efectos adversos, en especial los neurológicos pueden deberse a acumulación tóxica de metabolitos, por lo que cambiar a otro opioide u otra vía de administración, puede permitir una nueva titulación para analgesia adecuada sin los mismos efectos adversos5.
Uno de los eventos adversos más graves es la depresión respiratoria, por lo que se debe tener especial atención en pacientes con reserva cardiopulmonar limitada ya que son los más susceptibles y que previo a la hipoxia aparece hipercarbia2. Para revertir los efectos de los opioides se usa la naloxona, un antagonista opioide de corta acción, el cual debe ser administrado con precaución para no precipitar un síndrome de abstinencia a opioides en pacientes con tolerancia2. Si la frecuencia respiratoria del paciente es menor a ocho por minuto, el paciente está muy somnoliento o inconsciente o presenta cianosis: diluir una ampolla de naloxona de 400 microgramos en 10 mL de cloruro de sodio 0.9%. Administrar 0.5 mL (20 microgramos) IV cada dos minutos, hasta que el estado respiratorio del paciente sea satisfactorio. Pueden requerirse varios bolos de naloxona debido a que su tiempo de acción es más corto que el del clorhidrato de morfina y otros opioides12.
Como regla general, siempre que los síntomas mencionados aparezcan, deben descartarse otras causas orgánicas antes de asegurar que son debidos a los opioides, ya que estos síntomas, en especial náuseas, vómito y estreñimiento, pueden aparecer en caso de una obstrucción intestinal, que puede poner en riesgo inminente la vida del paciente5.
• Abuso y desviación de opioides
Aunque los opioides son los principales analgésicos para el manejo de dolor moderado a severo, su uso implica riesgos tanto para el paciente como para la sociedad. El abuso de opioides es de gran preocupación, pues cada vez se registran más casos de muertes relacionadas con uso inapropiado. Es por esta razón que se debe asegurar una adecuada prescripción de estas sustancias. Dentro de las responsabilidades del prescriptor se encuentra2:
Establecer metas para la terapia analgésica de manera individualizada y reevaluar regularmente la respuesta terapéutica a los opioides.
Evaluar en cada paciente factores de riesgo asociados a uso inapropiado o abuso de opioides.
Educar a los pacientes acerca del uso seguro, almacenamiento y disposición final de los opioides.
• Paciente con compromiso renal
En pacientes con compromiso severo de la función renal (tasa de filtrado glomerular < 30 mL/min) los opioides deben ser administrados con precaución. Los opioides de primera elección son el fentanyl o buprenorfina iniciando a bajas dosis y continuando con titulación cuidadosa7. Debido a la acumulación de metabolitos activos de la morfina, se debe disminuir la dosis y administrarse a intervalos más amplios, para disminuir el riesgo de eventos adversos7. El fentanyl transdérmico es el opioide de elección en pacientes que han recibido opioides previamente8.
• Paciente con compromiso hepático
Todos los opioides son metabolizados por el hígado. Ante enfermedad hepática su depuración disminuye y la biodisponibilidad y vida media de los opioides aumenta, así como la probabilidad de efectos adversos, secundario a altas concentraciones plasmáticas8.
El metabolismo de la morfina y la metadona no se altera significativamente en enfermedad hepática, por lo que pueden usarse en estos pacientes. Adicionalmente se recomienda disminuir la dosis, disminuir la frecuencia de administración o evitar el uso de acetaminofén si el paciente tiene enfermedad hepática o historia de consumo moderado o pesado de alcohol8. La vía transdérmica debe evitarse en estos pacientes, debido a que la absorción del medicamento puede ser variable e impredecible.
Otras opciones de tratamiento farmacológico
Es posible que los opioides no sean suficientes para lograr un control óptimo del dolor, pero usados en combinación con analgésicos no opioides (AINEs) u otros adyuvantes antidepresivos, anticonvulsivantes, agentes tópicos y corticosteroides) aumenta la probabilidad de que se alcancen los objetivos terapéuticos2. Medicamentos de varios grupos terapéuticos pueden ser usados como adyuvantes, incluyendo anticonvulsivantes (gabapentin, pregabalina), antidepresivos (inhibidores de la recaptación de serotonina, antidepresivos tricíclicos), corticosteroides, anestésicos locales/tópicos (parches de lidocaína). Son usados comúnmente para ayudar al manejo del dolor óseo, neuropático y visceral y para reducir la dosis sistémica de opioides2,8.
El gabapentin ha demostrado ser efectivo en el manejo del dolor en casos de mucositis en pacientes que reciben de manera conjunta radioterapia y quimioterapia. Los agentes tópicos como la lidocaína, son útiles para prevenir el dolor asociado a procedimientos y para aliviar el dolor neuropático, ya que actúan localmente y también tienen un efecto inhibitorio del dolor a nivel central2.
Los corticosteroides son efectivos en el manejo del dolor neuropático y para tratar el dolor óseo debido a su efecto antiinflamatorio. En cuanto a los analgésicos no opioides como el acetaminofén y los AINEs, recientemente se ha alertado respecto al exceso de uso de acetaminofén combinado con opioides por el riesgo de falla hepática, por lo que se debe prestar especial atención al riesgo de sobredosificación2. Con los AINEs se debe tener precaución por el riesgo de sangrado del tracto gastrointestinal y perforación, por lo que se debe interrogar al paciente previamente acerca de patologías gastrointestinales y uso concurrente de corticosteroides. Se recomienda siempre que se usen estos medicamentos, iniciar medidas de protección gástrica2. Además, debe tenerse en cuenta el potencial nefrotóxico de estos medicamentos, por lo que deben ser prescritos con precaución en pacientes mayores de 60 años, deshidratados, con insuficiencia renal, administración concomitante de otros nefrotóxicos y quimioterapia de excreción renal, para evitar toxicidad2.
Tratamiento de las exacerbaciones de dolor
Las exacerbaciones o «dolor incidental» se definen como una crisis de dolor que ocurre en el contexto de dolor relativamente bien controlado. Un episodio típico de exacerbación tiene una intensidad de moderada a severa con una duración relativamente corta (mediana de 30 minutos)5. Todo paciente con cáncer con dolor súbito y severo debe ser tratado como una urgencia médica8.
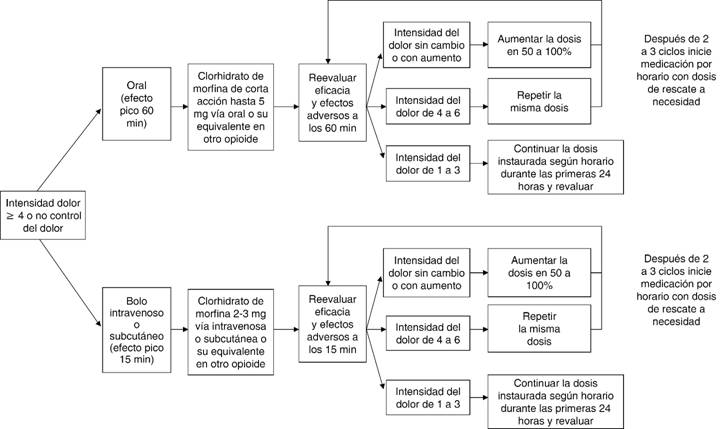
Formulaciones de opioides de liberación inmediata deben ser usadas para tratar las exacerbaciones de dolor. Se recomienda el uso de morfina oral de liberación inmediata para tratar los episodios predecibles de agudización del dolor (p.e. dolor al movimiento, con la deglución, etc.), 20 minutos antes del estímulo doloroso5,7,8,11. La dosis de rescate puede aumentarse si no se ha logrado el efecto analgésico buscado y si los efectos adversos son tolerables. La dosis recomendada corresponde al 10-20% de la dosis diaria de opioides recibida regularmente (Figura 3)6,8.
Seguimiento
El tratamiento subsiguiente está basado en la calificación del dolor por parte del paciente. Para el mantenimiento se debe administrar dosis regulares de opioides, con dosis de rescate a necesidad y manejo de los efectos adversos como la constipación. Además, se requiere soporte psicosocial y educación al paciente y su familia. Si no se observa una respuesta positiva al tratamiento, el paciente debe ser reevaluado de manera exhaustiva2. Se debe evaluar si el paciente tolera los efectos adversos, de lo contrario realizar rotación de opioides o adicionar medicamentos adyuvantes que permitan reducir la dosis de opioide. En pacientes con dolor moderado a severo y con alivio con tratamiento actual, se debe mantener la dosis o incrementarla en algunos casos2. Siempre se debe brindar acompañamiento psicológico y las interconsultas que sean necesarias.
En pacientes con dolor leve y alivio con tratamiento actual, pero con efectos adversos intolerables o inmanejables, la dosis del analgésico puede reducirse en 25% y se puede considerar el uso de medicamentos adyuvantes2. Si se logra un nivel aceptable de control de dolor y funcionalidad con tratamiento intravenoso de opioides durante 24 horas y el requerimiento es estable, se recomienda cambiar a medicación oral preferiblemente o transdérmica en caso de requerirlo2. Es importante asegurar que el paciente tiene un acceso adecuado a los medicamentos y tiene comunicación con el especialista del dolor2.
Manejo no farmacológico para controlar el dolor
Teniendo en cuenta que el dolor afecta las dimensiones física, psicosocial y espiritual, el tratamiento del dolor oncológico requiere la integración de terapias dirigidas a estos aspectos, incluyendo la terapia cognitivo-comportamental7,8. Las medidas físicas incluyen masaje, uso de calor o frío, acupuntura y acupresión. Las intervenciones cognitivas están dirigidas a fortalecer el sentido de control sobre el dolor o la enfermedad de base. Otras estrategias como ejercicios de respiración, relajación, hipnosis y otras terapias comportamentales pueden ser útiles2.
La atención también debe enfocarse en el soporte psicosocial, brindando educación a pacientes y familiares. En el cuidado del paciente con cáncer, se debe tener en cuenta las necesidades espirituales del paciente, por lo que la atención espiritual debe incluirse como un componente del manejo integral del dolor2,3.
Tratamiento de tipos específicos de dolor
• Dolor neuropático
El dolor neuropático es frecuente en los pacientes con cáncer y es de difícil manejo, puede ser causado por infiltración tumoral, síndrome paraneoplásico o secundario a polineuropatía inducida por el tratamiento. Puede tratarse con analgésicos opioides, no opioides y antidepresivos tricíclicos o anticonvulsivantes. El gabapentin ha demostrado que mejora el dolor neuropático en los pacientes con cáncer6. La eficacia y tolerabilidad de la terapia debe ser monitorizada en el tiempo y en caso de compresión nerviosa pueden usarse esteroides5.
• Dolor óseo
Además de la analgesia, existen dos opciones de tratamiento para el dolor óseo por metástasis, la radioterapia y la terapia dirigida. Todos los pacientes con dolor secundario a metástasis óseas deben ser evaluados para radioterapia con prescripción de 8 Gy dosis única5.
Los bifosfonatos hacen parte de la terapia estándar para hipercalcemia y la prevención de eventos adversos relacionados con el esqueleto óseo y son efectivos para el control del dolor. Se deben tomar medidas preventivas dentales antes de empezar el tratamiento con estas sustancias5.
Una de las complicaciones de las metástasis óseas es la compresión del cordón espinal que generalmente está precedida de dolor y requiere de tratamiento inmediato para evitar complicaciones. Se debe administrar esteroides tan pronto se hace el diagnóstico, el más frecuentemente usado es la dexametasona con dosis que oscilan entre 16 mg/día a 36-96 mg/día. Por lo general, puede ser tratada con radioterapia sola y sólo casos seleccionados requieren cirugía5.
Dolor refractario
Cerca del 10% de los pacientes con cáncer presentan dolor de difícil manejo, incluso con tratamiento parenteral. En este contexto son útiles algunas técnicas invasivas como bloqueos nerviosos y administración medicamentosa espinal o epidural5.
• Administración de medicamento vía intratecal
La dosis requerida de opioides por vía espinal es 20 a 40% de la dosis sistémica para alcanzar equianalgesia, y sólo del 10% si se realiza vía intratecal. Esta vía debe considerarse en pacientes con dolor en varias regiones anatómicas, inadecuado control de dolor a pesar de dosis incrementales de opioides sistémicos, falta de respuesta a cambio de opioide o ruta de administración, aumento de efectos adversos o expectativa de vida mayor a seis meses5.
El sistema implantable tiene menos riesgo de infección y menores requerimientos de mantenimiento comparado con el percutáneo, sin embargo, su posicionamiento es más complejo5. Estas estrategias están contraindicadas en pacientes con infecciones, coagulopatía o con expectativa de vida muy corta.
• Bloqueo de nervio periférico
Los bloqueos de nervios periféricos o plexos pueden ser usados cuando el dolor ocurre en el campo de uno o más nervios periféricos, o si el dolor es causado por complicaciones como fracturas patológicas u oclusiones vasculares. Generalmente es usado como coadyuvante de analgesia sistémica2,5. El uso de agentes neurolíticos en los nervios periféricos puede producir neuritis, lo que en pacientes con buen pronóstico puede resultar contraproducente pues los síntomas pueden ser más difíciles de manejar que el dolor original5.
• Bloqueo neurolítico
El bloqueo neurolítico debe limitarse a aquellos pacientes con una corta expectativa de vida, pues el efecto del bloqueo tiene una duración de tres a seis meses. Este bloqueo permite disminuir el uso de analgésicos sistémicos para el control del dolor visceral. Esta técnica es usada para el plexo hipogástrico superior y para el plexo celiaco (especialmente en cáncer de páncreas). Ha demostrado ser efectiva, incluso sobre la terapia sistémica, con una duración de seis meses5.
Conclusión
El dolor se presenta en la mayoría de los pacientes diagnosticados con algún tipo de cáncer, exacerbándose dependiendo del compromiso y el tipo de neoplasia. Este tipo de dolor inadecuadamente tratado constituye un problema de salud pública, por lo cual es primordial la exhaustiva evaluación para asegurar un manejo oportuno y adecuado desde el momento del diagnóstico, con seguimiento a intervalos regulares, en busca de identificar el mejor balance entre la eficacia y seguridad de las intervenciones, y alcanzar el principal objetivo de maximizar la funcionalidad y mejorar la calidad de vida del paciente. El manejo del dolor oncológico requiere por lo tanto, un abordaje multidisciplinario, que involucre medidas dirigidas a intervenir tanto las dimensiones físicas, como las psicosociales y espirituales de los pacientes.











 nueva página del texto (beta)
nueva página del texto (beta)