Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Veterinaria México
versión impresa ISSN 0301-5092
Vet. Méx vol.39 no.3 Ciudad de México jul./sep. 2008
Notas de investigación
Secuenciación de un fragmento de ADNc homólogo a interleucina–1 alfa humana derivado de leucocitos de armadillo (Dasypus novemcinctus)
Sequencing of an armadillo (Dasypus novemcinctus) leukocyte–derived cDNA fragment homolog to human interleukin–1 alpha.
Saúl Flores–Medina*,** Francisco J. Díaz–García** Fernando M. Guerra–Infante*
* Laboratorio de Microbiología Veterinaria, Departamento de Microbiología, Escuela Nacional de Ciencias Biológicas, Instituto Politécnico Nacional, Prolongación de Carpio y Plan de Ayala s/n, Col. Casco de Santo Tomás, C.P. 11340, México, D. F., correo electrónico: s.flores@servidor.inper.edu.mx Correspondecia: misma dirección.
** Área de Materias Tecnológicas y Academia de Química. CECyT 15 Diódoro Antúnez Echegaray, Instituto Politécnico Nacional, Av. Dr. Gastón Melo 441, C.P. 12100, Col. San Antonio Tecomitl, México, D. F.
*** Laboratorio de Biología Molecular, Edificio de Investigación, Facultad de Medicina, Universidad Nacional Autónoma de México, C.P. 04510, México, D. F.
Recibido el 1 de agosto de 2007
Aceptado el 13 de febrero de 2008.
Abstract
Messenger RNA (RNAm) detection was done by a reverse–transcription assay coupled to the polymerase chain reaction (RT–PCR) specific for human interleukin–1 alpha on armadillo leukocytes stimulated with phorbol myristate acetate (PMA). This strategy allowed amplifying a DNA fragment of 491 bp. Furthermore, the sequence showed high nucleotide homology with the human (99%), monkey (93%), pig (82%), horse (81%) and llama (81%) cDNA. Meanwhile, the deduced amino acid sequence was compatible with the precursor of the human interleukin–1 alpha. These results suggest the presence of the interleukin–1 gene in the armadillo genome. However, it is necessary to characterize the complete sequence of the gene and prove the functionality of the translated protein to clarify the immune response mechanisms in the armadillo against Mycobacterium leprae.
Key words: Dasypus novemcinctus, Interleukin–1, RT–PCR, Sequencing.
Resumen
Se realizó detección del ARN mensajero (ARNm) mediante un ensayo de transcripción reversa acoplada a la reacción en cadena de la polimerasa (RT–PCR) específico para la detección de Interleucina–1 alfa humana en leucocitos de armadillo estimulados con acetato de forbol miristato (PMA, por su siglas en inglés); esta estrategia permitió amplificar un fragmento de ADN de 491 pares de bases. Adicionalmente, la secuencia mostró alta homología nucleotídica con las secuencias de ADNc humano (99%), mono (93%), cerdo (82%), caballo (81%) y llama (81%), mientras que la secuencia deducida de aminoácidos fue compatible con el precursor de la proteína IL–1a humana. Estos resultados sugieren presencia del gen de interleucina–1 en el genoma del armadillo; sin embargo, es necesario caracterizar la secuencia completa del gen y comprobar la funcionalidad de la proteína traducida para dilucidar los mecanismos de la respuesta inmune del armadillo contra Mycobacterium leprae.
Palabras clave: Dasypus novemcinctus, Interleucina–1, RT–PCR, Secuenciación.
Introducción
La interleucina–1 (IL–1) es una citocina pro–inflamatoria con actividad plurifuncional, sintetizada predominantemente por monocitos y otros tipos de células que incluyen fibroblastos, células endoteliales, células dendríticas y keratinocitos, entre otros.1,2 La IL–1 es importante en la hematogénesis y en la regulación de las respuestas inmune e inflamatoria.1,2 En otras especies los genes de la IL–1 se han clonado y secuenciado,3–5 pero sólo en el humano y ratón dichos genes han sido totalmente caracterizados.6,7
La molécula de IL–1 se encuentra en dos formas biológicamente activas; IL–1 alfa (IL–1α) e IL–1 beta (IL–1β), los genes que codifican para cada uno de los miembros de esta familia se localizan en el brazo largo del cromosoma 2. Ambas formas provienen de precursores denominados pro–IL–1α y pro–IL–1β de 31 kDa, mientras que las formas maduras de la IL–1α e IL–1β presentan un peso aproximado de 17 kDa, respectivamente, y se unen al mismo receptor con afinidad similar ejerciendo la misma actividad biológica.6 En el armadillo de nueve bandas (Dasypus novemcinctus) nunca se ha registrado presencia de IL–1 y es considerado como el único modelo animal capaz de reproducir experimentalmente la lepra lepromatosa, similar a la producida en humanos.8
Recientemente se demostró presencia de una molécula con actividad semejante al factor de necrosis tumoral alfa (TNF–α) en el sobrenadante de un cultivo de leucocitos de armadillo de nueve bandas,9 mientras que Van Dyjk y Jong10 clonaron y secuenciaron un fragmento del gen de TNF en la especie de armadillo Cabassous unicinctus, que presentó homología nucleotídica de 88% respecto de su contraparte humana. Con estos hallazgos se puede suponer que los armadillos son capaces de liberar citocinas similares a las identificadas en otras especies. De hecho, la IL–1 humana comparte características genéticas, estructurales y funcionales con la IL–1 de otras especies de vertebrados e invertebrados, lo que sugiere que esta molécula se ha conservado evolutivamente.11–13
El objetivo del presente trabajo fue detectar un fragmento de ARN mensajero (ARNm) mediante un ensayo de transcripción reversa acoplada a la reacción en cadena de la polimerasa (RT–PCR), específico a la IL–1α humana, en leucocitos de armadillo estimulados con acetato de forbol miristato (PMA). En este estudio se emplearon cinco armadillos de nueve bandas (Dasypus novemcinctus) capturados en Chilapa, Guerrero, México, que se enviaron al bioterio de la Escuela Nacional de Ciencias Biológicas, del Instituto Politécnico Nacional, para su adaptación.
Se recolectaron 10 mL de sangre periférica mediante punción cardiaca en cinco animales anestesiados con ketamina base.* La sangre se transfirió a tubos que contenían anticoagulante (EDTA 5 mg) y al mismo tiempo se estimularon con 50 ng/mL de PMA** como se describió previamente.9 Los tubos se incubaron a 37°C en atmósfera de CO2 al 5% durante 4 h, luego se centrifugaron a 450 g por 20 minutos. La fracción de leucocitos se separó y se lavó dos veces con solución de lisis para eritrocitos (Tris–base 10 mM pH 7.6, MgCl2 5 mM y NaCl 10 mM) con el fin de purificar el ARN total empleando Tripure Isolation Reagent,*** según las instrucciones del proveedor. Debido a que el ARNm de IL–1α sufre modificación postranscripcional, éste no se trató con ADNsas. El ARN obtenido en los cinco animales se colocó en un solo tubo para su análisis posterior.
La síntesis de la cadena complementaria (ADNc) se realizó al usar 1 µg del ARN purificado, iniciador oligo(dT) y transcriptasa reversa Moloney–Murine Leukemia Virus.
y transcriptasa reversa Moloney–Murine Leukemia Virus. * El ARN obtenido en los cinco animales se colocó en un solo tubo para su análisis posterior. Cuatro microlitros del ADNc obtenido se sometieron a amplificación por reacción en cadena de la polimerasa (PCR) en volumen final de 50 µL. La mezcla de reacción contenía: 20 mM de Tris–HCl pH 8.4, 50 mM de KCl, 0.2 µM de cada dNTP, 1.75 mM de MgCl2, 20 pmol/µL de cada iniciador; F–5'–CAAGGAGAGCATGGTGGTAGTAGCAACCAA CG–3', R–3'–TAGTGCCGTGAGTTTCCCAGAAGA–AGAGGAGG–5' y 1.5 unidades de Taq ADN polimerasa.
* El ARN obtenido en los cinco animales se colocó en un solo tubo para su análisis posterior. Cuatro microlitros del ADNc obtenido se sometieron a amplificación por reacción en cadena de la polimerasa (PCR) en volumen final de 50 µL. La mezcla de reacción contenía: 20 mM de Tris–HCl pH 8.4, 50 mM de KCl, 0.2 µM de cada dNTP, 1.75 mM de MgCl2, 20 pmol/µL de cada iniciador; F–5'–CAAGGAGAGCATGGTGGTAGTAGCAACCAA CG–3', R–3'–TAGTGCCGTGAGTTTCCCAGAAGA–AGAGGAGG–5' y 1.5 unidades de Taq ADN polimerasa. * La amplificación se realizó bajo las siguientes condiciones: desnaturalización inicial 94°C/3 min, seguida por 40 ciclos de 94°C/1 min, 61°C/1.5 min y 72°C/2 min con una extensión final de 72°C, durante 7 min. En cada corrida se incluyó un testigo negativo y otro positivo. Los productos amplificados fueron resueltos en un gel de agarosa al 2%, teñidos con bromuro de etidio (Figura 1); el fragmento esperado fue purificado directamente del gel empleando el software kit QIAquick Gel Extraction
* La amplificación se realizó bajo las siguientes condiciones: desnaturalización inicial 94°C/3 min, seguida por 40 ciclos de 94°C/1 min, 61°C/1.5 min y 72°C/2 min con una extensión final de 72°C, durante 7 min. En cada corrida se incluyó un testigo negativo y otro positivo. Los productos amplificados fueron resueltos en un gel de agarosa al 2%, teñidos con bromuro de etidio (Figura 1); el fragmento esperado fue purificado directamente del gel empleando el software kit QIAquick Gel Extraction * y procesado en un secuenciador automatizado ABI–PRISM 3100.
* y procesado en un secuenciador automatizado ABI–PRISM 3100. *
*
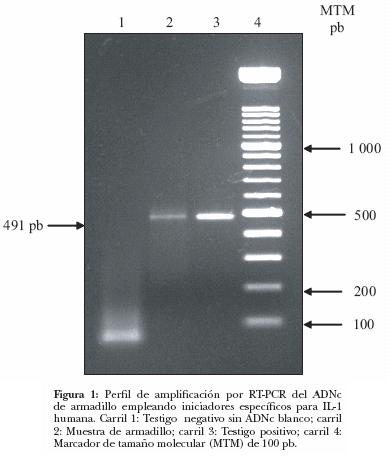
La amplificación directa a partir de probable ADN genómico contaminante no es probable bajo estas condiciones, además el tamaño de éste sería mucho mayor (> 5 kb) que el del amplificado de ADNc. Asimismo, la alineación de la secuencia obtenida (número de acceso en el GenBank: AY800133) con respecto a otras secuencias (Figura 2), reveló alta homología nucleotídica con cadenas complementarias de IL–1α de humano (99%), mono (93%), cerdo (82%), caballo (81%) y llama (81%). En la Figura 3 se muestra la secuencia, la cual presentó un fragmento compatible con el precursor de la IL–1 humana. Es necesario aclarar que los resultados obtenidos con respecto a las homologías nucleotídicas representan sólo un pequeño fragmento (491 pares de bases) y no toda la proteína, de manera que si se contara con la secuencia nucleotídica completa, quizá la homología entre estas especies y en especial con la del humano sería menor.
Con tales resultados se puede especular que en el armadillo la molécula relacionada con IL–lα podría desplegar una funcionalidad biológica similar a la interleucina–1α humana. De hecho, la presencia de una pro teína semejante a la IL–1, que fue purificada del celoma de una estrella de mar, presentó actividad similar a la IL–1 de humano y de ratón,11 ello sugiere que la funcionalidad de la IL–1 ha sido conservada evolutivamente en especies de vertebrados y de invertebrados.11,14
A pesar de que la actividad de la IL–1 ha sido fácilmente detectada en sobrenadantes de cultivos de neutrófilos y otras células fagocíticas,11,15,16 la presencia de esta molécula en los sobrenadantes de cultivos de leucocitos de armadillo no se ha demostrado aún. Por tanto, la detección de una secuencia del ARNm relacionada con la IL–1 en el armadillo abre la posibilidad de aislar el gen completo y ampliar las investigaciones sobre la regulación genética de su síntesis y liberación posterior a la estimulación con antígenos micobacterianos o de lipoarabinomanana, lo cual ayudaría a entender la importancia de las células fagocíticas en respuesta a la infección por M. leprae, y a clarificar por qué sólo algunos animales desarrollan lepra después de una inoculación experimental con esta bacteria.17,18 En síntesis, la detección de un fragmento de ARNm relacionado con IL–1 en el armadillo, apoya la presencia de citocinas en ese animal y pudiera proveer las bases moleculares para investigar su presencia en ese mamífero. Sin embargo, se requieren estudios adicionales para comprobar su estructura y funcionalidad y así entender su regulación inmune y su función en el control y erradicación de la lepra.
Referencias
1. Oppenheim JJ, Kovacs EJ, Matsushima K, Durum SK. There is more than one interleukin 1. Immunol Today 1986; 7:45–55. [ Links ]
2. Dinarello AC. Proinflammatory cytokines. CHEST 2000; 118:503–508. [ Links ]
3. Andrews EA, Barcham GJ, Brandon MR, Nash AD. Molecular cloning and characterization of ovine IL–1 alpha and IL–1 beta. Immunology 1991; 74: 453– 132 460. [ Links ]
4. Huether MJ, Lin G, Smith DM, Murtaugh MP, Molitor TW. Cloning, secuencing and regulation of a mRNA encoding porcine interleukin–1 beta. Gene 1993; 129:285–289. [ Links ]
5. Denis F, Archambault D. Molecular cloning and characterization of beluga whale (Delphinapterus leucas) interleukin–1beta and tumor necrosis factor– alpha. Can J Vet Res 2001; 65:233–40. [ Links ]
6. March CJ, Mosley B, Larsen A, Cerratti DP, Braedt G, Price V et al. Cloning, sequence and expression of two distinct human interleukin–1 complementary DNAs. Nature 1985; 315:641–647. [ Links ]
7. Gray PW, Gliaster D, Chen E, Goeddel DV, Pennica D. Two interleukin 1 genes in the mouse: cloning and expression of the cDNA for murine interleukin 1 beta. J Immunol 1986; 137:3644–3648. [ Links ]
8. Job K. Nine–banded armadillo and leprosy research. Indian J Pathol Microbiol 2003; 46:541–550. [ Links ]
9. Guerra–Infante FM, López–Hurtado M, Flores–Medina S, Zamora–Ruiz A, De Haro–Cruz MaJ. Detection of a tumor necrosis factor–like activity in culture supernatants of armadillo leukocytes. Int J Lepr Other Mycobact Dis 2001; 69:354– 150 357. [ Links ]
10. Van Dyjk MA, Jong WW. Cabassous unicinctus partial tumor necrosis factor precursor, exon 1. Partial cds. GenBank Data Bank 2000 February 7. Cited: 2006 February 13. Accesion Number: AJ286829. [ Links ]
11. Beck G, Habicht GS. Isolation and characterization of a primitive interleukin–1 like protein from an invertebrate, Asterias forbesi. Proc Natl Acad Sci USA 1986; 83:7429–7433. [ Links ]
12. Beck G, Habicht GS. Primitive cytokines: harbingers of vertebrate defense. Immunol Today 1991; 121:180–183. [ Links ]
13. Bird S, Zou J, Munday B, Cunningham C, Secombes CJ. Evolution of interleukin–1 beta. Cytokine Growth Factor Rev 2002; 13:483–502. [ Links ]
14. Huising OM, Stet JMR. Savelkoul FJH, Kemenade VLBM. The molecular evolution of the interleukin–1 family of cytokines; IL–18 in teolost fish. Dev Comp Immunol 2004; 28:395–413. [ Links ]
15. Rosenwasser LJ, Dinarello CA. Ability of human leukocyte pyrogen to enhance phytohemagglutinin induced murine thymocyte proliferation. Cell Immunol 1981; 63:134–142. [ Links ]
16. Schmidt JA, Mizel SB, Cohen D, Green I. Interleukin 1 a potential regulator of fibroblast proliferation. J Immunol 1982; 128:2177–2182. [ Links ]
17. Quesada–Pascual F, Rojas–Espinosa O, Santos–Argumedo L, Estrada–Parra S. A Mexican armadillo (Dasypus novemcinctus) colony for leprosy research. Int J Lepr Other Mycobact Dis 1987; 55:716–718. [ Links ]
18. Guerra–Infante F, Quesada–Pascual F, Estrada–Parra S, Santos–Argumedo L. Evolution of lymphocyte populations in armadillos (Dasypus novemcinctus) inoculated with M. leprae. Int J Lepr Other Mycobact Dis 1996; 64:152–158. [ Links ]
Notas
* Revetmex, S.A., México. regresar
** Sigma, Estados Unidos de América. regresar
*** Roche, Estados Unidos de América regresar
 Promega, Estados Unidos de América. regresar
Promega, Estados Unidos de América. regresar
 Promega, Estados Unidos de América. regresar
Promega, Estados Unidos de América. regresar
 Invitrogen, Estados Unidos de América. regresar
Invitrogen, Estados Unidos de América. regresar
 QIAGEN, Alemania. regresar
QIAGEN, Alemania. regresar
 Applied Biosystem, Estados Unidos de América. regresar
Applied Biosystem, Estados Unidos de América. regresar














