ANTECEDENTES
El estruma ovárico es una tumoración poco frecuente, descrita inicialmente por Von Kalden en 1895.1 En 1888 Böttlin reportó la existencia de tejido tiroideo en un teratoma de origen ovárico.2 Esta tumoración es una variedad infrecuente de teratoma que se define por el predominio de tejido tiroideo (más de 50%) en torno del ovario. En esta estirpe también se incluyen los teratomas quísticos maduros con tejido tiroideo macroscópicamente identificable o que contienen tejido tiroideo maligno, aun cuando el componente de tejido neoplásico representa menos de 50% de la lesión.2 Supone 0.5-1% de los tumores ováricos (3% de los teratomas); el teratoma monodérmico es la forma de presentación más frecuente.1 La mayor parte aparece entre los 40 y 60 años de edad.3 Las variedades histológicas más frecuentes de la estirpe maligna son el carcinoma papilar (51%) y el folicular tiroideo.4,5 Alrededor de 1% de los teratomas maduros pueden malignizarse;6 en el caso del estruma ovárico esta cifra se eleva a 5-10%, aunque solo 5% hacen metástasis a distancia.7 Debido a la rareza del tumor, y falta de uniformidad de los criterios histológicos de diagnóstico de malignidad, se carece de protocolos de tratamiento universal aceptados por las sociedades científicas actuales.8
Enseguida se expone un caso clínico de esta estirpe histológica infrecuente, y la revisión bibliográfica de su diagnóstico, tratamiento y seguimiento.
CASO CLÍNICO
Paciente de 42 años de edad, que acudió asintomática a una revisión ginecológica rutinaria, con un dispositivo intrauterino de cobre desde hacía cinco años. Antecedentes ginecoobstétricos: cesárea y anexectomía izquierda 10 años antes, por patología anexial benigna. Durante la exploración ecográfica se evidenció un quiste anexial derecho complejo, bilobulado, de 10 cm, compuesto por dos formaciones heterogéneas independientes: una de aspecto uniforme ecorrefringente de 52.6 mm y otra de ecorrefringencia alternante de 36.7 mm.
La sospecha ecográfica fue de teratoma quístico. La resonancia magnética nuclear confirmó el diagnóstico de sospecha, lo mismo que los marcadores tumorales que reportaron elevación del Ca19.9 (140.8 U/mL). Enseguida de esas pruebas complementarias se decidió la anexectomía derecha laparoscópica, sin complicaciones operatorias ni hospitalarias de interés, con alta al siguiente día de la cirugía. El reporte anatomopatológico fue de: anejo de 30 g, de superficie lisa, compuesto por material gredoso y blanco-amarillento, pelo, calcificaciones y áreas sólidas intraanexiales. Al microscopio se observó un teratoma quístico maduro que incluía la tiroides (menos de 50% de todo el tumor), con componente de carcinoma papilar de patrón folicular, tipo estruma ovárico. La tumoración estaba fundamentalmente constituida por tejidos ectodérmicos maduros. La neoplasia tiroidea estaba muy localizada y no afectaba la superficie externa de la masa. El estudio inmunohistoquímico reveló una citoqueratina 19 (CK-19) y galectina (GAL-3) focal en la neoplasia tiroidea, expresión generalizada de factor de transcripción tiroideo 1 (TTF-1) y un índice de proliferación bajo (inferior al 5%) (Figura 1). La paciente fue enviada, en julio de 2014, a la Unidad de Endocrinología para completar el estudio. Ahí se llevó a cabo una exploración que resultó normal, sin clínica de disfunción tiroidea, bocio ni adenopatías.
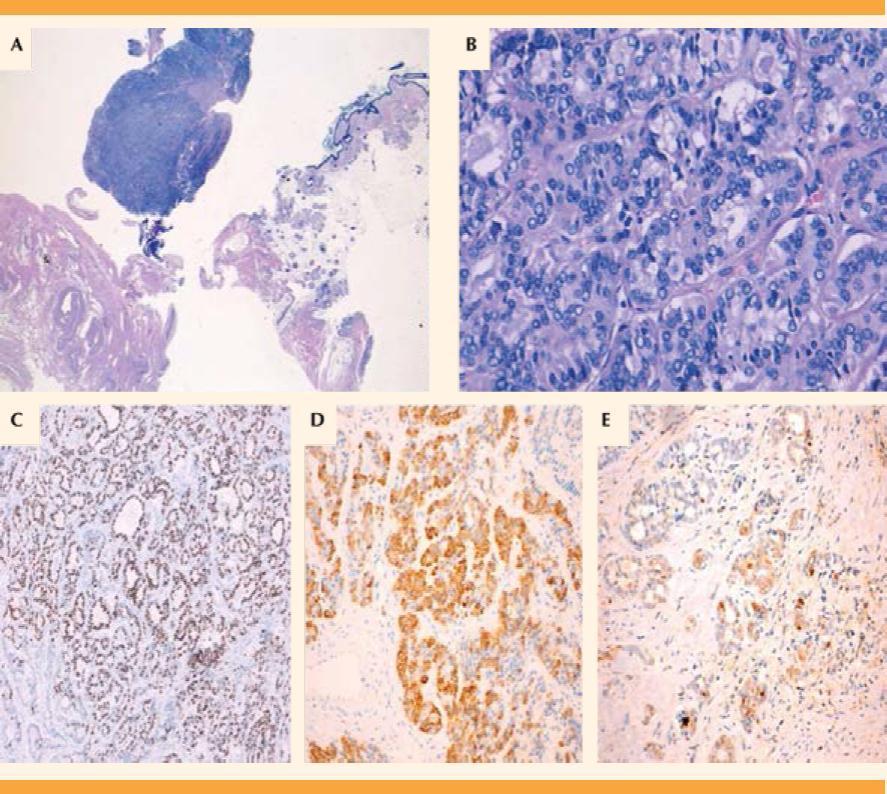
Figura 1 Estruma ovárico maligno, con foco de carcinoma papilar. A) En la parte derecha de la imagen se aprecia tejido ectodérmico maduro, compuesto por epidermis, pelo y glándulas sebáceas. En la parte central de la imagen destaca el tejido tiroideo (HE, lupa). B) A mayor aumento en el tejido tiroideo se aprecia una proliferación folicular con características nucleares típicas (núcleos vacíos, amontonamiento nuclear, pseudoinclusiones, etc.) del carcinoma papilar (HE, 40x). C) Intensa inmunotinción para TTF-1 (factor de transcripción tiroideo 1) (TTF-1, 10x). D) Intensa inmunotinción para CK19 (CK19, 10x). E) Inmunotinción focal para galectina (Galectina, 10x).
La ecografía tiroidea advirtió la existencia de un pequeño nódulo hipoisoecoico izquierdo, con circulación periférica y bordes mínimamente irregulares de 5x7x10 mm. Posteriormente, en la punción-aspiración con aguja fina se confirmó la hiperplasia tiroidea benigna. La gammagrafía tiroidea con pertecnetato sódico, con tecnecio 99 metaestable, confirmó que la tiroides era normal. En la tomografía axial computada, con contraste, no se encontraron adenopatías retroperitoneales ni inguinales sospechosas. Los marcadores tiroideos fueron negativos y los anticuerpos antitiroglubulina se elevaron a 128.7 UI/mL. Posteriormente se completó la cirugía ginecológica con histerectomía total, omentectomía, lavado peritoneal e inspección de la cavidad abdominal por vía laparotómica. El reporte anatomopatológico descartó la existencia de patología orgánica o elementos neoplásicos en la muestra. A pesar de la inexistencia de hallazgos sospechosos en la tiroides, el comité de cáncer de tiroides acordó, con base en el reporte de malignidad de la pieza quirúrgica ovárica y el tamaño tumoral de ésta, efectuar una tiroidectomía total e indicar tratamiento con yodo radiactivo y la cirugía programada. En el estudio anatomopatológico se comprobó la existencia de una hiperplasia nodular tiroidea, pero sin evidencia de elementos neoplásicos malignos, ni ganglios linfáticos afectados. La paciente se encuentra actualmente asintomática, con controles normales llevados a cabo por las unidades de Ginecología oncológica y Endocrinología.
DISCUSIÓN
El estruma ovárico es una variedad rara de teratoma quístico que se caracteriza por tejido tiroideo ectópico. La definición clásica incluye a los teratomas ováricos con más de 50% de componente tiroideo, pero también se contemplan enfermedades que incluyen menos de 50% de dicho tejido, cuando éste tiene criterios de malignidad,2 como es el caso aquí reportado. Si bien se estima que inclusive 20% de los teratomas ováricos tienen tejido tiroideo, menos de 5% de ellos son estrumas ováricos.6 Esta tumoración afecta, predominantemente, a mujeres entre la cuarta y sexta décadas de la vida,3 a diferencia del teratoma clásico, que es más frecuente en menores de 45 años; la edad media de aparición es de 34 años. El estruma ovárico y su estirpe maligna carecen de clínica y hallazgos específicos para su diagnóstico que depende, finalmente, del hallazgo en el estudio anatomopatológico.2 Suele manifestarse como una masa pélvica unilateral (58%), asintomática (40%) y asociada con dolor pélvico en 12% de los casos. Menos frecuente es la clínica de ascitis (20%) o hipertiroidismo (8%), así como la asociación con síndrome de Meigs (5%) o carcinoma tiroideo. En ocasiones se ha observado la elevación del marcador tumoral CA 125, sin ser éste un marcador específico. Suele crecer unilateralmente pero, en ocasiones, se asocia con teratoma maduro o cistoadenoma contralateral.2,3,7,8,9 En nuestro caso clínico se desconoce el motivo de la anexectomía izquierda practicada años antes, así como el diagnóstico anatomopatológico definitivo, que la paciente informó que fue benigno.
El estruma ovárico simula, ecográficamente, a los tumores ováricos malignos, por la coexistencia de quistes complejos y heterogéneos, por lo que casi todos se operan por vía laparotómica.3 En nuestro caso no podemos aportar las imágenes de las pruebas ecográficas realizadas porque se efectuaron en un centro hospitalario privado (que no facilitaron para este reporte), que solo proporcionó el informe radiológico. En la mayoría de los casos esta tumoración la diagnostican los anatomopatólogos. Robboy y su grupo expusieron que el estruma ovárico no se diagnosticó antes de la cirugía en ninguno de los 88 casos estudiados, a pesar de que 28.4% de las pacientes habían tenido signos o síntomas de hiperfunción tiroidea.10
Los criterios histológicos de malignidad utilizados por la mayoría de los autores son similares a los de la glándula tiroides.2 Las manifestaciones clínicas que sugieren malignidad son: extensión extraovárica, adherencias a órganos adyacentes, ascitis significativa (mayor de 1 litro), diámetro estromal mayor de 5 cm, o la lesión proliferativa que afecta más de 50% del tejido tiroideo.7A priori, estas características no se contemplaron en el caso aquí informado.
El riesgo de metástasis en el estruma ovárico maligno es de 5 a 16%; puede aparecer en el ovario contralateral, ganglios linfáticos abdominopélvicos, omento, cavidad peritoneal, pulmón, cuero cabelludo, hueso, cerebro, pleura, diafragma e hígado.2 En caso de estruma ovárico benigno Ayhan y sus coautores recomiendan el tratamiento conservador y radical en caso de malignidad o deseo genésico satisfecho.11 De Simone y colaboradores también contemplan la posibilidad de cirugía conservadora en caso de metástasis, en mujeres con deseo gestacional no satisfecho.12 El tratamiento adyuvante a la cirugía ginecológica en caso de metástasis sigue siendo motivo de controversia. El protocolo terapéutico es similar al aplicado al carcinoma de tiroides, incluida la tiroidectomía, la aplicación de yodo 131 radiactivo, la terapia supresora con hormona estimulante de la tiroides (TSH) y el posterior tratamiento con tiroxina (T4).7
Existe poca información acerca de los efectos del yodo 131 en estas pacientes y serán necesarios años de investigación y de recolección de datos para poder considerar al yodo 131 como primera línea de tratamiento después de la cirugía, en el caso de pacientes con metástasis.1,2 Para Luo JR y sus colegas este tratamiento tiene grandes ventajas, entre las que destaca la posible eliminación de células tumorales, la fácil tolerabilidad y el costo del tratamiento.2
La tiroidectomía total es necesaria para excluir un carcinoma tiroideo primario con metástasis ovárica; y es condición previa a la administración de yodo 131. Además, facilita el posterior seguimiento a partir de valores analíticos seriados de tiroglobulina y el posible diagnóstico de recurrencia o metástasis.3 El tratamiento postiroidectomía y cirugía ginecológica, basado en TSH administrada antes del yodo 131, puede incrementar su efecto terapéutico y evitar los síntomas y riesgos derivados del hipotiroidismo secundario.7
La quimioterapia citotóxica se ha aplicado a pacientes muy seleccionadas con metástasis, aunque no está contemplada en el tratamiento rutinario de los carcinomas folicular y papilar de tiroides; su indicación se limita a casos de enfermedad progresiva o que no responde a la cirugía y al yodo 131.2 Las indicaciones de las terapias con yodo 131 más frecuentes son en pacientes con metástasis a distancia, cirugías de citorreducción incompletas, tumoraciones mayores de 1 cm, cirugías subóptimas sin linfadenectomía, tipos histológicos agresivos o edad inferior a 16 años. Con esto se ha demostrado menor tasa de recurrencia y mortalidad con respecto de las pacientes que no han recibido ese tratamiento. No parece indicada en pacientes que no cumplan estos criterios porque no se han objetivado efectos positivos terapéuticos que compensen sus posibles complicaciones.13 El seguimiento posterior de las pacientes tratadas con yodo 131 o tiroidectomía debe incluir la determinación en sangre de tiroglobulina, como biodetector tumoral y estudio de imagen nuclear utilizando Iodo como marcador para el diagnóstico temprano de posibles metástasis (la tasa de recurrencia después de una respuesta completa al tratamiento inicial puede ser, incluso, de 35%, en algunas series). Es importante recordar que debe haber una separación mínima de 6 semanas entre la utilización del Iodo en rango terapéutico con respecto al diagnóstico, debido a las competencias tisulares que se pueden producir entre ambos.13,14 En el caso de nuestra paciente, al cumplir alguno de los criterios citados (como por ejemplo el tamaño tumoral) se optó por implantar estas terapias profilácticas, con buenos resultados en el seguimiento posterior. En la actualidad, el tratamiento quirúrgico por vía laparoscópica del estruma ovárico está bien establecido y se considera de elección.1 Si bien es cierto que el diagnóstico de estruma ovárico es casi siempre posquirúrgico, existe controversia en la vía de acceso laparoscópico de una masa ovárica sospechosa de malignidad porque pueda afectar al estadiaje del tumor, incrementar las metástasis en puertos de entrada y la diseminación abdominal de células tumorales. Por esto la cirugía debe ser cuidadosa para evitar la ruptura intraabdominal del tumor.1,3 Laberge y Levesque exponen que la vía de acceso laparoscópico en la cirugía del estruma ovárico aumenta el riesgo de recurrencia,15 mientras que Ezon y su grupo defienden que el acceso laparoscópico no afecta las tasas de supervivencia libre de enfermedad.16 En nuestro caso, el acceso inicial del quiste fue por vía laparoscópica porque no se sospechaba la tumoración, y la probabilidad de malignidad a priori era baja. Wee y sus colegas llevaron a cabo el seguimiento de una paciente con estruma ovárico maligno durante 76 meses después de la cirugía sin evidenciar recurrencia, aunque sí se demostró la aparición de un quiste ipsilateral en 2 de los 67 casos de estruma ovárico benigno intervenido (13%), en los que no se administró terapia adyuvante. No fue posible catalogarlo de recurrencia porque las pacientes no quisieron intervenirse de nuevo.1 Yoo y sus coautores dieron seguimiento, durante 65 meses, a un grupo de pacientes con criterios de malignidad.17
Es importante destacar el papel de la inmunohistoquímica en el diagnóstico diferencial de las formas de estruma ovárico con respecto a las metástasis ováricas de neoplasias primarias de tiroides. La localización ovárica de metástasis de origen tiroideo tipo papilar es sumamente rara; algunas revisiones bibliográficas muestran series no superiores a dos casos publicados, que se caracterizan por aparecer muchos años después del diagnóstico de tumor primario.18 Estas tumoraciones crecen, sobre todo, en otros tejidos, como el pulmón o los huesos, y menos frecuentemente en el cerebro, hígado, riñón y piel.19 El TTF-1, la CK-19, la HBME-1 (Hector Battifora mesothelial-1) y la GAL-3 son los principales marcadores inmunohistoquímicos para el diagnóstico de neoplasias de tejido tiroideo, unido a los estudios genéticos actuales sobre expresión de oncogenes relacionados, como el KRAS, BRAF y RET/PTC, que también se encuentran en las formas carcinoides ováricas.19,20,21,22 En virtud de la baja incidencia de las metástasis ováricas de tumores primarios de tiroides y los escasos estudios, no es posible determinar un patrón inmunohistoquímico o genético específico que permita diferenciar, mediante estas técnicas, el estruma ovárico maligno de las formas metastásicas de neoplasias tiroideas. En nuestra paciente se objetivó positividad para TTF-1, CK-19 y GAL-3, aunque estos mismos marcadores pueden ser positivos en las metástasis de origen tiroideo de otros territorios anatómicos. El seguimiento actual de nuestra paciente carece de evidencia clínica, analítica o de pruebas de imagen, recidiva o enfermedad metastásica.
CONCLUSIONES
El estruma ovárico maligno es un tumor de ovario poco frecuente; su característica sobresaliente es el componente tisular tiroideo, superior a 50% o sus características malignas. Carece de manifestaciones clínicas típicas y de estudios específicos de laboratorio que den certeza al diagnóstico. Su pronóstico es incierto y el tratamiento adecuado aún no se establece de manera definitiva. La opción es el tratamiento conjunto que combine criterios ginecológicos y endocrinos para afrontar este tipo de casos.











 nueva página del texto (beta)
nueva página del texto (beta)


