ANTECEDENTES
La enfermedad trofoblástica gestacional incluye una variedad de alteraciones del desarrollo de la placenta que van desde cambios premalignos hasta tumores malignos del trofoblasto.1 Una de estas alteraciones es la mola hidatiforme, la cual puede ser de dos tipos: mola hidatiforme completa y la mola hidatiforme parcial. La mola hidatiforme completa se origina en la mayoría de los casos de la fertilización de un óvulo vacío por un espermatozoide haploide, resultando en un cariotipo paterno duplicado (46XX), con ADN de origen paterno y ADN mitocondrial de origen materno. Por otra parte, la mola hidatiforme parcial se origina de la fertilización de un óvulo por dos espermatozoides, de lo cual resulta un cariotipo triploide y presencia de tejido embrionario. Ambos tipos de mola se originan del trofoblasto velloso.2,3
Las características clínicas de la mola clásica o completa, es que no presenta feto; en cambio, la mola parcial o incompleta se acompaña generalmente de vestigios embrionarios o feto con cariotipo triploide, con pocas posibilidades sobrevivir.4,5 Sin embargo, la coexistencia de mola con feto vivo, puede ocurrir tanto en la mola hidatiforme completa,6,7 como en la mola hidatiforme parcial.8,9 La incidencia de embarazo molar coexistente con feto vivo es de 1 por cada 22,000 a 100,000 embarazos para mola hidatiforme completa10 y de 0.005 % para mola hidatiforme parcial.11 Tanto la mola hidatiforme completa como la mola hidatiforme parcial comparten un espectro clínico variable que se manifiesta por sangrado transvaginal, hiperémesis, hipertiroidismo, preeclampsia y por regla general, la longitud sínfisis pubis-fondo uterino (AFU) es mayor a la edad gestacional.12,13 En ambos tipos de mola, las concentraciones séricas de gonadotropina coriónica (hCG) están elevadas.14 Esto hace difícil distinguir clínicamente estas dos presentaciones de mola; además, el ultrasonido de primer contacto solo detecta 30 a 60% de las molas en etapas tempranas de la gestación.15,16 El diagnóstico diferencial en ambos tipos de mola son los estudios moleculares, citogenético e histopatológico de las vellosidades coriales.17-19
El hallazgo temprano de embarazo molar coexistente con feto vivo plantea los siguientes problemas al ginecoobstetra:
A. Es necesario establecer diagnóstico diferencial entre mola hidatiforme parcial o completa.
B. La decisión más crítica es interrumpir o continuar con el embarazo, que se basa en la estimación de las complicaciones presentes o potenciales que condicionan el riesgo de muerte materna, tales como hemorragia obstétrica, preeclampsia, o transformación maligna del trofoblasto. Las condiciones del embarazo y la edad gestacional que repercuten en la sobrevivencia fetal y neonatal.20
CASOS CLÍNICOS
En este trabajo se reportan dos casos de mola hidatiforme coexistente con feto vivo en la segunda mitad del embarazo, uno con mola hidatiforme completa y otro con mola hidatiforme parcial, atendidos en hospitales de segundo nivel de atención del Instituto Mexicano del Seguro Social. Las pacientes autorizaron por escrito la utilización de los datos clínicos para este reporte.
Caso 1. Paciente de 34 años de edad. Dos gestaciones, 1 hijo vivo (nacimiento por cesárea, neonato a término, eutrófico). Embarazo actual de 33 semanas de gestación (SDG) por fecha de última menstruación (FUM). Se hospitaliza por embarazo con mola completa, coexistiendo con feto vivo, sin trabajo de parto. A su ingreso en buen estado general, asintomática. Signos vitales: TA 150/100 mm Hg, FC 83 lpm, FR 19 x, T 360C. La evaluación obstétrica reveló altura del fondo uterino (AFU) mayor al que correspondía para su edad gestacional, feto único vivo intrauterino, frecuencia cardíaca fetal (FCF) con Doppler de 136 lpm. Actividad uterina no palpable. Al tacto vaginal cérvix posterior, blando, cerrado, sin hemorragia uterina, ni salida de líquido amniótico transvaginal. USG abdominopélvico: embarazo molar, con feto único vivo de 31 semanas de gestación ocupando una de las cavidades amnióticas. Una placenta normal, localizada en el fondo y cara anterior del útero; además, se observó una segunda placenta con múltiples cavidades quísticas en “panal de abejas”, e índice de líquido amniótico de 8. Figuras 1 y 2
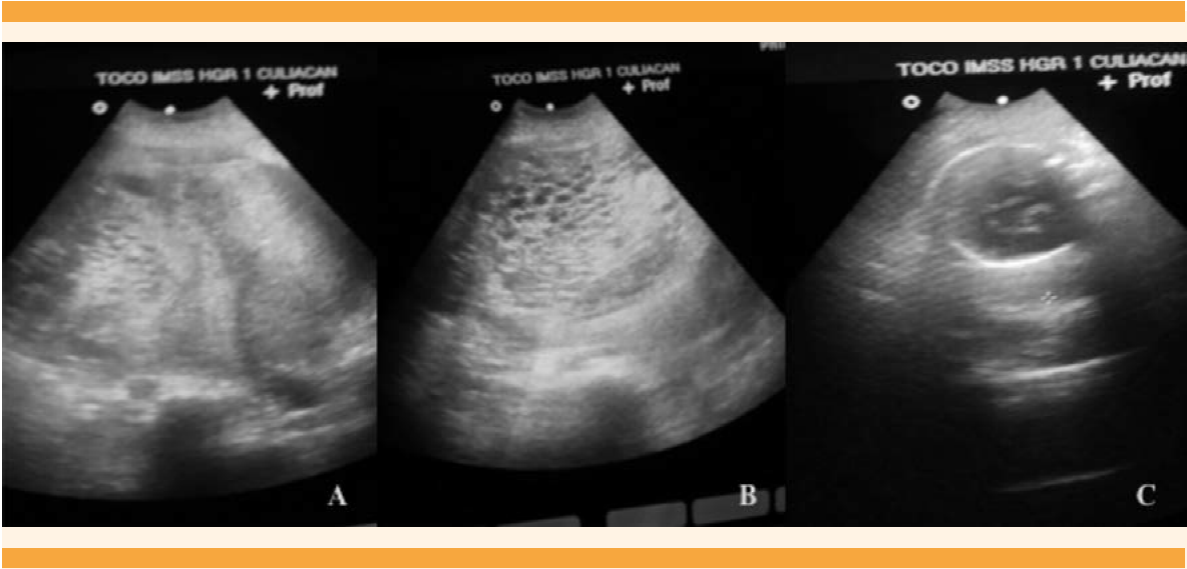
Figura 1 Ultrasonido abdominopélvico del tercer trimestre del embarazo (Caso 1). A: Corte sagital del útero que muestra el embarazo gemelar, con dos placentas y dos bolsas amnióticas. B: Primera placenta con masa ecogénica que contiene numerosos espacios quísticos (imagen en “panal de abeja”) que corresponden a las vellosidades coriónicas marcadamente hidrópicas, con ausencia de feto. Segunda placenta de aspecto normal. C: Feto vivo de 31 semanas que ocupa la segunda bolsa amniótica, con placenta normal.
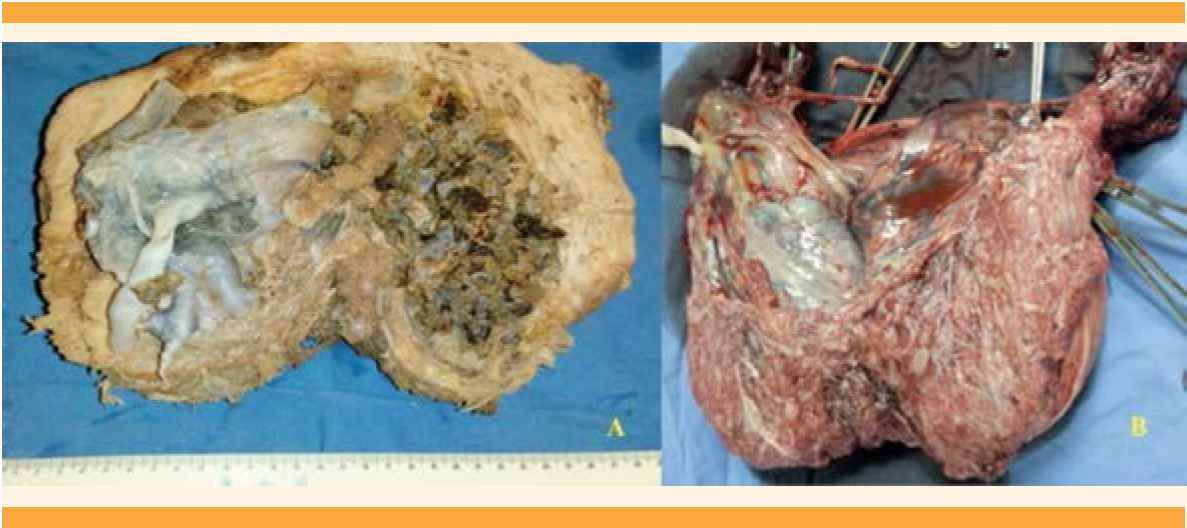
Figura 2 Imágenes macroscópicas. A: Placenta de características normales; 14 x 10 cm; lóbulos completos; cordón umbilical de inserción central de 10 x 1.2 cm, con tres vasos. Las membranas sin alteraciones macroscópicas. B: Segunda placenta con degeneración hidrópica evidente, sin infiltración a la pared uterina; constituida por conglomerado de vesículas.
Estudios de laboratorio. Hemoglobina 10.4 g/dL (12-14), hematocrito 32.2 % (38.0-47.0), Leucocitos 12.5 103/mL (5.0-10.0), plaquetas 252 x 103/mL (150.0- 450.0), tiempo de protrombina 10.6 segundos (testigo 11.8), tiempo parcial de tromboplastina 30.1 seg (testigo 29). Glucosa 78 mg/dL (74-106), Urea 16.3 mg/dL (9.0-23.0), creatinina 0.6 mg/dL (0.5-1.3), ácido úrico 9.3 mg/dL (3.1-9.2), bilirrubina total 0.6 mg/dL (0.30-1.20), albúmina 3.3 g/dL (3.2-4.8), alanina aminotransferasa 12 UI/L (10-49), aspartato aminotransferasa 20 UI/L (0-34), deshidrogenasa láctica 214 UI/L (120-246). Depuración corregida de creatinina 94.78 mL/min (90.0-120.0). Cuantificación de beta-HCG 411,458 mUI/mL (valor de referencia 13,950 - 62,530 mUI/mL). T4 Libre 1.26 ng/dL (0.93-1.70), T3 Total 1.07 pg/mL (0.80-2.00),TSH 0.152 mIU/dL (0.270-4.20). Proteínas en orina 0.296 g/ 24 h (0.05-0.20); sedimento 15-20 leucocitos por campo.
Tratamiento médico. Se indica esquema de inductores de la madurez pulmonar, antihipertensivos y antibiótico. Evolución. Paciente sin deterioro de su estado general, asintomática, sin trabajo de parto, perfil biofísico 8/8. Después de 4 días de estancia y tratamiento hospitalario se realiza operación cesárea clásica, y se extrae un feto vivo, femenino, con Apgar de 7 al minuto y 8 a los 5 minutos, peso 1,560 g, talla 44 cm, perímetro cefálico 29.5 cm, sin malformaciones congénitas, Ballard de 33 SDG. Sin complicaciones posquirúrgicas. El estudio histopatológico reportó embarazo molar bicorial, biamniótico (Figuras 3 y 4). El seguimiento clínico de la madre en la consulta externa, confirmó negativización de beta-HCG, tele de tórax normal. La recién nacida tuvo cuadro de dificultad respiratoria leve, tratada con oxígeno suplementario en puntas nasales por una semana. Se egresó de cuneros al mes de vida, con un peso de 1,850 g y tolerancia adecuada al seno materno. El cariotipo de la niña fue 46XX, actualmente sana y con 3 años de edad.
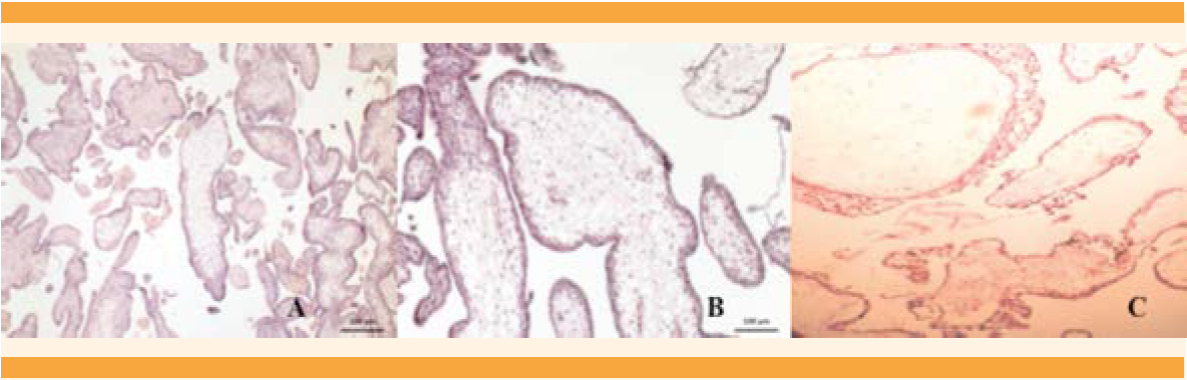
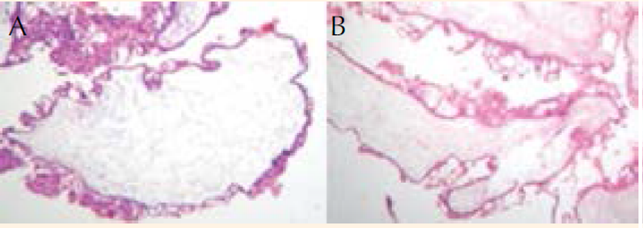
Figura 3 Imágenes microscópicas. Vellosidades del tercer trimestre del embarazo. Se distinguen dos tipos de vellosidades: A y B. En el centro se observan troncos vellosos, con grandes vasos, sin alteraciones, rodeados de vellosidades coriales correspondientes al tercer trimestre de la gestación, sin hiperplasia del trofoblasto. C. Vellosidades molares, con edema vesicular y aumento de tamaño; ausencia de vasos sanguíneos e hiperplasia del trofoblasto, sin atipias. No se mezclan con las primeras.
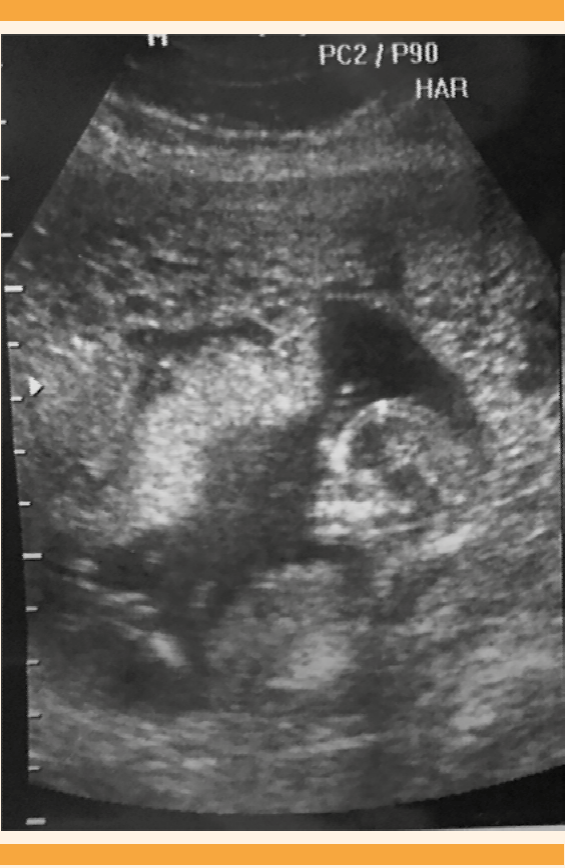
Figura 4 Ultrasonido abdomino-pélvico del segundo trimestre del embarazo (Caso 2). Placenta heterogénea, con de múltiples quistes focalizados hacia el fondo uterino, y feto único vivo.
Caso 2. Paciente de 27 años de edad, con antecedentes ginecoobstétricos de tres embarazos y dos partos de término. El embarazo en curso estaba en las 25.4 semanas, por fecha de la última menstruación, con episodios de amenaza de aborto desde el primer trimestre e infección recurrente de vías urinarias. Se hospitalizó debido a la persistencia de cefalea, palpitaciones, insomnio, desesperación y sudoración profusa. Al ingreso hospitalario la paciente se encontró: consciente, tensión arterial de 150-100 mmHg, frecuencia cardiaca de 108 latidos por minuto y temperatura de 37°C. Antecedentes obstétricos: embarazo de 26 semanas, por fecha de la última menstruación, con feto único vivo, intrauterino, sin alteraciones morfológicas, sin trabajo de parto, cuello uterino cerrado y escasa hemorragia transvaginal. La frecuencia cardiaca fetal: 110 lpm, peso fetal estimado 710 g, ILA de 18, placenta con inserción baja, en la cara anterior del segmento uterino, con imágenes “en esponja” focalizadas, con engrosamiento anormal de 10 cm en un extremo y hacia el fondo uterino, placenta normal con grosor de 3.7 cm, ovarios con imágenes quísticas mayores de 10 cm, edad gestacional 24.1 semanas por fetometría (Figura 4).
Estudios de laboratorio: hemoglobina: 7.7 g/dL (12-14); hematocrito: 26.9% (38.0-47.0); leucocitos: 13.5 x 103/mL (5.0-10.0); plaquetas: 99 x 103/mL (150.0- 450.0); tiempo de protrombina: 12.1 segundos (testigo 11.8 segundos); tiempo parcial de tromboplastina: 29.4 segundos (testigo 28.7 segundos). Sodio: 133 mmol/L (132-146); potasio: 3.7 mmol/L (3.5-5.5); calcio: 8.5 mg/dL (8.3-10.6); magnesio: 1.22 mg/dL (1-30-2.70); cloro: 97 mmol/L (99-109). Glucosa: 88 mg/dL (74-106); urea: 9.4 mg/dL (9.0-23.0); creatinina: 0.6 mg/dL (0.5-1.3); ácido úrico: 4.3 mg/dL (3.1-9.2); albúmina: 2.8 g/dL (3.2-4.8); bilirrubina total: 1.6 mg/dL (0.30-1.20); alanino aminotransferasa: 73.1 UI/L (10-49); aspartato aminotransferasa: 68 UI/L (0-34); deshidrogenasa láctica: 277 UI/L (120-246). Proteínas en orina: 4 g/ 24 h (0.05-0.20); T4 libre: 1.84 ng/dL (0.93-1.70); T3 total: 2.04 pg/mL (0.80-2.00); TSH: 0.005 mIU/dL (0.270-4.20); β-hCG: 482,174 mUI/mL (13,950-62,530).
Tratamiento médico: inducción de madurez pulmonar con 24 mg de betametasona en 48 horas; 6 g de sulfato de magnesio como neuroprotector; antihipertensivos y antitiroideos. Evolucionó sin mejoría clínica, con aumento del sangrado transvaginal y el feto con bradicardia.
Tratamiento preoperatorio: básico, con cristaloides y hemoderivados a requerimiento.
Finalización del embarazo: cesárea clásica, recién nacido vivo, sexo femenino, frecuencia cardiaca de 60 latidos por minuto, sin respuesta a las maniobras de reanimación neonatal. Apgar 0-0, peso 625 g. No se observaron malformaciones congénitas; feto de 24 semanas por índice de Ballard.
Hallazgos transoperatorios: placenta con múltiples vesículas, acretismo placentario en la región del segmento; ovarios con quistes tecaluteínicos bilaterales y torsión del ovario derecho que requirió histerectomía y salpingooforectomía derecha.
Evolución posquirúrgica: inmediata complicada, con datos de choque hipovolémico grado IV. Simultáneamente se inició el soporte vital avanzado y LAPE de urgencia. Se identificó hemoperitoneo (aproximado de 2,000 mL) por sangrado de la cúpula vaginal. Se realizó la hemostasia correspondiente y la atención se continuó en la unidad de cuidados intensivos. Cuantificación de hormonas a las 48 h: beta-hCG: 21,279; TSH: 0.005; T3T: 0.95 y T4 libre: 1.39. El seguimiento clínico de la madre a las 2 semanas: beta-hCG: 1,173 mUI/mL, TSH: 0.017 mIU/dL, T4 libre: 0.77 ng/dL y T3 total: 0.4. La telerradiografía de tórax se reportó normal. Un mes después de este episodio permanecía asintomática, con ajustes de la dosis del tratamiento antihipertensivo. Además, PFH, DHL, bilirrubina total, plaquetas y estudios básicos normales. El estudio histopatológico reportó: placenta con degeneración molar parcial (Figuras 5 y 6), de 1,350 g.
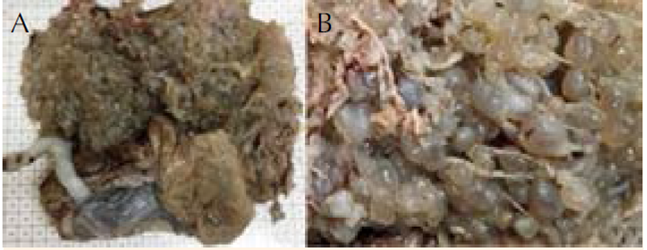
Figura 5 Imágenes macroscópicas. A. Placenta única, con cotiledones fraccionados por tejido placenatrio edematizado “hidrópico”. B. Tejido placentario de aspecto vesicular.
DISCUSIÓN
La coexistencia de embarazo gemelar con mola completa ocurre en 1 de cada 22,000 a 100,000 embarazos y es aún más raro con feto superviviente.10 En este artículo se reporta el caso de una paciente con embarazo gemelar, con mola clásica o completa, feto vivo coexistente (Figura 1) hasta su nacimiento a las 33 semanas de gestación. El aspecto macroscópico mostró claramente dos placentas: una de aspecto normal y la otra con vellosidades edematosas, con la imagen clásica de mola hidatiforme con “vellosidades en racimo de uvas”. Figura 2
Desde la perspectiva microscópica se observaron dos tipos de vellosidades. En una placenta las vellosidades eran del tercer trimestre, en límites normales; otras, sin mezclarse con las primeras, fueron hidrópicas, avasculares y con grados variables de hiperplasia del trofoblasto (Figura 3). Con estos tres elementos se integró el diagnóstico histológico de mola completa. Este caso se suma a los 78 reportados de mola hidatiforme completa y nacimiento de feto vivo sano, que supervive.21
El caso 2 correspondió a mola parcial o incompleta con feto vivo (Figura 4), que cursó clínicamente de manera atípica. La bibliografía reporta que rara vez se asocia con complicaciones médicas y casi siempre la hCG es menor de 100,000 mUI/mL.22 En este caso se asoció con hiperemesis, hipertiroidismo, preeclampsia severa, placenta previa y β-hCG de 482,174 mUI/mL. Además, el feto no tuvo malformaciones congénitas mayores, aunque no se confirmó o descartó triploidia porque no fue posible obtener el cariotipo. Lembet y sus colaboradores23 reportaron un caso semejante con feto vivo de 560 g, que no sobrevivió a los cuidados neonatales intensivos, el cariotipo del feto y la placenta fue 46XY. Está reportado que 32% de los casos de mola parcial pueden tener cariotipos normales.24 En el caso aquí comunicado el diagnóstico temprano de mola incompleta se derivó del estudio temprano del ultrasonido pélvico-abdominal del primer trimestre del embarazo, que mostró imágenes focalizadas de “placenta quística”, sugerentes de mola hidatiforme parcial, además de concentraciones séricas de hCG mayores de 100,000 mUI/mL. El estudio histopatológico confirmó dos tipos de vellosidades (Figura 5). Desde el punto de vista histológico y biológico todo lo anterior cumplió los criterios de mola parcial, que es la mezcla en la misma placenta de vellosidades normales y vellosidades hidrópicas, pero sin hiperplasia del trofoblasto (Figura 6). Estos hallazgos deberían complementarse con una biopsia de las vellosidades coriales o una amniocentesis, para evaluar el cariotipo y normar la decisión clínica.
La historia natural de mola es que ambos tipos evolucionan a neoplasia trofoblástica gestacional persistente, sobre todo en casos de alto riesgo: AFU mayor que la edad gestacional con cifras mayores de 400,000 de hCG por mUI/mL durante el embarazo, hallazgo de hiperplasia del trofoblasto.25,26
Es difícil generalizar la conducta médica cuando se identifica un embarazo molar con feto vivo viable. Ante la concurrencia de complicaciones maternas graves se recomienda la interrupción del embarazo.22,27 Sebire y colaboradores28 reportaron que la complicación más frecuente e indicación para interrumpir el embarazo es la preeclampsia severa. En estos dos casos, posterior a la cesárea-histerectomía, el protocolo de seguimiento mostró negativización de β-hCG después de los tres meses.
Hasta ahora, la causa de la mola hidatiforme sigue ignorándose y los datos epidemiológicos son muy discordantes. Lo único que se sabe es que en la patogenia de estas condiciones participa el genoma paterno, que prevalece de manera casi exclusiva en la mola completa y coexiste con un juego de cromosomas maternos para conformar una triploidia en la mola parcial. El mecanismo por el que se pierde el genoma materno, en cualquiera de las modalidades de mola, se desconoce. Los estudios disponibles señalan que no basta que esté ausente el genoma materno para explicar las alteraciones en el crecimiento del trofoblasto, que son características de la mola, sino que coexisten amplios cambios en la demetilación del genoma paterno, que deben resultar en la expresión de genes que normalmente estarían silenciados y que al estar activos resultan en la proliferación y crecimiento celulares propios de la patología.29
CONCLUSIÓN
Desde la perspectiva clínica es difícil establecer si se trata de mola hidatiforme completa o parcial. El tratamiento médico del embarazo molar con feto vivo viable es complicado y debe adaptarse a las condiciones individuales de salud de cada paciente. La madre debe recibir el consejo acerca de los riesgos y complicaciones materno-fetales y el embarazo debe ser vigilado por un equipo especializado en gestaciones de alto riesgo. Además, estos casos forzosamente deben atenderse en instituciones con servicios de cuidados intensivos maternos y neonatales porque la posibilidad de supervivencia del feto es muy baja y las complicaciones maternas pueden amenazar su vida.











 nueva página del texto (beta)
nueva página del texto (beta)