Introducción
Dos de los grandes retos en la biología de las Células Madre (CM) y la medicina regenerativa, son el control en la diferenciación de CM y asegurar la pureza de las células diferenciadas [1]. Una CM, se define como aquella célula que tiene capacidad de autorenovación y potencialidad de diferenciación, y puede mantenerse en estado indiferenciado por tiempo prolongado. De acuerdo a su potencialidad, las CM se clasifican en totipotentes, pluripotentes, multipotentes y unipotentes. Una propiedad esencial de las Células Madre Pluripotentes (CMP), es su capacidad de diferenciarse en más de 200 tipos de células especializadas bajo ciertas condiciones de cultivo [2]. Diversos estudios experimentales en animales y algunos ensayos clínicos empleando CM, han demostrado su potencial terapéutico en enfermedades de impacto mundial y social como la Diabetes, en las cuales los tratamientos médicos actuales son insuficientes para el control metabólico y sin opción de regenerar el órgano dañado para aumentar su función [3]. Se han propuesto diversos protocolos para la obtención de Células Pancreáticas Diferenciadas (CPD) a partir de CMP, caracterizándolas antes de ser implantadas en modelos diabéticos animales mediante técnicas especializadas como inmunocitoquímica, citometría de flujo y análisis de marcadores moleculares, las cuales requieren personal especializado, tiempo prolongado y en algunas ocasiones un gran número de células [4,5]. Por estas razones, es necesario proponer técnicas eficientes, rápidas y no invasivas, que faciliten la identificación de células o etapas de maduración durante el proceso de diferenciación celular.
La espectroscopía Infrarroja por Transformada de Fourier (FTIR) es una técnica empleada para obtener la huella dactilar molecular de una muestra biológica que absorbe la onda infrarroja de acuerdo con los enlaces químicos y estructurales de las moléculas, proporcionando información de la estructura específica de biomoléculas como lípidos, proteínas, carbohidratos y ácidos nucleicos, a través de una serie de bandas identificables de grupos funcionales en la región electromagnética del infrarrojo medio [6]. Algunos autores han reportado el uso de la espectroscopía FTIR para aplicaciones potenciales en sistemas biológicos, los cuales incluyen estudios citológicos, histológicos y microbianos, acercándose al diagnóstico clínico en combinación con técnicas computacionales [7]. El Análisis de Componentes Principales (ACP) es una técnica estadística que procesa las bandas espectrales FTIR y permite discriminar diferentes tipos de linajes celulares [8]. Por esta razón, la bioespectroscopía comienza a ser una herramienta común en la detección o diagnóstico de laboratorio. Hasta el momento, en la literatura no existen reportes sobre el análisis espectroscópico FTIR y sus componentes principales en la diferenciación de CM a células pancreáticas. El objetivo central de éste proyecto es determinar si el ACP a partir de espectros vibracionales FTIR permite caracterizar el proceso de diferenciación de CM a CPD.
Métodos
Diseño experimental
Se sembraron CMP y se sometieron a un protocolo de diferenciación de 21 días. Durante el proceso de diferenciación, se caracterizaron morfológica y espectroscópicamente las CMP (día 0) y las CPD en diferentes etapas de diferenciación (11, 17 y 21 días). Finalmente, los espectros FTIR de CMP y CPD se normalizaron y se calculó su segunda derivada, la cual se utilizó para realizar el ACP. Todos los datos se realizaron por triplicado, y todos los experimentos se repitieron al menos tres veces.
Cultivos celulares
Se sembraron CMP (ATCC cat: SCRR-2010) a una densidad de 50,000 células/cm 2 sobre una monocapa de fibroblastos embrionarios de ratón previamente arrestados, para mantener las CMP en un estado indiferenciado, utilizando medio basal de células madre (ATCC cat: SCRR-2010) suplementado con 15% de suero fetal bovino (FBS), 2-ß mercaptoetanol al 0,1 mM (Invitrogen cat: 21985023) y factor inhibidor de leucemia a razón de 1 000 U/ml (Chemicon cat: ESG1107).
Posteriormente, las CMP se separaron de la monocapa de fibroblastos y se sometieron a un protocolo de diferenciación pancreática de 21 días, sembrándose a una densidad de 50,000 células/cm 2 , empleando 4 medios de diferenciación en tiempos específicos como sigue: medios de diferenciación 1 y 2 fueron utilizados en los días 0 y 2 de diferenciación respectivamente, mismos que contenían medio Iscove modificado por Dulbecco (IMDM) (Sigma; 51471C) suplementado con 15% de suero fetal de ternera (FCS) (Promocell; C-37350), 50 (g/ml de ácido ascórbico (AA) (Sigma; A5960) y monotioglicerol (MTG) (Sigma; M4165) a una concentración de 6 X103 y 6 X104 M para los medios de diferenciación 1 y 2 respectivamente. El medio de diferenciación 3 fue utilizado del día 6 al día 13 de diferenciación, y consistió de medio Eagle modificado por Dulbecco/F12 (DMEM/F12) (Invitrogen, 11320-033) suplementado con 15% FBS y 10 ng/ml de factor de crecimiento fibroblástico humano recombinante (FGF2) (Sigma, F0291); finalmente, del día 13 hasta el final del protocolo de diferenciación (día 21), las CPD se mantuvieron en medio de diferenciación 4, el cual contenía medio de diferenciación 3 más 10 mM de nicotinamida (Sigma, N0636), 0.1 nM de exendina-4 (American Peptide Company; 46-3-12) y 10 ng/ml de activina-B humana recombinante (Sigma; A1729). Todas las líneas celulares se incubaron a 37°C, 95% de humedad y 5% de CO2.
Análisis morfológico
Las CMP (día 0) y las CPD a los días 11, 17 y 21 de diferenciación, fueron analizadas morfológicamente mediante microscopía directa de campo claro y contraste de fases, empleando un microscopio invertido (Ti-U Eclipse, Nikon) determinando su forma y confluencia celular.
Espectroscopía Infrarroja por Transformada de Fourier
El análisis por espectroscopía FTIR de las CMP y CPD en sus diferentes etapas de diferenciación, fue realizado en el intervalo espectral entre 4000-400 cm -1 utilizando un espectrómetro FTIR (Vertex 70, Bruker) en el modo de Reflectancia Total Atenuada (ATR). El instrumento cuenta con una resolución espectral fija de 4 cm -1 . Se prepararon tres réplicas de cada etapa de diferenciación (0, 11, 17 y 21 días) para su análisis espectroscópico FTIR. Las muestras de células fueron obtenidas y se lavaron dos veces con PBS con el fin de eliminar el medio de cultivo; se centrifugaron a 1,200 rpm durante 3 minutos y se eliminó el sobrenadante. Finalmente, la muestra celular (∼105 células resuspendidas en 3 μl) fue colocada sobre la superficie del cristal ATR y se dejó secar a temperatura ambiente durante 15 minutos para eliminar el exceso de agua, midiendo los espectros hasta que las bandas de absorción relacionadas con el agua fueran indetectables. La radiación infrarroja se propagó a través del cristal y de la muestra para obtener el espectro correspondiente a la absorción infrarroja de las células, en un promedio de 120 adquisiciones por cada medición.
Tratamiento espectral y análisis multiariado
Una vez que se adquirieron todos los espectros FTIR (espectros en crudo), se les aplicó un tratamiento de normalización de variable aleatoria normal tipificada (SNV) utilizando el programa Unscrambler X versión 10.3 (CAMO Software AS); posteriormente, se realizó el cálculo de la segunda derivada de cada espectro empleando el algoritmo Savitzky-Golay, el cual aplica un ajuste sucesivo de subconjuntos de datos puntuales adyacentes con un bajo grado polinominal por mínimos cuadrados a la aproximación lineal. Después de que los espectros fueron tratados y calculados en segunda derivada, se utilizaron como datos de entrada para la aplicación del método multivariado de ACP mediante el programa Unscrambler X 10.3. Este método de ACP es una técnica estadística de síntesis de la información o reducción de dimensión (número de variables), es decir, ante un banco de datos con muchas variables (espectros FTIR), el objetivo es reducirlas a un menor número perdiendo la menor cantidad de información posible buscando combinaciones lineales de las variables originales que representan lo mejor posible la variabilidad presente en los datos. De este modo, con unas pocas combinaciones lineales, que son los componentes principales, sería suficiente para entender la información contenida en los datos. Al mismo tiempo, la forma en que se construyen los componentes (gráficas de puntuación), sirve para entender la estructura de correlación (formando agrupaciones y/o trayectorias) inherente a los datos.
Resultados
Las CMP (día 0) presentaron una morfología esférica y simétrica, con características adherentes y tendencia a formar colonias celulares, característica morfológica de su estado de indiferenciación en cultivo (Figura 1).
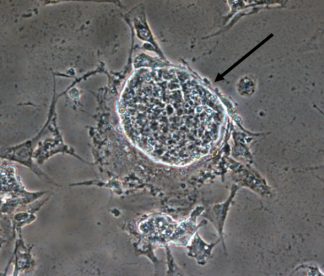
Figura 1 Colonia de células madre pluripotentes ((), característica morfológica del estado de indiferenciación en cultivo (100X).
Posteriormente, una vez separadas las CMP de la monocapa de fibroblastos, se disgregaron y se sometieron al protocolo de diferenciación de 21 días, resultando CPD con morfología esférica y tendencia a formar agregados celulares tridimensionales denominados Cuerpos Embrionarios (CE), los cuales se observaron claramente a partir del día 6 de diferenciación y aumentaron de tamaño conforme al tiempo de cultivo hasta presentar una tridimensionalidad al día 21 de diferenciación (Figura 2).
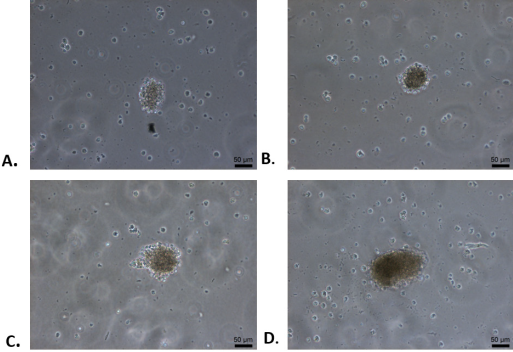
Figura 2 Diferenciación de células madre pluripotentes a cuerpos embrionarios (CE) conformados por células pancreáticas diferenciadas, (100X). A. Células en 6 días de diferenciación conformando un CE. B. Aumento del CE conformado por células en 11 días de diferenciación. C. CE de 17 días de diferenciación. D. CE denso conformado por células pancreáticas diferenciadas al día 21 de diferenciación.
Respecto a los espectros FTIR de CMP y CPD en sus diferentes etapas de maduración (0, 11, 17 y 21 días), se observó en los espectros en crudo normalizados, bandas de absorción asociadas con diferentes tipos de biomoléculas, encontrando diferencias en la composición estructural y bioquímica entre CMP y CPD (Figura 3).

Figura 3 Espectros FTIR de Células Madre Pluripotentes (CMP) y Células Pancreáticas Diferenciadas (CPD) en diferentes etapas de maduración (11, 17 y 21 días) representados en la región de la huella dactilar biológica (1800-800 cm -1 ).
Bandas de absorción a 1744 cm -1 están relacionadas con las vibraciones de extensión del grupo éster C=O de lípidos, mientras que dos bandas intensas a 1650 cm -1 y 1540 cm -1 están relacionadas con los grupos funcionales amida I y amida II de proteínas respectivamente.
Las bandas a 1454 cm -1 corresponden a los grupos metilo y metileno de lípidos y proteínas, en tanto las bandas a 1396 cm -1 se deben a las vibraciones de extensión COO-de las cadenas laterales de aminoácidos. Las siguientes bandas a 1238 cm -1 y 1080 cm -1 están relacionadas con las vibraciones de extensión asimétricas y simétricas P=O de los grupos fosfodiéster PO2 de moléculas fosforiladas respectivamente. Enseguida, las bandas a 1030 cm -1 corresponden a la absorción de vibraciones C-O de glucógeno.
Por último, las bandas en el intervalo 992-986 cm -1 están asociadas con la cadena principal de fosfato ribosa, mientras que las bandas a 966 cm -1 provienen de las vibraciones de extensión del esqueleto de DNA.
Subsecuentemente, se obtuvo la segunda derivada de los espectros FTIR normalizados de CMP y CPD en las regiones de amida I de proteínas (1700-1600 cm -1 ) y carbohidratos y ácidos nucleicos (1100-850 cm -1 ) (Figura 4). En la Figura 4A correspondiente a la región amida I de proteínas, se observan bandas relacionadas con los componentes de la estructura secundaria de proteínas como giros β (1693 cm -1 y 1682 cm -1 ), hélices α (1650 cm -1 ) y láminas β (1634 cm -1 ), los cuales son específicos y sensibles a cambios estructurales y conformacionales de las proteínas, apreciando un aumento en la intensidad de las bandas respectivas a giros-β y disminución en la intensidad de las bandas de hélices-α y láminas-β en las CPD respecto a las CMP. Respecto a la segunda derivada en la región de carbohidratos y ácidos nucleicos (Figura 4B), se observó un incremento significativo en la intensidad de las bandas correspondientes a los grupos fosfato y glucógeno entre 1080 y 1030 cm -1 en las CPD y una disminución significativa en las bandas correspondientes a la vibración de la cadena principal de fosfato ribosa (992 cm -1 ) y al anillo de ribosa (914 cm -1 ) en las CMP al someterlas al proceso de diferenciación pancreática. Así mismo, también se apreció en las CPD un desplazamiento y aumento de la intensidad en las bandas correspondientes a las vibraciones de extensión del esqueleto de DNA (986 cm -1 ) así como la banda espectral a 899 cm -1 correspondiente a DNA/RNA.
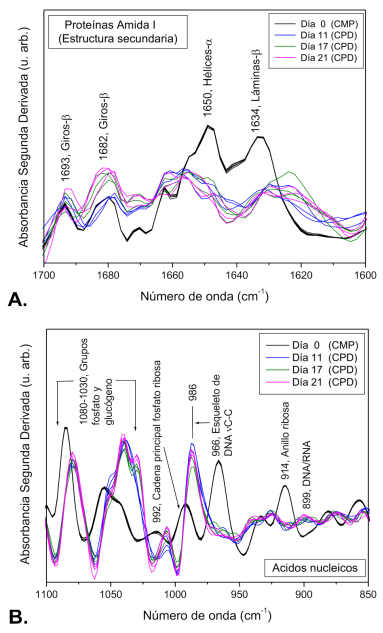
Figura 4 Segunda derivada de los espectros FTIR de Células Madre Pluripotentes (CMP) y Células Pancreáticas Diferenciadas (CPD) en diferentes etapas de maduración (11, 17 y 21 días), en dos regiones (N=3). A. Amida I de proteínas. B. Carbohidratos y ácidos nucleicos.
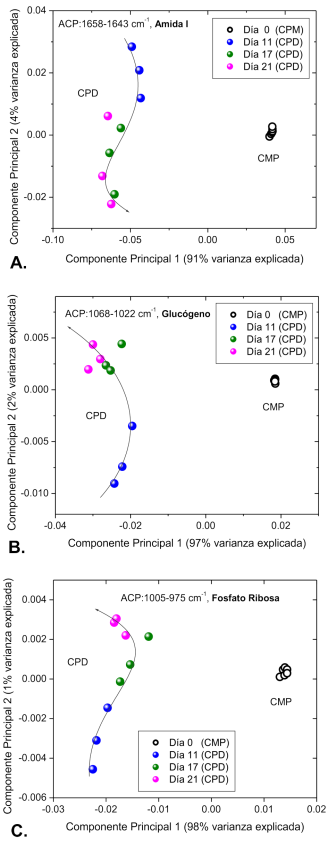
Finalmente, con los espectros tratados y calculados en segunda derivada, se utilizaron los datos espectrales de la región amida I de proteínas (1700-1600 cm -1 ) así como de la región de carbohidratos y ácidos nucleicos (1100-850 cm -1 ) para realizar el análisis multivariado de ACP (Figura 5). Se obtuvieron gráficas de puntuación en las siguientes regiones: región amida I de proteínas correspondiente a las hélices α (1658-1643 cm -1 ) (Figura 5A), región de grupos fosfato y carbohidratos correspondiente al glucógeno (1068-1022 cm -1 ) (Figura 5B), y región de ácidos nucleicos correspondiente a fosfato ribosa (1005-975 cm -1 ) (Figura 5C). Se observa en las gráficas de puntuación de las tres regiones una clara discriminación entre datos asociados a CMP con respecto a los de CPD. Además de lo anterior, los datos asociados a CPD en las tres regiones espectrales analizadas pudieron ser agrupados en trayectorias, cuya magnitud del segundo componente principal determina la discriminación en las diferentes etapas del proceso de diferenciación de CMP a CPD. Esta discriminación resulta muy evidente en la tercera gráfica de puntuación correspondiente a la región de fosfato ribosa (1005-975 cm -1 ).
Discusión
De acuerdo a la espectroscopía vibracional infrarroja, el espectro FTIR obtenido de CMP, fue similar a lo reportado por Ami y cols. [8], y posterior a su diferenciación se observaron cambios notorios en las intensidades y frecuencias de las bandas de absorción de las CPD con respecto a las CMP, particularmente en las regiones espectrales de proteínas, carbohidratos y ácidos nucleicos, reflejando diferencias estructurales entre estas líneas celulares (Figura 3). Así mismo, Ami y cols. también reportaron estos cambios espectrales durante la diferenciación de CMP conformando CE, confirmando con estos resultados la obtención de CE a partir de CMP mediante espectroscopía vibracional.
Similar a otros estudios, como los reportados por Ami y cols. y Cao y cols. [8,9], los espectros FTIR obtenidos en este trabajo de CMP y CPD fueron complejos, pero el uso del análisis multivariado nos facilitó el procesamiento para identificar y evidenciar los cambios espectrales más significativos durante la diferenciación; en nuestro caso, la segunda derivada de los espectros de CMP y CPD (Figura 4), fue utilizada para proporcionar mayor precisión al ACP.
Con al análisis de la segunda derivada de los espectros FTIR, pudimos observar en la región amida I de proteínas cambios en la intensidad relativa de los componentes asociados con la estructura secundaria de las proteínas como giros β, hélices α y láminas β, lo que sugiere que proteínas específicas fueron expresadas y reorganizadas durante la diferenciación de CMP. Además, similar a lo reportado por Oyamada y cols., observamos una sobreexpresión de giros β la cual está relacionada con un aumento de las uniones gap durante la diferenciación de CMP [10].
En lo que respecta a la segunda derivada en la región de carbohidratos y ácidos nucleicos, apreciamos un aumento significativo en la intensidad de las bandas asociadas con las vibraciones de los grupos fosfato y glucógeno (1080-1030 cm -1 ) en las CPD, lo cual se atribuye a que la autorenovación de las CMP está potenciada por la inhibición parcial de la enzima glucógeno sintasa quinasa 3 (Gsk3), y cuando las CMP pierden su estado de indiferenciación, ésta enzima se activa e incrementan los niveles de glucógeno en las CPD [11].
Así mismo, en esta región observamos un incremento y desplazamiento de la banda espectral 966 cm -1 de CMP a 986 cm -1 en las CPD, así como la presencia de un nuevo componente a 899 cm -1 en las CPD, lo cual puede ser asignado a la traslación de mRNA y a un modo vibracional que indica la presencia de un nuevo DNA/RNA híbridos una vez que ocurre el proceso de diferenciación [12].
Realizando el análisis multivariado de ACP (Figura 5), pudimos observar en el primer componente principal para las tres regiones exploradas, una clara discriminación entre CMP y CPD, evidenciando el cambio bioquímico y estructural que sufren las CM al ser diferenciadas, resultados que han sido reportados por diversos autores y nuestro grupo de investigación mediante técnicas moleculares o fenotípicas durante la diferenciación dirigida de CMP [2,4,5,8,13,14].
Respecto al segundo componente principal en las primera y segunda regiones (proteínas y carbohidratos), este análisis nos posibilitó discriminar la primera fase de diferenciación (día 11), en la cual como se mencionó anteriormente, se ha reportado la expresión de nuevas proteínas relacionado con el aumento en la complejidad celular y en el contenido proteico, así como el aumento de las moléculas de azúcar por el metabolismo de los carbohidratos como el glucógeno durante la diferenciación de CMP [2,8,10]. Además, esta segunda región analizada correspondiente al glucógeno, refuerza mediante ACP lo reportado por Walsh y cols., quienes mencionan que este intervalo espectral, constituye un buen indicador de las alteraciones en la estructura secundaria del DNA y lo destacan como una región fundamental para el proceso de diferenciación [15].
Por último, el segundo componente principal en la tercera región (fosfato ribosa), es el que nos permitió discriminar efectivamente todo el proceso de diferenciación (días 11, 17 y 21) y está relacionado con cambios en el contenido de RNA debido a una sobre o baja regulación de los genes y a la activación transcripcional que se lleva a cabo durante la diferenciación de CM [16].
La aplicación de esta metodología puede ser útil para caracterizar CM y su proceso de diferenciación a diversos linajes celulares en tiempos cortos, aunque se necesitan otros ensayos para caracterizar y discriminar células diferenciadas altamente especializadas.
Conclusiones
El ACP a partir de la espectroscopía FTIR, permite caracterizar química y estructuralmente CMP y su proceso de diferenciación a células pancreáticas. Tales resultados infieren viabilidad técnica para proponer el ACP como una técnica no invasiva y rápida para caracterizar un proceso de diferenciación celular.











 nueva página del texto (beta)
nueva página del texto (beta)