INTRODUCCIÓN
Cannavalia ensiformis, L. DC. es una leguminosa que destaca por su contenido nutrimental (Sandoval et al. 2001), la cual es sumamente resistente a la sequía e inmune a pesticidas (FAO, 2012), el género Cannavalia está compuesto por 48 especies, que son originarios de las regiones tropicales donde están ampliamente distribuidas (Fagbenro et al. 2007). Su potencial nutricional ha sido bien estudiado en organismos monogástricos, aves de corral (Wyss & Bicjel, 1988; Udedibie, 1990; Udedibie & Nkwocha, 1990) y peces (Martínez-Palacios et al. 1988; Akinbiyi, 1992; Abdo De la Parra et al. 1998; Osuigwe et al. 2002; Fagbenro et al. 2007). C. ensiformis es una fuente potencial de energía, proteínas, vitaminas y minerales; sin embargo, este enorme potencial nutritivo se ve reducido por factores antinutricionales (FAN), que limitan su utilización en la elaboración de dietas para peces (Martinez-Palacios et al. 1988; Abdo de la Parra et al. 1998; Osuigwe et al. 2002, Fagbenro et al. 2007; Akande et al. 2010). Para la utilización de esta leguminosa como ingrediente para la alimentación animal se han estudiado diversos procesos de eliminación de FAN, para mejorar su digestibilidad. Asimismo, se han desarrollado métodos para medir la digestibilidad de la proteína contenida en el alimento, como es el método “in vitro” de pH-STAT el cual permite un estudio detallado del proceso de hidrólisis de la proteína durante la digestión a través de la cuantificación de los aminoácidos y péptidos liberados (Dimes & Haard, 1994; Oña et al. 2003; Moyano et al. 2014), permitiendo evaluar la digestibilidad y selectividad de los ingredientes dietarios (Tacon, 1995; Alarcón et al. 2002) que pueden utilizarse en el cultivo de peces. Se han realizados estudios de digestibilidad in vitro en especies de peces como Paralabrax maculatofasciatus, Steindachner, 1868, Atractosteus spatula, Lacepède, 1803, Chirostoma estor, Jordan, 1880, Centropomus undecimalis, Bloch, 1792, Atractosteus tropicus, Gill, 1863 y Cichlasoma urophthalmus, Günther, 1862, entre otros (Álvarez-González, 2003; Aguilera et al. 2005; Ávalos-Sánchez, 2006; Concha-Frías, 2008; Frías-Quintana et al. 2010; Cuenca-Soria et al. 2013), que han permitido crear o mejorar sus formulaciones alimenticias. Este estudio se diseñó para evaluar la eliminación de FAN mediante los procesos de hidratación, extracción ácida, decorticado, cocción, germinado, autoclave y desgrasado de las semillas de C. ensiformis, utilizando análisis químicos proximales y digestibilidad in vitro de las harinas obtenidas de estos procesos, con la finalidad de sustituir parcialmente la harina de pasta de soya en dietas de Oreochromis niloticus, Linnaeus, 1758.
MATERIALES Y MÉTODOS
El presente estudio se dividió en dos etapas: la primera comprendió la elaboración de las harinas de las semillas de C. ensiformis a través de 7 diferentes procesos de eliminación de FAN y la segunda consistió en la determinación de la digestibilidad in vitro mediante pH STAT de las harinas obtenidas previamente utilizando extractos enzimáticos digestivos de juveniles de O. niloticus.
Etapa 1: Elaboración de las harinas de las semillas de C. ensiformis. Las semillas de C. ensiformis fueron obtenidas del rancho el Recreo en Teapa, Tabasco, México, cosechadas manualmente y empaquetadas en bolsas de polietileno con capacidad de 10 Kg; para lo cual no se utilizó ningún tratamiento de conservación. Este estudio de procesamiento y análisis proximales fueron realizados en el Laboratorio de Fisiología Comparada y Genómica Funcional, del Centro de Investigaciones Biológicas del Noroeste (CIBNOR) en La Paz, B.C.S. Para los procesos de hidratación, extracción con ácido, decorticado, cocido y autoclavado se utilizaron 200 g de semillas de C. ensiformis para cada tratamiento. Todos los ensayos fueron realizados por cuadruplicado.
Hidratación. Las semillas se colocaron en un matraz Erlenmeyer y fueron hidratadas con un litro de agua destilada, en agitación constante durante 36 h, con recambio total de agua destilada cada 12 h.
Extracción con ácido. Las semillas se colocaron en un matraz Erlenmeyer y fueron hidratadas en un litro de agua destilada durante 24 h, con un recambio total de agua destilada a las 12 h, finalmente fueron colocadas en una solución de HCl 20 mM por 12 h, todo este proceso se realizó con agitación constante.
Decorticado. Las semillas fueron trituradas con un molino mecánico (molino café Braun KSM 2), posteriormente se eliminó la corteza de la semilla y el decorticado se almacenó en un recipiente con sellado hermético (Bautista, 2009), para la posterior preparación de la harina.
Cocción. Las semillas se colocaron en un matraz Erlenmeyer y fueron hidratadas con un litro de agua destilada, durante 12 h a temperatura ambiente, luego se procedió a decantar y lavar con agua destilada. Posteriormente, fueron cocidas a ebullición durante 30 minutos utilizando una relación frijol: agua de 1:5 (Anduaga-Cota et al. 2002).
Germinado. Se seleccionaron 100 semillas (SCE), previamente desinfectadas con cloro al 10% por 3 minutos y lavadas en 3 tiempos de un minuto con agua destilada estéril, luego fueron colocadas en papel toalla húmeda dentro de una bolsa plástica, este proceso se realizó en una cámara UV para evitar contaminación por gérmenes. Posteriormente se trasladaron a una incubadora (Binder, modelo BD53-UL) en completa oscuridad por 27°C y 50% de humedad relativa, durante 6 días, las semillas fueron humedecidas con agua destilada estéril cada 24 horas.
Autoclavado. Las semillas fueron colocadas en un colador y sumergidas para hidratación en agua destilada por 3 minutos, seguidamente se retiró el colador y se decantó el agua; las semillas se colocaron en bolsas y expuestas en la autoclave a 121°C 15 lb por pulg2, por 30 minutos.
Desgrasado. Se pesaron 2 kg de semillas y se realizó una molienda en un molino industrial (marca Pulvex. S.A. de C.V.), se tamizaron a 500 micras para homogenizar el tamaño de las partículas, acto seguido se pesaron 200 g de harina y fue introducida en un reactor de vidrio de un litro y se agregaron 400 mililitros de éter de petróleo con agitación a 120 RPM en un agitador industrial (MAXQ 3000) durante 2 h. La mezcla se filtró en un dispositivo de succión con la ayuda de una bomba de vació.
Al final de los ensayos de hidratación, extracción con ácido, cocido, autoclavado, germinado y desgrasado, las muestras fueron lavadas con agua destilada, decantadas y secadas en una estufa (VWR, modelo 1680) a temperatura de 70 °C por 24 h y molidas en un pulverizador PULVEX 200, México, D. F. Posteriormente las harinas se tamizaron a 500 micras y se almacenaron a 4°C para su posterior análisis según Rivas (2006).
Análisis químico proximal a las harinas procesadas de C. ensiformis. Se aplicaron los métodos de la AOAC (1990) para las determinaciones de: a) humedad, determinación por diferencia de peso a 70°C por 24 h; b) proteína cruda, cuantificando la concentración de nitrógeno con el Método de DUMAS (Equipo Leco FP-528); c) extracto etéreo, usando el método de Soxtec-Avanti, TECATOR; d) fibra cruda, Método de hidrólisis sucesiva (ácido / base) y e) cenizas, determinación por diferencia de peso, previa calcinación a 500° C por 24 h. Se calculó el extracto libre de nitrógeno, por diferencia de 100% con las determinaciones anteriores.
Etapa 2: Digestibilidad in vitro. Los juveniles fueron obtenidos de un lote de reproductores de tilapia del área de reproducción del Laboratorio de Acuicultura Tropical de la División Académica de Ciencias Biológicas en la Universidad Juárez Autónoma de Tabasco. Las larvas, fueron alimentadas con una dieta comercial hormonada para tilapia con 52% de proteína y 14% de lípidos (El pedregal Silver Cup®, México, Estado de México, Toluca) con una dosis de 60 mg de 17 α-metiltestosterona (MT) Kg de alimento-1, por un periodo de 28 días. Una vez concluido el periodo de masculinización, se les suministró una dieta para tilapia con 45% de proteína y 5% de lípidos (El pedregal Silver Cup®,). Los juveniles fueron mantenidos en un sistema de recirculación de agua, durante un periodo de dos semanas adicionales antes de su procesamiento. Los parámetros de la calidad del agua fueron medidos diariamente, se mantuvieron a 29 ± 1°C de temperatura, para el oxígeno disuelto (6.3 ± 0.5 mg 1-1) se utilizó un oxímetro YSI 55 (con138 precisión de 0.1°C y 0.01 mg l-1, California, USA) y para el pH (7.1 ± 0.2) se utilizó un potenciómetro (Hanna Instruments, HI 98311, Rhode Island, USA).
Obtención de extractos multienzimáticos. Para estos ensayos se sacrificaron un total de 35 juveniles con una longitud promedio de 21 ± 3 cm y un peso promedio de 177.25 ± 4.5 g, que previamente fueron dejados en inanición por un periodo de 48 horas antes de ser sacrificados y pesados antes y después de la evisceración, posteriormente se le extrajo el estómago y el intestino por separado, los cuales fueron triturados con un homogenizador de tejidos (ULTRA TURRAX® IKA T18 Basic). Los extractos del estómago se prepararon en agua destilada ajustando el pH a 3.55 con ácido clorhídrico (0,1 M) y para los extractos del intestino el agua destilada fue ajustada con hidróxido de sodio (0,1 M) a pH de 7.95 a 4 °C. Se utilizó una relación 5:1 (5 ml de agua destilada por g de tejido). La mezcla obtenida fue colocada en tubos Eppendorf de 2 mL y centrifugada a 12 000 rpm a 4 ºC. El sobrenadante fue extraído y se les ajustó el pH requerido para cada extracto, luego fueron almacenados en tubos Eppendorf a -20 ºC hasta su posterior análisis.
Actividad específica de enzimas estomacales e intestinales. Con el fin de conocer la cantidad de unidades de proteasa ácida en el extracto estomacal, se utilizó el método de Anson (1938), con las siguientes modificaciones: a 1 ml de hemoglobina (1 %) en tampón 0,1 M glicina HCl a pH 2 y se le añadieron 5 μl de extracto enzimático de estómago de O. niloticus. La mezcla de reacción se incubó durante 5 minutos a 37 ºC y la reacción se detuvo por adición de 0,5 ml de ácido tricloroacético (TCA) al 20 %. Después se dejó reposar la mezcla de reacción (15 a 30 minutos), se centrifugó a 12000 rpm durante 5 minutos a 4ºC. En el sobrenadante, se midió la cantidad de equivalentes de tirosina liberados (ABS280nm) mediante un espectrofotómetro uv/visible. Una unidad de actividad se definió como la cantidad de enzima que cataliza la liberación de 1 μg de tirosina por minuto. Para determinar el coeficiente de extinción molar de la tirosina, se realizó un recta patrón con diferentes concentraciones de tirosina (0 a 300 μg ml-1). Todos los ensayos se realizaron por triplicado.
Para determinar la actividad de las proteasas intestinales se utilizó el método de Kunitz (1947), modificado por Walter (1984), usando como sustrato caseína al 1% en tampón 100 mM Tris-HCl, 10 mM CaCl2 a pH 9. Se agregó 0,5 ml de caseína, más 0,5 ml de tampón Tris-HCl 100 mM + CaCl2 10 mM, pH 9 y 10 μl de extracto enzimático del intestino y se incubó por 10 minutos, la reacción se detuvo con 0,5 ml de ácido tricloroacético (TCA) al 20 %, se centrifugó a 12 000 rpm por 5 minutos y se determinó la cantidad de equivalentes de tirosina liberados según el protocolo descrito en el apartado anterior.
Evaluación de la digestibilidad in vitro ácida y alcalina en pH Stat. Un total de 7 harinas de C. ensiformis como ingredientes proteínicos de origen vegetal (Tabla 1) fueron expuestas a degradación enzimática en un sistema pH Stat Titrando (Metrohm 902 Suiza), de acuerdo a Saunders et al. (1972), modificado por Dimes & Haard (1994), para evaluar su grado de hidrólisis (GH, %). Los ensayos de digestión ácida se realizaron en un volumen final de 5 ml de la mezcla de reacción. Cada ingrediente de prueba se resuspendió en agua destilada a una concentración de 8 mg de proteína mL-1 en un vaso de 20 mL, ajustando el pH a 3.5 con HCl 0.1 N para proteasas ácidas, a esta mezcla se le agregaron 189 μl (10 U mL-1 de mezcla de reacción) de la preparación enzimática a pH 3 manteniendo la mezcla de reacción en agitación continua (500 rpm) a 37 ºC durante 15 minutos. Se utilizó a la hemoglobina como ingrediente de referencia. De la misma forma se realizó la digestión alcalina, para lo cual se ajustó el pH a 7.9 con NaOH 0.1N y se le agregaron 263 μL (100 U mL-1 de mezcla de reacción) de extracto enzimático a pH 8 manteniendo en agitación continua (500 RPM) a 37 ºC durante 45 minutos y se utilizó caseína como ingrediente de referencia. Se tomaron muestras de 20 µL del vaso de reacción: en la fase ácida cada 100 s hasta los 900 s y en la fase alcalina cada 250 s hasta los 2 700 s y conservadas a -20 °C para determinar los aminoácidos libres totales (AALT). La unidad de tiempo previa a la adición de extracto multienzimático, fue definida como el tiempo cero. A partir del gasto de HCl (Fase ácida) y de NaOH (Fase alcalina) se determinó (GH), el cual se expresa como el porcentaje del número de enlaces peptídicos hidrolizados (h) con respecto al total de la proteína (htot). Donde el valor de (h) = [consumo de base en ml (Vb)] x [normalidad de la base (Nb)] x [1 x (constante de disociación de los grupos α-NH2 y α-COOH respectivamente)-1] x [1 x (masa de proteína en la mezcla de reacción)-1]. Todas las determinaciones se realizaron por triplicado.
Tabla 1 Composición proximal (%) de harinas de Cannavalia ensiformis,L. DC, utilizando diferentes métodos de procesamiento.
| Parámetros | Humedad (%) | Proteína (%) | Extracto Etéreo (%) | Fibra cruda (%) | Cenizas (%) | ELN (%) | Energía (cal/g) |
|---|---|---|---|---|---|---|---|
| Harina Desgrasado | 5.13 ± 0.21 | 32.57 ± 0.21 | 0.48 ± 0.08 | 11.31 ± 0.05 | 4.16 ± 0.09 | 51.47 | 4178.29 ± 6.76 |
| Harina E. ácido | 6.61 ± 0.20 | 32.41 ± 0.16 | 1.93 ± 0.03 | 9.78 ± 0.10 | 3.33 ± 0.08 | 52.54 | 4224.84 ± 5.06 |
| Harina Autoclavado | 7.40 ± 0.23 | 31.59 ± 0.22 | 2.07 ± 0.06 | 10.05 ± 0.05 | 4.10 ± 0.05 | 52.19 | 4243.29 ± 1.50 |
| Harina Cocción | 9.07 ± 0.08 | 32.37 ± 0.27 | 1.98 ± 0.10 | 9.91 ± 0.06 | 3.28 ± 0.03 | 52.46 | 4305.83 ± 3.20 |
| Harina Decorticado | 11.23 ± 0.10 | 39.38 ± 0.14 | 2.17 ± 0.03 | 0.80 ± 0.00 | 4.15 ± 0.03 | 53.51 | 4330.05 ± 7.59 |
| Harina Hidratación | 6.46 ± 0.28 | 32.26 ± 0.17 | 2.13 ± 0.10 | 10.71 ± 0.21 | 3.31 ± 0.11 | 51.59 | 4275.90 ± 2.68 |
| Harina Germinado | 12.41 ± 0.29 | 34.39 ± 0.14 | 1.95 ± 0.05 | 9.72 ± 0.26 | 4.31 ± 0.04 | 49.63 | 4154.91 ± 1.00 |
| Harina sin Tratamiento | 10.18 ± 0.10 | 32.87 ± 0.16 | 2.08 ± 0.06 | 8.22 ± 0.15 | 4.04 ± 0.03 | 52.79 | 4200.69 ± 2.49 |
Valores promedio ± desviación estándar de 3 réplicas por muestra. Resultados expresados en base seca, excepto humedad.
Análisis de aminoácidos libres totales (AALT). Las muestras pre-hidrolizadas (20µl) del vaso de reacción, se fijaron con 20 µl de una solución de ácido tricloroacético (TCA) al 12% y fueron analizadas mediante la técnica de o-phtaldialdehido (OPA), de acuerdo con Church et al. (1983), que consiste en la unión de la parte amino terminal de los aminoácidos con el reactivo OPA. La solución de OPA está compuesta de 50 ml de tetraborato sódico 0,1 M; 5 mL de SDS al 20 %; 80mg de o-phtaldialdehido (disueltos en 1 mL de metanol) y 0,2 mL de ß-mercaptoetanol, aforando con agua destilada hasta 100 mL de volumen final. Las muestras prehidrolizadas que fueron mezcladas con TCA se centrifugaron a 12 000 rpm por 15 minutos. Se tomaron 10 µl del sobrenadante y se añadieron directamente a 1 mL del reactivo OPA, mezclado brevemente e incubando durante 5 minutos a temperatura ambiente. Finalmente se midió la absorbancia a 340 nm y se comparó con un estándar elaborado con l-leucina (0.5 mg mL-1) concentraciones crecientes de 0 a 20 µg ml-1 para la determinación de la cantidad de aminoácidos libres totales en las muestras. Los resultados se expresan como µg de equivalentes de l-leucina liberados por cada µg de proteína. Los ensayos fueron realizados por triplicado.
Análisis estadístico. Se corroboró la normalidad y homoscedasticidad para los valores de GH y liberación de aminoácidos totales, por lo que se aplicó un análisis de varianza de una vía y pruebas posteriores de Tukey para determinar las diferencias entre los tratamientos. Para todas las pruebas estadísticas se utilizó un valor de significancia de (P< 0.05). Así mismo para todos los estadísticos se utilizó el programa estadístico STATISTICA V7.
RESULTADOS
Análisis químico proximal. El análisis proximal de las harinas procesadas de las semillas de C. ensiformis se muestra en la Tabla 1.
Actividad específica de extractos multienzimáticos de estómago e intestino. Los ensayos de proteasas ácidas y alcalinas, revelaron que los juveniles de O. niloticus, tienen una mayor actividad de proteasas en el intestino en relación a la actividad enzimática presentada en la sección estomacal del tracto digestivo (Tabla 2). Ambos valores de actividad específica se tomaron como base para calcular el volumen de extracto multienzimático, tanto en el proceso de hidrólisis ácida, como en la alcalina.
Tabla 2 Actividad de enzimas proteolíticas del estómago (proteasas ácidas) e intestino (proteasas alcalinas) de Oreochromis niloticus, Linnaeus, 1758.
| Actividad Proteolítica | Unidades ml-1 | Unidades g Tejido fresco-1 | Unidades juveniles-1 |
|---|---|---|---|
| Ácida | 52.78±5.38 | 263.9±26.91 | 2111.2±215.27 |
| Alcalina | 380.02±15.26 | 1900.1±76.28 | 1215.6±48.80 |
Digestibilidad in vitro de las harinas de C. ensiformis como ingredientes proteínicos. Para la hidrolisis ácida se utilizaron los extractos enzimáticos estomacales de O.niloticus y fueron expuestos a las diferentes harinas procesadas de C. ensiformis mediante la técnica del pH STAT, tomando como base la hemoglobina, donde sus valores fueron considerados como el 100 % del grado de hidrólisis (GH, %). Todas las harinas mostraron valores de GH menores al 100 %, siendo la harina cocida la que presenta mayor valor de GH con respecto al resto de los tratamientos. Por otro lado, el tratamiento con ácido alcanzó el valor más bajo (Fig. 1a).
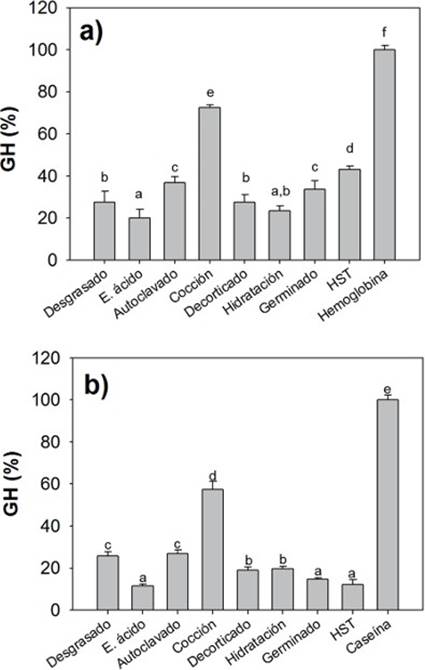
Figura 1 Valores de GH (% ± DE) de los ingredientes proteínicos de las harinas de Cannavalia ensiformis: a) fase ácida, como ingrediente de referencia la hemoglobina y b) fase alcalina, como ingrediente de referencia la caseína.
En la fase alcalina las harinas fueron expuestas a extractos multienzimáticos intestinales, utilizando los valores de la caseína como el 100 % de GH. Los resultados mostraron que la harina cocida tiene el mayor valor de GH con respecto al resto de los tratamientos, siendo el tratamiento con ácido quien mostró el valor más bajo (Fig.1b).
En la Tabla 3, se muestran los valores de GH para cada fase (ácida y alcalina) y el valor del GH total, así mismo el porcentaje de digestibilidad alcanzado por cada una de las harinas analizadas, donde la suma del GH de la hemoglobina y la caseína, se tomaron como control y fue considerada como el 100% de la digestibilidad. Aquí podemos observar que el tratamiento por cocción presenta un GH total mayor y por encima del 50 % de digestibilidad con respecto a los demás tratamientos.
Tabla 3 Valores finales de los grados de hidrólisis (GH) fase ácida, fase alcalina, GH total y digestibilidad relativa (%) de los ingredientes proteínicos de las harinas de Cannavalia ensiformis, L. DC. e ingrediente de referencia (hemoglobina y caseína).
| Ingrediente | GH Ácido | GH Alcalino | GH Total | Digestibilidad (%) |
|---|---|---|---|---|
| Harina Desgrasado | 0.29 ± 0.06 | 2.97 ± 0.25 | 3.26 | 28.11 |
| Harina E. ácido | 0.21 ± 0.05 | 1.23 ± 0.07 | 1.44 | 12.40 |
| Harina Autoclavado | 0.39 ± 0.03 | 2.84 ± 0.12 | 3.23 | 27.89 |
| Harina Cocción | 0.76 ± 0.01 | 6.04 ± 0.37 | 6.80 | 58.73 |
| Harina Decorticado | 0.29 ± 0.04 | 2.00 ± 0.18 | 2.29 | 19.74 |
| Harina Hidratación | 0.25 ± 0.02 | 2.08 ± 0.05 | 2.33 | 20.10 |
| Harina Germinado | 0.35 ± 0.04 | 1.55 ± 0.11 | 1.90 | 16.43 |
| Harina sin Tratamiento | 0.45 ± 0.03 | 1.29 ± 0.20 | 1.74 | 15.05 |
| Hemoglobina/Caseína | 1.05 ± 0.02 | 10.53 ± 0.24 | 11.58 | 100.00 |
Se incluye el % y la desviación estándar.
Determinación de aminoácidos libres totales mediante la técnica de OPA. En la fase ácida, el tratamiento por germinado mostró los mayores valores de AALT (0.28 ± 0.006 µg mL-1) seguidos del decorticado (0.12 ± 0.022 µg mL-1) (Fig.2a), estos valores fueron mayores a los mostrados por la hemoglobina (0.09 ± 0.009 µg mL-1), los tratamientos de cocido (0.02 ± 0.006 µg mL-1) y por autoclave (0.03 ± 0.012 µg mL-1) presentaron los valores más bajos de AALT (Tabla 4).
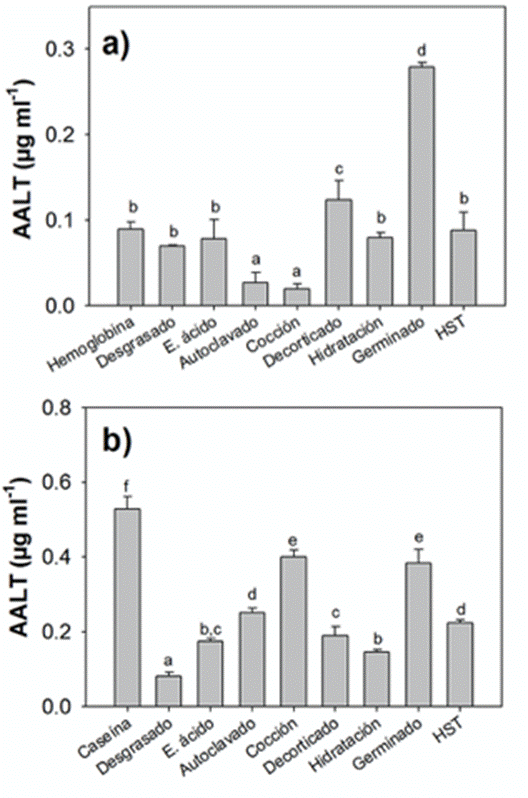
Figura 2 Valores de AALT (µg mL-1 ± DE) de los ingredientes proteínicos de las harinas de Cannavalia ensiformis: a) fase ácida, como ingrediente de referencia la hemoglobina y b) fase alcalina, como ingrediente de referencia la caseína.
Tabla 4 Valores finales de la liberación de aminoácidos totales (AALT) fase ácida de los ingredientes proteínicos de harinas de Cannavalia ensiformis,L. DC. e ingrediente de referencia (hemoglobina).
| Ingrediente | AALT (µg ml-1) | AALT (%) |
|---|---|---|
| Hemoglobina | 0.09 ± 0.009 | 100.00 |
| Harina Desgrasado | 0.07 ± 0.001 | 77.70 |
| Harina E. ácido | 0.08 ± 0.023 | 86.99 |
| Harina Autoclavado | 0.03 ± 0.012 | 30.11 |
| Harina Cocción | 0.02 ± 0.006 | 21.93 |
| Harina Decorticado | 0.12 ± 0.022 | 138.29 |
| Harina Hidratación | 0.08 ± 0.006 | 88.48 |
| Harina Germinado | 0.28 ± 0.006 | 311.15 |
| Harina sin Tratamiento | 0.09 ± 0.021 | 98.14 |
Se incluye el % y la desviación estándar.
En la fase alcalina el tratamiento por cocción presentó valores significativamente altos (0.40 ± 0.02 µg mL-1) (Fig.2b), siendo el tratamiento por desgrasado que mostró el valor más bajo de AALT (0.08 ± 0.01 µg mL-1) (Tabla 5), en donde la caseína presentó valores de 0.53 ± 0.03 µg mL-1.
Tabla 5 Valores finales de la liberación de aminoácidos totales (AALT) fase alcalina de los ingredientes proteínicos de harinas de Cannavalia ensiformis,L. DC. e ingrediente de referencia (caseína).
| Ingrediente | AALT (µg ml-1) | AALT (%) |
|---|---|---|
| Caseína | 0.53 ± 0.03 | 100.00 |
| Harina Desgrasado | 0.08 ± 0.01 | 15.45 |
| Harina E. ácido | 0.17 ± 0.01 | 32.98 |
| Harina Autoclavado | 0.25 ± 0.01 | 47.48 |
| Harina Cocción | 0.40 ± 0.02 | 75.85 |
| Harina Decorticado | 0.19 ± 0.02 | 35.94 |
| Harina Hidratación | 0.15 ± 0.01 | 27.68 |
| Harina Germinado | 0.38 ± 0.04 | 72.57 |
| Harina sin Tratamiento | 0.23 ± 0.01 | 42.56 |
Se incluye el % y la desviación estándar.
DISCUSIÓN
En este estudio se aplicaron de forma independiente 7 diferentes procesos para la eliminación de FAN en semillas de C. ensiformis. A cada una de las harinas obtenidas de estos procesos se les evaluó el GH y los AALT. Los análisis proximales muestran que la harina cocida presenta un contenido de proteínas y grasas similares a la harina sin tratamiento. Según Okomoda et al. (2016), el tratamiento térmico de hasta 40 min no afecta significativamente el contenido de proteína y grasa de C. ensiformis, pero a partir de 30 min disminuyen los contenidos de lectinas, saponinas e inhibidores de tripsina, no así la canavalina, similar a lo reportado por Tiamiyu et al. (2016), mediante el proceso de tostado de semillas de esta especie. Sin embargo, Ndidi et al. (2014) reportaron pérdidas de proteína cruda y grasa en hervidos y asados de semillas Sphenosty stenocarpa, Hochst. ex A. Rich. Harms; mientras Audu & Aremu (2011), encontraron perdidas de grasas por tratamiento térmico, pero no significativamente en proteínas de haba procesada (Phaseolus vulgaris L.), lo que indica que el efecto térmico depende de la composición bioquímica de las semillas y la especie a tratar, afectando no solo a los FAN sino también a los nutrientes, aunque en C. ensiformis solo afectó a los FAN.
Todas las harinas analizadas presentaron valores menores al 100% de digestibilidad en la fase ácida y alcalina con respecto al control. La harina cocida mostró el valor más alto (58.73 %) de digestibilidad en relación al resto de los tratamientos, datos similares son reportados por Concha-Frías (2008), para pasta de soya y gluten de trigo en C. undecimalis. Asimismo, se ha observado que C. ensiformis presenta GH menores a otras harinas vegetales (Cuenca et al. 2013), esto puede deberse a que esta especie contenga mayor cantidad de FAN que las especies analizadas por este autor, los cuales inhiben el crecimiento de los peces (Moyano et al. 1998; Alarcón et al. 2001; Francis et al. 2001; Alarcón et al. 2002; Chong et al. 2002; Pérez et al. 2003; Oña et al. 2005), al disminuir la biodisponibilidad de los nutrientes mediante la inhibición de la actividad enzimática. De Oña et al. (2003), mencionan que las diferencias en los valores de hidrólisis entre las distintas proteínas, podrían estar relacionadas a sus perfiles aminoacídicos y a las características de sus estructuras terciarias.
En el análisis de AALT, en la fase ácida, los mejores valores se obtuvieron en los tratamientos de germinado y decorticado, mientras que en la fase alcalina fue el tratamiento por cocción, seguido del germinado con respecto a los demás tratamientos. En este sentido, se considera que las enzimas intestinales tienen una mayor actividad proteolítica que las enzimas gástricas para O. niloticus, lo cual es normal si consideramos que la tilapia no posee un estómago bien desarrollado (Pérez-Muñoz & Sáenz-Ramos, 2015), datos similares reportaron Chong et al. (2002) en el cíclido azul (Symphysodon aequifasciata, Pellegrin, 1904), lo anterior se vio reflejado en el proceso de hidrólisis de los diferentes tratamientos de C. ensiformis, debido a que la fase alcalina mostró valores mayores de hidrólisis que los presentados por la fase ácida del estómago, indicando que en el estómago de O. niloticus se lleva a cabo la iniciación de la hidrólisis proteica pero que es en el intestino donde ocurre la mayor parte de la degradación y por ende una mayor cantidad de aminoácidos libres que son absorbidos al torrente sanguíneo por los enterocitos de las paredes intestinales (Moyano et al. 1998; Concha-Frías, 2008).
La harina con mayor digestibilidad in vitro y valores de AALT en fase alcalina fue la harina cocida de C. ensiformis con respecto al resto de harinas. En este aspecto, los estudios realizados indican que las proteasas alcalinas durante el proceso de hidrólisis proteínica en O. niloticus son las que llevan a cabo la mayor cantidad de hidrólisis y apoya que el intestino es el órgano donde se absorbe la mayor cantidad de aminoácidos liberados en el proceso. Por su parte, los valores GH y AALT para la harina de cocido, nos indican que es posible realizar una sustitución parcial de pasta de soya por C. ensiformis en dietas para O. niloticus.











 nueva página del texto (beta)
nueva página del texto (beta)


