Services on Demand
Journal
Article
Indicators
Related links
Share
Hidrobiológica
Print version ISSN 0188-8897
Hidrobiológica vol.24 n.2 Ciudad de México May./Aug. 2014
Artículos
Parámetros reproductivos de las hembras de la raya mariposa Gymnura micrura (Elasmobranchii) en el sur del Golfo de México
Reproductive parameters of females of butterfly ray Gymnura micrura (Elasmobranchii) in the southern Gulf of Mexico
Nicte-Ha Cu-Salazar1, Juan Carlos Pérez-Jiménez1, Iván Méndez-Loeza1 y Manuel Mendoza-Carranza2
1 Laboratorio de Pesquerías, El Colegio de la Frontera Sur (ECOSUR). Libramiento Carretero Campeche km 1.5; Av. Rancho, Polígono 2-A; Ciudad Industrial, Lerma, Campeche, 24500. México
2 Laboratorio de Pesquerías, El Colegio de la Frontera Sur (ECOSUR). Carretera Villahermosa-Reforma km 15.5, Ranchería Guineo, sección II, Villahermosa, 86280. México. e-mail: jcperez@ecosur.mx
Recibido: 12 de julio de 2012.
Aceptado: 18 de agosto de 2013.
RESUMEN
La raya mariposa Gymnura micrura es relativamente abundante en el sur del Golfo de México, en donde es capturada incidentalmente y comercializada para consumo humano. En esta región, a la fecha no existen estimaciones de los parámetros reproductivos necesarios para conocer su dinámica poblacional y evaluar su vulnerabilidad a la presión de pesca por medio de evaluaciones de riesgo ecológico. Del análisis de 142 hembras con un intervalo de ancho de disco (AD) de 23-87 cm, se estimó una longitud de madurez (AD50%) de 56.8 cm. El ciclo reproductivo de las hembras es anual; la ovulación y el alumbramiento ocurren entre febrero y julio. La gestación tiene una duración de 10-11 meses y es concurrente con la vitelogénesis. La fecundidad fue de 1-11 embriones (promedio = 4.3) y es directamente proporcional al AD de las hembras. La proporción de sexos de los embriones fue de 1.2 hembras por cada macho, pero el número promedio de hembras y machos no fue estadísticamente diferente. El AD de madurez de las hembras y el ciclo reproductivo de G. micrura es aparentemente diferente entre la población del sur del Golfo de México y la de la costa de Brasil.
Palabras clave: Ciclo reproductivo, fecundidad, Gymnura micrura, longitud de madurez.
ABSTRACT
The butterfly ray Gymnura micrura is a relatively abundant batoid species in southern Gulf of Mexico, where is incidentally caught and commercialized for human consumption. In this region, however, there are no estimations of reproductive parameters needed to assess population dynamics and vulnerability to fishing pressure by means of ecological risk assessments. From the analysis of 142 females with a disc width (DW) range of 23-87 cm, it was estimated a DW at maturity (DW50%) of 56.8 cm. The female reproductive cycle is annual, and the ovulation and parturition occur from February to July. Gestation last 10-11 months, and is concurrent with the vitellogenesis. Fecundity resulted of 1-11 embryos (average = 4.3), and is directly proportional to maternal DW. The sex ratio of embryos was female biased (1.2 females per each male), however, the mean number of females and males were not statistically different. There are apparent differences in the DW at maturity and the reproductive cycle of females between the southern Gulf of Mexico and the coast of Brazil populations.
Key words: Fecundity, G. micrura, length at maturity, reproductive cycle.
INTRODUCCIÓN
Las rayas del género Gymnura son cosmopolitas de aguas tropicales cálido-templadas. Habitan en fondos arenosos y fangosos de aguas costeras, en donde son frecuentemente capturadas con redes de fondo (McEachran & de Carvalho, 2002). La raya mariposa Gymnura micrura (Bloch & Schneider, 1801) alcanza un ancho de disco (AD) máximo de 120 cm y se distribuye desde la Bahía de Chesapeake, en el Atlántico noroeste, hasta Brasil, incluyendo el Golfo de México. Esta especie es béntica y se alimenta de moluscos, crustáceos y peces (Bigelow & Schroeder, 1953; McEachran & de Carvalho, 2002).
La información sobre la historia de vida de G. micrura junto con otras cuatro especies del género Gymnura es escasa y de acuerdo con la Unión Internacional para la Conservación de la Naturaleza (UICN), no existe información suficiente para determinar su estado de conservación. De acuerdo con la lista roja de la UICN, Gymnura poecilura (Shaw, 1804) está casi amenazada, y G. altavela (Linnaeus, 1758) y G. zonura (Bleeker, 1852) son vulnerables. De las nueve especies del género, solo Gymnura australis (Ramsay & Ogilby, 1885) no representa preocupación de disminución poblacional. Se infiere por lo anterior, que las especies de Gymnura son potencialmente vulnerables a la presión de pesca como la mayoría de los elasmobranquios, y que, en ausencia de datos de captura y esfuerzo por especie en las estadísticas pesqueras oficiales de México, el conocimiento de sus historias de vida, es fundamental para evaluar la susceptibilidad a la presión de pesca por medio de evaluaciones de riesgo ecológico (Braccini et al., 2006; Cortés et al., 2010).
Varios autores han realizado estimaciones de algunos parámetros reproductivos de G. micrura, como la longitud de madurez, fecundidad, longitud de nacimiento y ciclo reproductivo (Bigelow & Schroeder, 1953; Daiber & Booth, 1960; McEachran & Fechhelm, 1998; McEachran & de Carvalho, 2002; Yokota & Lessa, 2006; 2007; Yokota, 2010).
Las estimaciones de longitud de madurez de G. micrura difieren entre los distintos estudios. Para las hembras, Bigelow & Schroeder (1953) la estimaron de 62.5 cm AD o menor, McEachran & Fechhelm (1998) de 26-27 cm AD, McEachran & de Carvalho (2002) de 50 cm AD y Yokota & Lessa (2007) de 34-36 cm AD. Para los machos, McEachran & Fechhelm (1998) y McEachran & de Carvalho (2002) la estimaron de 42 cm AD y Yokota & Lessa (2007) de 27-30 cm AD. El estudio de Yokota & Lessa (2006) fue realizado en Brasil, y el resto de los estudios son catálogos que presentan estimaciones con especímenes de diferentes regiones, sugiriendo que existen diferencias en los parámetros reproductivos entre distintas poblaciones a lo largo de la distribución de esta especie.
La longitud de nacimiento también difiere entre estudios, siendo de 13.5-17.5 cm AD en Brasil (Yokota, 2010) y de 15-22.5 cm AD en diversas regiones (Bigelow & Schroeder, 1953; McEachran & Fechhelm, 1998; McEachran & de Carvalho, 2002). La fecundidad es de cinco crías en la costa del Atlántico noroeste (Daiber & Booth, 1960; Hoese, 1962) y de 1-6 en la costa de Brasil (Yokota & Lessa, 2006; Yokota, 2010). Yokota & Lessa (2006) estimaron una gestación aproximada de 5 meses y Yokota (2010) de 2 a 6 meses. Yokota (2010) determinó que la gestación y el ciclo ovárico son concurrentes, por lo que sugiere que G. micrura se reproduce dos veces por año (ciclo bianual).
En el litoral mexicano del Golfo de México, los estados de Campeche y Tabasco son los principales productores de rayas en el periodo 1999-2008, con un 44.7% y 28.5 % de la producción total, respectivamente (Poder Ejecutivo Federal, 2012; Anuarios Estadísticos de Acuacultura y Pesca, 1999-2008). Con datos de los últimos tres años de registros disponibles (2009-2011), el estado de Tabasco representa el 41% de la producción, con un promedio de 1,120 toneladas y el estado de Campeche el 36% de la producción, con un promedio de 977 toneladas (Anuarios Estadísticos de Acuacultura y Pesca, 2009-2011). Las principales especies que sustentan esta pesquería son la raya látigo Dasyatis americana (Hildebrand & Schroeder, 1928), la raya pinta Aetobatus narinari (Euphrasen, 1790), la chucha Rhinoptera bosasus (Mitchill, 1815) y G. micrura. En el Golfo de México se desconocen los parámetros de historia de vida de G. micrura, por ello, el principal objetivo de este estudio fue determinar los parámetros reproductivos de las hembras, necesarios para evaluar la vulnerabilidad de la especie a la presión de pesca.
MATERIALES Y MÉTODOS
Los especímenes analizados se obtuvieron en el periodo de agosto de 2007-octubre de 2011. Un total de 138 especímenes capturados con palangre de fondo (anzuelo circular de 60 mm de longitud 11/0) por embarcaciones menores de la localidad de San Pedro, Tabasco, y 12 especímenes capturados con redes camaroneras (con luz de malla de 1.5 pulgadas) por embarcaciones menores en las localidades de Emiliano Zapata y Ciudad del Carmen, Campeche (Figura 1).
De cada espécimen se midió el ancho de disco (AD) al centímetro más cercano y se determinó el sexo por la presencia o ausencia de gonopterigios. Todas las rayas fueron medidas y examinadas para estimar los parámetros reproductivos.
Madurez sexual y longitud de madurez. Aunque el número de machos registrados fue bajo (N = 8), fueron analizados para presentar una estimación preliminar de intervalo de longitud de madurez. En los machos se midió la longitud de los gonopterigios desde el punto de inserción en la cloaca hasta la punta del gonopterigio y se registró su grado de calcificación. Los especímenes fueron considerados inmaduros cuando tenían gonopterigios relativamente cortos y flexibles, y maduros cuando los gonopterigios estaban calcificados y pudieron rotar hacia la parte anterior sin doblarse (Clark & von Schmidt, 1965).
El criterio para determinar la madurez en hembras fue la primera ovulación (Walker, 2005). En las hembras se midieron los ovocitos del ovario y el ancho de los úteros, y se registró la presencia de embriones o huevos uterinos. Se determinó el sexo de los embriones y se midió su AD. Cada hembra fue clasificada como inmadura o madura no grávida o grávida. Tomando en cuenta el criterio de la primera ovulación, se consideraron como maduras no grávidas a las hembras que cumplieron dos condiciones: contenían ovocitos vitelogénicos (próximos a ser ovulados) y sus úteros estaban ensanchados, sugiriendo alumbramiento reciente. Las hembras que solo cumplieron la primer condición fueron consideradas inmaduras y próximas a su primera ovulación.
La longitud a la cual el 50% de los organismos están maduros (AD50%) fue estimada de acuerdo con Mollet et al. (2000) por medio del ajuste del modelo logístico Y = [1+e-(a+bX)]-1 a los datos binarios de madurez (inmaduras = 0, maduras = 1) mediante el cálculo de la mediana (MAD = -a/b). En el modelo logístico, a y b son coeficientes estimados en el ajuste, mientras que Y es la proporción de especímenes maduros a un ancho de disco (X) determinado. La estimación de los parámetros, incluyendo los intervalos de confianza, se realizó con una regresión logística binaria con el software Minitab 16.0.
Ciclo reproductivo de las hembras. El ciclo ovárico se estimó mediante el análisis de la variación temporal del diámetro promedio de ovocitos de hembras maduras y el período de gestación se determinó con el incremento temporal de la longitud de los embriones y el registro de hembras con huevos uterinos. Se realizó un análisis de correlación entre el promedio de AD de los embriones y el diámetro promedio de los ovocitos de cada hembra grávida con el fin de determinar sí el ciclo ovárico y el periodo de gestación eran concurrentes o consecutivos. Con esta información fue estimado el ciclo reproductivo.
Fecundidad y longitud de nacimiento. La fecundidad se estimó como el número de huevos uterinos y/o embriones por hembra. Se exploró la relación lineal entre la longitud materna (AD) y la fecundidad con un análisis de regresión. La proporción sexual embrionaria se examinó con una prueba t para muestras en pares (Walker, 2005), previa transformación de los datos con raíz cuadrada (Zar, 1999). El intervalo de la longitud de nacimiento se determinó con el registro de los embriones de mayor AD y los neonatos de menor AD.
RESULTADOS
Fueron examinadas un total de 142 hembras con un intervalo de 23-87 cm AD y un promedio de 62.5 cm AD (d.s. = 12.3), y un total de ocho machos con un intervalo de 20-45.5 cm AD y un promedio de 29 cm AD (d.s. = 9.9) (Fig. 2). Todos los especímenes menores de 40 cm AD fueron capturados con redes camaroneras frente a las localidades de Emiliano Zapata y Ciudad del Carmen, y los especímenes mayores a 40 cm AD con palangre frente a la localidad de San Pedro, Tabasco.
Madurez sexual y longitud de madurez. De los ocho machos analizados, solo cuatro fueron maduros. El inmaduro más grande midió 24 cm AD y sus gonopterigios de 2 cm no estaban calcificados. El maduro de menor AD midió 29 cm y tenía gonopterigios calcificados de 4.2 cm. El intervalo de madurez preliminar para los machos resultó de 24-29 cm AD.
La longitud de madurez (AD50%) para las hembras fue de 56.8 cm y una pendiente para el modelo logístico de 0.33. El intervalo de confianza de 95% fue de 54.1-58.7 cm para AD50% y de 0.17-0.48 para la pendiente (Fig. 3). El ajuste del modelo logístico fue significativo (G = 30.8, p < 0.0001). Fueron analizadas 37 hembras inmaduras, 24 hembras maduras no grávidas y 81 hembras grávidas. La hembra inmadura más grande midió 63 cm AD, con ovocitos de 13 mm y úteros de 24 mm. La hembra madura más pequeña estaba grávida y midió 51 cm AD, con ovocitos de 3 mm, úteros de 32 mm y con un embrión de 75 mm AD. Fueron examinadas 20 hembras inmaduras con AD ≥ 51 cm. En esas hembras los ovocitos midieron entre 0.5-15.2 mm y los úteros entre 8-30 mm.
El diámetro de los ovocitos de especímenes menores a 50 cm AD no excedió los 7 mm y en ocho hembras el ovario aún no estaba diferenciado. En hembras mayores de 51 cm AD, el diámetro de los ovocitos fue variable, dependiendo del estadio de madurez (Fig. 4a). Fueron registradas hembras inmaduras con ovocitos pequeños (< 8 mm) y algunas con ovocitos vitelogénicos mayores de 12 mm y cercanos a la ovulación. Entre las hembras grávidas se distinguieron las que recientemente habían ovulado y contenían ovocitos pequeños (< 8 mm), y aquellas que estaban en fase avanzada de gestación, con ovocitos vitelogénicos mayores de 10 mm. Las hembras maduras no grávidas contenían ovocitos vitelogénicos grandes (>12 mm). El intervalo de diámetro de ovocitos en hembras inmaduras fue de 0.5-15.2 (promedio = 5.3 mm, d.s. = 4.9), en maduras no grávidas de 12.8-16.2 (promedio = 14.7 mm, d.s. = 1.3), y en grávidas de 2-17.2 (promedio = 6.6 mm, s.d. = 3.7).
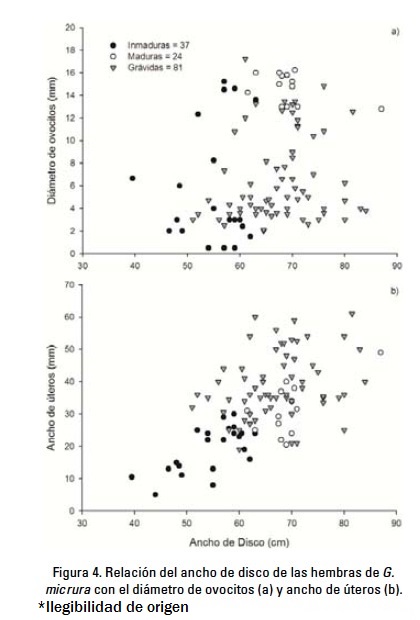
Se observó un incremento gradual del ancho de los úteros en los diferentes grupos de hembras; la anchura máxima en inmaduras, maduras no grávidas y grávidas fue de 30 mm, 49 mm y 61 mm, respectivamente (Fig. 4b). El intervalo del ancho de los úteros en inmaduras fue de 5-30 (promedio = 18.1 mm, d.s. = 8.0), en maduras no grávidas de 20-49 (promedio = 31.4, d.s. = 8.1) y en grávidas de 19-61 (promedio = 39.3 mm, d.s. = 10.0).
Ciclo reproductivo. Los datos sugieren que el ciclo ovárico y el periodo de gestación duran alrededor de 10-11 meses y que son concurrentes (Fig. 5a y b). A mediados del mes de abril fue registrada una hembra grávida que contenía huevos uterinos, indicando su reciente ovulación. Después, en los meses de junio y julio fueron registradas hembras grávidas con huevos uterinos, y a partir del mes de agosto se observó un crecimiento gradual de los embriones hasta finales de enero (Fig. 5b).
En el mes de enero fueron registrados los embriones más grandes, y a finales de ese mes y principios de febrero fueron registradas algunas hembras con huevos uterinos, indicando su ovulación reciente. Lo anterior indica que alrededor de estos meses ocurre el final de un ciclo y el comienzo del otro. Sin embargo, el ancho de disco de los embriones fue muy variable entre agosto y enero, y aunado a que fueron registradas hembras con huevos uterinos desde finales de enero y hasta finales de agosto, sugiere que los periodos de ovulación y alumbramiento son extensos, probablemente entre tres y seis meses a partir del mes de febrero (Fig. 5a y b). Lo anterior se corrobora con los registros de neonatos ≤ 23 cm AD, a mediados de febrero (n = 2) y a principios de julio (n = 2).
La información indica que las hembras de G. micrura se reproducen una vez por año (ciclo anual). Se determinó que existe una correlación positiva y significativa entre el AD promedio de los embriones y el diámetro de los ovocitos (r = 0.82, p < 0.0001), con lo que se concluye que el ciclo ovárico y la gestación son concurrentes. Por ejemplo, las hembras que contenían embriones cercanos al nacimiento, tenían ovocitos vitelogénicos, por lo que ovularían poco después del alumbramiento.
Fecundidad y longitud de nacimiento. Se determinó que la fecundidad de G. micrura es de 1-11 (promedio = 4.3, d.s. = 2.1). Además, se encontró que existe una relación significativa entre el AD de las hembras y el número de embriones; a mayor AD mayor es la fecundidad (Fig. 6). Fueron registrados 99 huevos uterinos y 195 embriones, de los que fue posible determinar el sexo de 177, siendo 97 hembras y 80 machos. El número de hembras (promedio = 1.9, d.s. = 1.1) no fue diferente del número de machos (promedio = 1.6, d.s. = 1.3) (t = -1.4, gl = 49, P = 0.16). El intervalo de longitud de nacimiento resultó de 20-21 cm AD.
DISCUSIÓN
Las estimaciones de los parámetros reproductivos de especies del género Gymnura son escasas, siendo la fecundidad el principal parámetro estimado basado en el análisis de un número reducido de hembras grávidas (Daiber & Booth, 1960; Hoese, 1962; James, 1966; Jacobsen et al., 2009; White & Dharmadi, 2007). Previo a este estudio solo se habían estimado los parámetros reproductivos de G. micrura en la costa de Brasil (Yokota & Lessa, 2006, 2007; Yokota, 2010) y G. altavela en la costa de Túnez (Capapé et al., 1992). En este estudio se presentan los parámetros reproductivos necesarios para la evaluación de la vulnerabilidad de G. micrura a la presión de pesca en el sur del Golfo de México.
El número reducido de machos registrados en este estudio se debió posiblemente a la selectividad de los equipos de pesca y a la profundidad a la que operaron las flotas pesqueras analizadas. En el palangre que opera en profundidades de 10-60 m, fueron comunes los especímenes más grandes, principalmente hembras adultas, y los especímenes más pequeños de ambos sexos (<30 cm AD) fueron capturados con redes camaroneras en zonas muy cercanas a la costa (<10 m de profundidad). Los machos fueron raros tanto en el palangre como en las redes por la profundidad de operación y por la selectividad de los equipos (los especímenes midieron menos de 50 cm AD).
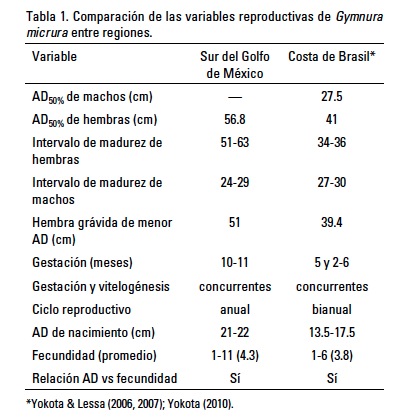
Existen diferencias entre el ancho de disco de madurez de las hembras del sur del Golfo de México y la costa de Brasil (Tabla 1). Es evidente que las hembras del sur del Golfo de México maduran a un AD mayor, en comparación con las hembras de la costa de Brasil. El intervalo de AD de madurez de las hembras del Golfo de México no se traslapa con el intervalo de AD de madurez de las hembras de la costa de Brasil. De cualquier manera, las diferencias observadas pueden deberse tanto al uso de diferentes criterios para determinar la madurez como a las diferencias en las condiciones oceanográficas prevalecientes.
Los estudios de Yokota & Lessa (2007) y Yokota (2010) utilizaron como criterio para determinar la madurez la vitelogénesis, la presencia de huevos uterinos o embriones, y la morfología de la glándula oviducal y la de los úteros. En el presente estudio el criterio fue la primera ovulación, de tal manera que solo fueron consideradas maduras aquellas hembras que habían ovulado al menos una vez, ya sea conteniendo huevos uterinos o embriones, o habiendo alumbrado recientemente, con úteros ensanchados y ovocitos vitelogénicos próximos a ser ovulados. Este criterio evita la subjetividad de valorar macroscópicamente el inicio de la vitelogénesis y las características morfológicas de los úteros (Walker, 2005).
El AD de madurez para las hembras del sur del Golfo de México es similar al AD reportado por Bigelow & Schroeder (1953) de 62.5 cm AD y al reportado por McEachran & de Carvalho (2002) de 50 cm AD; sin embargo difiere del reportado por McEachran & Fechhelm (1998) de 26-27 cm AD. Esas estimaciones fueron realizadas con especímenes a lo largo de toda la distribución de la especie en el Atlántico oeste, por lo que es difícil determinar si existen diferencias entre regiones debido a condiciones oceanográficas, o se deben a los diferentes criterios usados para determinar la madurez.
También existen diferencias en la duración del ciclo reproductivo entre el sur del Golfo de México (anual) y la costa de Brasil (bianual), si la hipótesis de Yokota & Lessa (2006) y Yokota (2010) es verdadera. Yokota & Lessa (2006) estimaron una gestación de 5 meses y Yokota (2010) de 2-6 meses. El principal problema que tuvieron los autores para realizar una estimación precisa fue que las hembras son asincrónicas, es decir, no existe un periodo definido de alumbramiento, por lo que a lo largo de todo el año registraron embriones de todos los tamaños y neonatos. De cualquier manera, los autores determinaron que el ciclo reproductivo es bianual porque sus registros de embriones a lo largo de los meses sugieren un periodo de gestación corto, y el ciclo ovárico y la gestación son concurrentes, por lo que las hembras ovulan justo después del alumbramiento, permitiendo la ocurrencia de dos ciclos por año.
En el presente estudio se determinó que la gestación dura alrededor de 10-11 meses, y dado que el ciclo ovárico y la gestación son concurrentes, se determinó que el ciclo reproductivo es anual. En el sur del Golfo de México existe gran variabilidad en la longitud de los embriones entre los meses de agosto y enero, y aunado a que fueron registradas hembras con huevos uterinos en un lapso de tiempo prolongado, también se determinó que el ciclo reproductivo es relativamente asincrónico, aunque eso no impidió observar un patrón de crecimiento gradual de los embriones a lo largo del año.
Capapé et al. (1992) estimaron que el ciclo reproductivo es anual para G. altavela, con una gestación de 4-9 meses, y que el ciclo ovárico y la gestación son concurrentes. No existe estimación del ciclo reproductivo para las otras siete especies del género Gymnura. Devadoss (1998) solo determinó que el ciclo ovárico y la gestación son concurrentes para G. poecilura, por lo que el desarrollo simultáneo de ovocitos y embriones podría ser común en las especies de este género.
La fecundidad y AD de nacimiento estimadas en el sur del Golfo de México para G. micrura son relativamente mayores a las estimadas en Brasil (Tabla 1). Lo anterior corrobora que los especímenes del sur del Golfo de México son mayores que los de la costa de Brasil. Adicionalmente, la máxima longitud reportada en el Golfo de México fue de 87 cm AD y en la costa de Brasil de 66 cm AD (Yokota & Lessa, 2007). Al igual que en el presente estudio, Yokota (2010) determinó que la fecundidad es directamente proporcional al ancho de disco de las hembras.
La fecundidad máxima reportada en especies de Gymnura es de siete, así que la fecundidad máxima de G. micrura (n = 11) en el sur del Golfo de México es la mayor entre las especies del género. Para G. altavela, Capapé et al. (1992) estimó una fecundidad de 2-6 (promedio = 3.8) y Daiber & Booth (1960) de 4-7 (promedio = 5.7), siendo este último el promedio de fecundidad más alto entre las especies del género. Jacobsen et al. (2009) estimó una fecundidad de 1-5 (promedio = 1.9) para G. australis, James (1966) de 1-7 (promedio = 2.9) para G. poecilura, y White & Dharmadi (2007) de 2-4 para G. zonura y de tres para Gymnura japonica (Temminck & Schlegal, 1850). Capapé et al. (1992) y James (1966) determinaron que para G. altavela y G. poecilura respectivamente, no existe una relación entre el AD de las hembras y la fecundidad; por lo que a la fecha, entre las especies del género Gymnura, la relación proporcional solo se ha estimado en G. micrura.
Considerando que tres especies del género Gymnura (G. poecilura, G. altavela y G. zonura) han sido clasificadas como vulnerables o amenazadas por la presión de pesca en la lista roja de la Unión Internacional para la Conservación de la Naturaleza, se infiere que las poblaciones de las demás especies del género son potencialmente susceptibles a la extracción pesquera. Probablemente la raya mariposa G. micrura no es la excepción, con una fecundidad promedio baja, de 4.3 embriones por año. Aunque su captura es relativamente baja en la flota palangrera de pequeña escala de San Pedro, Tabasco (< 0.1 raya por viaje de pesca), la incidencia de hembras grávidas es alta (54% de los especímenes). Por otro lado, la ocurrencia de neonatos y juveniles en las operaciones de la flota camaronera de pequeña escala es común, y esta especie también es un componente de la fauna de acompañamiento en operaciones de la flota industrial camaronera (Oviedo-Pérez et al., 2006). Estimaciones futuras de las tasas de crecimiento y de las fuentes de mortalidad por pesca son necesarias para evaluar su vulnerabilidad a la presión de pesca.
AGRADECIMIENTOS
Espacial agradecimiento para los pescadores de San Pedro, Emiliano Zapata y Ciudad de Carmen, por permitirnos analizar sus capturas y colectar material biológico. E. Cuevas-Zimbrón y C.C. Hernández-Lazo participaron en el registro de datos y colecta de material en campo.
REFERENCIAS
Anuarios Estadísticos de Acuacultura y Pesca (1999-2011). Comisión Nacional de Acuacultura y Pesca. Secretaria de Agricultura, Ganadería, Desarrollo Rural, Pesca y Alimentación. Mazatlán, Sinaloa, México. [ Links ]
Bigelow, H. B. & W. C. Schroeder. 1953 Sawfishes, guitarfishes, skates and rays. Memories Sears Foundation Marine Research 1 (2): 1-514. [ Links ]
Braccini, J.M., B.M. Gillanders & T.l. Walker. 2006. Hierarchical approach to the assessment of fishing effects on nontarget Chondrichthyans; case study of Squalus megalops in southeastern Australia. Canadian Journal of Fisheries and Aquatic Sciences 63: 2456-2466. [ Links ]
Capapé, C., J. Zaouali, J.A. Tomasini & J.L. Bouchereau. 1992. Reproductive biology of the spiny butterfly ray, Gymnura altavela (Linnaeus, 1758) (Pisces: Gymnuridae) from off the Tunisian coast. Scientia Marina 56: 347-355. [ Links ]
Clark, E. & K. von Schmidt. 1965. Sharks of the central gulf coast of Florida. Bulletin of Marine Science 15: 13-83. [ Links ]
Cortés, E., F. Arocha, L. Beerkircher, F. Carvalho, A. Domingo, M. Heupel, H. Holtzhausen, M. N. Santos, M. Ribera & C. Simpfendorfer. 2010. Ecological risk assessment of pelagic sharks caught in Atlantic pelagic longline fisheries. Aquatic Living Resources 23:25-34. [ Links ]
Daiber, F.C. & R.A. Booth. 1960. Notes on the biology of the butterfly rays, Gymnura altavela and Gymnura micrura. Copeia 1960: 137-139. [ Links ]
Devadoss, P. 1998. Observations on the breeding and development in some batoid fishes. Indian Journal of Fisheries 45: 271-283. [ Links ]
Hoese, H.D. 1962. Sharks and rays of Virginia's Seaside Bays. Chesapeake Science 3: 166-172. [ Links ]
Jacobsen, I.P., J.W. Johnson & M.B. Bennett. 2009. Diet and reproduction in the Australian butterfly ray Gymnura australis from northern and north-eastern Australia. Journal of Fish Biology 75: 2475-2489. [ Links ]
James, P.S.B.R. 1966. Notes on the biology and fishery of the butterfly ray, Gymnura poecilura (Shaw) from the Palk Bay and Gulf of Mannar. Indian Journal of Fisheries 13: 150-157. [ Links ]
McEachran, J.D. & M.R. Carvalho. 2002. Batoid Fishes. In: Carpenter, K.E. (Ed.) The living marine resources of the Western Central Atlantic. Vol. 1. Introduction, molluscs, crustaceans, hagfishes, sharks, batoid fishes and chimaeras. FAO Species Identification Guide for Fishery Purposes and American Society of Ichthyologists and Herpetologists Special Publication No. 5. pp. 507-589. [ Links ]
McEachran, J.D. & J.D. Fechhelm. 1998. Fishes of the Gulf of Mexico. 1. Myxiniformes to Gasterosteiformes. Austin, University of Texas Press, 1112 p. [ Links ]
Mollet, H.F., G. Cliff, H.L. Pratt Jr. & J.D. Stevens. 2000. Reproductive biology of the female shortfin mako, Isurus oxyrinchus Rafinesque, 1810, with comments on the embryonic development of lamnoids. Fishery Bulletin 98: 299-318. [ Links ]
Oviedo-Pérez, J.L., L. González-Ocaranza & L.E. Martínez-Cruz. 2006. Presencia de Elasmobranquios en las operaciones de Pesca de Arrastre de Camarón en el Litoral Veracruzano durante la Veda 2006. II Simposium Nacional de Tiburones y Rayas, del 21 al 25 de Agosto de 2006, Facultad de Ciencias de la UNAM. [ Links ]
Poder Ejecutivo Federal. 2010. Carta Nacional Pesquera. Publicada en el Diario Oficial de la Federación el 02 de Diciembre de 2010, Tercera Sección. Ciudad de México. [ Links ]
Walker, T.l. 2005. Reproduction in fisheries science. En: W.C. Hamlett (ed.). Reproductive Biology and Phylogeny of Chondrichthyes Sharks, Batoids and Chimaeras. Volume 3 of Series: Reproductive Biology and Phylogeny. Enfield: Science Publishers, Inc., pp. 81-127. [ Links ]
White, W.T. & Dharmadi. 2007. Species and size composition and reproductive biology of rays (Chondrichthyes, Batoidea) caught in target and non-target fisheries in eastern Indonesia. Journal of Fish Biology 70: 1809-1837. [ Links ]
Yokota, L. 2010. Taxonomía, biología reprodutiva e dieta da raia borboleta, Gymnura micrura (Myliobatiformes: Elasmobranchii). Tesis de Doctorado. Universidade Estadual Paulista. 126 p. [ Links ]
Yokota, L. & R.P. Lessa. 2006. A nursery area for sharks and rays in Northeastern Brazil. Environmental Biology of Fishes 75: 349-360. [ Links ]
Yokota, L. & Lessa, R.P. (2007). Reproductive biology of three ray species: Gymnura micrura (Bloch & Schneider, 1801), Dasyatis guttata (Bloch & Schneider, 1801) and Dasyatis marianae Gomes, Rosa & Gadig, 2000, caught by artisanal fisheries in Northeastern Brazil. Cahiers de Biologie Marine, 48:249-257. [ Links ]
Zar, J.H. 1999. Biostatistical Analysis. Prentice-Hall Inc. Upper Saddle River. 663 p. [ Links ]














