Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Hidrobiológica
versión impresa ISSN 0188-8897
Hidrobiológica vol.23 no.2 Ciudad de México may./ago. 2013
Variación temporal del ictioplancton colectado con trampas de luz en los puertos de Chuburná y Yucalpetén, Yucatán, México
Temporal variation of ichthyoplankton sampling with light traps in Chuburna and Yucalpeten, Yucatan, Mexico
Uriel Ordóñez-López,1 Roger Huchin-Sel,2 Jorge Peniche-Pérez,2 Sandra Gallegos-Fernández,2 Roger Sosa-Pinto2 y Lourdes Vásquez-Yeomans3
1 Instituto Politécnico Nacional, Centro de Investigación y de Estudios Avanzados Unidad Mérida. Km 6, antigua carretera a Progreso, A. P. 73 Cordemex, Mérida Yucatán, 97310. México.
2 Universidad Autónoma de Yucatán, Campus Ciencias Biológicas y Agropecuarias, Licenciatura en Biología Marina. A. P. 4-116 Col. Itzimná, Mérida, Yucatán, 97100. México.
3 El Colegio de la Frontera Sur, Av. Centenario Km 5.5, Apdo. Postal 424, Chetumal, Quintana Roo, 77014. México. e-mail: uriel@mda.cinvestav.mx.
Recibido: 13 de septiembre del 2012.
Aceptado: 18 de enero de 2013.
RESUMEN
Se comparan la abundancia de larvas de peces, colectadas con trampas de luz, colocadas en las bocas de los puertos de Chuburná y Yucalpetén, Yucatán durante un ciclo anual (2009). Se capturó un total de 193 organismos con una talla promedio de 1.5 ± 0.2 cm, correspondientes a 13 especies distribuidas en seis familias de peces. Eucinostomus argenteus (45.1%), Sardinella aurita (30.1%) y Harengula jaguana (7.3%), fueron las especies con mayor abundancia al constituir el 82.5% de la fauna capturadas, mientras que la familia Gerreidae fue la más diversa, al estar presente con tres especies. Eucinostomus argenteusfue la especie dominante en Chuburná, en tanto que Sardinella aurita y Harengula jaguana lo fueron en Yucalpetén. La mayor abundancia y diversidad larvaria fue registrada en Chuburná. Los organismos con mayor talla promedio se colectaron en Yucalpetén. La variación temporal de los componentes estructurales estuvo relacionada con el régimen hidrológico de cada localidad, asimismo, la abundancia del ictioplancton fue menor, pero semejante en composición, a la reportado para otros sistemas costeros de la península de Yucatán. Se concluye que, la utilización de trampas de luz, es un complemento a la red de plancton estándar y ayudaría a conocer mejor la comunidad de larvas de peces costeros.
Palabras clave: Laguna, larvas de peces, México, trampas de luz, Yucatán.
ABSTRACT
Fish larvae associated to the inlet of Yucatan, México ports of Chuburná and Yucalpeten were analyzed with light traps along an annual cycle (2009). A total of 193 fish larvae with average size of 1.5 ± 0.2 cm was captured; they represented 13 species distributed in six fish families. Eucinostomus argenteus (45.1%), Sardinella aurita (30.1%) and Harengula jaguana (7.3%) were most abundant species, together they constituted 82.5% of the captured larvae. The family Gerreidae was the most diverse, with three species. Eucinostomus argenteus was dominant in Chuburná whereas Sardinella aurita and Hrengula jaguana were so in Yucalpeten. The greatest larval abundance and diversity were recorded in Chuburna, but the greatest size average was recorded in Yucalpeten. The temporal variation of the structural components was related to the hydrologic regimen of each locality, also, fish larvae abundance was lower but similar to the reported of another coastal systems of the Yucatan Peninsula. Finally, the utilization of light traps is a complement to plankton net surveys and helps to understand the communities of coastal fish larvae.
Keywords: Fish Larvae, Lagoon, light traps, Mexico, Yucatan.
INTRODUCCIÓN
Los sistemas costeros se caracterizan por poseer una amplia variedad de hábitats (como praderas de pastos, pantanos, manglares, arrecifes, etc) y cuyos ambientes son utilizados como áreas de crianza, alimentación, reclutamiento, asentamiento y/o punto de dispersión de muchas especies de peces marinos (Beck et al., 2001). Las etapas tempranas de los peces costeros en las últimas décadas han recibido una importante atención, particularmente aquellos que evalúan los rasgos estructurales de la comunidad, asociados con la dinámica y diversidad de hábitats del medio costero. La heterogeneidad espacial de algunos ambientes costeros, plantea ciertos problemas en el muestreo con la red planctónica tradicional (Rooker et al., 1996; Anderson et al., 2002; Sponaugle et al., 2003). Para resolver esta problemática han sido desarrollados varios métodos alternativos, entre ellos las trampas de luz; éste método ha generado información complementaria que ha contribuido a incrementar la composición en las colecciones planctónicas locales (Doherty, 1987; Rooker et al., 1996). Asimismo, un incremento con este tipo de herramientas en ambientes costeros complejos, coadyuvará a comprender mejor la variación de la fauna meroplanctónica, por lo que el presente trabajo tuvo por objetivo conocer la composición de larvas de peces colectadas con trampas de luz en las bocas de los puertos de Chuburná y Yucalpetén, así como conocer las posibles relaciones de la abundancia de las especies con los principales parámetros hidrológicos del medio.
MATERIAL Y MÉTODOS
Los puertos de Chuburná y Yucalpetén se ubican en el litoral noroeste de la península de Yucatán y conforman la entrada a las lagunas del mismo nombre (Fig. 1). La región presenta un clima de tipo cálido semi-seco de marzo a junio, con intensas lluvias de julio a octubre, y fuertes vientos del norte y lluvias de menor intensidad el resto del año. Ambas lagunas son someras y en su comunicación con el mar, registran una profundidad media de 3.5 m y presentan características típicamente marinas con tendencia a la hipersalinidad durante la época de secas, se presenta un mayor aporte de agua dulce proveniente del manto freático (manantiales) durante las lluvias (Valdés & Real, 1998). Al interior de Yucalpetén se presenta una combinación de praderas de fanerógamas marinas en tanto que en Chuburná dominan los blanquizales de arena (Herrera-Silveira et al., 1999). Hasta el momento, en las lagunas costeras de la península se han registrado 117 especies de larvas de peces, de las cuales 39 están presentes en las localidades estudiadas y Menidia coleiHubbs, 1936, Funduluspolyommus Hubbs, 1936 y Eucinostomus argenteus Baird & Girard, 1855, son las especies dominantes (García-Hernández et al., 2009).
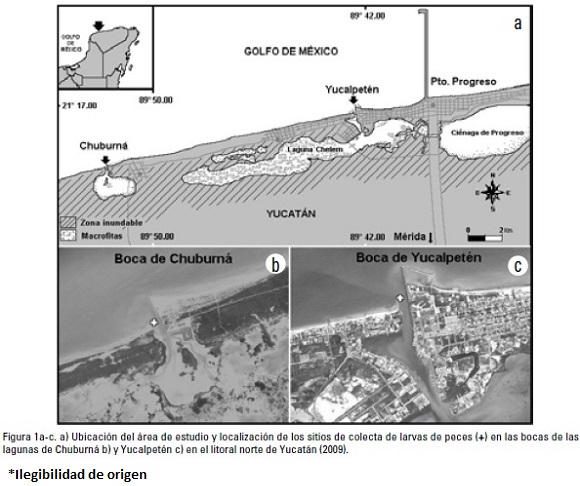
Las larvas de peces fueron capturadas colocando trampas de luz (Jones, 2006) a una profundidad de 1.5 m, durante las distintas épocas climáticas de 2009: secas (23-24 de abril), lluvias (19-20 de agosto) y nortes (15-16 de noviembre). Las trampas fueron instaladas en sitios de remanso (lejos de tráfico de embarcaciones), en cada una de las bocas de los puertos de Chuburná (21°14.661' N y 89°52.100' W) y Yucalpetén (21°16.748' N y 89°42.492' W) (Fig. 1). Los muestreos fueron realizados durante la marea viva y en momentos de luna nueva, con un tiempo de exposición de tres horas (23:00 a 02:00 h); tiempo en que se registra la mayor concentración del zooplancton en la superficie (Doherty, 1987). Las muestras obtenidas fueron fijadas en una solución de formalina en agua de mar al 4% y neutralizadas con borato de sodio a un pH = 7.5. Se registró la temperatura (°C), salinidad (ups) y el oxígeno saturado (%) por medio de un multisensor de campo YSI85/50FT y el pH con un potenciómetro de campo Corning. Posteriormente, las larvas de peces fueron separadas de la muestra total, cuantificadas y medidas en su longitud estándar (mm). La identificación de las especies se realizó con los trabajos de Richards (2006) y Fahay (2007). Los organismos no identificados a nivel de especie, fueron considerados como entidades morfológicas operacionales (sp.), para realizar los análisis estadístico-ecológicos a un mismo nivel jerárquico (McCune & Grace, 2002).
Para determinar las diferencias hidrológicas por sitio y época, se realizó un análisis de varianza ((ANDEVA) de dos vías (p < 0.05) (Zar, 1988) utilizando el paquete Statgraphisc Centurion (Sta-tPoint, 2007). Se utilizó el programa ANACOM (De la Cruz-Agüero, 1993) para estimar la dominancia, riqueza, diversidad y equidad.
La riqueza específica (S) se consideró como el número de especies identificadas presentes por localidad y época, en tanto que la importancia relativa de las especies por sitio, fue determinada a través del Índice de Valor de Importancia (IVI), considerándose a las especies dominantes aquellas mayores al 20%. La diversidad (H') se estimó a través del Índice de Shannon-Weaner, la equidad (J) mediante la siguiente ecuación J= H'/Hmáx (Harris et al., 2000) y la similitud entre sitios se evaluó a través del coeficiente de Jaccard (Krebs, 1999). Finalmente, para la evaluación cuantitativa de las asociaciones de las especies y los parámetros del medio registrados, se realizó un Análisis de Correspondencia Canónica (ACC). Este procedimiento permitió posicionar a las especies y los factores ambientales en un sistema de coordenadas sintéticas (componentes 1 y 2) y éstas a su vez se relacionaron con las variables ambientales (Ter Braak & Verdonschot, 1995); previo a los análisis los datos fueron transformados a logaritmo base diez (Log X+1) para cumplir con los supuestos de normalidad y homocedasticidad.
RESULTADOS
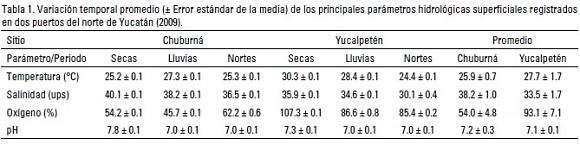
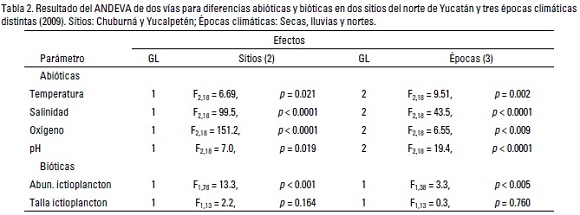
Características hidrológicas. Durante el año de 2009, todas las variables hidrológicas medidas variaron temporalmente con mayores valores reportados en la época de secas, y decreciendo hacia paulatinamente durante el periodo de vientos del norte en ambos sitios. No obstante, en Yucalpetén se registraron aguas más cálidas y oxigenadas, en tanto que la salinidad fue mayor en Chuburná y menor en Yucalpetén; cabe destacar la tendencia a la hipersalinidad de la laguna de Chuburná, alcanzando valores mayores de 40 ups durante las secas. Además, se denotaron valores de similares de pH entre ambos sitios (Tabla 1). Asimismo, la ANDEVA registró diferencias significativas p < 0.05 de la salinidad y el oxigeno entre sitios y épocas, y sólo la temperatura y pH registró diferencias entre épocas (Tabla 2).
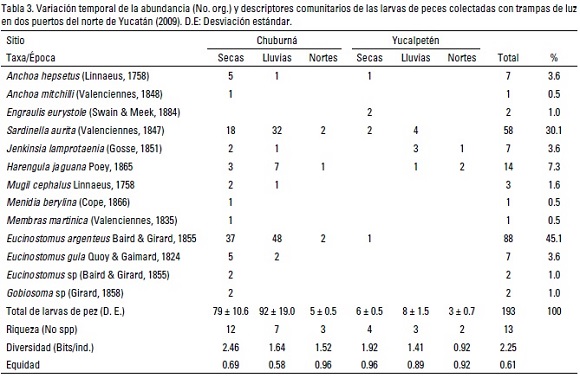
Comunidades. Un total de 193 larvas de peces fueron colectados en ambos sitios (Chuburná: 176 y Yucalpetén: 17), pertenecientes a seis familias, ocho géneros y 13 especies (12 especies en Chuburná y 5 en Yucalpetén). Las especies más abundantes fueron Eucinostomus argenteus (45.1%), Sardinella aurita (Valenciennes,1835) (30.1%) y Harengula jaguana Poey,1865 (7.3%), quienes representaron el 82.5% de la abundancia total (Tabla 3), cabe destacar que Jenkinsia lamprotaenia (Gosse, 1851), Engraulis eurystole (Swain & Meek, 1884), Harengula jaguana y Mugil cephalus Linnaeus, 1758 corresponden a nuevos registros para estas localidades del estado de Yucatán. En general la mayor abundancia de larvas se capturó en Chuburná durante la época de secas, mientras que en Yucalpetén fue durante las lluvias. La ANDEVA de una vía mostró diferencias entre localidades y entre periodos (Tabla 2).
Las larvas con mayor talla promedio (25.2 mm), fueron capturadas en Chuburná durante la época de lluvias, mientras que en Yucalpetén fue en secas (22.0 mm). En ambos sitios las larvas de peces con mayor talla, pertenecieron a las familias Engraulidae y Clupleidae y las menores a Atherinidae (Tabla 4). El análisis de varianza simple demostró que no hubo diferencias entre localidades y épocas (Tabla 2), lo que presupone que al momento de realizar el muestreo, las tallas de captura de la trampa no se vieron afectadas por estos factores.
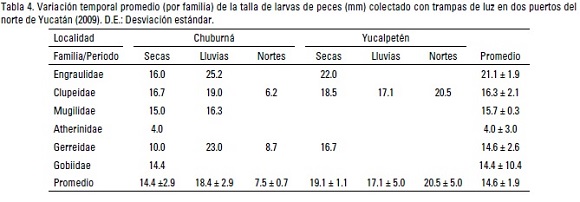
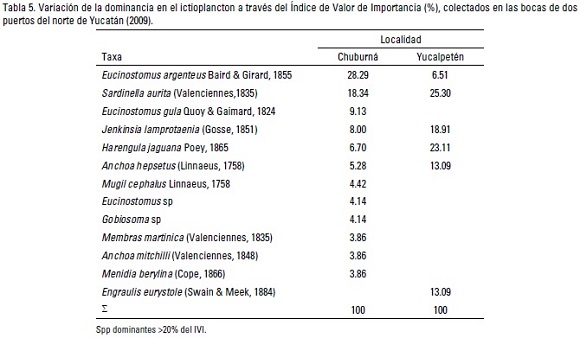
La importancia de las especies varió entre los sitios, denotándose que Eucinostomus argenteus fue la dominante en Chuburná, mientras que Sardinella aurita y Harengula jaguana lo fueron en Yucalpetén (Tabla 5). En cuanto a la riqueza, se registraron un total de 13 especies, con una riqueza media de 5 ± 1.5 especies por sitio. La distribución espacial de la riqueza fue muy heterogénea, registrándose el mayor número de especies en la boca del puerto de abrigo de Chuburná (12 spp). Asimismo, se registró una diversidad (H') general de 2.25 bits/ind., con los valores más altos en Chuburná y los menores en Yucalpetén (2.30 y 2.09 bits/ind.) en ambas localidades los mayores valores ocurrieron durante la época de secas (Tabla 3); en tanto que la repartición de la dominancia total fue de 0.61, con el valor mayor en Yucalpetén (0.89) y el menor en Chuburná (0.58).
El análisis de similitud entre sitios, a través del coeficiente de Jaccard (C), indicó que la composición ictioplanctónica tiende a ser diferente entre los sitios (C = 0.40), lo anterior debido a que de las 12 especies registradas en Chuburná, siete fueron únicas para este sitio, en tanto que de las seis se registraron en Yucalpetén sólo una fue particular de este sitio, y cinco estuvieron compartidas entre ambas localidades. Lo anterior también fue corroborado al obtener un valor de riqueza de especies de 72.2%, lo que indicó que el número de especies fue diferente en las tres épocas climáticas y en los dos sitios.
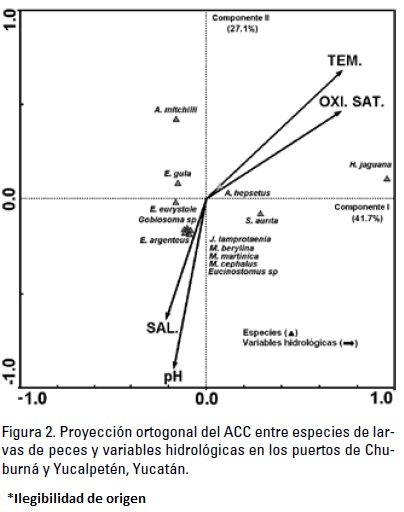
Relación de las especies con el medio. El ACC de especies y variables hidrológicas, estableció que la varianza explicada que relacionó al componente uno con el dos fue de 68.8%, indicando una importante relación entre ambos. Este análisis indico que Harengula jaguana y Anchoa mitchilli (Valenciennes, 1848) estuvieron asociadas a una mayor temperatura y oxígeno saturado. Por el contrario Eucinostomus argenteus, Sardinella aurita, Me-nidia berylina, (Cope, 1866) Mugil cephalus, Membras martinica y Jenkinsia lamprotaenia se relacionaron con aguas de mayor salinidad y pH. Asimismo, Engraulis eurystole, Anchoa hepsetus y Eucinostomus gula Quoy & Gaimard, 1824, no mostraron una clara relación con alguna variable del ambiente evaluado (Figura 2).
DISCUSIÓN
Las diferencias hidrológicas registradas, indicaron una variación espacial y temporal en Chuburná y Yucalpetén, que de acuerdo con Herrera-Silveira et al. (1999), son el resultado de la asociación entre la intensidad y la frecuencia de varios factores, como la fuerza y dirección de los vientos, tiempo de residencia del agua, flujos de marea, aportes dulceacuícolas subterráneos y características fisiográficas de la comunicación de las lagunas con el mar. Asimismo, los valores promedio de la salinidad, denotaron un medio típicamente marino y el registro de valores mayores de 40 ups durante secas, denotan una tendencia de Chuburná hacia la hipersalinidad en secas, eventos también señalado por Valdés y Real (1998) para la laguna de Chelem en el mismo periodo.
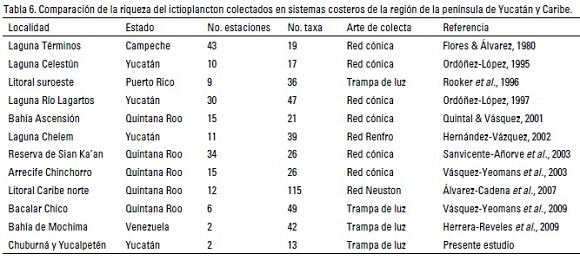
La abundancia de las larvas de peces estuvo relacionada con los gradientes hidrológicos y con los cambios temporales del medio; cambios que también han sido señalados en otros sistemas costeros cercanos a la localidad estudiada (Ordóñez-López, 1995; 1997; Ordóñez-López & García-Hernández, 2005). Además, se registró un mayor número de especies del componente marino que en su estado adulto son eurihalinas y pocas estenohalinas, como Jenkinsia lamprotaenia y Sardinella aurita. El número de especies fue considerado bajo en relación a la fauna ictioplanctónica asociada a sistemas coralinos y otros sistemas costeros de la península (Álvarez-Cadena et al., 2007; Vásquez-Yeomans et al., 2003) (Tabla 6). Las diferencias en abundancia y riqueza pueden atribuirse al uso de artes de pesca diferentes, a una intensidad y periodicidad de muestreo mayores, así como a la colecta en distintos hábitats, como puede observarse en los estudios de Flores-Coto y Álvarez-Cadena (1980) y Ordóñez-López (1997), cuyos resultados derivaron de un mayor número de estaciones de colecta y de hábitats, es decir de un mayor esfuerzo espacial y temporal (Álvarez-Cadena et al., 2009). En este mismo sentido, la información recolectada en este estudio sólo es comparable con los trabajos que utilizaron el mismo arte de colecta, al respecto Vásquez-Yeomans et al. (2009), señalan la captura de 119 especies con diferentes artes de colecta; 49 con trampas de luz, 31 de las cuales fueron exclusivas de este arte, con muestreos intensivos de 2-3 días durante día/noche en periodos de secas y lluvias en el medio lagunar de arrecife Bacalar Chico, Quintana Roo, En tanto que el estudio de Rooker et al. (1996), mencionan la colecta de 36 taxa comprendiendo diferentes fases lunares y diversos hábitats del medio costero. Las diferencias con el presente estudio seguramente se deben a que estos últimos autores utilizaron un mayor número de trampas (3-6) en cada sitio de muestreo y en diversos hábitats y mientras que el presente trabajo sólo se realizaron muestreos con una trampa por cada sitio. Una mayor abundancia de especies eurihalinas marinas fueron capturadas en Chuburná y Yucalpetén, lo que sugiere un importante intercambio de fauna marina con la estuarina. Al respecto García-Hernández et al. (2009), reportan que es común que en las lagunas costeras con fuerte influencia marina, la riqueza de larvas y juveniles sea mayor particularmente en la boca, conformando una comunidad mixta de especies marinas y estuarinas, con predominancia de las primeras. Además, la alta abundancia de especies estenohalinas (Sardinella aurita) y de eurihalinas marinas (Anchoa mitchilliy Eucinostomus argenteus), sobre las demás especies capturadas, también ha sido reportada para otros cuerpos costeros cercanos a la localidad (Flores & Álvarez 1980; Rooker et al., 1996; Ordoñez-López 1995, 1997; Vásquez-Yeomans et al., 2009). El registro de larvas de peces, cuyo estado adulto presenta una afinidad típicamente marina (Anchoa hepsetus, Engraulis eurystole, Sardinella aurita, Jenkinsia lamprotaenia), sugiere que la principal fuente de organismos es la zona costera, no obstante las variaciones en sus abundancias, están estrechamente relacionadas con los flujos de marea y con los cambios estacionales que modifican los gradientes de salinidad. Estos factores, también han sido señalados como responsables de la variación de la abundancia de larvas de peces en otros sistemas costeros de la península (Flores-Coto & Pérez-Argudín 1991; Ordoñez-López, 1995, 1997). En este sentido, la alta salinidad registrada en Yucalpetén durante las secas, podría ser un factor que controle la distribución temporal de las especies más abundantes. Así, las mayores concentraciones de Eucinostomus argenteus y Sardinella aurita se presentaron en salinidades mayores a 40 ups, seguramente debido a su condición estuarino-costera (Johnson, 1978; Jones et al., 1978). Lo anterior quedó corroborado al obtener una importante relación de estas larvas con la variable mencionada.
Por otra parte las tallas mayores de larvas de clupéidos y engráulidos registradas en lluvias, pueden atribuirse a que al final de este periodo, ocurre el mayor reclutamiento en el año de dichas familias (Johanes, 1978; Ditty, 1986), otro momento importante en donde se registran larvas en abundancia fue hacia el final de secas aunque en menor intensidad, como lo señala Ordóñez-López y García-Hernández (2005), Hernández-Vázquez (2002) y García-Hernández et al. (2009).
La diferencia registrada entre sitios con el índice de Jaccard (0.4), presupone que las características fisiográficas de las lagunas (amplia comunicación con el mar, interior con manglares o praderas de macrófitos), posiblemente influyeron no solo en la abundancia en las capturas sino también en la composición de las larvas. Al respecto, varios autores han mencionado que, los sistemas costeros de la península de Yucatán tienen una composición distinta en larvas de peces, debida posiblemente a que estos ambientes presentan características hidrológicas diferentes, así como una mezcla de diversos hábitats (praderas de pastos y algas, blanquizales de arena y extensa línea de manglar (García-Hernández et al., 2009; Sanvicente-Añorve et al. 2011). La mayor abundancia de larvas de peces en Chuburná, sugiere que las condiciones ambientales en general fueron más estables, debido probablemente a una menor urbanización cerca del sitio de muestreo, que produce una menor influencia de luces externas. Asimismo, en esta zona no existen descargas de drenaje que generen contaminación; además, también es bajo el número de embarcaciones que transitan, todo lo cual genera un menor disturbio en contraste con Yucalpetén, donde la urbanización es mayor, ocasionando probablemente un mayor impacto al sitio de mues-treo, puesto que las luces del puerto se encuentran muy cercana del sitio de estudio, lo cual pudo perjudicar la efectividad de la trampa. Por otro lado, las aguas de drenaje provenientes de la zona urbana son descargadas sobre la laguna, por lo que también pudo haber ocasionado un mayor impacto sobre la fauna existente, y en consecuencia una menor captura de muestreo. Otro factor relacionado con estos resultados, pudo ser el tránsito de lanchas puesto que era mayor que en Chuburná, porque genera disturbios en las corrientes en las cuales transitaban las larvas de peces, ocasionando su posible desorientación al momento de entrar a la laguna, pudiendo hacer que algunas se dispersaran justo al momento de pasar por la trampa evitando así, ser colectadas. Con respecto a la variación entre épocas, la mayor abundancia de larvas se presentó en lluvias para Yucalpetén y en secas para Chuburná, lo cual presupone una mayor actividad de reproducción de los peces adultos principalmente durante la época de lluvias. Lo anterior también ha sido registrado para otros sistemas costeros cercanos, como lo ha mencionado Ordóñez-López (1995, 1997). Este mismo autor indica que se registran dos momentos de mayor concentración de larvas durante el año: el primero en secas y el segundo y más intenso al final de la época de lluvias. De la misma manera, se señala que durante el periodo en que se presentan los vientos del norte se registran las menores abundancias de larvas.
En cuanto a la relación de la abundancia de las larvas de Anchoa mitchilii y Harengula jaguana con la temperatura del agua, se sugiere una tolerancia de ambas especies a una alta temperatura. De acuerdo con Jones et al. (1978), las larvas y juveniles de estas especies son euritérmicas y suelen encontrase en áreas con temperatura entre los 9 a los 31°C. Tales autores mencionan que Anchoa mitchilli es abundante en aguas superficiales de playas arenosas y en el interior de bahías; que generalmente presentan extensas praderas de vegetación sumergida, debido quizá también a su necesidad de un mayor contenido de oxígeno y en áreas con baja salinidad como es el caso de Harengula jaguana. De la misma manera, la relación de las larvas de Eucinostomus argenteus, Jenkinsia lamprotaenia, Menidia berylina, Membras martinica y Mugil cephalus con la salinidad, presupone que estas especies son tolerantes a mayores concentraciones de esta variable. Al respecto la primera especie ha sido registrada como eurihalina y frecuente en áreas de alta salinidad (45.2 ups) dentro de bahías, pero separada de Eucinostomus gula (Johnson, 1978; Ordóñez-López, 1997), en tanto en la segunda especie, el adulto es considerado típicamente del medio marino y sus larvas se han registrado en la zona de las bocas de los sistemas costeros de Yucatán (Ordóñez-López, 1997; García-Hernández et al., 2009). Asimismo, Martin y Drewry (1978) han colectado a las larvas de ambas especies de aterínidos (Menidia berylina y Membras martinica) en salinidades de 37 ups y Ordóñez-López (1997) en el interior de Ría Lagartos, en salinidades mayores de 60 ups. Por su parte las larvas de mugílidos en la boca de Chuburná, seguramente se deba al transporte por corrientes, ya que de acuerdo con Martin y Drewry (1978) el desove de éstos peces ocurre lejos de la costa; al respecto Ordóñez-López (1995, 1997) y García-Hernández et al. (2009) señalan que este tipo de larvas son frecuentemente capturadas en las bocas de las lagunas de Yucatán.
Finalmente, podemos concluir que la trampa de luz, es un arte complementario a la red cónica convencional, ya que suele capturar especies que normalmente no se colectan en el día (tal como ocurrió en el presente estudio), o que se encuentran asociados a la fuerte heterogeneidad que representa la intrincada red de raíces del mangle, praderas de macrófitos sumergidos y/o de sitios poco accesibles (Doherty, 1987), por lo anterior el uso de este método ayudaría a entender de manera amplia las asociaciones de larvas de peces neríticos. Además, este tipo de colecta provee una representación más completa de las clases de tamaño de la fase pelágica de los peces y por ello proporcionó datos sobre una importante fracción de las especies del interior de las lagunas del litoral norte de Yucatán.
AGRADECIMIENTOS
Los autores expresan su agradecimiento a Margarita Ornelas, Nariely Amaya y Evelyn Carrillo, por su colaboración en la identificación de las especies y su apoyo en el trabajo de campo. A Roberto Barrientos, Carlos González, Miguel Ruiz y a un revisor anónimo, por sus atinadas observaciones y correcciones al manuscrito. La presente investigación forma parte del curso "Dinámica de Comunidades", que se imparte en la Licenciatura en Biología Marina en la Universidad Autónoma de Yucatán, México.
REFERENCIAS
Álvarez-Cadena, J. N., U. Ordóñez-López, A. R. Almaral-Mendml, M. Ornelas-Roa & A. Uicab-Sabido. 2007. Larvas de peces del litoral del norte de Quintana Roo, Mar Caribe de México. Hidrobiológica 17 (2): 139-150. [ Links ]
Álvarez-Cadena, J. N., U. Ordóñez-López, A. R. Almaral-Mendivil & A. Uicab-Sabido. 2009. Composition and abundance of zooplancton groups from a coral ref. lagoon in Puerto Morelos, Quintana Roo, Mexico, during an annual cycle. Revista de Biología Tropical57 (3): 647-658. [ Links ]
Anderson, T. W., E. Bartels, C. T. Bartels, M. H. Carr, M. A. Hixon & J. M. Shenker. 2002. Current velocity and catch efficiency in sampling settlement-stage larvae of coral-reef fishes. Fishery Bulletin 100: 404-413. [ Links ]
Beck, W. M., Heck, I. K., Able, W. K., Childers, I. D., Eggleston, B. D., Gi-llanders, M. B., Halpern, B., Hays, G. C., Hoshino, K., Minello, J. T., Orth, J. R., Sheridan, F. P. & M. P. Weinstein. 2001. The identification, conservation, and management of estuarine and marine nurseries for fish and invertebrates. BioScience 51 (8): 633-641. [ Links ]
De la Cruz Aguero, G. 1993. ANACOM: Sistema para el ANAlisis de COMunidades en computadoras personales. In Resúmenes del V Congreso Latinoamericano sobre Ciencias del Mar. 27 sept. - 1 oct. De 1993. La Paz, Baja California Sur, México. 65 p. [ Links ]
Ditty, J. G. 1986. Ichthyoplankton in neritic waters of the northern Gulf of Mexico off Louisiana: composition, relative abundance, and seaso-nality. Fishery Bulletin 84 (4): 935-946. [ Links ]
Doherty, P. J. 1987. Light-traps: selective but useful devices for quantifying the distributions and abundances of larval fishes. Bulletin Marine Science 41: 423-431. [ Links ]
Fahay, M. P. 2007. Early Stages of Fishes in the Western North Atlantic Ocean (Davis Strait, Southern Greenland and Flemish Cap to Cape Hatteras). Journal Norh West Atlantic Fishery Science (I-II): 1-1681. [ Links ]
Flores-Coto, C. & J. N. Álvarez-Cadena. 1980. Estudios preliminares sobre la abundancia y distribución del ictioplancton en la Laguna de, Términos, Campeche, 1980. Anales del Centro Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México (2): 67-87. [ Links ]
Flores-Coto, C. & M. Pérez-Argudín. 1991. Efecto de la marea en el paso de larvas de Sciaenidae (Pisces) en Boca del Carmen, Laguna de Términos, Campeche. Anales del Centro Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México 18 (1): 25-35. [ Links ]
García-Hernández, V., U. Ordóñez-López, T. Hernández-Vázquez & J. N. Álvarez-Cadena. 2009. Fish larvae and juveniles checklist (Pisces) from the North of the Yucatan Peninsula, Mexico with 39 new records for the region. Revista Mexicana de Biodiversidad, Instituto Biología, Universidad Nacional Autónoma de México 80: 85-94. [ Links ]
Hernández-Vázquez, T. P. 2002. Estructura de la comunidad y ensamblaje de peces juveniles, en la Laguna de Chelem, Yucatán (norte-secas). Tesis Licenciatura, Escuela de Biología, UAP. 63 p. [ Links ]
Herrera-Reveles, A., B. Marín, A. Brito & R. Eudin. 2009. Dos métodos de muestreo de larvas y estadios pelágicos tempranos de peces sobre los ecosistemas marinos costeros: una comparación realizada en la Bahía de Mochima, Parque Nacional Mochima, Venezuela. Proceeding of the 62th Gulf and Caribeean Fisheries Institute, Cumana, Venezuela: 246-251. [ Links ]
Herrera-Silveira, J., J. Ramírez & A. Zaldívar. 1999. Overview and characterization of the hydrology and primary producer communities of selected coastal lagoons of Yucatan, Mexico. Aquatic Ecosystem Heath and Management 1: 353-372. [ Links ]
Hickford, M. & D. Schiel. 1999. Evaluation of the performance of light traps for sampling fish larvae in inshore temperate water. Marine Ecology Progress Series 186: 293-302. [ Links ]
Johanes, R. E. 1978. Reproductive strategies of coastal marine fishes in the tropics. Environmental Biology Fisheries 3: 65-84. [ Links ]
Johnson, G. D. 1978. Development of fishes of the Mid-Atlantic Bight: an atlas of egg, larval and juvenile stages. Carangidae through Ephip-pidae. Edited by U.S. Dept. Interior, Fish. Wild. Serv., Biol. Serv. Program, Vol. 4. 314 p. [ Links ]
Jones, D. L. 2006. Design, construction and use of a new light trap for sampling larval coral reef fishes. NOAA Technical Memorandum NMFS-SEFSC-544, 30 p. [ Links ]
Jones, P. W., Martin, F. D. & J. D. Hardy. 1978. Development of fishes of the Mid-Atlantic Bight: an atlas of egg, larval and juvenile stages. Acipenseridae through Ictaluridae. Edited by U.S. Dept. Interior Fish. Wild. Serv., Biol. Serv. Program, Vol. 1. 366 p. [ Links ]
Krebs, J. Ch. 1999. Ecological Methodology. Addison Wesley Longman, Inc., Nueva York. 620 p. [ Links ]
Martin, F. D. & G. E. Drewry. 1978. Development of fishes of the Mid-Atlantic Bight: an atlas of egg, larval and juvenile stages. Stromateidae through Ogcocephalidae. Edited by U.S. Dept. Interior, Fish Wildlife Service. Biology Service Program 6: 416 p. [ Links ]
McCune, B. & J. Grace. 2002. Analysis of Ecological Communities. MjM Software Desing. Gleneden Beach, Oregon US. 300 p. [ Links ]
Ordóñez-López, U. 1995. Análisis del ictioplancton de la reserva faunística de Celestún, Yucatán. Instituto Politécnico Nacional, Centro de Investigación y de Estudios Avanzados-Mérida. Informe Final SNIB-CONABIO proyecto No. B020. México D.F. 85 p. [ Links ]
Ordóñez-López, U. 1997. Análisis del ictioplancton de la reserva faunística de Ría Lagartos, Yucatán. Instituto Politécnico Nacional, Centro de Investigación y de Estudios Avanzados-Mérida. Informe Final SNIB-CONABIO proyecto No. L148. México D. F. 180 p. [ Links ]
Ordóñez-López, U. & V. D. García-Hernández. 2005. Ictiofauna juvenil asociada a Thalassia testudinum en Laguna Yalahau, Quintana Roo. Hidrobiológica 15 (2): 195-204. [ Links ]
Quintal Lizama, C. & L. Vásquez Yeomans. 2001. Asociaciones de larvas de peces en una bahía del Caribe mexicano. Revista de Biología Tropical 49 (2): 559-570. [ Links ]
Richards, W. J. 2006. Early Stages of Atlantic Fishes. An Identification Guide for the Western Central North Atlantic. Vol. I y II. CRC Taylor & Francis. New York, US, 2640 p. [ Links ]
Rooker, R. J., G. D. Dennis & D. Goulet. 1996. Sampling larval fishes with a nightlight lift-net in tropical inshore waters. Fisheries Research 26: 1-15. [ Links ]
Sanvicente-Añorve, L., A. Hernández-Gallardo, S. Gómez-Aguirre & C. Flores-Coto. 2003. Fish larvae from a Caribbean estuarine system. In: The Big Fish Bang. Proceedings of the 26th Annual Larval Fish Conference: 365-379. [ Links ]
Sanvicente-Añorve, L., M. Sánchez-Ramírez, A. Ocaña-Luna, C. Flores-Coto & U. Ordóñez-López. 2011. Metacommunity structure of estuarine fish larvae: the role of regional and local. Journal of Plankton Research 33 (1): 179-194. [ Links ]
Sponaugle, S., J. Fortuna, K. Grorud & T. Lee. 2003. Dynamics of larval fish assemblages over a shallow coral reef in the Florida Keys. Marine Biology 143: 175-189. [ Links ]
Ter Braak F. C. & P. F. M. Verdonschot. 1995. Canonical Correspondence Analysis and Related Multivariate Methods in Acuatic Ecology. Aquatic Science 57: 255-288. [ Links ]
Valdés, L. D. & E. Real. 1998. Variations and relationships of salinity, nutrients and suspended solids in Chelem coastal lagoon at Yucatan, Mexico. Indian Journal of Marine Sciences 27: 149-156. [ Links ]
Vásquez-Yeomans, L., U. Ordóñez-López, C. Quintal-Lizama & M. Ornelas-Roa. 2003. A preliminary fish larvae survey in Banco Chinchorro. Bulletin of Marine Science 73 (1): 141-152. [ Links ]
Vásquez-Yeomans, L., U. Ordóñez-López, M. Vega-Cendejas & J. Montero. 2009. Diversidad de larvas y juveniles de peces de Balcalar Chico, Caribe mexicano. In: Resúmenes XV Reunión de la Sociedad Mexicana de Planctología, Tlalnepantla, Estado de México. 37 p. [ Links ]
Zar, J. H. 1988. Biostatistical Analysis. Prentice Hall, New Jersey, U.S. 718 p. [ Links ]














