Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Hidrobiológica
versión impresa ISSN 0188-8897
Hidrobiológica vol.12 no.2 Ciudad de México dic. 2002
Artículo
Respuesta metabólica de la alimentación natural y artificial en juveniles de la langosta espinosa Panulirus argus (Latreille, 1804)
Metabolic responses to tatural and artificial feeding on the Caribbean Spiny Lobster juveniles, Panulirus argus (Latreille, 1804)
Eugenio Díaz-Iglesias1,3, Marysabel Báez-Hidalgo1, Erick Perera Bravet1 e Ileana Fraga Castro2
1 CIM, Centro de Investigaciones Marinas, Universidad de la Habana, Calle 16 No. 114 e/ 1ra y 3ra., Miramar, Playa, C. P. 11300 La Habana, Cuba.
2 CIP, Centro de Investigaciones Pesqueras, Ministerio de la Industria Pesquera, 5ta. Ave. y 248, Barlovento, Santa Fé, Playa, C. P. 19500, La Habana, Cuba.
3 Depto. de Acuicultura. CICESE. Km 107 carretera Tijuana-Ensenada, Baja California. Apdo. Postal 2732. México 22860. E-mail: ediaz@cicese.mx
Recibido: 25 de septiembre de 2001
Aceptado: 31 de julio de 2002
Resumen
Con el objetivo de evaluar la respuesta metabólica y el efecto calorigénico de la alimentación natural y artificial en juveniles de la langosta espinosa, Panulirus argus, se efectuaron experimentos en un respirómetro dinámico cuyas cámaras funcionaron como jaulas metabólicas acuáticas, permitiendo la determinación del consumo de oxígeno y la excreción amoniacal durante el ayuno y la alimentación. Se calcularon los índices bioenergéticos, incremento de calor aparente (ICA), excreción postalimentaria (UPA) y la razón atómica O:N. Los alimentos estudiados fueron los moluscos: lima Lima scabra, quitón Acanthopleura granullata, y litorina Littorina mespillum; el erizo negro Echinometra lucunter, el cangrejo Plagussia depressa; y dos alimentos balanceados isocalóricos que contienen 25 y 45% de proteína. A los alimentos balanceados, al quitón y al erizo se les hizo análisis bromatológico. Durante las 6 horas de experimentación, para las langostas alimentadas con quitón A. granullata, el VO2/W aumentó a 2.4 veces el valor del ayuno, o sea, 2454 joules kg−1bh.h−1, mientras que el U/W tomó un valor 2.9 veces mayor, equivalente a 632 joules kg−1bh.h−1. La razón atómica O:N disminuyó a 12.9, indicando el catabolismo de proteínas. Se comparan los resultados entre sí, observándose que no en todos los casos se utilizan las proteínas como sustrato energético, sobre todo en aquellas especies en que están bien representados los lípidos. Se analizaron elementos que permiten afirmar la carnivoría estricta de esta especie.
Palabras clave: Respuesta metabólica, Panulirus argus, alimentación artificial.
Abstract
With the objetive of evaluating the metabolic response and the calorigenic effect of the natural and artificial feeding in spiny lobster Panulirus argus juveniles, experiments were made in a dynamic respirometer where cameras worked as aquatic metabolic cages, allowing the determination of the oxygen consumption and the ammonia excretion during the fast and the feeding. The bioenergetics index was calculated, apparent head Increment (AHI), postpandrial nitrogen excretion (PPNE) and the atomic ration O:N. The studied foods were the mollusks, Lima scabra, chiton Acanthopleura granullata, and sea snail Littorina mespillum, the black sea urchin Echinometra lucunter, the crab Plagussia depressa; and two isocaloric foods that contain 25 and 45 protein %. To the artificial foods, the chiton and the sea urchin a bromathologic analysis was carried out. During the 6 hours of experimentation, for the chiton A. granullata, the VO2/W increased to 2.4 times the value of the fast, which represents 2454 joules kg−1bh.h−1, while the U/W took a value 2.9 times higher, equivalent to 632 joules kg−1bh.h−1. The ratio O:N diminished at 12.9, indicating the catabolism of proteins. Results are compared with the following observation not in all the cases, the proteins are used as an energy substrate, mainly in those species in which the lipids are well represented. Elements are analyzed in order to confirm the strict carnivory of this species.
Key words: Metabolic response, Panulirus argus, man-made food.
Introducción
Como se ha considerado en un trabajo anterior (Díaz-Iglesias et al., 2001 a) la langosta espinosa Panulirus argus (Latreille, 1804) es objeto de una pesquería con un alto nivel de explotación (Cruz, 1999) en fase IV o de decadencia (FAO, 2000), siendo la única vía en Cuba para incrementar su producción la del maricultuvo. La mayor dificultad hasta el presente en el cultivo de la langosta espinosa es la larvicultura, por los requerimientos fisiológicos y ecológicos especiales de las larvas filosomas.
Sin embargo, P. argus reúne otras características que la hacen potencialmente cultivable debido a que madura y se reproduce en cautiverio y sus hábitos gregarios, facilitan la cría de postlarvas y juveniles en muchos aspectos, a diferencia de las langostas homáridos.
Se han realizado investigaciones relacionadas con el conocimiento de la bioenergética del género, tanto para su evaluación como entidad ecológica, como para el desarrollo de biotécnicas coherentes para la cría y cultivo (Brito y Díaz-Iglesias, 1983; Brito et al., 1991; Buesa, 1979; Conceiçao et al., 1995; Díaz-Iglesias y Brito, 1987; Díaz-Iglesias et al., 1991, 1996; Kanazawa, 1994; Kittaka, 1988a, 1988b, 1989, 1997; Lemmens, 1994). No obstante, la información concerniente al efecto bioenergético de los alimentos naturales no está disponible.
La acción dinámica específica de los alimentos, conocida moderadamente como incremento del valor aparente (ICA) (Beamish y Trippel, 1990), es un indicador del uso catabólico del alimento ingerido, de ahí la conveniencia de conocer en detalle algunos indicadores bioenergéticos para el mejor aprovechamiento de la energía contenida en los alimentos, ya sean naturales o artificiales y por ende, un manejo más adecuado de la cría o cultivo. El ICA permite profundizar en el funcionamiento de la especie ante la presencia del alimento en dependencia de su naturaleza y composición. Desde el punto de vista energético, el ICA ha sido asociado con los requerimientos de energía (medido por el consumo de oxígeno), tanto para el trabajo mecánico de la captura, masticación y deglución del alimento, como para el trabajo metabólico de los procesos absortivos que siguen a la ingestión del alimento. De esta manera se conoce que las proteínas producen un ICA mayor en la medida en que la concentración de éstas aumenta (debido a la remoción del Nα-amino de los aminoácidos), lo que incrementa el costo energético de la dieta en comparación con el catabolismo de glúcidos o ácidos grasos cuyo gasto calórico es menor (Hochachka, 1990).
La mayoría de los animales acuáticos son amoniotélicos, siendo el principal producto final del metabolismo del nitrógeno, el amoníaco. Éste es más importante que la urea, el ácido úrico u otros compuestos nitrogenados, pues representa un bajo costo metabólico ya que se forma en muchas reacciones catabólicas y no requiere de procesamientos posteriores para su excreción (Kormanik y Cameron, 1981). En los crustáceos, el amoníaco comprende entre el 40 y 90% de la excreción nitrogenada postalimentaria (UPA), el cual es excretado en su mayor parte a través del epitelio branquial (Kinne, 1976).
El creciente uso de índices metabólicos como O:N y O:P (razón atómica entre el oxígeno consumido y el nitrógeno o fósforo excretados) se inicia con los cálculos teóricos realizados por Harris (1959) al estudiar el catabolismo de los mamíferos. La hipótesis de la utilización de la razón atómica O:N como un indicador del sustrato oxidado en el metabolismo energético de crustáceos fue desarrollada posteriormente por Conover y Corner (1968). La razón atómica O:N parte del principio de que la energía que es utilizada para la producción de ATP proviene de los carbohidratos, lípidos y proteínas. Tomando en cuenta que el catabolismo de estos sustratos necesita diferentes cantidades de oxígeno según en qué forma son canalizados al ciclo de Krebs y que el amoníaco representa el principal producto de excreción del catabolismo de los productos nitrogenados, la relación entre el oxígeno consumido y el nitrógeno excretado indica la magnitud en que son degradados los diferentes sustratos en el organismo. Al analizar la razón atómica O:N como una herramienta en la descripción del metabolismo del zooplancton, Mayzaud y Conover (1988) revisaron los límites teóricos, señalando que valores entre 3 y 16 representan un catabolismo de proporciones iguales de proteínas y lípidos, mientras que valores mayores indican mayor utilización de los lípidos y carbohidratos.
La razón entre el oxígeno consumido y el nitrógeno excretado ha sido ampliamente utilizada como índice del sustrato metabólico que es oxidado en los crustáceos (Regnault, 1981; Dall y Smith, 1986; Chu y Ovsianico-Koulikowsky, 1994; Rosas et al., 1995; Díaz-Iglesias et al., 1996, 2001 a, b, c.). Sgún Mayzaud y Conover (1988) los cambios en la razón atómica O:N no sólo reflejan el tipo de sustrato metabólico que está siendo oxidado, sino que también indican la relación entre los animales y el alimento que ingieren dependiendo de la utilización que hagan del suministro de aminoácidos para el crecimiento, la producción de energía o la síntesis de otros compuestos.
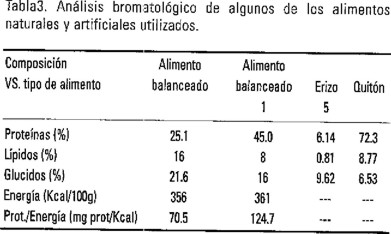
El objetivo de este trabajo fue el análisis comparado del uso que hacen los juveniles de langosta, de la energía alimentaria que les proporcionan los moluscos, Lima scabra, Acanthopleura granullata, Littorina mespillum, el erizo Echinometra lucunter, el cangrejo Plagussia depressa, los cuales forman parte del grupo de organismos bentónicos mejor representados en el espectro alimentario de ejemplares silvestres (Colinas y Briones, 1990; Espinosa et al., 1991; Herrera et al., 1991; Cox et al., 1997) y dos alimentos balanceados isocalóricos de 25% y 45% de proteína dietética que han sido formulados por Fraga (1996), especialmente para postlarvas y juveniles de langosta.
Materiales y métodos
Se utilizaron juveniles de langosta espinosa Panulirus argus de ambos sexos, cuya biomasa húmeda osciló entre 16 - 101 g. Los organismos se recolectaron en la zona de Bocas de Alonso, SE de la Isla de la Juventud, Archipiélago de los Canarreos. Para la colecta se utilizaron las estructuras de hormigón diseñadas por Cruz et al. (1986), para el monitoreo de la fase juvenil de esta especie. La zona es una extensa pradera de seibadal, típica de las áreas de crianza, con una profundidad promedio de 5 m. Los ejemplares se trasladaron hasta el laboratorio en un recipiente plástico de 50 L con suministro de aire constante.
En el laboratorio, se colocaron individualmente en recipientes cilíndricos de 90 L de capacidad con aireación constante y agua circulante, proveniente de un sistema cerrado con filtración biológica de 600 L. Para reducir la concentración de nitratos se realizó un recambio mensual de aproximadamente el 50 % del volumen total del sistema. Se colocó en cada recipiente una pequeña estructura de hormigón a fin de proveer el refugio a las langostas. Los ejemplares se alimentaron durante el día por aproximadamente tres semanas hasta que se adaptaron a las nuevas condiciones.
Se emplearon 13 juveniles cuya biomasa húmeda osciló entre 16 y 101 g. Antes de cada experimento se les suministró durante una semana el alimento natural ad libitum, que se utilizaría en cada caso. Los ejemplares utilizados con estos fines fueron: el pelecípodo Lima scabra, el gasterópodo Littorina mespillum, el anfineuro Acanthopleura granullata, el erizo Echinometra lucunter y el cangrejo Plagussia depressa, los que se recolectaron en el litoral aledaño. En el caso de las dietas artificiales, las cuales fueron elaboradas y proporcionadas por Fraga (1996) del Centro de Investigaciones Pesqueras, se alternaron con alimento natural antes de los experimentos con el objetivo de evitar carencias nutricionales. Para el análisis de la composición de los elementos se emplearon las técnicas bromatológicas de la AOAC (1990) (Tabla 1). Los factores como, concentración de oxígeno disuelto, temperatura, salinidad y concentración de amoníaco se monitorearon diariamente, presentando valores que están referidos como óptimos para la especie. En la Tabla 1 se presentan las variaciones de los factores ambientales durante el lapso experimental, que se extendió desde diciembre de 1998 hasta abril del 2000. Como se analizó la variación térmica, se ajustaron todos los resultados a 28°C según el procedimiento de Winberg (1956).
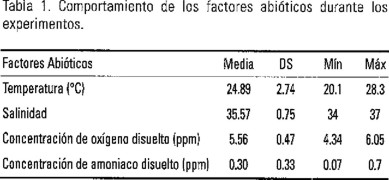
Para determinar la respuesta metabólica provocada por cada alimento en el tiempo, se realizó la medición del consumo de oxígeno respecto al peso (VO2/W = mg O2 kg−1 hr−1) y la excreción de amoníaco respecto al peso (U/W = mg NH3 kg−1 hr−1). Las mediciones se hicieron en un dispositivo respirométrico dinámico de seis cámaras o jaulas metabólicas acuáticas, aproximadamente a la descrita por Martínez y Díaz-Iglesias (1975). Para ambas mediciones se utilizaron electrodos selectivos de oxígeno y amoníaco acoplados a sus analizadores digitales (YSI y ORION). Ésta instalación está acoplada al sistema de circulación de agua que alimenta el dispositivo experimental descrito anteriormente. Los animales (n = 5) se colocaron en cámaras respirométricas desde las 0800 h, en condiciones postabsortivas (ayuno de 48 horas). Se mantuvo una cámara sin animal, como testigo de la actividad metabólica del plancton circulante en el circuito cerrado del dispositivo experimental. A las 12:00 h comenzó la toma de las muestras de agua a la entrada y salida de las cámaras, la cual se realizó cada hora, durante 6, para determinar el consumo de oxígeno y la producción de amoníaco. Se realizó un experimento previo sin añadir alimento para determinar la ritmicidad biológica de las variables estudiadas en el lapso experimental de los ejemplares en estudio. El alimento, objeto de cada experimento, se suministro ad libitum después de tomar la primera muestra. En este momento los ejemplares se encontraban en ayuno.
Para la evaluación de la energía contenida en el alimento consumido por el animal se calculó el incremento de calor aparente (ICA) (Beamish y Trippel, 1990). El cálculo se efectuó restando el valor del consumo de oxígeno del tiempo inicial o ayuno, al valor máximo que alcanzó el metabolismo respiratorio después de la ingestión del alimento; de la misma manera se procedió con la excreción postalimentaria de amoníaco (UPA). También se evaluó la razón atómina O:N, (oxígeno consumido/nitrógeno amoniacal excretado) convertidos convenientemente en microátomos-gramos. Dicha razón es un indicador de la naturaleza del sustrato metabólico que está siendo oxidado preferentemente por el organismo (Harris, 1959; Dall y Smith, 1986). El catabolismo de proteínas produce relaciones O:N en el intervalo de 3-16, mezclas de proteínas y lípidos entre 17 y 50 cantidades equivalentes de lípidos y proteínas corresponden a valores del O:N entre 50 y 60, mientras que valores superiores a 60 indican el uso de lípidos y carbohidratos (mayzaus y Conover, 1988 ). Para el cálculo se tuvo en cuenta que 1 mg de O2 = 62.5 microátomos-gramos y 1 mg N = 48.5 μg-átomo-gramos.
Estos experimentos se realizaron con un diseño de bloques al azar, con seis tratamientos que fueron las mediciones de las variables o los índices calculados, en ayuno y en cada una de las 5 h siguientes a la ingestión del alimento; los bloques o repeticiones fueron los individuos en sus cámaras respectivas. Las variables medidas fueron: ICA, UPA y razón atómica de O:N. El análisis estadístico se basó en métodos paramétricos, teniendo en cuenta que los resultados se ajustaron a una distribución normal y presentaron homogeneidad de varianza al aplicarse las pruebas Kolmogorov-Smirnov y Bartlett (Zar, 1996).
Los cálculos primarios y el análisis estadístico univariado se efectuaron con los programas Microsoft Excel 2000 y el paquete estadístico Statistica 5.1, respectivamente. Los resultados se transformaron en calorías utilizando los siguientes equivalentes energéticos: para el O2 = 3,53 cal mg−1 y para el amoníaco = 5,94 cal mg−1 (Bradfield y Solomon, 1972). Para convertir en joules se utilizó el factor 4,186 j cal−1 (Lucas, 1993). Los datos fueron normalizados a 28,0°C, utilizando el procedimiento de Winberg (1956).
Resultados
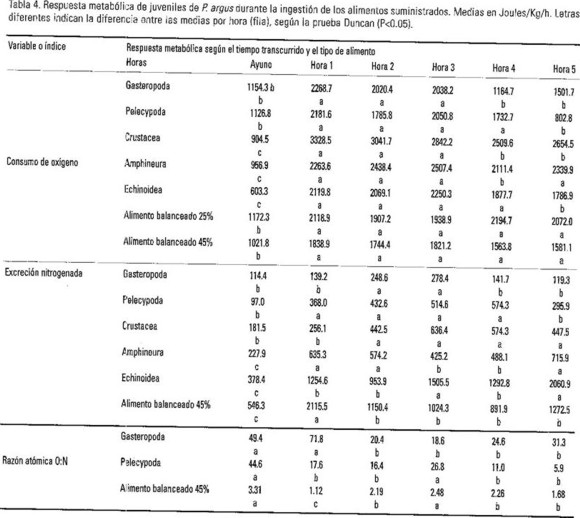
Los resultados de los análisis de varianza realizados, se presentan en la Tabla 2 y en las Figuras 3, 4, 5 y 6, en donde es evidente la variabilidad en la respuesta metabólica de los juveniles al procesar los alimentos naturales y artificiales ofrecidos. En la Tabla 3 se consignan los datos del análisis bromatológico practicado a cuatro de los siete alimentos estudiados.

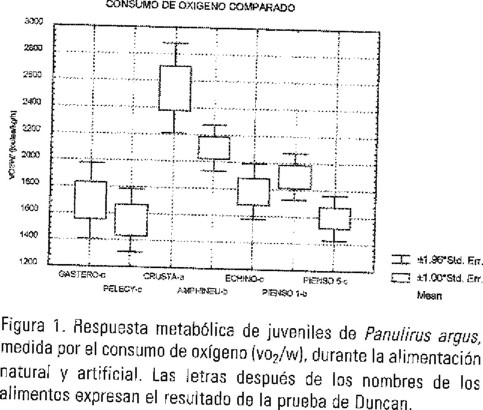
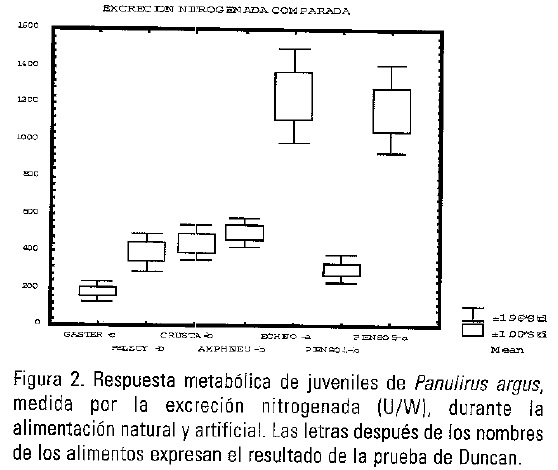

En el estudio de los efectos de la alimentación sobre el metabolismo, las tasas respiratorias de las langostas en condiciones de ayuno (postabsortivas) tanto en los diferentes experimentos, como en las repeticiones de cada uno, fueron muy próximos, lo cual resultó de importancia para el procesamiento de los resultados y para poder establecer comparaciones entre alimentos. Analizado el efecto del alimento sobre el consumo de oxígeno de las langostas se observó que la dieta con crustáceos desencadenó una mayor respuesta metabólica, del orden de 1.6 veces mayor que con pelecípodos. Estos son los de la menor expresión, junto a los gasterópodos y los erizos, que según la prueba Duncan, son respuestas que no difieren significativamente (p<0.05). Con el alimento balanceado 1 el VO2/W se expresa con una elevación aproximada a la dieta con quitones pero superior 1,19 veces (P<0.05) a la del alimento balanceado 5. La máxima excreción amoniacal media fue producida por la dieta con erizos con un valor aproximado a la del alimento balanceado 5 (45% de proteínas dietética) pero ambos difieren significativamente (p<0.05) de los bivalvos, anfineuros y crustáceos que es el grupo que le sigue, apartándose todos de los gasterópodos que presentan la expresión más reducida, 14.4% del valor que alcanzan con quitones.
Las variaciones de la relación atómica calculada O:N se presentan en la Fig. 5, en donde se puede observar que son los gasterópodos quienes menos aportan proteínas al metabolismo energético, en contraste con los erizos y el alimento balanceado 5, seguidos por el alimento balanceado 1 y los quitones. No obstante las dietas con crustáceos y pelecípodos, aunque sus valores superan al límite de 16 planteado por Mayzaud y Conover (1988), contribuyen al metabolismo energético consumiendo una mezcla mayoritaria en proteínas que en lípidos.
Discusión
El objetivo de los experimentos respirométricos empleando diferentes alimentos, fue determinar las variaciones que se producen en la tasa respiratoria y la excreción amoniacal de juveniles de P. argus asociadas con la ingestión. La ritmicidad de algunos procesos biológicos se ha demostrado en distintos crustáceos decápodos (Brito et al., 1991; Carvalho y Phan, 1997), por lo que el análisis de las oscilaciones de las variables mencionadas debido al biorritmo de los animales, constituyó un paso previo a la realización de estos experimentos (Perera et al., 2001 a, b, c.). Según refieren estos autores, no se observaron variaciones significativas (P>0.05) del VO2/W y U/W durante el lapso experimental, al igual que lo encontrado por Brito et al., (1991) para el VO2 de la misma especie en estas horas del día. Esto indicó lo adecuado de este horario para estudiar los efectos de cualquier tratamiento sobre estos indicadores metabólicos.
Los valores del consumo de oxígeno se correspondieron con la tasa metabólica específica consignada por Buesa (1979), para la misma especie, en condiciones de ayuno (48-72 h) y factores abióticos aproximados; también hubo equivalencia con los resultados referidos por Lemmens (1994) para juveniles tempranos J2 de Panulirus cygnus. Las tasas metabólicas obtenidas son ligeramente superiores a las reportadas por Company y Sardá (1998) en Palinurus mauritanicus, lo cual puede ser debido a que estas determinaciones fueron realizadas a 13°C, que es la temperatura de la mayor profundidad donde fueron capturadas las langostas (200-1250 m).
Las experiencias con juveniles de Penaeus brasiliensis han permitido comprobar la influencia que tiene el alimento sobre la tasa respiratoria, generando incrementos superiores al 40% sobre el metabolismo de ejemplares no alimentados (Zuñiga, 1983). El autor señala que del costo de mantenimiento o respiración, que es más del 85% de la energía asimilada, gran parte corresponde al ICA, mientras que en Homarus americanus las langostas tuvieron una tasa metabólica 120% mayor que las no alimentadas (Logan y Epifanio, 1978). Estos efectos fueron constatados también por Díaz-Iglesias et al., (1996), en P. argus, con la ingestión de lombriz de tierra Eudrillus eugeniae y del gasterópodo Littorina sp. quienes registraron aumentos de 168% y 261% respectivamente, respecto a los valores de ayuno del grupo control.
La causa de este incremento en el nivel metabólico asociado a la alimentación aún se desconoce, aunque los factores que pueden contribuir son: el trabajo mecánico involucrado en la ingestión, la oxidación de aminoácidos y la biosíntesis de proteínas, fundamentalmente empleadas en la producción de enzimas digestivas (Fox et al., 1994) En P. esculentus, Hewitt e Irving (1990) no encontraron un aumento significativo de la excreción luego de alimentarlo, lo cual apoya la idea que el ICA no es resultado de la desaminación de aminoácidos.
En todos los casos se pudo observar que el VO2 en P. argus se incrementa inmediatamente luego de ingerir los alimentos, permaneciendo en niveles elevados hasta el final de los experimentos. Taboada et al., (1998) observaron respuestas metabólicas en el tiempo semejantes a las de este trabajo, de hasta 2 h para el ICA en experimentos con alimentos balanceados de diferentes niveles de proteína en juveniles de Penaeus setiferus. Rosas et al., (1993) determinaron que de la energía asimilada por Callinectes rathbunae, el 21.3% se usa en la respiración mientras que Zuñiga (1983) señala que el costo de mantenimiento o respiración de Penaeus brasiliensis, un decápodo más activo, es más del 85% de la energía asimilada y gran parte corresponde al ICA.
Cuando se utilizan alimentos balanceados, siempre y cuando el aglutinante sea el mismo, como es el caso, no deben existir variaciones en el costo energético de la digestión mecánica, por lo que de producirse diferencias en el VO2 pueden ser adjudicadas a la composición química de los alimentos y mas aún, a la utilización diferencial de las fracciones del mismo. En el caso de los alimentos naturales el análisis se tornó complejo debido a que además de la imposibilidad de separar en la práctica la energía invertida en la digestión mecánica y en los procesos post-absortivos (Beamish y Trippel, 1990), el quitón, la lima, la litorina, el cangrejo y el erizo por sus diferencias en textura podrían demandar cantidades variables de energía en el procesamiento mecánico. Otro aspecto que dificulta el análisis es que no se conoce acerca de la calidad de sus proteínas.
Rosas et al., (1995) han relacionado el ICA con el porcentaje de proteínas de la dieta. En este trabajo se encontraron también diferencias en los ICA que provocaron los alimentos suministrados (Díaz-Iglesias et al., 2001 a, b y c; Perera et al., 2001 a, b y c) incluso entre los dos alimentos balanceados los cuales cumplen con el análisis anterior y difieren marcadamente en su composición. No obstante, el corto tiempo en que se alcanzaron los picos en la VO2/W y U/W, indicaron una eficiente asimilación de los nutrientes, lo que confirma lo adecuado de los componentes de los alimentos balanceados en este sentido.
Los crustáceos y peces (amoniotélicos) tienen menores ICA que organismos uricotélicos y ureotélicos cuando ingieren dietas ricas en proteínas (Hewitt e Irving, 1990), lo cual está relacionado con el menor costo energético de la síntesis y excreción de amoníaco que de urea y ácido úrico e indica que el metabolismo de proteínas contribuye al ICA. Sin embargo, las causas que desencadenan el aumento en el VO2 en un inicio pudieran ser diferentes al catabolismo de proteínas, debido al desfase en el tiempo de los picos de VO2/W y U/W observados en este trabajo y en los de otros autores. Los resultados de este estudio tuvieron más relación con lo propuesto por Fox et al., (1994) que el ICA no está directamente relacionado con el catabolismo de proteínas.
La excreción de amoníaco se ajustó a los valores de la recta de regresión de juveniles de P. argus en ayuno que reportan Conceiçao et al., (1995), es decir, 4.73 μg-at NH3 ejemplar−1 h−1, o lo que es equivalente, 0.098 mg NH3 ejemplar−1.h−1, y se inserta comparativamente en el intervalo que mencionan Marangos et al., (1990) para el camarón Penaeus japonicus de 6.6 mg NH3 kg−1 de biomasa húmeda h−1 y Kikuchi et al., (1991) de 7.5 mg NH3 kg−1 de biomasa húmeda h−1 para el lenguado Paralichthys olivaceus, teniendo en cuenta la intensidad y amplitud metabólica superiores de estas especies.
Zoutendyk (1987) obtuvo un pico en la excreción amoniacal de la langosta Jasus lalandii inmediatamente después de alimentar con la almeja Chromytilus meridionalis. El autor señala que en ocasiones se presentaba un segundo pico entre la tercera y cuarta hora, sugiriendo que la excreción de amonio es pulsátil. Así mismo, Schmitt y Santos (1998) y Taboada et al., (1998) refieren que la excreción amoniacal de Penaeus paulensis y Penaeus setiferus respectivamente, se incrementó inmediatamente de la ingestión de dietas con alto contenido proteíco. En el presente trabajo se presentó una situación aproximada a la descrita por estos autores: la excreción de amoníaco de las langostas se incrementó significativamente (p< 0.05) luego de la ingestión de los alimentos, con la excepción del alimento balanceado 1, con 25% de proteínas.
Con el análisis de los UPA producidos, se lograron detectar diferencias en el aprovechamiento de las fracciones de los alimentos, fundamentalmente la proteica (Fig. 8) Los gasterópodos, pelecípodos crustáceos, quitones y el alimento balanceado 1 (25% proteínas) fueron los empleados más eficientemente desde el punto de vista nutricional por los juveniles, no encontrándose diferencias significativas entre ellos. Con el erizo y el alimento balanceado 5 (45% de proteína) se alcanzaron UPAs significativamente (p<0.05) mayores y sin diferencias entre ellos, lo que indica que una buena parte de la proteína dietática de estos alimentos se destinó al metabolismo energético en P. argus, a diferencia del resto de los alimentos empleados.
De acuerdo con Claybrook (1983), la desaminación se produce cuando la proteína dietética es deficiente en uno o más aminoácidos esenciales o hay un pobre balance de aminoácidos, cuando se ingieren cantidades excesivas de proteínas o cuando la cantidad de energía derivada de los lípidos y carbohidratos es insuficiente para mantener los procesos corporales. En este sentido, una mayor excreción de amonio en los juveniles alimentados con erizo podría relacionarse a alguna deficiencia en el balance proteico de este alimento o a un contenido calórico insuficiente o a ambos factores.
El UPA que produjo la ingestión del erizo, fue significativamente (p<0.05) mayor que el de quitón a pesar de contener escasa proteína (6.14 %) respecto e este último (72.3 %). Este resultado se puede deber: 1) a una interacción entre la cantidad de ceniza del erizo (88.43 %) y las proteínas, impidiendo un uso eficiente de las últimas y provocando la desaminación de sus aminoácidos, a pesar del bajo nivel de proteína dietética; 2) a que las proteínas del erizo son de mala calidad desde el punto de vista nutricional, es decir, carencia de uno o más aminoácidos esenciales para la especie o composición de aminoácídos desbalanceada; 3) al bajo nivel de lípidos de esta presa (0.81%) que no protege a las proteínas del uso catabólico; 4) a la suma o combinación de algunos de estos efectos o de otros. Por consiguiente, los resultados indican que la ingestión de los erizos tuvieron poco valor para el metabolismo plástico, no así como fuente de micronutrientes como el calcio.
Los UPA producidos por los dos alimentos balanceados, como se pudo apreciar, difieren significativamente (p<0.05). El hecho que el alimento balanceado 1 tuviera el doble de lípidos que el alimento balanceado 5 (16% vs. 8%) y niveles mas elevados de carbohidratos (21.6% vs. 16%), debió ser la causa que los animales usaran menos catabólicamente las proteínas del primero, dando como resultado las menores tasas de excreción nitrogenada y los menores UPA obtenidos en los juveniles de langosta.
El uso de índices metabólicos es más conveniente para analizar el catabolismo de una especie, que la medición de las variaciones de los componentes bioquímicos de la misma en diferentes condiciones (mayzaud y Conover, 1988). A partir del cociente respiratorio (QR = CO2 producido/O2 consumido) se puede deducir el tipo de sustancia oxidada por un animal, pero la medición del CO2 es compleja, debido entre otras cosas a las interacciones del gas con el bicarbonato del exoesqueleto lo que produce una sobreestimación del QR (Waterman, 1960).
En organismos con metabolismo proteíco marcado, la relación atómica oxígeno consumido:nitrógeno excretado (O:N), es un buen indicador del sustrato metabólico que está siendo oxidado para la obtención de energía, ya que responde a cambios en el ambiente nutricional y depende del uso de las diferentes fracciones del alimento (Dall y Smith, 1986).
En este sentido la trucha Salvelinus namaycush alimentada con dieta de bajo contenido lipídico, incrementó su excreción en 150-175% los niveles del ayuno (7.0-9.8 mg/Kg/h) en 4-8 h, mientras que con dietas ricas en lípidos, a las 8-12 h el incremento es del 90-120% (Jayaram y Beamish, 1992). Se comprobó que la pérdida de energía en la excreción depende del contenido proteico del alimento y es inversamente proporcional al de lípidos, mostrando la importancia de estos dos sustratos metabólicos para organismos que no pueden aprovechar eficientemente los carbohidratos del alimento.
Se ha demostrado en varias especies de camarones peneidos, que la razón atómica O:N disminuye con el incremento de las proteínas dietéticas (Rosas et al., 1995). Dall y Smith (1986), utilizaron la razón atómica O:N en P. esculentus, determinando el marcado metabolismo proteico de la especie (O:N de 7 y 13.6-16.4 para individuos en ayuno y alimentados respectivamente). En el caso del camarón Litopenaeus setiferus, de hábitos más omnívoros, Taboada et al., (1998) encontraron preferencia por mezclas de lípidos y proteínas. No obstante, Brito et al., (2000) en postlarvas de L. setiferus demostraron una transición con la edad en el uso de las proteínas como fuente de energía en los primeros estadios más avanzados, aunque también los autores indican que la razón atómica O:N varía con el tipo de alimento.
En la langosta H. americanus se han obtenido niveles enzimáticos que indican que esta especie tiene un metabolismo basado en la utilización de carbohidratos (Stewart et al., 1992). Los resultados de estos autores guardan relación con los requerimientos lipídicos relativamente bajos señalados para esta langosta (Castell y Corey 1976).
La razón atómica O:N para P. argus al ingerir Littorina spp. obtenida por Díaz-Iglesias et al., (1996) indica la oxidación de lípidos y proteínas durante el procesamiento del alimento. A pesar de que estos resultados están influenciados por las características tanto físicas como químicas de los diferentes alimentos suministrados, resulta claro que a diferencia de los homáridos, P. argus tiene un metabolismo basado en la utilización de proteínas y lípidos.
Los resultados con el alimento balanceado 5 el cual tenía la misma calidad de proteínas que el alimento balanceado 1, que como se observó tuvo un buen aprovechamiento, hace pensar que 45 % de proteínas en la dieta excede los requerimientos de juveniles de P. argus al ser alimentados con piensos. El alimento balanceado 5 (45% de proteínas) fue el alimento que produjo los valores menores de la razón atómica O:N, lo que confirma que se produce un aumento en el catabolismo de proteínas. No obstante, ésto no significa que se produzca un crecimiento deficiente de los ejemplares por el catabolismo tan alto de las proteínas, lo que se ha demostrado por Fraga et al., (2000) que no ocurre, pero sin duda sí es un desaprovechamiento de un componente crítico de la dieta. Estos resultados no concuerdan con los obtenidos por Fraga (1996), quien obtuvo en post-larvas de langostas mejores tasas de crecimiento, de eficiencia proteica y factor de conversión del alimento con dietas con 45-50 % de proteínas.
Es conocido que el metabolismo se atenúa con la ontogenia y por ende las post-larvas deben tener requerimientos energéticos mayores que juveniles, lo que teniendo en cuenta el marcado metabolismo proteico de estos decápodos, se traduciría en mayores necesidades de proteína dietética; se ha notado que los post-puérulos de P. argus tienen mayor intensidad metabólica que los juveniles (Conceiçao, 1993). Lamentablemente no se cuentan con datos suficientes de crecimiento de P. argus con dietas artificiales, pero se han obtenido resultados de interés, debido a que algunas de las dietas ensayadas fueron las mismas que las empleadas en este trabajo y se usaron en juveniles. En estas investigaciones se han obtenido mejores crecimientos con 35% de proteínas en los alimentos balanceados (Fraga, 1996 ), lo cual apoya la idea que 45% de proteínas en dietas como éstas, excede los requerimientos proteicos de juveniles de la especie.
En general, como se muestra en la Fig. 3, los alimentos empleados se pueden dividir en dos grupos, atendiendo a la utilización metabólica de las proteínas en las langostas. Las razones O:N obtenidas se encuentran en el intervalo citado con respecto a la oxidación preferencial de proteínas como sustrato energético (Mayzaud y Conover, 1988); dichas razones son menores para los organismos alimentados con quitón, erizo y los alimentos balanceados 1 y 5 (25% y 45% de proteínas respectivamente). Las proteínas de este grupo se desaminan y utilizan en el metabolismo energético en mayor medida que las de los otros tres alimentos suministrados, es decir, gasterópodos, pelecípodos y crustáceos.
El quitón según los resultados bromatológicos presentó 8.77% de lípidos, nivel que ligeramente superior, a los valores propuestos como óptimos (3 - 6%) para el crecimiento de post-larvas de P. argus (Fraga, 1996). Considerando que tiene un elevado porcentaje de proteínas en comparación con el resto de los alimentos y que las langostas según los resultados hacen un buen uso anabólico de las mismas, se podría esperar un mejor crecimiento con esta dieta. Aunque esto no se puede comprobar directamente con estos experimentos, si se puede predecir la utilización metabólica que hará el animal del alimento sin requerir períodos prolongados de experimentación, lo cual es una de las desventajas de este tipo de estudios.
Los resultados permiten asegurar que los juveniles de P. argus son capaces de aprovechar eficientemente alimentos con más de 45% de proteínas, como sucedió con el quitón (72.3%). Sin embargo, a pesar de presentar niveles de lípidos muy próximos, las proteínas del alimento balanceado 5 (45%) probablemente se canalizaron en mayor medida al metabolismo energético, lo que sugiere, obviamente, que este alimento natural es el más completo nutricionalmente y se ajusta más a la fisiología de la especie.
Como se observó, los juveniles de P. argus no utilizan en el catabolismo las proteínas puras de gasterópodos, pelecípodos y crustáceos; lo hacen en una mezcla con lípidos según se refleja en la Tabla 2 y Fig. 5, mientras que las proteínas del erizo el quitón y los alimentos balanceados 1 y 5 son canalizadas enteramente al metabolismo energético, a juzgar por los valores inferiores a 16 de la razón atómica O:N (Mayzaud y Conover, 1988).
Es evidente que los juveniles de P. argus, pueden resolver sus necesidades nutricionales, a partir de la ingestión de otros animales, es decir son carnívoros por excelencia, no obstante algunos de ellos, como el erizo no poseen la calidad proteica requerida en la biosíntesis de nuevas estructuras, productos sexuales, y otros, ya que la canalizan en su totalidad al catabolismo. Probablemente, el erizo aporte cantidades apreciables de minerales útiles en el endurecimiento del exoesqueleto durante la postmuda.
Conclusiones
La respuesta metabólica durante la ingestión de los alimentos tuvo incrementos significativos en todos los casos, siendo la del crustáceo Plagussia depressa, la que obtuvo la mayor amplitud. Por otra parte, la excreción durante la ingestión de los alimentos generó incrementos significativos en todos los casos, siendo la del erizo y el alimento balanceado 5, las que obtuvieron la mayor amplitud.
Según los resultados de la razón atómica O:N las proteínas puras del erizo y las del alimento balanceado 5 son las que más aportan al metabolismo energético de juveniles de langosta, le sigue en importancia el alimento balanceado 1 y los quitones, pero en cualquier caso las proteínas de estos cuatro alimentos son destinadas preferentemente al catabolismo.
Las proteínas de gasterópodos, pelecípodos y crustáceos son canalizadas en menor proporción al catabolismo en una mezcla con lípidos, ya que por su calidad se reserva una parte importante al anabolismo en juveniles de la talla estudiada.
Agradecimientos
Este trabajo se realizó gracias al apoyo institucional del Centro de Investigaciones Marinas de la Universidad de La Habana y al premio recibido en el Concurso de Proyectos de Investigación "Alma Mater" 1998. Asimismo se agradece la participación del Lic. Roberto Adriano Padrón en la ejecución de los experimentos y al Dr. Fernando Díaz Herrera del Departamento de Acuicultura y Biotecnología Marina del Centro de Investigación Científica y Educación Superior de Ensenada, B. C., por la revisión crítica del manuscrito.
Referencias
ADAC., 1990. Official methods of analysis. 15 Ed. Association of Official Analytical Chemists. Washington D. C. 1108 p. [ Links ]
Beamish, F. y E. Triple, 1990. Heat increment a static or dynamic dimension in bioenergetics models? Transactions of the American Fisheries Society 119: 649-661. [ Links ]
Bradfield A. E. y D. J. Solomon, 1972. Oxicaloric coefficients for animal respiring nitrogenous substrates. Comparative Biochemistry and Physiology 43A: 837-841. [ Links ]
Brito R., E. Díaz-Iglesias, E. Rodríguez y de R. N. Lima Conceiçao, 1991. Metabolismo energético de postlarvas de langosta Panulirus argus sometidas a diferentes condiciones experimentales. Revista de Investigaciones Marinas, Universidad de La Habana 12(1-3): 312-322. [ Links ]
Brito R. y El Díaz-Iglesias, 1983. Observaciones sobre el consumo de alimentos y su efecto sobre el crecimiento en juveniles de langosta Panulirus argus en el laboratorio. Revista de Investigaciones Marinas, Universidad de La Habana 4(2): 75-90. [ Links ]
Brito, R., M. E. Chimal, G. Gaxiola y C. Rosas, 2000. Growth, metabolic rate and digestive enzyme activity in the white shrimp Litopenaeus setiferus early postlarvae feds differentes diets. Journal of Experimental Marine Biology and Ecology 255(2000): 21-36. [ Links ]
Buesa, R. J., 1979. Oxygen consumption of two tropical spiny lobster Panulirus argus (Latreille, 1804) and Panulirus guttatus (Latreille, 1804) (Decapoda, Palinuridae). Crustaceana 36(1): 99-107. [ Links ]
Carvalho, P. y V. Phan, 1997. Oxygen consumption and ammonia excretion of Xiphopenaeus kroyeri (Penaeidae) in relation to mass temperature and experimental procedures. Shrimp oxygen uptake and ammonia excretion. Journal Experimental Marine Biology Ecology 209(1-2): 143-153. [ Links ]
Castell, J. D. y J. F. Corey, 1976. Dietary lipid requierements of adult lobster, Homarus americanus (M. E). The Journal of Nutrition 106(8): 1159-1165. [ Links ]
Chu, K. y N. N. Ovsianico-Koulikowsky, 1994. Ontogenetic changes in metabolic activity and biochemical composition in the shrimp, Metapenaeus ensis. Journal Experimental Marine Biology Ecology 183: 11-26. [ Links ]
Claybrook, D. L., 1983. Nitrogen Metabolism. In: Mantel, L. H. (Ed.). The Biology of Crustacea. Vol. 5, Internal Anatomy and Physiological Regulation. Academic Press, New York, pp. 163-213. [ Links ]
Colinas F. y P. Briones, 1990. Feeding of the spiny lobsters Panulirus guttatus and Panulirus argus in the Mexican Caribean. Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México 17(1): 89-106. [ Links ]
Company C. y N. Sarda, 1998. Metabolic rates and energy content of deep-sea benthic decapod crustaceans in the western Mediterranean Sea. Deep-Sea Research I 45: 1861-1880. [ Links ]
Conceiçao, R. N., 1993. Biometría, genética-bioquímica y ecofisiología de postlarvas y juveniles de langosta P. argus (Latreille, 1804) (Crustacea: décapoda). Tesis Master en Biología Marina. Centro de Investigaciones Marinas, Universidad de La Habana. [ Links ]
Conceiçao, R. N., G. Espinosa, E. Díaz-Iglesias, M. Báez y R. Díaz, 1995. Genética-bioquímica de los estadios de postlarvas y juveniles de Panulirus argus. I. Heterocigosidad relacionada con actividad metabólica, variaciones morfológicas y factores ambientales. Arqhivos Ciencias Mar, Fortaleza 29(1): 48-53. [ Links ]
Conover, R. J. y E. D. S. Corner, 1968. Respiration and nitrogen excretion by some marine zooplankton in relation to their life cycles. Journal of the Marine Biological Association of the United Kingdom 48: 49-75. [ Links ]
Cox, C., J. H. Hunt, W. G. Lyons y G. E. Davis, 1997. Nocturnal foraging of the Caribbean spiny lobster, Panulirus argus on off shore reef of Florida, USA. Marine Freshwater Research 48: 671-679. [ Links ]
Cruz Izquierdo, R., 1999. Variabilidad del reclutamiento y pronóstico de la pesquería de langosta (Panulirus argus, Latreille 1804) en Cuba. Tesis de Doctorado, Universidad de La Habana, 100 p. [ Links ]
Cruz, R., R. Brito, E. Díaz-Iglesias y R. Lalana, 1986. Ecología de la langosta (Panulirus argus) al SE de la Isla de la Juventud. I. Colonización de arrecifes artificiales. Revista de Investigaciones Marinas, Universidad de La Habana 7(3): 3-17. [ Links ]
Dall, W. y D. M. Smith, 1986. Oxygen consumption and ammonia excretion in fed and starved tiger prawns, Penaeus esculantus Haswell. Aquaculture 55: 23-33. [ Links ]
Díaz-Iglesias, E., y R. Brito, 1987. Efectos de la ablación del complejo neurosecretor peduncular en juveniles de langosta, Panulirus argus. II. Algunos aspectos metabolicos. Revista de Investigaciones Marinas, Universidad de La Habana 8(2): 81-93. [ Links ]
Díaz-Iglesias, E., R. Adriano, M. Báez-Hidalgo y F. Nodas, 2001a. Análisis bioenergético de la alimentación natural en juveniles de la langosta común Panulirus argus (Latreille, 1804):1. Pelecypoda. Revista de Investigaciones Marinas, Universidad de La Habana 22(1): 19-26. [ Links ]
Díaz-Iglesias, E., R. Adriano, M. Báez-Hidalgo y F. Nodas, 2001b. Análisis bioenergético de la alimentación natural en juveniles de la langosta común Panulirus argus (Latreille, 1804): 2. Gasteropoda. Revista de Investigaciones Marinas, Universidad de La Habana 22(1): 27-32. [ Links ]
Díaz-Iglesias, E., R. Adriano, M. Báez-Hidalgo y F. Nodas, 2001c. Análisis bioenergético de la alimentación natural en juveniles de la langosta común Panulirus argus (Latreille, 1804):3. Crustacea. Revista de Investigaciones Marinas, Universidad de La Habana 22(1): 33-38. [ Links ]
Díaz-Iglesias, E., R. Brito y M. Báez-Hidalgo, 2001. Cría de Panulirus argus en condiciones de laboratorio. Revista de Investigaciones Marinas, Universidad de La Habana 12(1-3): 323-331. [ Links ]
Díaz-Iglesias, E., R. N. Conceiçao, R. Brito Perez y M. Báez-Hidalgo, 1996. Consumo de oxígeno y excreción de amoníaco en juveniles de langosta Panulirus argus alimentados con dieta natural: incremento de calor aparente y razón atómica O:N. Revista de Investigaciones Marinas, Universidad de La Habana 17(1): 51-58. [ Links ]
Espinosa, J., A. Herrera, R. Brito, E. Díaz-Iglesias, G. González, D. Ibarzabal y G. Gotera, 1991. Molluscs in the diet of the Caribbean losbter, Panulirus argus. Iberus 9: 127-140. [ Links ]
FAO, 2000. Crónica de la pesca marítima en Cuba. J. A. Baisre. Documento Técnico de Pesca No.394, 27 pp. Roma. [ Links ]
Fox, C., J. Brown y M. Briggs, 1994. The nutrition of prawns and shrimp in aquaculture- a review of resent researsh. In: V. Muir, J; Roberts, R (Eds.). Recent Advances in Aquaculture. Blackwell Science Ltd., Oxford, England, pp. 132-206. [ Links ]
Fraga, I., 1996. Estudios nutricionales en postlarvas de langosta espinosa Panulirus argus. Revista Investigaciones Pesqueras 20(2) 16-21. [ Links ]
Fraga, I., W. Blanco, J. Galindo y M. de Arazoza, 2000. Influencia de la proteína en el crecimiento de juveniles de langosta espinosa Panulirus argus. Marcuba 2000. No. 334, pp. 117, La Habana, Cuba. [ Links ]
Harris, E., 1959. Oceanography pf Long Island Sound. II. The nitrogen cycle in Long Island Sound. Bulletin Bingham Oceanographic Collection 17: 31-65. [ Links ]
Herrera, A., E. Díaz-Iglesias, R. Brito, G. González, G. Gotera, J. Espinosa y D. Ibarzábal, 1991. Alimentación natural de la langosta Panulirus argus en la región de los Indios (Plataforma SW de Cuba) y su relación con el bentos. Revista de Investigaciones Marinas, Universidad de La Habana 12(1-3): 172-182. [ Links ]
Hewitt, D. R. y M. G. Irving, 1990. Oxygen consumption and ammonia excretion of the brown tiger prawn Penaeus esculentus fed diets of varying protein content. Comparative Biochemical and Physiology 96A(3): 373-378. [ Links ]
Hochachka, P., 1990. Desing of Energy Metabolism, Cap. 8. In: C. L. Proser (ed.), Environmental and Metabolic Physiology. Ed. Wiley-Liss, Ney York. [ Links ]
Jayaram, M. y F. Beamish, 1992. Influence of dietary protein and lipid on nitrogen and energy losses in Lake Trout, Salvelinus namaycush. Canadian Journal Fisheries and Aquatic Science 49: 19-29. [ Links ]
Kanazawa, A., 1994. Nutrition and food. In: Phillips , B. F., Cobb, J. S., Kittaka, J. (Eds.) Spiny Lobster Management. UK Blackwell Scientific Publications. London, pp. 483-494. [ Links ]
Kikuchi K., S. Takeda, H. Honda y M. Kiyono, 1991. Effect of feeding on nitrogen excretion of japanese flounder Paralichthys olivaceus. Nippon Suisan Gakkaishi 57(11): 2059-2064. [ Links ]
Kinne, O., 1976. Cultivation of marine organisms. Water quality management and technology. In: Kinne O. (Ed.). Marine Ecology Vol I (2). Wiley-Interscience, New York, pp. 79-300. [ Links ]
Kittaka, J. y E. Ikegami, 1988. Culture of the Palinurid Palinurus elephas from egg stage to puerulus. Nippon Suisan Gakkaishi 54(7): 1149-1154. [ Links ]
Kittaka, J. y K. Kimura, 1989. Culture of the Japanese Spiny Lobster Panulirus japonicus from egg to juvenile stage. Nippon Suisan Gakkaishi 55(6): 963-970. [ Links ]
Kittaka, J., 1988. Culture of the Palinurid Jasus lalandii from egg stage to puerulus. Nippon Suisan Gakkaishi 54(1): 87-93. [ Links ]
Kittaka, J., 1997. Culture of larval spiny lobster: a review of work done in northern Japan. Marine and Freshwater Research 48: 923-930. [ Links ]
Kormanik, G. A. y J. N. Cameron, 1981. Ammonia excretion in animals that breathe water: A review. Marine Biology Letters 2: 11-23. [ Links ]
Lemmens, J., 1994. The western rock lobster Panulirus cygnus (George, 1962) (Decapoda: Palinuridae): the effects of temperature and developmental stage on requirements of pueruli. Journal Experimental Marine Biology Ecology 180: 221-234. [ Links ]
Logan, D. T y C. E. Epifanio, 1978. A laboratory energy balance for the larvae and juvenile of the american lobster Homarus americanus. Marine Biology 47: 381-389. [ Links ]
Lucas, A., 1993. Bioénergétique des Animaux Aquatíques. Masson, Paris, 178 pp. [ Links ]
Marangos Ch., E. Alliot, C. H. Brogren y H. J. Ceccaldi, 1990. Nycthemeral variations of ammonia excretion in Penaeus japonicus (Crustacea, Decapoda, Penaeidae). Aquasculture 4: 383-391. [ Links ]
Martínez Otero, A. y E. Díaz-Iglesias, 1975. Instalación respirométrica para el estudio de la acción de diversos agentes presentes en el agua de mar. Ciencias, Serie 8, Investigaciones Marinas. No. 18, 6 pp. [ Links ]
Mayzaud, P. y R. J. Conover, 1988. O:N atomic ratio as a tool to describe zooplankton metabolism. Marine Ecology Progress Series 45: 289-302. [ Links ]
Parry, G., 1960. Excretion. In: Waterman, A. T. (Ed.). The Physiology of Crustacea I. Academic Press, New York, pp. 341-366. [ Links ]
Perera Bravet, E., E. Díaz-Iglesias, M. Báez-Hidalgo e I. Fraga Castro, 2001 a. Efectos bioenergéticos de la alimentación artificial en juveniles de langosta, Panulirus argus (Latreille, 1804). Revista de Investigaciones Marinas, Universidad de La Habana (en prensa).
Perera Bravet, E., E. Díaz-Iglesias, M. Báez-Hidalgo y F. Nodas, 2001b. Análisis bioenergético de la alimentación natural en juveniles de la langosta común Panulinus argus (Latreille, 1804): 4. Amphineura. Revista de Investigaciones Marinas, Universidad de La Habana. (en prensa).
Perera Bravet, E., E. Díaz-Iglesias, M. Báez-Hidalgo y F. Nodas, 2001c. Análisis bioenergético de la alimentación natural en juveniles de la langosta común Panulirus argus (Latreille, 1804): 5. Echinoidea. Revista de Investigaciones Marinas, Universidad de La Habana . (en prensa).
Regnault, M., 1981. Respiration and ammonia excretion of the shrimp Crangon crangon L.: metabolic response to prolonged starvation. Journal of Comparative Physiology 141: 549-555. [ Links ]
Rosas, C., A. Sánchez, E. Díaz-Iglesias, L. A. Soto, G. Gaxiola, R. Brito, M. Báez-Hidalgo y R. Pedroza. 1995. Oxygen consumption and ammonia excretion of Penaeus setiferus, P. schmitti, P. duorarum and P. notialis postlarvae fed purified test diets: effect of protein levels on substrate metabolism. Aquatic Living Resources 8: 161-169. [ Links ]
Rosas, C., C. Vanegas, I. Tabares y Ramírez, J., 1993. Energy balance Callinectes rathbunae Contreras 1930, floating cages in a tropical coastal lagoon. Journal World Aquaculture Society 24(1): 116-120 [ Links ]
Shmitt, A. y E. Santos. 1998. Ammonia-N efflux rate and nutritional state of juvenile pink shrimp, Penaeus paulensis (Perez-Farfante) in relation to food type. Aquaculture Research 29(7): 495-502. [ Links ]
Stewart, J., M. Brass, R. Carlin y H. Black. 1992. Maximal enzime activities of energy production pathways in the heart, hepatopancreas, and white muscle of the gigant scallop (Placopecten magellanicus) and lobster (Homarus americanus). Canadian Journal of Zoology 70(4): 720 - 724. [ Links ]
Taboada, G., G. Gaxiola, T. García, R. Pedrosa, A. Sanchez, L. A. Soto y C. Rosas. 1998. Oxygen consumption and ammonia-N excretion related to protein requirement for growth of white shrimp, Penaeus setiferus (L.) juveniles. Aquaculture 29: 1-11. [ Links ]
Waterman, T. H., 1960. The Physiology of Crustacea. Vol. 1: Metabolism and Growth. Academic Press, N. Y. [ Links ]
Winberg, G. G., 1956. Rate of metabolism and food requeriments of fishes. Russian. Eng. Transl. Fisheries Research Board Canada, Translation Series, No. 194. FRBC. [ Links ]
Zar, J. H., 1996. Biostatistical Abalysis, 4/e. Prentice Hall, 929 pp. [ Links ]
Zoutendyk, P., 1987. Nitrogen excretion by the cape rock lobster Jasus lalandii and its possible contribution to the inshore Bengela System. South African Journal Marine Science 5: 565-574. [ Links ]
Zuñiga, O., 1983. Distribución de la energía en juveniles Penaeus brasiliensis alimentados con dietas diferentes. Ciencia y Técnica del Mar 7: 27-45. [ Links ]