Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Hidrobiológica
versión impresa ISSN 0188-8897
Hidrobiológica vol.10 no.2 Ciudad de México dic. 2000
Artículos
Presencia de los géneros Vibrio y Salmonella, y detección de coliformes fecales en almejas del Golfo de México
Elsa Irma Quiñones-Ramírez1, Carlos Vázquez-Salinas2, Francisco F. Pedroche3, L. Moreno-Sepúlveda1 y O. R. Rodas-Suárez1
1 Departamento de Microbiología, Escuela Nacional de Ciencias Biológicas, Instituto Politécnico Nacional; Carpio y Plan de Ayala S/N, Col. Santo Tomás, México, D. F. 11340.
2 Departamento de Biotecnología, C. B. S., UAM-Iztapalapa. Apdo. Postal 55-535, México, D. F. 09340.
3 Departamento de Hidrobiología, C. B. S., UAM-Iztapalapa. Apdo. Postal 55-535, México, D. F. 09340.
Recibido: 14 de enero de 2000
Aceptado: 14 de septiembre de 2000
Resumen
Los moluscos bivalvos, por su tipo de alimentación y por las zonas elegidas para su cultivo, pueden ser un vehículo de transmisión de microorganismos patógenos. Un total de 260 muestras de almejas obtenidas a lo largo de un ciclo anual, en la porción norte del Estado de Veracruz, Golfo de México, se estudiaron para determinar la presencia de Salmonella spp., Vibrio cholerae y organismos coliformes fecales. La metodología usada fue la recomendada por el Manual de Bacteriología Analítica de la Administración de Alimentos y Medicamentos (BAM-FDA). Del total de las muestras analizadas, en el 7% se aisló Vibrio cholerae 01 Inaba toxigénico, Salmonella spp. en el 11%, Vibrio cholerae no 01 en el 21.5% y el 100% de las almejas presentó coliformes fecales. Durante todo el período de muestreo, fue posible aislar a los microorganismos en estudio, teniendo la mayor contaminación en los meses de verano. La presencia de organismos patógenos manifiesta la contaminación y el riesgo del consumo de estos productos. La incidencia de organismos coliformes fecales señalan por lo general asentamientos humanos mal planificados que facilitan la contaminación del agua con heces.
Palabras clave: Vibrio cholerae, Salmonella, almeja, coliformes fecales, Golfo de México.
Abstract
In general, because the areas chosen for growing them and because the way they feed, mollusks are important vectors in the transmission of several diseases to humans. Among these diseases is cholera. In this study isolation and identification of Salmonella spp.; Vibrio cholerae, and fecal coliforms were carried in 260 clams collected during a year from the northern coast of Veracruz state, Gulf of Mexico. Baseline methods included those recommended by the Bacteriological Analytic Manual (BAM-FDA). Vibrio cholerae 01 was found in 7% of the samples, Salmonella spp. in 9%, and Vibrio no 01 in 22%. Besides, fecal coliforms were detected in all samples (100%). Summer was the time with higher presence of all the microorganisms; even they existed all year around. Pathogenic bacteria in clams make their consumption risky to public health. The detection of fecal coliforms in water shows the existence of non-well planned human settlements and activities around water reservoirs in Atlantic coast of Mexico.
Key words: Vibrio cholerae, Salmonella, clams, fecal coliforms, Gulf of Mexico.
Introducción
Se ha reconocido que los brotes de tifoidea, cólera, disentería y varias formas de gastroenteritis se adquieren por la ingestión de agua o alimentos contaminados, tal es el caso de algunos moluscos bivalvos (Brown y Dorn, 1977; Wood, 1979). Estos organismos se encuentran ampliamente distribuidos en las costas de los mares, estuarios y diversos cuerpos acuícolas, muchas de las veces y por razones antropogénicas, representando áreas con alto contenido de materia orgánica. Estas actividades incluyen el derrame de aguas residuales de zonas de cultivo o bien de calidad doméstica, en las cuales el contenido de heces es elevado. La posibilidad de que estas heces provengan de enfermos o portadores de diversas enfermedades gastrointestinales es alto. De esta forma, el porcentaje de las bacterias patógenas, como las pertenecientes a los géneros: Salmonella, Shigella y Vibrio, en especial V. cholerae, V. parahaemolyticus, otros vibrios y Escherichia coli, en moluscos es alarmante (Andrews et al., 1975; De Paola et al., 1990; Reily y Twedt, 1992; Wood, 1979).
Los moluscos en general poseen una alimentación por filtración. Este sistema de nutrición permite que se acumule una gran cantidad de microorganismos y otros elementos presentes en el ambiente donde los bivalvos se desarrollan. El consumo de bivalvos bajo estas condiciones ha sido la causa de un gran número de casos de enfermedades entéricas (Brawn y Dorn, 1977). Por supuesto que este riesgo se potencializa durante la comercialización y las operaciones de manejo (Wood, 1979). En el caso concreto de las almejas, estas pueden estar implicadas en la transmisión de cólera, salmonelosis y otras enfermedades gastrointestinales, esto aunado a la costumbre de ingerir estos organismos directamente en su concha, crudos o cocinados deficientemente.
Vibrio cholerae se encuentra con frecuencia en el sedimento en suspensión de aguas superficiales de diversos cuerpos acuíferos, así como en el contenido intestinal de animales marinos, en donde se puede considerar autóctono. Esta bacteria no se encuentra en alta mar aunque está presente en las regiones costeras o estuarios, sobre todo, en algunas áreas geográficas en donde el padecimiento del cólera es endémico o epidémico. La presencia de este microorganismo no se encuentra en función de los indicadores de contaminación fecal (De Paola et al., 1984). Su sobrevivencia está asociada a las condiciones ambientales de pH, salinidad, materia orgánica y temperatura del agua (Kaysner et al., 1987).
Por otra parte, la persistencia de V. cholerae en los moluscos, aún y cuando se sometan a una depuración, puede deberse a la hipótesis de que esta bacteria es aglutinada por la hemolinfa y el tejido del bivalvo. Esta reacción de aglutinación ha sido demostrada para todos los serotipos de V. cholerae en ostiones colectados tanto en el Golfo de México como en las costas del Atlántico. (Tamplin y Fisher, 1989).
En cuanto al género Salmonella, es uno de los patógenos más estudiados como causante de brotes de intoxicación alimentaria por el consumo de alimentos crudos o procesados. La tasa de mortalidad por salmonelosis se sitúa alrededor del 4.1% lo que hace que continúe siendo una de las formas más serias de infecciones entéricas en el humano, observándose en el ámbito mundial un marcado incremento en los últimos años (Maguire et al., 1993).
Si consideramos que el hábitat principal de Salmonella spp. es el conducto intestinal de animales, resulta pues lógico que los cuerpos acuícolas con asentamientos humanos se encuentren contaminados y por ende los productos que ahí se capturan. Cerca del 5% de las personas que sufren salmonelosis son portadoras por un tiempo considerable y pasan a ejercer un papel muy importante en la diseminación, especialmente si participan en la cadena de producción y comercialización de los alimentos (OPS, 1993).
Los análisis microbiológicos que se llevan a cabo para detectar microorganismos patógenos, constituyen un medio importante para proteger al consumidor y de asegurar que se está adquiriendo un producto libre de microorganismos patógenos. A diferencia de Vibrio cholerae, la determinación de otros patógenos que pudieran estar presentes en una muestra se puede estimar mediante la existencia de ciertos microorganismos indicadores como es el caso de las bacterias coliformes (Conell, 1988).
Por lo general, los estudios de detección de estos patógenos se han realizado profusamente en ostiones y peces, pero pocos han abordado su evaluación en otro grupo de moluscos que se consume ampliamente en diversas costas del mundo. Este grupo son las almejas de diversas especies. Por lo tanto, el propósito del presente trabajo fue realizar un estudio prospectivo sobre la presencia de Salmonella spp., Vibrio cholerae y organismos coliformes fecales (OCF) en varios representantes de estos moluscos que se comercializan en México. Para ello se eligió como región de estudio la porción norte del estado de Veracruz en el Golfo de México.
Debido a su carácter prospectivo el estudio es genérico (no desde el punto de vista taxonómico) y evalúa la importancia de las almejas como grupo potencial de contagio. Estudios posteriores deberán de profundizar en las diferencias, si estas existen, entre las diversas especies involucradas o entre varias regiones que permiten plantear soluciones o estrategias para enfrentar estos males.
Material y métodos
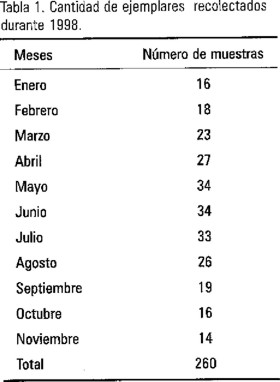
Doscientas sesenta (260) muestras de almejas fueron recolectadas mensualmente de enero a noviembre de 1998 en la porción norte del Estado de Veracruz. Los números mensuales variaron de acuerdo a la disponibilidad de organismos (Tabla 1). Cada muestra se colocó en bolsas de plástico en forma independiente, evitando su contacto. Los organismos fueron congelados empleando hielo seco y transportados en recipientes térmicos. El tiempo transcurrido entre su recolección y análisis no fue mayor de 10 horas. Los intervalos óptimos de temperatura en el caso concreto de este trabajo fueron entre 18 y 22°C y una salinidad no menor a 20 ppm.
Con el fin de que los resultados pudieran ser evaluados comparativamente, se utilizó la metodología recomendada por el Manual de Bacteriología Analítica de la Administración de Alimentos y Medicamentos (BAM-FDA) (USFDA, 1992).
Cada uno de los bivalvos que conformó la muestra, se desconchó en forma aséptica, de acuerdo a lo que marca el BAM-FDA, y el tejido se homogeneizó empleando una licuadora comercial estéril. Se pesaron 50 g y se colocaron en 450 mililitros de cada uno de los caldos de enriquecimiento empleados, para tener una dilución inicial de 1:10.
Aislamiento e identificación de Salmonella
La primera dilución (1:10) en caldo lauril sulfato triptosa, se incubó por 24 horas a 37°C. Posteriormente se transfirieron 10 ml a frascos que contenían 90 ml de caldo selenito y caldo tetrationato, se mezcló cuidadosamente y se incubó a 43°C por 18 h. Transcurrido este tiempo se sembró por estría cruzada en medios selectivos: agar verde brillante, agar xilosa lisina desoxicolato y agar Mac Conkey. La incubación se realizó a 35-37°C por 18-24 horas.
Para la identificación bioquímica se seleccionaron nueve colonias características (tres colonias por agar) para hacer pruebas bioquímicas presuntivas (agar triple azúcar-hierro y lisina descarboxilasa) y confirmatorias (caldo malonato, RM-VP [caldo rojo de metilo Vogues Proskauer], urea, SIM [sulfhídrico indol y movilidad], agar citrato de Simmons, ONPG [o–nitrofenil–b-D-galactopiranosidol]).
Se realizaron pruebas serológicas mediante la aglutinación con sueros polivalentes "O". Para su confirmación se enviaron al Instituto de Diagnóstico y Referencia Epidemiológica (INDRE) de la Secretaría de Salud.
Aislamiento e identificación de Vibrio cholerae
De la primera dilcución (1:10) con agua peptonada alcalina (pH 9.8-9), se hicieron diluciones decimales por duplicado hasta 106. Una serie se incubó a 35-37°C y otra a 42°C por 6 y 19 h. Pasado este tiempo se transfirió una asada de cada dilución a placas de TCBS (agar tiosulfato citrato sacarosa sales biliares), las que se incubaron a 35-37°C por 24 horas.
De las placas de TBCS se sembraron tres colonias con características morfológicas de V. cholerae, en T1N1 (agar triptona con cloruro de sodio al 1%). A las colonias que se desarrollaron en ambos medios se les realizó la prueba presuntiva del hilo mucoide y oxidasa. Las pruebas bioquímicas confirmatorias se hicieron mediante el sistema API-20E (BioMerieux®).
Se llevó a cabo una serotipificación por aglutinación con el suero polivalente y monovalentes 01 Inaba y Ogawa y se determinó su toxicidad mediante la técnica de RPLA (aglutinación pasiva inversa con látex sensibilizado). Para ello se sembraron los aislados en agar infusión cerebro corazón (ABHI) y se incubaron por 24 h a 35-37°C. A partir del crecimiento en ABHI, cada uno de los aislados se inocularon en 5 ml de caldo Craing (CC) y se incubaron a 30°C por 48 horas. El cultivo se centrifugó en refrigeración (4°C) por 10 minutos a 10,000 rmp, para sedimentar las células bacterianas. Se retiró el sobrenadante con una pipeta Pasteur y se almacenó a 4°C cuando se utilizó en un máximo de 7 días, y a -70°C cuando el tiempo para su uso fue mayor de 7 días. El mismo seguimiento se hizo a una cepa de Vibrio cholerae 01 toxigénico y de no toxigénico aislados de ostiones que sirvieron como testigos en la prueba.
La prueba de aglutinación inversa se realizó utilizando el reactivo VET-RPLA. Para cada muestra se emplearon dos columnas (ocho pozos por columna), en las que se depositaron 25 ml de solución salina amortiguada (PBS) en cada pozo, excepto en el primero de cada columna. Se agregaron 25 ml de cada muestra problema y testigo en el primero y segundo pozo de cada grupo de dos columnas de una placa de 96 pozos de fondo en U. A partir del segundo pozo de cada columna se tomaron 25 ml y se realizaron diluciones al doble. Los 25 ml del séptimo pozo se desecharon, de tal forma que el octavo pozo sólo contenía el diluyente. Se agregaron 25 ml de látex sensibilizado a cada pozo de la primera columna, para cada sobrenadante de prueba y testigo. Se agregó 25 ml de látex testigo no sensibilizado a cada pozo de la segunda columna para cada sobrenadante de prueba y testigo. Se mezclaron agitando la microplaca y ésta se colocó a temperatura ambiente por 20-24 horas. La presencia de la toxina del cólera causó la formación de una estructura reticular, que al sedimentar formó una capa difusa en el fondo del pozo, esto se observó en contra de un fondo oscuro. Este método en lo general se ajusta a lo sugerido por CDC/NCID (1994).
Aislamiento para organismos coliformes fecales (NMP)
Con la finalidad de complementar el estudio fue identificada también la presencia de organismos coliformes fecales mediante la técnica del Número Más Probable (NMP). A partir de la primera dilución en agua peptonada al 0.1%, se llevaron a cabo diluciones decimales hasta 106. Consideramos que ya que los ejemplares podían venir dañados, debido al transporte en hielo seco, deberíamos hacer la primera dilución en un amortiguador que no afectara aún más, siguiendo las recomendaciones de Hitchins et al. (1992), en lugar de utilizar un regulador salino como lo marca BAM. De cada dilución se tomó una alícuota de un mililitro y se transfirió a tubos que contenían caldo lauril sulfato triptosa, se utilizaron cinco tubos por cada dilución (serie 5/5/5). La incubación fue a 35-37°C por 24-48 horas. Para la producción de gas, los tubos negativos se incubaron 24 horas más. De los tubos positivos se sembró una asada a tubos que contenían caldo EC (Escherichia coli), incubándolos a 44.5 +/- 0.2°C en baño de agua por 24-48 horas. La lectura se hizo en tablas específicas para conocer el NMP/g de CF.
Resultados
Los resultados obtenidos del análisis de 260 muestras de almejas (Tabla 1), indican que en el 21.5% se encontró Vibrio cholerae no 01, el 7% contenía Vibrio cholerae 01 Inaba toxigénico, en el 11% se aisló Salmonella spp. y en el 100% se determinó la presencia de los organismos coliformes fecales. El contenido, de este grupo indicador de contaminación fecal en los moluscos bivalvos estudiados fue entre 101 a 106 NMP/g (Tabla 2).
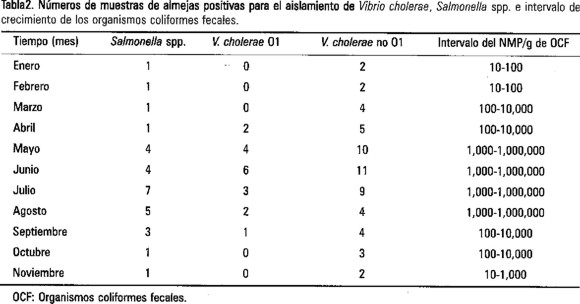
Las diversas especies de Salmonella aquí encontradas fueron: S. anatum, S. arizonae, S. choleraesuis, S. houtenae, S. edimburg, S. enteritidis, S. typhimurium, S. agona, S. gallinarum.
El patrón de crecimiento muestra un incremento desfasado entre los diferentes microorganismos, aunque en lo general se puede apreciar que durante el verano, el porcentaje de todos ellos aumenta considerablemente (Figura 1).
Vibrio cholerae se aisló durante todos los meses en que se llevó a cabo el estudio, incrementándose la contaminación durante los meses más calurosos. V. cholerae 01 Inaba toxigénico, fue más evidente durante los meses de abril a septiembre. En lo que se refiere a V. cholerae no 01 llegó a un máximo durante los meses de junio y julio. En cuanto Salmonella spp. se inicia su detección a partir del mes de enero, aumentando su presencia de acuerdo al patrón general (Figura 1, Tabla 2).
Todos los microorganismos de estudio alcanzan sus números en noviembre (Figura 1). En cuanto a los organismos coliformes fecales, estos muestran también el comportamiento general ya señalado para los otros microorganismos (Tabla 2).
Discusión
La importancia del aislamiento de V. cholerae en almejas, se suma a la ya conocida problemática de la salud pública en México por el consumo generalizado, en forma cruda o con una cocción ineficiente, de los productos de la pesca en diversas partes del país.
Las especies de Salmonella aisladas en las muestras de almejas estudiadas no sólo confirma que México es una zona endémica de salmonelosis sino señalan que las gastroenteritis entre la población que comercializa el producto y las personas que lo consumen juegan un papel muy importante en la diseminación de la enfermedad.
El género Salmonella es uno de los principales causantes de casos de mortalidad por las complicaciones en los pacientes, la tasa se sitúa alrededor del 4% y cerca del 5% de las personas que sufren la enfermedad son portadoras por un tiempo considerable (OPS, 1993).
El haber determinado la presencia de los organismos coliformes fecales en estos alimentos, indica una contaminación proveniente de una fuente terrestre (CIEMA, 1985). Desde el punto de salud pública la presencia de este grupo indicador es importante por su relación con bacterias patógenas provenientes de animales de sangre caliente (Fapohunda et al., 1994). La sobrevivencia de los coliformes depende de la concentración de sales, competición con la microbiota y los nutrientes (Hood y Ness, 1982).
En un estudio llevado a cabo por Eyles y Davey (1988) se encontró que el 20% de las muestras de ostiones (género Crassostrea), presentaron V. cholerae, Salmonella y E. coli. Estos autores encontraron también que el mayor número de aislamiento fue de vibrios no 01 y el contenido de E. coli como representante de los coliformes fue de 7.3%. En comparación, el 72% de los ostiones obtenidos en la Central de Abastos de Pescados y Mariscos "La Viga" de la Ciudad de México, contenían V. cholerae y el 3%, V. cholerae 01 Inaba toxigénico (Vázquez-Salinas et al., 1994).
La mayoría de los alimentos marinos son capturados en aguas próximas a la costa o en cuerpos acuícolas donde los asentamientos humanos son irregulares y junto con las operaciones primarias de manipulación a las que están sujetos, pueden llevar una biota patógena adventicia procedente de aguas de desecho. Esta biota provoca enfermedades gastrointestinales las cuales tienen una alta morbilidad a nivel mundial (Blake, 1994).
La dinámica presentada por los microorganismos estudiados sigue en lo general la de muchos organismos acuáticos presentes en las lagunas costeras tropicales. La época de verano incluye un aumento en las temperaturas medias, y en el caso del Golfo de México, la presencia de los vientos alisios y grandes cantidades de precipitación pluvial y el aumento de la fluvial trae consigo la disminución de la salinidad y movimientos en las masas de agua (Groen, 1967; De la Lanza et al., 1998).
Estos cambios motivan un intercambio más pronunciado entre las fases del cuerpo acuático. Por una parte los sedimentos, con grandes contenidos de materia orgánica y microorganismos, se distribuyen con mayor homogeneidad en la columna de agua. La disminución de la salinidad interfiere con el efecto bactericida que controla la cantidad de diversos habitantes, que aunque presentes en el agua, se encuentran en números bajos en las otras épocas del año. Por lo general en cuerpos de agua semejantes, la presencia de microorganismos patógenos se registra en la época de lluvias (Becerra Tapia y Botello, 1995).
El aumento de temperatura favorece la visibilidad e incrementa el ritmo de reproducción en muchos de los residentes de las lagunas tropicales. Aparentemente esta podría ser también la causa del incremento en las poblaciones de los microorganismos. Un caso característico es el fin del fitoplancton que aumenta su diversidad y su biomasa (Russell-Hunter, 1970; Castillo Treviño, 1985; Contreras, 1988; Santoyo Reyes, 1994), produciendo florecimientos no sólo de algas verdes sino también de cianobacterias. Como consecuencia, el resto de los integrantes de las redes tróficas proyectan también crecimientos diferentes a los de otras épocas del ciclo anual.
Desde hace algún tiempo se ha demostrado, por medio de epifluorescencia, que los microorganismos patógenos se adhieren a las superficies externas y en algunos casos internas, del zooplancton e incluso en el fitoplancton (Brayton et al., 1987; Tamplin et al., 1990). Esta condición aparentemente provee de substrato y de nutrientes a las bacterias, sobre todo en condiciones ecológicas adversas. Aunque seguramente la estancia de las bacterias es temporal, esto podría ser una explicación para la permanencia, más o menos constante, en el medio acuático de lagos y lagunas costeras de Salmonella y Vibrio, asegurando de esta manera que los moluscos y otros filtradores estén continuamente expuestos a los patógenos estudiados. Pues como se ha podido constatar en el presente estudio, su existencia se registra durante todo el año.
Otra explicación puede ser que la condición de los cuerpos de agua de donde provienen las muestras, presentan en términos microbiológicos, la denominación de áreas con endemia resultado del efecto humano con aportaciones constantes por parte de individuos portadores y enfermos. Esto se incrementa con las contribuciones de las descargas domésticas y por el arrastre del agua de lluvia sobre terrenos que han servido como reservorios del material fecal.
La presencia de los microorganismos aislados durante esta investigación, es lógica si consideramos que las actividades antropogénicas y por consiguiente la existencia de animales domésticos en el entorno de los cuerpos acuícolas generalmente no son planificados y se carece de infraestructura para las descargas domésticas, por lo que se vierten directamente a la costa o por el fecalismo al aire libre. El presente escrito representa uno de los escasos trabajos que se han realizado en almejas y comprueba que la zona costera del Atlántico mexicano es un área de alto riesgo y que necesariamente se requiere de un programa de monitoreo sostenido y no solo dirigido a los productos convencionales y de mayor distribución.
Literatura citada
Andrews, W. H., C. D. Diggs, M. W. Presnell, J. J. Miescier, C. R. Wilson, C. P. Goodwin, W. N. Adams, S. A. Furfari y J. F. Musselman, 1975.Comparative validity of members of the total coliform and fecal groups for indicating the presence of Salmonella in the eastern oyster, Crassostrea virginica. Journal of Milk and Food Technology 38: 453-458. [ Links ]
Becerra Tapia, N. y A. V. Botello, 1995. Bacterias coliformes totales, fecales y patógenas en el sistema lagunar Chantuto-Panzacola, Chiapas, México. Hidrobiológica 5: 87-94. [ Links ]
Blake, P. A., 1994. Historical perspectives on pandemic cholera. pp. 293-295. En: Wachsmuth, I. K., P. A. Blake y O. Olsvik (Eds.). Vibrio cholerae and cholera: molecular global perspectives. ASM Press, Washington, D. C. [ Links ]
Brayrton, P. R., M. L. Tamplin, A. Huq y R. R. Colwell, 1987. Enumeration of Vibrio cholerae 01 in Bangladesh waters by fluorescent-antibody direct viable count. Applied and Environmental Microbiology 53: 2862-2865. [ Links ]
Brown, L. D. y C. R. Dorn, 1977. Fish shellfish and human health. Journal of Food Protection 40: 712-717. [ Links ]
Castillo Treviño, A. G., 1985. Productividad primaria en la laguna de Pueblo Viejo, Ver. en el período Mayo-Octubre de 1982. Tesis de Licenciatura, Facultad de Ciencias, UNAM, México. 85 p. [ Links ]
Centro para el Control y la Prevención de Enfermedades; Centro Nacional de Enfermedades Infecciosas (CDC/NCID), 1994. Métodos de laboratorio para el diagnóstico de Vibrio cholerae. Organización Panamericana de la Salud, Washington, D. C. pp. 90-91. [ Links ]
Comisión Internacional de Especificaciones Microbiológicas para Alimentos (CIEMA), 1980. Pescados Mariscos y sus Productos, pp. 573-612. En: Ecología Microbiana de los Alimentos; Vol. 2. Productos Alimenticios. Acribia. Zaragoza, España. [ Links ]
Connell, J.J., 1988. Calidad intrínseca. pp. 43-47. En: J. J. Connell (Ed.). Control de la calidad del pescado. Acribia, Zaragoza. [ Links ]
Contreras, F., 1988. Las lagunas costeras mexicanas. 2a. Ed. Centro de Ecodesarollo y Secretaría de Pesca. México, D. F., 263 p. [ Links ]
De la Lanza, E. G., N. Sánchez Santillán y A. Esquivel H., 1998. Análisis temporal y espacial fisicoquímico de una laguna tropical a través del análisis multivariado. Hidrobiológica 8: 89-96. [ Links ]
De Paola, A., L. H. Hopkins, J. T. Peeler, B. Wentz y R. M. McPherson, 1990. Incidence of Vibrio parahaemolyticus in US coastal waters and oyster. Applied and Environmental Microbiology. 56: 2299-2302. [ Links ]
De Paola, A., M. W. Presnell, R. E. Backer, M. L. Mptes Jr., S. R. Zywno, J. F. Musselman, J. Taylorand y L. Williams, 1984. Distribution of Vibrio cholerae in the Apalachicola (Florida) bay estuary. Journal of Food Protection 47: 549-553. [ Links ]
Eyles, M. J. y G. R. Davey, 1988. Vibrio cholerae and enteric bacteria in oyster producing areas of two urban estuaries in Australia. International Journal of Food Microbiology 6(3): 207-218. [ Links ]
Fapohunda, A. O., K. W. McMillin, D. L. Marshall y W. N. Waites, 1994. Growth of selected cross-contaminating bacterial pathogens on beef and fish at 15-35°C. Journal of Food Protection 57: 337-340. [ Links ]
Groen, P., 1967. Physical hydrology of coastal lagoons. pp. 275-280. En: Ayala Castañares, A. y F. B. Phleger (Eds.). Lagunas costeras, un simposio. UNAM, México. [ Links ]
Hitchins, A. D., P. A. Hartman y E. C. Todd, 1992. Coliforms-Escherichia coli and its toxins. En: Vanderzant, C. y D. F. Splittstoesser (Eds.). Compendium of methods for the microbiological examination of foods. 3a Ed. American Public Health Association, New York. 336 p. [ Links ]
Hood, M. A. y G. E. Ness, 1982. Survival of Vibrio cholareae and Escherichia coli in estuarine waters and sediments. Applied and Environmental Microbiology 43: 578-584. [ Links ]
Kaysner, C. A., 1981. Incidence of Vibrio algynolyticus an bacteria of sanitary significance in the Bering sea. Applied and Environmental Microbiology 41: 1279-1282. [ Links ]
Maguire, H. C. F., A. A. Codd, V. E. Mackay, B. Rowe y E. Mitchell, 1993. A large outbreak of human Salmonella traced to local pig farm. Epidemiology and Infection 110: 239-246. [ Links ]
Organización Panamericana de la Salud (OPS), 1993. Evaluación microbiológica de los alimentos vendidos en la vía pública en algunas ciudades de América Latina y el Caribe y, mediante su consumo, del riesgo epidemiológico de contraer toxiinfecciones. Organización Mundial de la Salud. Washington, D. C. 148 p. [ Links ]
Reilly, E. J. A. y D. R. Twedt, 1992. Salmonella and Vibrio cholerae in brackiswater cultured tropical prawns. International Journal of Food Microbiology 16: 293-301. [ Links ]
Russell-Hunter, W. D., 1970. Aquatic productivity: an introduction to some basic aspects of biological oceanography and limnology. MacMilan & Collier Pub., New York. 306 p. [ Links ]
Santoyo Reyes, H., 1994. Fitoplancton y productividad. pp. 221-245. En: De la Lanza, G. y C. Cáceres (Eds.). Lagunas costeras y el litoral mexicano UABCS, La Paz, México. [ Links ]
Tamplin, M. L. y W. S. Fisher, 1989. Occurrence and characteristics of agglutination of Vibrio cholerae serogroup 01 to zooplankton and phytoplankton of Bangladesh waters. Applied and Environmental Microbiology 56: 1977-1980. [ Links ]
USFDA. Food and Drug Administration, 1992. Bacteriological analytical manual for foods. Association of Official Analytical Chemistry, C. L. F. Washington, D. C. [ Links ]
Vázquez-Salinas, C., C. Castro-Martínez, E. I. Quiñones-Ramírez, G. Salazar-Gómez y G. Lugo, 1994. Investigación de Vibrio cholerae en moluscos bivalvos. Oceanología 1: 127-132. [ Links ]
Wood, P. C., 1979. Manual de higiene de los moluscos. Factores del medio marino que influyen sobre la higiene de los moluscos. Acribia. Zaragoza, España. 135 p. [ Links ]














