NANOPARTÍCULAS: SÍNTESIS Y APLICACIONES
El desarrollo de la nanotecnología aumenta continuamente la disponibilidad de nanomateriales, con aplicaciones en áreas cada vez más diversas. Los nanomateriales se pueden definir como aquellos en los que alguna de sus dimensiones se encuentra entre 1 y 100 nm, presentando distintas formas y materiales, en correspondencia con su aplicación. Los nanomateriales suelen clasificarse respecto a cuantas de sus tres dimensiones espaciales se encuentren en escala nanométrica, por ejemplo: 0D (puntos cuánticos y nanopartículas), 1D (nanotubos), 2D (nanopelículas) y 3D (policristales) (Numan 2021). Otro criterio de clasificación de los nanomateriales depende del método de obtención: de manera natural, es decir, que son formados sin intervención del hombre y los manufacturados. Los fenómenos naturales como erupciones volcánicas, fuegos forestales, polvos minerales, erosión del suelo o polvos de fuentes cósmicas o desiertos, pueden ser orígenes de nanomateriales (Maiti 2015), además de la condensación y cristalización a través de neblina o precipitaciones (Mohamed et al. 2021). Los nanomateriales manufacturados pueden clasificarse de forma general de acuerdo con los métodos de síntesis, por ejemplo, abajo-arriba (bottom-up) si son construidos a partir de síntesis química o nucleación, es decir, de abajo hacia arriba; o arriba-abajo (top-down) si son sintetizados a partir de macromateriales hasta alcanzar escalas menores, de arriba hacia abajo (Saleh 2020).
Dentro de los nanomateriales, las nanopartículas son ampliamente utilizadas en distintas áreas por sus propiedades ópticas, electroquímicas y mecánicas. Las nanopartículas son clasificadas por su composición, como orgánicas e inorgánicas. Las primeras, entre las que destacan dendrímeros, micelas, liposomas, partículas poliméricas, polímero-cápsulas, ferritina y polímeros mesoporos, suelen estar construidos a base de moléculas orgánicas, mientras que las segundas, entre las que se incluyen, puntos cuánticos, partículas paramagnéticas, superparamagéticas, óxido metálicas y metálicas suelen estar constituidas por Au, Cu, Ag, Zn, Pb, Co, Cd, Al2O3, SiO2, Fe2O3, TiO2, CuO, CdSn, ZnO y ZnS (Ijaz et al. 2020).
Entre la amplia variedad de métodos de síntesis de nanopartículas, físicos, químicos, mecánicos o biológicos, se encuentran el electrodepósito, generación de aerosoles, pulverización mecánica/catódica, pirólisis láser/espray, sol-gel, depósito químico de vapor, condensación atómica/molecular, ablación láser, síntesis química, y la síntesis verde como una alternativa a esta última (Saleh 2020), que puede incluir microorganismos, plantas y biopolímeros (Manivasagan et al. 2016, Sun et al. 2017, Singh et al. 2018). Los distintos métodos de obtención de nanopartículas varían de acuerdo con la compatibilidad del material y sus propiedades eléctricas, químicas, físicas y mecánicas, así como de su estabilidad, contención e identificación en el medio de dispersión (Baig et al. 2021). Además de dichas propiedades, la elección del método de síntesis dependerá también del tipo de uso que se le dará y si se realizará funcionalización a través de algún método adicional, entre los que destacan, los de adsorción, retención, adsorción con entrecruzamiento, atrapamiento, copolimerización o enlaces covalentes, entre otros (Thangudu 2020).
En particular, la aplicación de nanopartículas metálicas es muy amplia y ha sido determinante en los últimos desarrollos de nano marcadores, como medios de transporte de fármacos o material genético, así como en el desarrollo de sensores, catalizadores, recubrimientos y dispositivos electrónicos, y en el progreso de la investigación sobre remediación, remoción, filtración, restauración, conducción, encapsulación y magnetismo (Ealia y Saravanakumar 2017). Los inventarios que describen el estatus de uso de nanomateriales en el mercado, refieren que alrededor del 37 % de éstos incluyen metales y óxidos metálicos en su fabricación (Vance et al. 2015) y que dentro de los materiales nanoestructurados, las nanopartículas son las más producidas (StatNano 2021). Este incremento en el uso de nanomateriales en la industria y en productos comerciales realza la importancia de conocer sus procesos de fabricación y su disposición final.
La exposición de los seres vivos a nanopartículas liberadas al ambiente puede ocurrir de diversas formas, por ejemplo, durante los procesos de fabricación o al finalizar el ciclo de vida de los productos. Además de la descarga directa, las nanopartículas pueden redistribuirse entre distintos medios a través de fenómenos naturales, como el caso de la captación desde la atmósfera y posteriormente el escurrimiento pluvial. Para entender este tipo de dinámicas, se requiere conocer la composición de los materiales, su estabilidad y carga superficial, la complejidad de los enlaces y la velocidad de degradación de cada uno de sus componentes (Ubaid et al. 2020, Mohamed et al. 2021).
NANOPARTÍCULAS PRESENTES EN LA ATMÓSFERA
Las partículas presentes en la atmósfera han sido clasificadas por su tamaño, destacando las PM10, con diámetros comprendidos entre a 2.5 y 10 µm, y las PM2.5, con diámetros menores a 2.5 µm. En particular, las partículas ultrafinas, menores que 0.1 µm, son de especial interés por su incidencia y los efectos que pueden provocar a la salud y al ambiente (Caudillo et al. 2020), se estima que estos nanomateriales aportan alrededor del 36 % de las partículas atmosféricas (Mohamed et al. 2021). Entre los años de 1990 a 2000, la mayor parte de la investigación estuvo centrada en el desarrollo y la producción de nanopartículas, sin visualizar el rápido incremento en la concentración de éstas en la atmósfera (Srivastava et al. 2015). A partir de la investigación de aerosoles, se han clasificado las partículas aéreas de acuerdo con criterios relacionados con las fuentes de emisión, masa, dimensiones, composición química, mecanismos de formación y distribución de tamaños, a partir de combinaciones de dichos criterios se han definido “modas” (nucleación Aitken, modo de acumulación, modo grueso) (Kumar et al. 2010).
Nanopartículas generadas por el sector automotriz
Es ampliamente conocido que gran parte de las partículas contaminantes en entornos urbanos son generadas por el sector automotriz, estimándose que comprenden alrededor del 77 % de las PM10 y, considerando el total de partículas, el 86 % corresponde a nanopartículas (Kumar et al. 2010). Los vehículos de motor de combustión continúan siendo el principal método de movilidad. La mayoría de las partículas emitidas por vehículos que funcionan con diésel, tienen tamaños inferiores a 130 nm y aquellas de los vehículos a gasolina son de tamaños inferiores a 60 nm; y más aún, aunque se ha popularizado el uso de biocombustibles por sus ventajas en la disminución de gases de efecto invernadero como CO, CO2 y HC, tienen como desventaja la alta emisión de partículas que son difíciles de detectar por tener dimensiones 10 veces menores a las originadas por gasolina y biodiesel (Kumar et al. 2010).
En el sector automotriz también es importante considerar la liberación secundaria de nanopartículas durante la fabricación y uso de materiales como catalizadores o mejoradores de la eficiencia energética, tanto para partes de automóviles como para aditivos que contienen nanopartículas. Estos productos representan alrededor del 7 % de los nanoproductos en el mercado, que incluyen aditivos para motores (diésel o gasolina), autopartes (motores de gasolina) e insumos de mantenimiento (vidrio, pinturas, plásticos), para cuya fabricación se utilizan materiales como sílice, dióxido de titanio, cerámicas y óxido de zinc, así como disulfuro de tungsteno, diamante y cobre, para aditivos (StatNano 2021).
Debido al gran incremento en el uso de vehículos, la legislación exige reducir las emisiones en los escapes para disminuir posibles efectos tóxicos. Las últimas tecnologías basadas en elementos catalíticos han sido muy estudiadas en motores diésel, filtros y catalizadores de oxidación, que acumulan una carga concentrada de metales como el platino (Ramalingam et al. 2020). Se han investigado las nanopartículas (NP) de óxido de cobre (NP-CuO) para mejorar significativamente la eficiencia térmica del frenado y se han probado composiciones de biodiésel con nanoaditivos de CuO, obteniendo una reducción de las emisiones de humo, HC y CO, sin embargo, a una mayor concentración de las NP-CuO la emisión de CO2 aumenta (Rastogi et al. 2021). También se ha reportado que las NP-CuO con fluidos a base de etilenglicol y dietilenglicol intensifican la conductividad térmica y elevan la viscosidad (Ramalingam et al. 2020). Respecto a otras mejoras, se ha descrito que la adición de una pequeña cantidad de zinc (hasta un 1.3 %) incrementa la resistencia mecánica sin reducción de la ductilidad (Moheimani et al. 2021). Las NP-CuO, tienen además amplias aplicaciones térmicas, puesto que se ha observado un ascenso en el coeficiente de transferencia de calor del 8 % con tan sólo una concentración del 0.4 % de CuO vol/vol en agua (Shafique y Luo 2019).
Nanopartículas generadas por el sector industrial
Es importante tomar en cuenta que para la producción de nanomateriales deben considerarse aspectos básicos de su ciclo de vida: material, manufactura, aplicación y disposición o reciclaje, lo cual ha tenido menor interés cuando se trata de nanopartículas (Meyer et al. 2009). La fabricación de nanopartículas se ha incrementado en las últimas décadas en sectores como la construcción y las industrias petrolera y textil (Vance et al. 2015). Aproximadamente el 20 % de los nanoproductos en el mercado son derivados del sector industrial (StatNano 2021). En ocasiones, las emisiones de fábricas contienen nanopartículas por la quema de combustibles o como subproducto por el desprendimiento en alguno de los procesos de manufactura. También se utilizan nanopartículas como aditivos de un producto final, siendo incorporadas para modificar la composición y mejorar algunas características, por ejemplo, se han empleado nanopartículas de óxidos metálicos (TiO2, ZnO, SiO2) para el tratamiento de madera (Papadopoulos et al. 2019) o nanopartículas de óxido de zinc (NP-ZnO) integradas al caucho para mejorar su resistencia al desgaste y aumentar la dureza del material (Sahoo et al. 2007).
El desarrollo de los nanomateriales ha permitido la fabricación de textiles con características antibacterianas y repelentes al agua, además de protección UV y propiedades contra manchas y olores (Ibrahim et al. 2007). La industria textil ha generado también un incremento en las fuentes de contaminación debido a la alta demanda de sus productos, que exige el uso exhaustivo de colorantes, por lo que se ha impulsado el desarrollo de métodos de tratamiento de agua con nanomateriales como nanopartículas de óxido de tungsteno (Saleh et al. 2017) o de ZnO, cuyas propiedades semiconductoras impulsan el desarrollo de fotocatalizadores (Saravanan et al. 2013).
Desde el punto de vista ecológico, se ha reducido el gasto energético en la producción de nanomateriales en comparación con su contraparte convencional, aunque hay que considerar también el gasto energético detrás de la fabricación y extracción de los precursores en los procesos de síntesis (Meyer et al. 2009). Dicha reducción energética en la manufactura es lograda también gracias al desarrollo de nanomateriales que mejoran los componentes industriales que operan en condiciones de alta demanda por presión, temperatura y velocidad, exigiendo condiciones de lubricación en distintas superficies de contacto. Se ha demostrado que el ZnO y el CuO como nanoaditivos mejoran dichas condiciones, reduciendo el desgaste en la maquinaria (Rawat et al. 2020).
Nanopartículas generadas por actividades urbanas y rurales
Los productos de uso doméstico que contienen nanopartículas son bastante comunes, actualmente muchos son utilizados cotidianamente, por ejemplo, productos de limpieza y cosméticos, electrodomésticos, alimentos, en calderas de gas, carbón o petróleo, pilas de combustibles, diagnóstico, imágenes biomédicas y consumibles de laboratorios, en electrónica, en impresión y en el cuidado del ambiente. Los bienes de consumo aportan aproximadamente el 60 % de los nanomateriales manufacturados (StatNano 2021).
Las nanopartículas óxido metálicas son ampliamente utilizadas, por ejemplo las NP-ZnO, se aplican con frecuencia en cosméticos para el cuidado de la piel, en sensores y dispositivos ópticos, para el tratamiento de aguas, como bactericidas en medicina y en lubricantes de aceite para motor (Sabir et al. 2014, Reddy y Kim 2015, Reddy et al. 2018), las NP-CuO se utilizan en el desarrollo de pantallas táctiles, como antivirales, catalizadores y lubricantes (Rani et al. 2016, Sajeeb y Rajendrakumar 2020, Tavakoli y Hashemzadeh 2020).
La gama de aplicaciones continúa ampliándose a gran velocidad, impulsada por el desarrollo de nanocompuestos de CuO-ZnO, que presentan mayor porosidad, generando una elevada relación superficie-volumen y disponibilidad de sitios activos (Mariammal et al. 2012). El aumento de la capacidad catalítica de estos nanocompuestos permite una mayor difusión de gases y transporte de masa, promoviendo la difusión de moléculas de colorantes y especies de oxígeno reactivo (Jung y Yong 2011). De esta manera se ha impulsado también el desarrollo de las aplicaciones de generación de hidrógeno, gracias al incremento en la superficie específica del material, que permite una mejor transferencia de electrones que reduce la recombinación hueco-electrón (Kargar et al. 2013, Das y Srivastava 2018).
Con referencia a las aplicaciones médicas, la administración de alimentos y medicamentos de los Estados Unidos de América (FDA) ha aprobado algunas aplicaciones de óxidos metálicos como CuO y ZnO, debido a su baja toxicidad y biocompatibilidad (Borkow et al. 2010, Espitia et al. 2012, Zhong et al. 2018, Borkow et al. 2020). Además de las propiedades antibacterianas ya mencionadas, se han demostrado cualidades antivirales, antifúngicas y anticancerígenas, y en específico, las NP-CuO se han aplicado en el desarrollo del transporte de fármacos (Mohamed et al. 2020). En México, la Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS) aprueba el uso de nanomateriales orgánicos, como liposomas, para su empleo en los procesos de fabricación para aplicaciones médicas, aunque no regula explícitamente si el producto final continua siendo nanoestructurado (González-De la Rosa et al. 2019, Meza-Ríos et al. 2020).
Nanopartículas generadas para el sector agrícola
La producción masiva de alimentos ha generado la necesidad de utilizar productos que ayuden al crecimiento rápido de cultivos y que brinden protección contra patógenos, dichos productos representan una parte significativa de los costos, lo que ha llevado al desarrollo de nanocompuestos que ayudan a disminuir la cantidad de aditivos y agroquímicos utilizados, y que mejoren condiciones del producto, como el sabor, aroma y textura, entre ellos se encuentran los nanofertilizantes, nanofungicidas y nanopesticidas, conformados por nanopartículas (Chhipa 2017, Prasad et al. 2017, Fatima et al. 2021). Otras ventajas que los nanomateriales pueden ofrecer a la agronomía son el fitomejoramiento, el aumento de la permeabilidad del suelo, además del desarrollo de recubrimientos comestibles o biodegradables para los frutos (Jafarzadeh et al. 2021).
Los productos alimenticios de consumo final han sido también mejorados mediante el desarrollo de membranas para la liberación controlada de nutrientes y adición de vitaminas y minerales (Baruah y Dutta 2009), o con la optimización de los empaques al agregar etiquetas con sensores indicadores de contaminación y calidad de los alimentos (Morales et al. 2011a, Mukherjee et al. 2014, Vance et al. 2015, Lira-Saldivar et al. 2018). Se han utilizado NP-ZnO como aditivos para mejorar las características de productos alimenticios, intensificando sus propiedades antioxidantes y rendimiento, así como en la industria avícola para mejorar la calidad de los huevos y elevar la productividad de las gallinas (Abedini et al. 2018). Se estima que el 3 % de los nanoproductos actuales en el mercado, son dedicados al sector agrícola (StatNano 2021), materiales que pueden causar toxicidad al ser liberados al ambiente tras ser aplicados a los cultivos o de manera indirecta a través del consumo de alimentos (Dimkpa et al. 2012). En particular, las nanopartículas de ZnO y CuO, son útiles en aplicaciones agronómicas, gracias a sus características morfológicas y electroquímicas, entre las que destacan sus cualidades semiconductoras y fotocatalíticas, estructura monoclínica y alta constate dieléctrica (Cava 1990, Tranquada et al. 1995, Chand et al. 2012), dichas propiedades intervienen en su interacción con las plantas, contribuyendo a la translocación vascular a través del xilema y floema, y a la captación a través de los tejidos foliares tras la aplicación de aerosoles, aportando además propiedades fungicidas y bactericidas (Lira-Saldivar et al. 2018).
DETECCIÓN DE NANOPARTÍCULAS
La detección y caracterización de nanopartículas puede realizarse por medio de una amplia variedad de métodos, que van desde la microscopía óptica de campo claro, hasta espectroscopías, incluyendo aquellas menos tradicionales como pinzas ópticas (Kyrsting et al. 2011, Tamura e Iida 2012, Kudo et al. 2018) y técnicas fototérmicas (López-Muñoz et al. 2012, Abrica-González et al. 2018). Dependiendo de las propiedades del nanomaterial y el medio en el que se encuentra es que se eligen las técnicas más apropiadas (Zhang et al. 2010, Brabazon y Raffer 2014).
Las dimensiones de las nanopartículas se encuentran por debajo del límite de difracción de Abbe, que define la mínima distancia a la que pueden distinguirse dos objetos, para longitudes de onda determinadas; aun así es posible obtener imágenes de nanopartículas con técnicas basadas en microscopía óptica, gracias a fenómenos como la fluorescencia, la resonancia de plasmón superficial y la amplia sección transversal de esparcimiento, que describe el área efectiva de interacción de una partícula con la radiación electromagnética (Luo et al. 2005, Guffey y Scherer 2010, Clayton et al. 2016, Taylor y Sandoghdar 2019).
Microscopía óptica
La microscopía óptica para la detección de nanopartículas es especialmente útil para el caso de aquellas que presentan efectos de resonancia de plasmón superficial localizado y algunas otras que, en particular, muestren gran esparcimiento de luz, incluyendo óxidos metálicos y nanopartículas semiconductoras (Larson et al. 2007, Spindler et al. 2016). Cuando las dimensiones de las partículas están por debajo de la longitud de onda de la radiación de la luz, los fenómenos de esparcimiento Rayleigh y de Mie son aprovechados en las técnicas de microscopía óptica para visualizar objetos nanométricos (Clayton et al. 2016). Asimismo, algunas otras técnicas de caracterización de nanopartículas, aunque no sean usadas para la generación de imágenes, están basadas en los fenómenos de interacción de la luz con las partículas, en especial la dispersión dinámica de luz (DLS, por sus siglas en inglés) y el análisis por seguimiento de nanopartículas (NTA, por sus siglas en inglés) (Boyd et al. 2011).
Para superar las limitaciones de los métodos ópticos en el régimen nanométrico, el desarrollo de los sistemas de cómputo es determinante. En especial, las nanopartículas metálicas y puntos cuánticos son detectables por técnicas de microscopía óptica con la ayuda del procesamiento digital de imágenes; en general se habla de detección debido al reto que sigue presentando la generación de imágenes de objetos nanométricos con alta resolución por métodos ópticos (Attota et al. 2014). De esta premisa surgen técnicas ópticas que aprovechan herramientas adicionales, como la microscopía de campo oscuro, las basadas en fluorescencia, como la microscopía confocal láser de barrido (CLSM, por sus siglas en inglés), aquellas dentro del conjunto de súper-resolución, y otras que aprovechan la interferometría como la microscopía de contraste de fases y la microscopía por dispersión interferométrica (iSCAT) (Jacobsen et al. 2006). Esta última puede ser usada para generar imágenes da alta resolución de objetos micro y nanométricos de distintos tipos, incluyendo lípidos, microtúbulos, células, proteínas y bacterias, entre otros (Taylor y Sandoghdar 2019). Las técnicas de microscopía confocal son útiles sólo cuando se tienen muestras que fluorescen por sí solas o que son marcadas con moléculas fluorescentes, por ello, para caracterizar sistemas complejos suelen incorporarse otras técnicas como la espectroscopía de correlación de fluorescencia (FCS, por sus siglas en inglés) (Hess y Webb 2002).
Microscopías electrónicas
El límite de difracción definido por Abbe en 1873 está directamente relacionado con la longitud de onda electromagnética, de ahí que la distancia mínima que se puede resolver por la microscopía óptica convencional, tomando en cuenta las longitudes de onda de la luz visible, se encuentre alrededor de los 200 nm. Para el caso de las microscopías electrónicas, tomando en cuenta que las dimensiones de un electrón pueden llegar a ser 5000 veces menores que las de un fotón, es posible inferir el porqué con ellas se pueden obtener imágenes con resolución en el orden de los nanómetros y que se pueda describir la estructura atómica de los materiales (Wang 2000).
La microscopía electrónica de transmisión (TEM) es especialmente útil en la descripción de las dimensiones de los nanomateriales y de su estructura cristalina y puede llegar a resolver hasta 0.63 Å para muestras delgadas (500 nm) (Wang 2000). De manera simplificada, su configuración es similar a un microscopio óptico, siendo las bobinas electromagnéticas análogas a las componentes ópticas, y el emisor de electrones a la fuente de luz (Zheng et al. 2018). Se usa frecuentemente para describir la morfología de las nanopartículas, de manera especial para nanopartículas metálicas y muestras biológicas marcadas con éstas. Debido a que la imagen se genera por electrones transmitidos, de manera similar a un microscopio invertido, es necesario que las muestras sean delgadas (Wang 2016).
Cuando se examinan aplicaciones de nanomateriales conjugados o embebidos con otros materiales, aumentando la complejidad de la muestra, es de gran utilidad la microscopía electrónica de barrido (SEM) (Wirth 2009). En este caso, la detección no se realiza a partir de electrones transmitidos, sino por el principio del esparcimiento de las partículas, encontrando electrones retrotransmitidos, secundarios, y otros fenómenos elásticos e inelásticos como el fenómeno Auger, en el que se emiten electrones desde el material sobre el que inciden los electrones SEM (Wang 2000). De igual forma se puede pensar en la SEM como la técnica de electrones análoga a la microscopía epifluorescente, ya que no se detectan las partículas transmitidas. Es especialmente útil para la caracterización de la topología del material, y la detección de nanopartículas dentro de arreglos más complejos, aprovechando la incorporación del detector EDX (rayos X por energía dispersiva) (Wirth 2009). Esta herramienta es determinante en la detección de los elementos que forman parte de la muestra, caracterizando, por ejemplo, desde nanopartículas metálicas simples, hasta conjugados con polímeros, incluyendo óxidos metálicos y compuestos organometálicos (Manivasagan et al. 2016).
Algunos de los métodos más usados en la preparación de muestras para TEM y SEM, consisten en depositar las partículas a analizarse en una rejilla recubierta con esmalte formvar (Larson et al. 2007). Estas rejillas tienen baja interacción con las nanopartículas y son relativamente transparentes a los electrones, de esta forma la muestra es fácilmente visible. Cuando se tiene una suspensión coloidal de nanopartículas metálicas o de óxidos metálicos, es viable la preparación de la muestra depositando una gota del coloide en la rejilla y dejando secar en horno o a temperatura ambiente para la observación directa en SEM o TEM (Larson et al. 2007, Kwon et al. 2019). Para el caso de nanopartículas suspendidas en el aire, el primer reto es la captación y posteriormente la separación o filtración del resto de las partículas. Para ello se han desarrollado equipos, entre los que destacan los impactadores de depósito uniforme de micro orificio, basados en impactadores de cascada para la recolección selectiva de aerosoles (Rahim et al. 2019). Este equipo separa las partículas de acuerdo con su diámetro aerodinámico y las deposita de manera subsecuente en superficies de impacto, que pueden ser sustituidas por rejillas para muestras TEM o SEM (Marple et al. 1991, Rahim et al. 2019).
Súper resolución
Las propiedades de algunos materiales son aprovechadas para mejorar la resolución y el contraste, estableciendo los principios para el desarrollo de las microscopías de súper resolución que, en sus formas más básicas, emplean la fluorescencia para el mejoramiento de la imagen o la interferometría electromagnética (Astratov 2019). El uso de fuentes de luz láser fue determinante en el desarrollo de estas técnicas, ya que cada material responde de formas particulares a longitudes de onda específicas. Uno de los ejemplos más útiles a este respecto son las técnicas de súper resolución como la reducción de emisión estimulada (STED), el agotamiento del estado fundamental (GSD) y las transiciones de fluorescencia óptica saturable reversible (RESOLFT), que explotan las propiedades espectrales moleculares, en lugar de centrarse en el fenómeno de difracción. De ahí que en estos casos se tengan más requerimientos respecto a la preparación de la muestra y al procesamiento de datos, así como en la disminución de aberraciones ópticas (Hell et al. 2015).
Las técnicas de súper resolución se han relacionado de manera estrecha con el desarrollo de las nanopartículas, ya que éstas últimas representan una opción viable como marcadores biológicos, en especial mediante la funcionalización o conjugación con moléculas fluorescentes o grupos funcionales específicos para cada aplicación (Zhan et al. 2017). Estas técnicas son útiles también para detectar la captación o acumulación de nanopartículas en el ambiente y en organismos, aprovechando los pigmentos de las plantas y las propiedades ópticas de las nanopartículas (Maurer-Jones et al. 2013, Paës et al. 2018).
Espectroscopías
Las espectroscopías se basan en el análisis de las interacciones de la radiación electromagnética con la materia, en particular con los fenómenos de absorción y emisión, de donde se derivan las técnicas por infrarrojo, microondas, rayos X y fluorescencia, entre otras (Titus et al. 2019). Además de las micrografías, estas técnicas generan espectros de radiación característicos para cada material (Zamborini et al. 2012).
Los cambios en las propiedades físicas y químicas de las nanopartículas permiten diferenciarlas del resto de los materiales que no se encuentran en la escala nanométrica mediante técnicas espectroscópicas, permitiendo la detección y caracterización en distintos medios (Zamborini et al. 2012), por ejemplo, se ha determinado la presencia de NP aéreas mediante bioindicadores centinelas, especialmente útil para bajas concentraciones (Castanheiro et al. 2020).
Con la espectrometría de masas con plasma acoplado inductivamente (ICPMS, por sus siglas en inglés), es posible detectar concentraciones muy bajas, integrando al espectrómetro una fuente de plasma para ionizar las muestras, llegando incluso a detectar átomos individuales, con equipos como el ICPMS de partícula individual (SP-ICPMS, por sus siglas en inglés) (Hadioui et al. 2015). Este tipo de equipos detecta materiales a nivel elemental, lo que deriva en que sea complicado discernir entre materiales con la misma composición, pero con diferente estructura, como el caso de las nanopartículas óxido metálicas y variantes de minerales. Derivado de estas dificultades, se han desarrollado preparaciones de muestras como la separación por resinas de intercambio iónico, que ha permitido detectar concentraciones de interés ambiental de nanopartículas de ZnO (Hadioui et al. 2015). De igual manera, se ha reportado el uso de la espectrometría de masas para la determinación de nanopartículas en hojas de plantas, logrando hallar y caracterizar NP-CuO en plantas comestibles por SP-ICPMS (Degueldre et al. 2006, Hayder et al. 2020).
Otras espectrometrías basadas en láser son especialmente útiles para determinar y caracterizar nanopartículas, como la fluorescencia inducida por láser (LIF), y la espectroscopía Raman (Li Bassi et al. 2005, Rani et al. 2016). Esta última ha sido también de gran utilidad para la detección de nanopartículas de óxidos metálicos, como las de TiO2, logrando conocer incluso su estado cristalino y su grado de oxidación (Li Bassi et al. 2005). Se ha reportado recientemente, que parte de la contaminación atmosférica es captada por las hojas de las plantas, esto se ha demostrado en gran parte gracias a los detectores EDX incluidos en los microscopios SEM, que generan espectrometrías elementales a partir de la energía esparcida por los materiales tras la excitación por una fuente de rayos X (Castanheiro et al. 2020).
Otras técnicas
Es importante mencionar UV-Vis, como una espectrometría menos específica para obtener una primera aproximación para la determinación de las nanopartículas. Dicha técnica se basa en la interacción de la luz con la muestra, registrando la absorbancia, transmitancia o reflectancia. Debido al fenómeno de resonancia de plasmón superficial localizada, que aumenta la absorbancia en longitudes de onda características en nanopartículas metálicas, dicha técnica resulta bastante útil para el caso de las nanopartículas metálicas (Coelho et al. 2015) y más aún para aquellas constituidas por óxidos metálicos, en las que las transiciones electrónicas entre el oxígeno y el metal pueden desplazar la banda de plasmón (Asamoah et al. 2020).
Hasta ahora se han mencionado algunas de las técnicas más usuales, aunque constantemente surgen necesidades particulares para cada investigación. Para el caso de muestras ambientales, en especial atmosféricas, la detección de nanopartículas en bajas concentraciones o embebidas en sistemas complejos continua siendo un reto para el cual se siguen haciendo propuestas; por ello, se han explorado también técnicas como la microfluídica (Felten et al. 2008, Lee et al. 2011, Arosio et al. 2014), la optofluídica (Yang et al. 2013, Jonáš et al. 2017), la fototérmica (López-Muñoz et al. 2012, Abrica-González et al. 2018) y el atrapamiento óptico (Kyrsting et al. 2011, Maragò et al. 2013, Brzobohatý et al. 2015), entre otras.
TOXICIDAD Y EFECTOS
Primeros indicios de toxicidad
Las nanopartículas de óxidos metálicos se encuentran entre los nanomateriales más producidos a nivel mundial. La popularización en el consumo de productos basados en estos materiales comenzó a generar preocupación respecto a la salud humana y ambiental hace algún tiempo, principalmente por los que contienen TiO2, ZnO, CuO y SiO2 (Vance et al. 2015). Algunas investigaciones relacionadas con la liberación de este tipo de nanopartículas y su toxicidad, han usado plantas como bioindicadores a partir de la captación (Siddiqi y Husen 2017, Castanheiro et al. 2020), seguida de la caracterización con algunos de los métodos mencionados en la sección anterior, principalmente SEM, TEM y XRF (Larue et al. 2011). Salvo algunos casos en los que se han presentado resultados contradictorios entre sí para ciertos materiales, como las NP-TiO2, en general distintas especies de plantas han sido usadas satisfactoriamente como bioindicadores para la toxicidad de los nanomateriales (Feizi et al. 2012, Morteza et al. 2013, Servin et al. 2013).
Efectos ambientales de nanopartículas metálicas
Además de casos evidentes como el daño a la salud del ser humano por exposición directa, no se tienen claros los efectos ambientales de algunas nanopartículas metálicas como las de ZnO y CuO, cuyos mecanismos de absorción en plantas pueden ser complejos, ya que intervienen la bioacumulación y la interacción con bacterias fijadoras de nitrógeno, alterando su potencial de fijación (Siddiqi y Husen 2017). Se ha reportado que la bioacumulación de metales puede inducirse por el aumento de la biodisponibilidad de metales en la presencia de sideróforos, ácidos orgánicos y surfactantes (Lebeau et al. 2011).
Aunque en general, se ha reportado que el uso de óxidos metálicos en fertilizantes mejora el crecimiento y la capacidad de fijación de nitrógeno, se han demostrado también efectos no deseados, como bioacumulación en semillas y hojas (Siddiqi y Husen 2017) o penetración a través de los estomas (Lv et al. 2019), lo que puede derivar en efectos tóxicos indirectos a lo largo de la cadena trófica (Prasad et al. 2017, dos Santos et al. 2020). Otros productos de consumo final que incorporan nanomateriales óxido metálicos como baterías, pinturas, cosméticos, cemento, catalizadores, entre otros, liberan dichos nanomateriales tras finalizar su ciclo de vida, contribuyendo también a los efectos negativos en el ambiente (Kandavelu et al. 2004, Biswas y Wu 2005, Schmid y Riediker 2008, Sengul y Asmatulu 2020).
Plantas como bioindicadores
Las plantas juegan un papel importante como centinelas sobre los efectos ambientales de la liberación de nanopartículas, ya que las paredes celulares funcionan como medios de interacción con los nanomateriales, aunque los mecanismos de captación e ingreso de los materiales nanoestructurados todavía no se han estudiado lo suficiente (Fatima et al. 2021). Además es necesario tomar en cuenta que durante las interacciones de los nanomateriales con su medio de dispersión, pueden ocurrir fenómenos de agregación, sedimentación y transformaciones químicas, que dependen en gran parte de la concentración del nanomaterial, el pH y la interacción con moléculas orgánicas que pueden ser adsorbidas en la superficie de las NP (Ubaid et al. 2020); por ejemplo, las NP-ZnO, generalmente presentan carga negativa en ambientes naturales acuáticos, pero esa carga es modificada conforme aumenta la presencia de materia orgánica (Keller et al. 2010).
La complejidad ya mencionada de las interacciones de las nanopartículas con las plantas puede generar resultados opuestos o contradictorios. Por ejemplo, aunque las NP-ZnO han sido usadas satisfactoriamente en el desarrollo de fertilizantes, otras investigaciones han mostrado efectos negativos en la germinación de semillas (Lee et al. 2010).
Es importante mencionar también la concentración de nanomaterial a incluir en las aplicaciones, se ha observado que a concentraciones bajas (alrededor de 50 mg/kg) las NP-ZnO tienen efectos favorables en las plantas. Por el contrario, en concentraciones superiores a 500 mg/kg pueden ser perjudiciales, a menos que haya una deficiencia de Zn en el sustrato. También se deben tomar en cuenta los factores bióticos y abióticos que sean capaces de mejorar el impacto de las NP-ZnO (Reddy et al. 2018).
Entre los numerosos efectos causados en plantas, en especial por las nanopartículas óxido metálicas, como las de ZnO y CuO, gran parte de las investigaciones reportan estrés oxidante (Wei y Wang 2013, Mukherjee et al. 2014), daño en vacuolas (Pokhrel y Dubey 2013) y reducción de la longitud de las raíces (Ma et al. 2010). A pesar de conocer estos efectos, el mecanismo aún no es claro, aunque, dependiendo de las dimensiones de las NP, se ha empezado a caracterizar la dinámica de su distribución en las distintas estructuras de las plantas (Wang et al. 2013, 2016), su distribución a través del sistema vascular y los efectos dependiendo del tamaño de las nanopartículas y sus aglomerados (Cox et al. 2016). En el cuadro I, se recopilan algunas publicaciones sobre los efectos de las NP de CuO y ZnO en distintos modelos de plantas. Se reconoce una convergencia de resultados que sugieren estrés oxidante, alteración en el crecimiento y deterioro de las raíces.
CUADRO I EFECTOS EN PLANTAS POR SU EXPOSICIÓN A DISTINTAS CONCENTRACIONES DE NANOPARTÍCULAS DE ÓXIDOS METÁLICOS. D: DIÁMETRO DE NANOPARTÍCULA EN NANÓMETROS
| NP | d (nm) | Planta | Concentra-ción | Observaciones | Referencia |
| ZnO | 44.4 | Arabidopsis | 400 mg/L | Mayor toxicidad con nanopartículas de ZnO, en comparación con nanopartículas de Fe3O4, SiO2, y Al2O3 . Se reportó reducción significativa en la germinación, presumiblemente debido a la facilidad de transporte a espacios intracelulares, favorecida por el tamaño reducido de las partículas, así como su alta solubilidad y monodispersidad | (Lee et al. 2010) nAl2O3 |
| ZnO | 8 | Medicago sativa Solanum lycopersicum | 1,600 mg/L | Reportan una reducción en la germinación del 40 % y 20 % para Medicago sativa y Solanum lycopersicum, respectivamente | (Reddy et al. 2018) |
| <50 | Fagopyrum esculentum | 10-2,000 mg/L | Se encontraron efectos de reducción en la biomasa y disminución en la germinación | ||
| CuO | 20-40 | Zea mays L. | 20, 50 mg/L | Se evidenciaron efectos de absorción, translocación y distribución de nanopartículas a través de xilema y floema | (Tripathi et al. 2017) |
| ZnO | 20±5 | Ryegrass | 50 mg/L | Se redujo significativamente la biomasa y se presentó acortamiento de raíces, se pudo observar daño en las células corticales y epidérmicas | (Mohamed et al. 2021) |
| ZnO | 20±5 | Radish | 50 mg/L | Los nanomateriales basados en zinc provocaron mayores efectos en la germinación y en el crecimiento de las raíces, encontrando valores de EC50 similares con ZnO y Zn | (Lin y Xing 2007) |
| CuO | <50 | Syrian barley | 1.5 mM | La germinación y el crecimiento de las raíces se vieron disminuidas tras la exposición de Hordeum vulgare a nanopartículas de CuO, dependiendo de la dosis y el tiempo de exposición | (Siddiqi y Husen 2017) |
| CuO | 20-40 | Zea mays L. | 100 mg/L | Se demostró la reducción de nanopartículas de CuO a Cu2O y Cu2S por plantas de maíz tras la absorción y translocación entre diferentes tipos de tejido | (Wang et al. 2012) |
| ZnO | 50 | Oryza sativa L. | 100 mg/L | Aunque no se observó un descenso significativo en el índice de germinación, se reportó deterioro de las raíces durante las primeras etapas de las plántulas | (Boonyanitipong et al. 2011) |
| ZnO | 1.2-6.8 | Zea mays L. | 50 mg/L | Promovió el metabolismo glucolítico y la biosíntesis de la pared celular, aumentando el índice de germinación de semillas de maíz y el crecimiento de raíces y embriones. Se propone el uso de NP para aliviar el estrés por sequía del sorgo al incrementar la absorción de nitrógeno y potasio | (Zhou et al. 2021) |
| ZnO | <50 | Soybean | 500 mg/kg | Raíces y brotes reducidos; muestran menor superficie y volumen; sin formación de semillas Se redujeron las raíces y el número de brotes. Disminuyó la superficie y volumen de las hojas y no maduraron las semillas | (Siddiqi y Husen 2017) |
| CuO | <100 | Radish, grasses | 10, 100, 500, 1000 mg/L | Se determinó daño al DNA e inhibición de crecimiento | (Atha et al. 2011) |
| ZnO | 24±3 | Corn | 50-1600 mg/L | A diferentes temperaturas, los nanomateriales de ZnO aumentaron el crecimiento de las raíces. Se observó acumulación de Zn y aumento en la actividad de peroxidasa de ascorbato en las plántulas | (Adisa et al. 2019) |
| ZnO | 8 | Glycine max | 2,000 mg/L | Se reportaron por primera vez los efectos genotóxicos por nanopartículas de ZnO en plantas, por medio de estudios de amplificación aleatoria de DNA polimórfico a concentraciones de 2,000 y 4,000 mg/L | (López-Moreno et al. 2010) |
Otro factor que contribuye a la captación de nanopartículas por las plantas es la retención en medios porosos no saturados, debida a las interfases aire-agua y aire-agua-sólidos (Morales et al. 2011a). La presencia de ácidos fúlvicos y ácidos húmicos, contribuyen a la retención de nanopartículas en medios coloidales, principalmente en las interfaces aire-agua, lo que puede contribuir también a la captación de nanopartículas (Morales et al. 2011b).
El estudio de la interacción de las NP con las plantas por vía aérea, tomó relevancia al reportarse efectos tóxicos tras la fotólisis y la oxidación de dichos materiales, presentándose como agravante el aumento en la biodisponibilidad de las nanopartículas al interaccionar con la materia orgánica natural, en especial con pinenos y sus productos (Lowry et al. 2010). La agregación y aglomeración hace difícil la detección de NP en el ambiente, y aunque se tienen indicios de que la mayoría termina en medios acuáticos (Lin et al. 2010), es importante ampliar el análisis de su presencia en la atmósfera, ya que existe poco instrumental para este tipo de determinaciones.
Dada la complejidad de la determinación de partículas en la atmósfera, se ha propuesto el uso de hojas de plantas como medio de captación para realizar su detección, algunos investigadores ya han comprobado la viabilidad de dicho método, reportando mejores resultados con hojas pequeñas y de topología compleja, así como con aquellas con tricomas, cera epicuticular o crestas superficiales (Dzierzanowski et al. 2011, Popek et al. 2013, Weerakkody et al. 2018, Corada et al. 2021). Se han obtenido importantes resultados a través del monitoreo de partículas en aire, tanto de exteriores como de interiores, analizando la captación en hojas de Hedera sp. y Fragaria sp., observándose mayor acumulación en Fragaria sp., logrando caracterizar de manera rápida el contenido de partículas por análisis biomagnético. Este tipo de procedimientos es posible utilizarlos como alternativa de bajo costo para la caracterización de partículas en la atmósfera (Castanheiro et al. 2020).
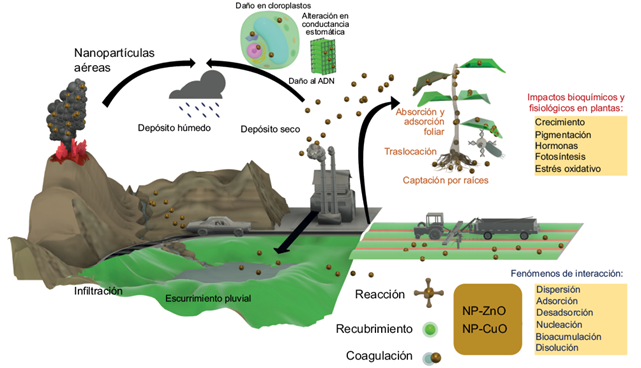
En la figura 1, se ilustran los posibles mecanismos de interacción de NP en plantas, cómo viajan en la atmósfera desde fuentes naturales y antropogénicas, principalmente emisiones vehiculares, agrícolas e industriales. Las NP pueden infiltrarse a mantos acuíferos, presentar depósito húmedo o seco, viajar por escurrimiento pluvial, y así llegar a todos los medios (Garner et al. 2017). El comportamiento de las NP en los distintos ambientes puede variar respecto a los fenómenos y condiciones que las rodean, también es posible que manifiesten algún tipo de recubrimiento o presenten coagulación (Goodwin et al. 2018, Rahim et al. 2019). Su llegada a las plantas puede ser por adsorción o absorción foliar, así como por captación desde las raíces, seguida de translocación a través de diversos tejidos (Tripathi et al. 2017, Lv et al. 2019). Cuando las NP llegan al interior de las células de las plantas, producen distintos efectos tóxicos que causan comportamientos anormales (Cox et al. 2016). Pueden provocar daño en las mitocondrias, como se ha observado por interacción con nanotubos de carbono, o daño en la permeabilidad como con las NP metálicas (Wu et al. 2020). La mayoría de los efectos que provocan las NP en las células, hacen referencia al estrés oxidante (Martínez et al. 2021).
Nanotecnología verde
La fabricación de productos nanotecnológicos continúa en incremento, por lo cual deben buscarse alternativas para que el impacto en su ciclo de vida sea el menor posible. Para la síntesis de nanomateriales, se requiere de procesos físicos, mecánicos y químicos y de sustancias que funcionen como agentes reductores y estabilizantes (Siddiqi et al. 2018). La complejidad de la síntesis de nanopartículas se incrementa debido a factores importantes que deben cuidarse en cada paso, tales como, forma, tamaño, temperatura, presión, pH de la solución y tiempos de reacción (Chowdhury et al. 2014, Usman et al. 2019). Aunado a esto, los reactivos o procedimientos pueden llegar a ser costosos, contener compuestos o disolventes químicos peligrosos y resultar dañinos al ambiente y los seres vivos. Es por esto que en la fabricación de NP se buscan alternativas de síntesis donde se logre evitar desperdicios de material, diseñar productos seguros, utilizar material renovable, evitar derivados químicos, aumentar la eficiencia energética y procurar la pronta degradación de los productos (Jyothi Reddy et al. 2021).
Actualmente existen distintas biosíntesis, llamadas también síntesis de un paso o síntesis verdes, en las cuales las nanopartículas son obtenidas con métodos que implican menor impacto al ambiente y a los consumidores. Las nanopartículas metálicas y óxido metálicas, son muy recurrentes en este tipo de procedimientos. En las síntesis de nanopartículas, el control de tamaño depende del tipo de reductor, y para el caso particular de las biosíntesis, este agente no es tóxico; por ejemplo, algunos flavonoides que contienen las plantas, como el eugenol y la quercetina que ayudan a la biorreducción y quelación de una gran variedad de iones metálicos, suelen ser buenos agentes reductores y estabilizantes (Jyothi Reddy et al. 2021).
Para la síntesis verde de nanopartículas se busca reemplazar los métodos convencionales, con reductores ecológicos como ciertos tipos de vegetación, procesos enzimáticos, bacterias, algas, miel, almidón, biopolímeros u otros. Las NP metálicas se forman con la reducción de iones metálicos y después se realiza su nucleación, para finalmente hacerlas crecer y estabilizarlas (Jyothi Reddy et al. 2021). De esto surgen distintas clasificaciones de síntesis verde, basadas en el tipo de agente reductor y el procedimiento físico, eléctrico, mecánico o biológico.
El uso del método de síntesis en un sólo paso, reduce la cantidad de procedimientos y trata de aprovechar una única reacción para el producto final, por ejemplo, el uso de quitosano como agente reductor y estabilizador, ha demostrado ser más controlable y seguro para aplicaciones biomédicas (Nazirov et al. 2016). Al igual que los métodos de síntesis tradicionales, en el caso de la de un paso, el tamaño de partícula y su distribución dependen de la concentración del agente reductor.
Los métodos biológicos utilizan algún extracto o producto de microorganismos vivos como agente reductor y estabilizador: enzimas/proteínas, aminoácidos, polisacáridos y vitaminas. En el caso de las plantas, los reductores pueden encontrarse en raíces, hojas, flores, tallos, cortezas, brotes y semillas. Son métodos seguros, rentables y sostenibles. Algunos de los inconvenientes es que las reacciones llevan tiempos largos y en ocasiones hay dificultad en el control de tamaño, además de que, debido a la baja capacidad reductiva, en algunos casos es necesario usar un reductor secundario o elevar la temperatura durante las reacciones (Jamkhande et al. 2019).
Cuando la síntesis verde se realiza a partir de enzimas, éstas pueden servir como agentes estabilizantes además de reductores. Toda la enzima o los aminoácidos liberados después de la desnaturalización de la enzima pueden participar en la catálisis de formación de NP. Cuando se usan microorganismos, éstos reducen los iones metálicos para formar complejos insolubles en agua para defenderse de la toxicidad. Los microorganismos poseen la capacidad de producir compuestos orgánicos o inorgánicos de diferentes tamaños y formas, con estructuras ordenadas, al realizar la desintoxicación de los iones objetivo mediante la generación de biopolímeros durante la actividad celular (Jyothi Reddy et al. 2021).
CONCLUSIONES
El aumento en el uso de nanomateriales para la industria y productos de consumo final ha aumentado drásticamente, dejando rezagada la investigación sobre los efectos ambientales y a la salud. Si bien se han realizado estudios que han develado información importante respecto a toxicidad, distribución en el ambiente y efectos a la salud humana y los ecosistemas, es necesario ampliar la investigación desde un punto de vista más adecuado a la escala nanométrica, coadyuvando así al planteamiento de procedimientos de seguridad para evitar y remediar la liberación de nanomateriales sintetizados al ambiente.
Aunque se ha reconocido en general que, tras liberarse al ambiente las nanopartículas terminan agregándose, sedimentándose y finalmente regresando a su estado macro de manera natural, se ha encontrado que éstas interactúan con seres vivos de formas que no han logrado ser modeladas de manera suficiente, y que pueden llevar contaminantes nanoestructurados a través de la cadena trófica. Por otra parte, a esto se suman las nuevas evidencias de la presencia de NP en la atmósfera, que debe ser estudiada aprovechando métodos novedosos de detección y caracterización de aerosoles y partículas suspendidas.
Aunque aún falta mucho por investigar acerca de los efectos de los nanomateriales en los seres vivos, ha empezado a surgir una tendencia hacia la síntesis verde, a través del uso de precursores naturales y biodegradables. Existe discrepancia en la literatura sobre las ventajas de este tipo de métodos de síntesis, por ejemplo, si el aumento en la biodisponibilidad de los materiales obtenidos podría incrementar la toxicidad al no alertar al sistema inmune de los organismos, por lo cual, se remarca la importancia del estudio de dichos efectos.
Se enfatiza el área de oportunidad en el estudio de los mecanismos de transporte de nanopartículas por vía aérea, en especial con la propuesta de nuevas técnicas de detección y caracterización, teniendo en cuenta que las interfaces aire-agua, aire-suelo y la exposición a los seres vivos inician procesos complejos de distribución, en especial NP-ZnO y NP-CuO, que tienen alta incidencia en distintas áreas y cuyas propiedades cambian drásticamente dependiendo de sus dimensiones, estructura y funcionalización, proponiendo además la caracterización de nanopartículas ambientales a través de su interacción con las plantas.











 nueva página del texto (beta)
nueva página del texto (beta)