INTRODUCCIÓN
El petróleo crudo es una mezcla compleja de hidrocarburos alifáticos y aromáticos (Chao et al. 2020). La acumulación en suelos de petróleo y sus derivados se ha convertido en un grave problema ambiental (Patowary et al. 2017, Singh et al. 2020, Feng et al. 2021). La biorremediación es una de las tecnologías de saneamiento y recuperación de ecosistemas contaminados más utilizadas en las últimas décadas; se basa en la capacidad natural de los organismos para convertir parcialmente los contaminantes en compuestos menos tóxicos o completamente en dióxido de carbono y agua (Azubuike et al. 2016). Por ello tiene una relación de rentabilidad inferior al de los tratamientos físicos y químicos y es más ecoamigable. Además, se puede aplicar in situ en grandes áreas (Azubuike et al. 2016, Lim et al. 2016, Macaya et al. 2019, Feng et al. 2021, Singh et al. 2021) ya sea mediante bioaumentación o bioestimulación. La biorremediación por bioaumentación se define como la adición de microorganismos externos a la población existente en el ambiente a tratar, para incrementar la degradación. En cambio, en la bioestimulación se activan los microorganismos degradadores nativos de la zona afectada con la adición de nutrientes, biotensioactivos (Dhanya 2021) o biopolímeros (Lim et al. 2016, Macaya et al. 2019).
Sin embargo, la eficiencia de la biorremediación puede estar limitada por características del contaminante, como su baja solubilidad y toxicidad (Chen et al. 2020), la distribución espacial de los microorganismos y su capacidad metabólica. En este sentido, los biotensioactivos emergen como una alternativa segura para incrementar la eficiencia del proceso de degradación al facilitar la solubilización y emulsificación de moléculas hidrofóbicas, así como su biodisponibilidad y asimilación por las células microbianas (Santos et al. 2016, Liu et al. 2018, Dhanya 2021, Feng et al. 2021).
Miller y Zhang (1997) demostraron el efecto positivo de los biotensioactivos en la biodegradación de hidrocarburos, y se han publicado varias revisiones sobre esta temática (Souza et al. 2014, Kumar et al. 2018, Singh et al. 2020) destacando los géneros Pseudomonas sp., Bacillus sp. y Candida sp. como los microorganismos más utilizados en la bioremediación de suelos (Chao et al. 2020, Singh et al. 2020). Por otra parte, los ramnolípidos son los biotensioactivos que más se describen en la biodegradación de petróleo y sus derivados (Abalos et al. 2004, de Cassia et al. 2014, Santos et al. 2016, Patowary et al. 2018, Torres et al. 2018, Chao et al. 2020). Los ramnolípidos son moléculas con una o dos unidades de ramnosa con enlace glucosídico a una o dos cadenas de ácido β-hidroxidecanoico. Son sintetizados principalmente por cepas bacterianas de Pseudomonas y Burkholderia (Muthusamy et al. 2008, Mukherjee y Das 2010, Vandana y Singh 2018).
Cuando se aplican ramnolípidos en la biodegradación de hidrocarburos, es necesario considerar, además, la inclusión de ensayos de toxicidad de los mismos (Franzetti et al. 2010) debido a que independientemente de los beneficios, pueden ocasionar problemas de contaminación por toxicidad cuando se introducen en el medio ambiente. La alteración de la membrana celular por la interacción con sus componentes lipídicos y proteínas es uno de los mecanismos más importantes de toxicidad. El efecto negativo más descrito es el que tiene lugar cuando el biotensoactivo provee como alternativa a los microorganismos biodegradadores, naturales o añadidos, una fuente de carbono de más fácil degradación que el contaminante.
La mayoría de los resultados de biodegradación de hidrocarburos descritos en la literatura corresponden a ensayos a escala de laboratorio, en los cuales habitualmente se pueden controlar las condiciones de trabajo, a diferencia de los experimentos en campo que son de mayor complejidad (Liu et al. 2018). El objetivo de este trabajo fue evaluar la influencia de la bioestimulación con ramnolípidos de Pseudomonas sp. Y3-B1A, en la degradación de hidrocarburos a diferentes escalas, determinando a su vez la toxicidad de estas moléculas.
MATERIALES Y MÉTODOS
Microorganismos
Se empleó un cultivo mixto (CM) de cuatro cepas bacterianas aisladas y caracterizadas previamente como degradadoras de hidrocarburos: Pseudomonas sp. B10, Alcaligenes sp. F10S1, Bacillus sp. F9S y Bacillus sp. RFA (Acosta et al. 2021) y Bacillus sp. F10 (Barrios et al. 2012) de la colección del Centro de Investigación del Petróleo (CEINPET). Las cepas se cultivaron por separado en caldo triptona soya con agitación orbital a 30 ºC hasta la fase de crecimiento exponencial (Barrios et al. 2014). Los cultivos se centrifugaron a 5000 r/min durante 15 min (centrífuga Digicen 21, Ortoalresa, España), se lavaron dos veces con solución Ringer (en 100 mL de agua destilada: 0.85 g de NaCl, 0.04 g de KCl y 0.34 g de CaCl2×2H2O) y se resuspendieron en esta solución. En cada cultivo se adicionó la cantidad de inóculo necesaria para alcanzar una concentración inicial de 0.2 unidades de densidad óptica (UDO) (espectrofotómetro UV-Visible Genesys 10S, λ = 540).
Producción del crudo de ramnolípidos
El trabajo se realizó con el crudo de ramnolípidos: caldo agotado libre de células obtenido del cultivo de la cepa Pseudomonas sp. Y3-B1A. Ésta se cultivó en matraces de Erlenmeyer de 500 mL con 100 mL de medio mínimo mineral (MMM) suplementado con glicerol (4 % m/v) y se incubaron en agitación orbital a 30 ºC y 130 r/min durante 72 h (Barrios et al. 2021). La composición del medio MMM fue (g/L): NaNO3: 4.5; K2HPO4: 1.33; KH2PO4: 0.6675; MgSO4×7H2O: 0.5; KCl: 0.1; CaCl2: 0.0073; FeSO4×7H2O: 0.0073; extracto de levadura: 0.1, y solución de elementos traza: 0.05 mL/L (B: 0.026 %; Cu: 0.05 %; Mn: 0.05 %; Mo: 0.006 %, Z: 0.07 %). Posteriormente se centrifugó a 5000 r/min durante 15 min (centrífuga Eppendorf 5804, Alemania) y se separó el sobrenadante. Se realizaron diluciones seriadas del cultivo libre de células, se midió la tensión superficial de cada dilución por el método del anillo de Du Noüy (tensiómetro Kruss K100, Alemania) (Vakili-Nezhaad et al. 2019) y se calculó la dilución mínima del tensioactivo a partir de la cual se forman micelas en una disolución e manera espontánea (dilución micelar crítica, CMD). Además, se determinó la concentración de ramnosa por el método espectrofotométrico de Chandrasekaran y Bemiller (1980) empleando una solución de ramnosa como patrón (espectrofotómetro UV-visible, Genesys 10S). La concentración de ramnolípidos se calculó multiplicando por el coeficiente 3.24, determinado en estudios previos (Barrios et al. 2021). A partir de la CMD y del cálculo de la concentración de ramnolípidos se determinó la concentración micelar crítica (CMC), que es la concentración mínima a partir de la cual se forman las micelas.
Toxicidad del crudo de ramnolípidos
Se utilizaron dos organismos como indicadores de toxicidad, el microcrustáceo Artemia salina y Solanum lycopersicum (tomate). Se prepararon tres concentraciones diferentes a partir de caldo libre de células ½ CMC (60 mg/L), CMC (120 mg/L) y 2 × CMC (240 mg/L).
Artemia salina
Las larvas se emplearon un día después de eclosionadas. Las soluciones con el tensioactivo se prepararon en agua de mar estéril. Se inocularon diez larvas en tubos de vidrio con 5 mL de cada solución, como testigo se empleó agua de mar estéril. Los ensayos se ejecutaron por triplicado. A las 24 h se observaron los tubos y se calculó la mortalidad. Se definió que la menor concentración que elimina todas las larvas en 24 h es la concentración umbral de toxicidad, expresada en concentración del tensioactivo por 100 mL de agua de mar (Rufino et al. 2014). Se determinó la concentración letal media (CL50) referida a la concentración del ramnolípido, que se estima letal para el 50 % de los organismos de ensayo.
Solanum lycopersicum
El ensayo se realizó con las semillas y la toxicidad se evaluó en un análisis estático de germinación de éstas (Rufino et al. 2014, Charles-Oluwaseun et al. 2017). Las soluciones del ramnolípido se prepararon con agua destilada estéril. El ensayo se ejecutó en placas de Petri (1 cm × 10 cm) con papel de filtro Whatman N 1, las cuales se inocularon con 5 mL de la solución y se colocaron 10 semillas. Se empleó agua destilada estéril como testigo. Los ensayos se ejecutaron por triplicado. Las placas se incubaron durante cinco días a 25 ºC en la oscuridad. Posteriormente se determinó la germinación relativa de las semillas (ecuación 1):
Los experimentos de biodegradación de hidrocarburos se realizaron a tres escalas: laboratorio, microcosmos y parcelas. En los ensayos de laboratorio y microcosmos se utilizó petróleo crudo Mesa 30, simulando una contaminación real.
Biodegradación de petróleo crudo a escala de laboratorio
Diseño del ensayo
El ensayo de biodegradación se realizó en matrices de Erlenmeyer de 100 mL con 20 mL de medio MMM (descrito anteriormente) suplementado con crudo Mesa 30 (gravedad ºAPI: 0.6; densidad a 20 ºC: 0.9953 g/cm3; contenido asfalténico: 11.66 % m/m) como única fuente de carbono (1 % m/v). Los cultivos se incubaron en agitación orbital de 130 r/min a 30 ºC durante 28 días; adicionalmente se incubó como testigo abiótico el medio con crudo sin inocular. Se evaluaron cuatro tratamientos, preparados todos por triplicado:
Tratamiento 1 (CM): adición del cultivo mixto descrito en el apartado Microorganismos (5 % v/v, las cuatro cepas en igual proporción de volumen y concentración).
Tratamiento 2 (CM + RL): adición de cultivo mixto (semejante a tratamiento 1) + adición de ramnolípidos descritos en el apartado Producción del crudo de ramnolípidos (RL), en una concentración final igual a 116.5 mg/L.
Tratamiento 3 (B): adición de la cepa Bacillus sp. F10 (5 % v/v) descrito en el apartado Microorganismos.
Tratamiento 4 (B + RL): adición de la cepa Bacillus sp. F10 (semejante a tratamiento 3) + adición de ramnolípidos descritos en el apartado Producción del crudo de ramnolípidos, en una concentración final igual a 116.5 mg/L.
Extracción y análisis del petróleo crudo residual
Se realizaron cinco extracciones sucesivas a los cultivos con 7 mL de diclorometano. El extracto se secó por percolación a través de Na2SO4 y se concentró en un evaporador rotatorio (R111 Büchi, Suiza) hasta un volumen final aproximado de 1 mL. Para el análisis cromatográfico se disolvió en 5 mL de diclorometano de los cuales se tomó 1 mL y se pasó a través de una columna de alúmina activada (2 g). Como fase móvil se emplearon 10 mL de diclorometano. Los extractos se concentraron nuevamente a 1 mL para su posterior análisis. La fracción limpia resultante se inyectó en un cromatógrafo de gases Trace 2000 (Thermo Quest, Italia) acoplado a un detector de ionización de llama (GC-FID)
La degradación de petróleo crudo se determinó por la variación de los hidrocarburos totales del petróleo (HTP) empleando la ecuación 2 (el valor se reporta en %). El porcentaje de incremento de la degradación se calculó según la ecuación propuesta por Minf et al. (2015) (ecuación 3).
donde RL son los ramnolípidos.
Biodegradación de petróleo crudo en microcosmos: bioaumentación y bioestimulación con ramnolípidos
Se aplicaron tres tratamientos de microcosmos con suelo de jardín del CEINPET (La Habana, Cuba). En todos los casos se empleó 1 kg de suelo que se contaminó con 5 % m/m de crudo Mesa 30:
Tratamiento 1 (bioaumentación, BA): adición del cultivo mixto descrito en el apartado Microorganismos (5 % v/m, las cuatro cepas en igual proporción de volumen y concentración).
Tratamiento 2 (bioestimulación, BE): adición de ramnolípidos descritos en el apartado Producción del crudo de ramnolípidos (5 % v/m).
Tratamiento 3 (bioestimulación + bioaumentación, BE + BA): adición del cultivo mixto (5 % v/m) + ramnolípidos (5 % v/m).
Todos los microcosmos se prepararon por triplicado y se incubaron durante 30 días en condiciones de humedad relativa (70-75 %) y temperatura ambiente (26-30 ºC). Los microcosmos se humectaron por intervalos de dos o tres días.
Biodegradación de hidrocarburos en parcelas: bioaumentación y bioestimulación con ramnolípidos
El experimento se realizó durante 30 días en terrenos de la Refinería Ñico López (La Habana, Cuba). Cada parcela abarcó 500 m2 de suelo contaminado con hidrocarburos. Se emplearon dos tratamientos en el diseño:
Tratamiento 1 (bioaumentación, BA): adición de 50 L del cultivo mixto ya descrito (las cuatro cepas en igual proporción de volumen y concentración).
Tratamiento 2 (bioestimulación, BE): adición de 50 L de ramnolípidos obtenidos como se describió anteriormente.
La liberación del cultivo mixto en terrenos de la Refinería Ñico López se realizó amparada en el permiso otorgado por el Centro Nacional de Seguridad Biológica [LH-17-P (38) 20].
Monitoreo analítico del proceso de biodegradación de hidrocarburos en microcosmos y parcelas
Se tomaron muestras de suelo (10 g en los microcosmos y 1000 g en las parcelas) a los días 0 y 30 para el seguimiento del proceso mediante ensayos químicos y microbiológicos. Se emplearon los métodos gravimétricos para calcular hidrocarburos totales del petróleo (HTP) (Rice et al. 2017); grasas y aceites (US-EPA 1999); compuestos saturados, aromáticos (Drews 1998, García-Rivero et al. 2007), resinas y asfaltenos (García-Rivero et al. 2007), y colorimétricos para determinar nitrógeno (US-EPA 2001) y fósforo total (Rice et al. 2017). El conteo de microorganismos totales y degradadores de hidrocarburos se realizó según metodología descrita por Margesin et al. (2003).
Toxicidad del suelo de las parcelas tratado con ramnolípidos
A los 30 días de aplicados los ramnolípidos en las parcelas, se tomaron muestras para realizar un ensayo toxicológico agudo con Eisenia andrei (lombriz de tierra). El ensayo se realizó durante 14 días empleando la mortalidad del modelo biológico como respuesta. Se prepararon tres réplicas de cada tratamiento con diez individuos por réplica, se expusieron a ciclos de 12 h de luz y de oscuridad. Como testigo se empleó suelo no contaminado y se consideró válido el ensayo de toxicidad para una mortalidad < 10 % en el testigo.
Análisis estadístico
Todos los experimentos se hicieron por triplicado. Se presentan los valores medios de los resultados ± la desviación estándar. Se realizaron análisis de varianza simple (ANOVA) y se calcularon las mínimas diferencias significativas (LSD de Fisher) entre los porcentajes de degradación de los procesos de bioestimulación y bioaumentación (Gutiérrez-Pulido y de la Vara-Salazar 2012). Se empleó el software STATGRAPHICS Centurion XV (v. 15.2.05).
RESULTADOS
Crudo de ramnolípidos
A las 72 h de cultivo de la cepa Pseudomonas sp. Y3-B1A se obtuvo el caldo libre de células con una concentración de 46.59 g/L de ramnolípidos. En la figura 1 se muestra la variación de la tensión superficial del caldo libre de células, lo que permitió el cálculo de la CMD (2.5 %) del cultivo y la CMC (116.5 mg/L).

Fig. 1 Variación de la tensión superficial en función de la concentración del caldo cultivo libre de células obtenido del cultivo de la cepa Pseudomonas sp. Y3-B1A en medio mínimo mineral suplementado con glicerol (4 % m/v), incubado durante 96 h en agitación orbital a 130 r/min y 30 ºC.
Por primera vez se realizaron ensayos toxicológicos a los ramnolípidos producidos por Pseudomonas sp. Y3-B1A. El valor de la concentración letal media en el ensayo con Artemia salina fue de 163.4 mg/L para un 95 % de confianza.
El índice de germinación de Solanum lycopersicum aumentó de 46.7 a 65.0 % en correspondencia con la disminución de la concentración de ramnolípidos de 240 a 60 mg/L. Para el 50 % de germinación, la concentración de ramnolípidos fue de 190.6 mg/L para el mismo intervalo de confianza.
Biodegradación de hidrocarburos a escala de laboratorio
A partir de los cromatogramas obtenidos a los 28 días de cultivo (Fig. 2) se determinaron los HTP y se calculó el porcentaje de degradación, observándose la variación de intensidad de los diferentes picos en los tratamientos aplicados respecto al testigo abiótico. Los resultados mostrados en el cuadro I confirman que la adición de ramnolípidos incrementa la biodegradación de hidrocarburos. En los tratamientos sin ramnolípidos (CM y B) se obtuvieron porcentajes de biodegradación muy bajos (29.9 y 21 %, respectivamente); sin embargo, en presencia de éstos en el cultivo mixto (CM + RL) se observó un notable incremento de la biodegradación, alcanzándose un 78 %. Este valor representa un incremento del 61.7 %. En el cultivo de Bacillus sp. F10 (B + RL) no se apreció un incremento significativo (Cuadro I).

Fig. 2 Evaluación cromatográfica de la biodegradación de petróleo utilizando ramnolípidos a los 28 días de cultivo: (a) testigo, (b) cultivo mixto, (c) cultivo mixto + ramnolípidos, (d) Bacillus sp. F10 y (e) Bacillus sp. F10 + ramnolípidos.
CUADRO I EFECTO DE LA ADICIÓN DE RAMNOLÍPIDOS A LA BIODEGRADACIÓN DE CRUDO POR BACTERIAS SELECCIONADAS. LAS CÉLULAS SE CULTIVARON EN MEDIO MÍNIMO MINERAL SUPLEMENTADO CON CRUDO (1 % m/v).
| Condición de cultivo | Biodegradación (%) | Incremento de la biodegradación (%) |
| Cultivo mixto | 29.9a ± 7.0 | -- |
| Cultivo mixto + RL | 78.0b ± 7.5 | 61.7 ± 3.9 |
| Bacillus sp. F10 | 26.1a ± 9.4 | -- |
| Bacillus sp. F10 + RL | 28.7a ± 2.4 | 9.1 ± 6.4 |
Valores con la misma letra no presentaronn diferencias estadísticamente significativas (p < 0.05), según el método LSD de Fisher (Gutiérrez-Pulido y de la Vara-Salazar 2012).
Biodegradación en microcosmos: bioaumentación y bioestimulación con ramnolípidos
A los 30 días de tratamiento se observó crecimiento de la población de microorganismos totales (Fig. 3). Al concluir el ensayo la población degradadora se incrementó en los tres tratamientos, siendo más evidente el incremento en la BE (9.7 × 105 UFC/g de suelo) y BA (2.0 × 106 UFC/g de suelo). La población degradadora de hidrocarburos representó más del 90 % de la población heterótrofa cultivable.
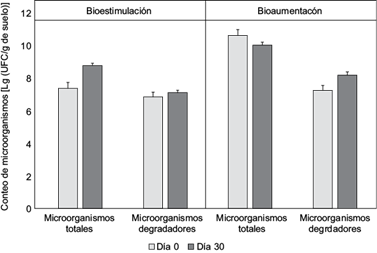
Fig. 3 Conteo de microorganismos en el proceso de biorremediación en microcosmos. Las barras representan la desviación estándar calculada para tres réplicas.
El consumo de nitrógeno y fósforo estuvo en correspondencia con el crecimiento microbiano (Cuadro II). El mayor consumo de estos nutrientes se observó en la bioestimulación con ramnolípidos (BE): nitrógeno (> 90 %) y fósforo (> 55 %), siendo este tratamiento el que mayor incremento de población mostró durante el ensayo. En el caso de la bioaumentación (BA) y la combinación (BA + BE), los consumos de estos nutrientes esenciales no superaron el 80 y el 50 %, respectivamente, para nitrógeno y fósforo (Cuadro II).
CUADRO II PROPIEDADES QUÍMICAS DEL SUELO DE LOS MICROCOSMOS DURANTE LA BIODEGRADACIÓN.
| Tratamiento | Nitrógeno (mg/kg) | Fósforo (mg/kg) | ||
| Día 0 | Día 30 | Día 0 | Día 30 | |
| Bioestimulación | 24.52 ± 0.07 | 1.83 ± 0.03 | 7.10 ± 0.50 | 3.08 ± 0.19 |
| Bioaumentación | 6.82 ± 0.07 | 3.86 ± 0.40 | ||
| Bioestimulación + bioaumentación | 5.21 ± 0.06 | 4.30 ± 0.62 | ||
A partir de los valores de HTP, grasas y aceites (GA) y de las fracciones de hidrocarburos (saturados, aromáticos, resinas y asfaltenos) determinados a los 0 y 30 días, se calculó el porcentaje de degradación (Cuadro III). Los porcentajes de degradación de GA, resinas y asfaltenos fueron inferiores al 20 % sin diferencias significativas entre los tres tratamientos. No obstante, con la bioestimulación con ramnolípidos (BE) se obtuvieron los mayores porcentajes de degradación para HTP (55.2 %) y fracciones de saturados (35.2 %) y aromáticos (73.7 %), siendo significativamente diferente este resultado respecto a los otros dos tratamientos aplicados (BA y BA + BE).
CUADRO III BIODEGRADACIÓN DE HIDROCARBUROS EN MICROCOSMOS EN 30 DÍAS.
| Tratamiento | HTP | Grasas y aceites | Saturados | Aromáticos | Resinas | Asfaltenos |
| Biodegradación (%) | ||||||
| Bioestimulación | 55.2a ± 1.5 | 3.3a ± 0.3 | 35.2a ± 2.2 | 73.7a ± 3.3 | 5.8a ± 1.1 | 1.54a ± 1.7 |
| Bioaumentación | 30.3b ± 0.1 | 4.4a ± 0.1 | 16.5b ± 0.3 | 43.1c ± 1.2 | 7.2a ± 1.6 | 18.0a ± 3.5 |
| Bioestimulación + bioaumentación | 33.9b ± 0.3 | 4.1a ± 0.1 | 19.5b ± 1.4 | 47.1b ± 1.9 | 1.4a ± 0.9 | 1.2a ± 1.8 |
HTP: hidrocarburos totales del petróleo.
Valores con la misma letra no presentan diferencias estadísticamente significativas (p > 0.05) para un mismo ensayo, según el método LSD de Fisher.
Considerando los resultados de biodegradación obtenidos con la bioestimulación con ramnolípidos (BE), se calcularon las tasas de incremento de degradación para HTP y las fracciones de saturados y aromáticos respecto a los otros dos tratamientos (BA y BA + BE). En el cuadro IV se observa que las tasas de incremento de la degradación con BE varían de 36 a 53 %.
CUADRO IV INFLUENCIA DE LOS RAMNOLÍPIDOS EN LA BIODEGRADACIÓN DE HIDROCARBUROS EN MICROCOSMOS.
| Tratamiento | Tasa de incremento de la biodegradación respecto a la bioaumentación (%) | Tasa de incremento de la biodegradación respecto a la bioestimulación + bioaumentación (%) | ||||
| Bioestimulación | HTP | Saturados | Aromáticos | HTP | Saturados | Aromáticos |
| 45.2 ± 1.7 | 53.3 ± 7.9 | 41.6 ± 1.3 | 38.7 ± 0.1 | 44.7 ± 0.1 | 36.1 ± 0.2 | |
HTP: hidrocarburos totales del petróleo.
Biodegradación en parcelas: bioaumentación y bioestimulación con ramnolípidos
Para evaluar la efectividad de la bioestimulación por la adición de ramnolípidos a escala de campo se determinaron el crecimiento microbiano (Fig. 4), los contenidos de nitrógeno y fósforo del suelo (Cuadro V) y los porcentajes de degradación de hidrocarburos (Cuadro VI). También se evaluó la toxicidad de la introducción de ramnolípidos y microrganismos exógenos (cultivo mixto CM) en el ecosistema impactado.

Fig. 4 Conteo de microorganismos en el proceso de biorremediación en parcelas. Las barras representan la desviación estándar calculada para tres réplicas.
CUADRO V PROPIEDADES QUÍMICAS DEL SUELO DE LAS PARCELAS DURANTE LA BIODEGRADACIÓN.
| Tratamiento | Nitrógeno (mg/kg) | Fósforo (mg/kg) | ||
| Día 0 | Día 30 | Día 0 | Día 30 | |
| Bioestimulación | 1.56 ± 0.10 | 0.66 ± 0.07 | 5.23 ± 0.07 | 4.84 ± 0.18 |
| Bioaumentación | 2.96 ± 0.12 | 1.34 ± 0.08 | 6.30 ± 0.12 | 5.35 ±0.23 |
CUADRO VI BIODEGRADACIÓN DE HIDROCARBUROS EN PARCELAS EN 30 DÍAS.
| Tratamiento | HTP | Grasas y aceites | Saturados | Aromáticos | Resinas | Asfaltenos |
| Porcentajes de biodegradación (%) | ||||||
| Bioestimulación | 36.7a ± 3.3 | 37.1a± 3.3 | 0.1a ± 0.1 | 63.7a ± 5.3 | 28.3b ± 1.5 | 22.7b ± 7.5 |
| Bioaumentación | 24.2b ± 2.2 | 5.1b± 2.2 | 1.1a ± 8.6 | 41.7b ± 2.7 | 56.0a ± 1.6 | 48.5a ± 4.6 |
HTP: hidrocarburos totales del petróleo.
Valores con la misma letra no presentan diferencias estadísticamente significativas (p > 0.05) para un mismo ensayo, según el método LSD de Fisher.
A los 30 días de aplicada la bioaumentación, se mantuvo el equilibrio en el crecimiento de la población total (el mismo orden decimal), mientras que en las parcelas con bioestimulación (BE) sí hubo incremento de esta población (un orden decimal). En ambos tratamientos aumentó la población degradadora, y se estimó que ésta representó del 80 al 87.5 % de la población cultivable.
El consumo de nitrógeno fue similar (55 %) en las parcelas con los dos tratamientos. En las parcelas donde se aplicó bioaumentación se consumió el 15 % del fósforo inicial, porcentaje superior a las parcelas con bioestimulación (Cuadro V).
La degradación de hidrocarburos se determinó empleando los métodos gravimétricos antes descritos. El cuadro VI muestra los porcentajes de degradación de hidrocarburos calculados del análisis matemático de los resultados. Los porcentajes de biodegradación aplicando ramnolípidos fueron más bajos que los obtenidos en los microcosmos, a excepción de las GA (37.1 %).
El comportamiento de la degradación de la fracción saturada tanto con bioaumentación como con bioestimulación a escala de campo no mostró cambios significativos. La aplicación de ramnolípidos (BE) favoreció los mayores porcentajes de degradación de HTP (36.7 %) y aromáticos (63.7 %) y en el caso de las fracciones resinas y asfaltenos, los porcentajes de biodegradación por bioestimulación fueron más bajas que con bioaumentación, no superando el 30 %. El incremento en la degradación de GA fue de 86.51 %, mientras que en HTP y aromáticos tuvo valores cercanos al 34 % (Cuadro VII).
CUADRO VII INFLUENCIA DE LOS RAMNOLÍPIDOS EN LA BIODEGRADACIÓN DE HIDROCARBUROS EN PARCELAS.
| Tratamiento | Tasa de incremento de la biodegradación respecto a la bioaumentación (%) | ||
| Bioestimulación | HTP | Grasas y aceites | Aromáticos |
| 33.4 ± 6.80 | 86.5 ± 4.8 | 34.2 ± 6.9 | |
HTP: hidrocarburos totales del petróleo.
Las técnicas de biorremediación utilizadas, bioestimulación con ramnolípidos (BE) y bioaumentación con el cultivo mixto (BA) no causaron efectos tóxicos al suelo, ya que la tasa de mortalidad de las lombrices para la BE y BA fue de 5 y 15 %, respectivamente, mientras que el de tiempo 0 fue de 70 %.
DISCUSIÓN
La biorremediación de suelos contaminados con hidrocarburos requiere mayor efectividad, además de sostenibilidad ambiental y económica (Chen et al. 2020). Este trabajo presenta el efecto de la bioestimulación con ramnolípidos de Pseudomonas sp. Y3-B1A (Barrios et al. 2021) en la degradación de petróleo crudo y sus derivados en condiciones de cultivo de laboratorio y campo. Se utiliza un cultivo mixto de cuatro bacterias degradadoras de hidrocarburos (Acosta et al. 2021) para evaluar la técnica de biorremediación por bioaumentación y se determina la toxicidad de los ramnolípidos.
Se realizó un primer ensayo en medio líquido en laboratorio y posteriormente se diseñaron microcosmos con suelos contaminados expresamente con petróleo crudo Mesa 30. Por último, se aplicó el estudio a parcelas reales contaminadas.
La aplicación de los ramnolípidos en biorremediación no requiere de alta pureza, por lo cual se emplea el caldo libre de células o crudo de ramnolípidos. Sin embargo, se evalúa la toxicidad del crudo para descartar la presencia de otros compuestos tóxicos producidos por la bacteria (Dobler et al. 2020).
Los resultados ecotoxicológicos realizados al crudo de ramnolípidos con los modelos Solanum lycopersicum y Artemia salina demostraron su baja toxicidad, ya que los valores de concentración letal media (CL50) estuvieron en el rango de 100-1000 mg/L, lo cual se considera seguro (Meyer et al. 1982). Otros autores han reportado resultados semejantes empleando los mismos modelos biológicos (Charles-Oluwaseun et al. 2017, Nogueira-Félix et al. 2019, Dobler et al. 2020), además de semillas de Latuca sativa (lechuga) y células de mamíferos (Ojeda-Morales et al. 2016, Charles-Oluwaseun et al. 2017). La baja toxicidad de los biotensioactivos (o ausencia de la misma) generalmente se atribuye a sus estructuras poliméricas, lo que concede una polaridad inferior a la de los tensoactivos sintéticos y conduce a la formación de micelas con menor carga electrostática, incrementando la compatibilidad con las membranas biológicas (Nogueira-Félix et al. 2019). Al igual que en estudios precedentes, los ramnolípidos producidos por un patógeno oportunista no afectaron los niveles de toxicidad de la muestra (Dobler et al., 2020), lo cual los hace más atractivos para estrategias de biorremediación por bioestimulación mediante aplicación directa al crudo (Liu et al. 2018, Patowary et al. 2018, Hogan et al. 2019, Dhanya 2021).
Los ensayos a escala de laboratorio permitieron comprobar los efectos de las bacterias y los ramnolípidos en la degradación de petróleo. En los cromatogramas (Fig. 2), se observó la disminución y desaparición de los picos cuando se bioestimularon los cultivos con ramnolípidos respecto a los testigos bióticos y abióticos. La disminución y desaparición de picos se debe a la degradación y metabolización de compuestos en el medio de cultivo (Mnif et al. 2017). La tasa de incremento de la degradación calculada para la cepa de Bacillus sp. está en el rango de las descritas para este proceso (Mnif et al. 2017); no obstante, la estimulación del cultivo mixto incrementa al doble la tasa de mejora que se describe en trabajo previos similares, alcanzándose un valor de 61.46 % (Cuadro VIII). El cultivo mixto utilizado está compuesto por cuatro cepas que degradan diferentes fracciones del petróleo crudo, así como otros derivados: queroseno, diésel, gasolina y Jet A-1, con lo que se logra un proceso de degradación más eficiente (Acosta et al. 2021).
CUADRO VIII LISTADO DE ENSAYOS A ESCALA DE LABORATORIO DE BIODEGRADACIÓN DE HIDROCARBUROS EMPLEANDO BIOTENSIOACTIVOS.
| Biotensioactivo | Contaminante | Condiciones de cultivo | Porcentaje de degradación (%) | Tasa de mejora de la degradación (%) | Referencia |
| Ramnolípidos | Crudo Casablanca | RL-500 mg/L, 20 días en medio líquido con agitación. | Consorcio: 61.86 Consorcio + RL: 71.00 | 12.87 * | (Abalos et al. 2004) |
| Lipopéptidos | Diésel | 21 días en medio líquido con agitación. | Consorcio: 31.44 Consorcio + LP: 43.52 | 38.42 | (Mnif et al. 2015) |
| Ramnolípidos | Diésel | Siete días, RL- 120 mg/L, lodo activado en medio líquido. | Consorcio: - 47 Consorcio + RL: 75 | 37.33 * | (Zdarta et al. 2016) |
| Lipopéptidos | Diésel | 21 días en medio líquido con suelo en agitación. | Consorcio: - 43.54 Consorcio + LP: 48.85 | 12.19 | (Mnif et al. 2017) |
| Ramnolípidos | Petróleo crudo | RL-1 × CMC, 28 días en medio líquido con agitación | Cultivo mixto: - 29.88 Cultivo mixto + RL: 78.03 | 61.46 | Este estudio |
RL: ramnolípidos, LP: lipopétidos.
*Estas tasas se calcularon a partir de los resultados publicados.
Los resultados a escala de laboratorio evidenciaron la influencia de los ramnolípidos en la degradación de hidrocarburos y sentaron las bases para evaluar su efecto en la biorremediación por bioestimulación en microcosmos y parcelas.
En el ensayo en laboratorio se empleó una concentración de ramnolípidos igual a la CMC y en microcosmos y parcelas una inferior a este valor para favorecer la solubilización de los hidrocarburos en el suelo. En estudios previos se reportó que concentraciones inferiores a la CMC incrementaron la solubilidad aparente de los hidrocarburos formando agregados con una solubilidad molar considerablemente mayor respecto a la alcanzada a concentraciones de ramnolípidos superiores a la CMC (Liu et al. 2018). Esto favorece la disminución de los costos de aplicación de la bioestimulación con ramnolípidos como alternativa de la biorremediación.
La biorremediación exitosa depende de la capacidad catabólica de las bacterias para crecer y degradar los contaminantes, la viabilidad del inóculo y la microbiota endógena (Patowary et al. 2018, Chen et al. 2020). Durante el estudio en microcosmos se comprobó la presencia de bacterias degradadoras de hidrocarburos viables, en concentraciones suficientes para lograr un buen proceso de degradación. El crecimiento observado fue semejante al reportado por otros autores (Bezza y Chirwa 2017, Ebadi et al. 2017, Patowary et al. 2018). El crecimiento de microorganismos en los microcosmos con bioestimulación con ramnolípidos (BE) fue mayor que en el resto de los tratamientos (BA y BA + BE). En los primeros días se degradaron los compuestos alifáticos de cadenas cortas (C ≤ 12), que son empleados en el crecimiento; una vez agotados, dicho crecimiento se ralentiza (Bezza et al. 2015). Sin embargo, debido a que los ramnolípidos incrementan la biodisponibilidad de compuestos más complejos, los microorganismos presentes continuaron creciendo.
Habitualmente varios factores influyen en la biodegradación de compuestos orgánicos en suelos contaminados, incluyendo la microbiota activa, la biodisponibilidad del contaminante y las condiciones ambientales. La biodisponibilidad es un factor limitante para el éxito del proceso de biodegradación (Feng et al. 2021). Se han reportado tasas de incremento de degradación empleando biotensioactivos en el rango de 20 a 90 % (Cuadro IX). La aplicación de ramnolípidos en la biorremediación de hidrocarburos es un fenómeno complejo, influenciado por los componentes del suelo (presencia de arcillas, rocas, etc.) y propiedades de la fase acuosa (concentración de ramnolípidos, pH, fuerzas iónicas, materia orgánica disuelta, etc.) (Liu et al. 2018). El hecho de favorecer la degradación de algunos compuestos provoca la inhibición de la degradación de otros.
CUADRO IX LISTADO DE ENSAYOS EN MICROCOSMOS DE BIODEGRADACIÓN DE HIDROCARBUROS EMPLEANDO BIOTENSIOACTIVOS.
| Biotensioactivo (concentración) | Condiciones de ensayo | Porcentajes de degradación (%) | Tasa de mejora de la degradación (%) | Referencia |
| Ramnolípidos (1.5 g/L) | 300 g de suelo de cultivo de arroz cercano a una estación de almacenamiento de petróleo crudo durante 30 días. | Testigo: 1.8 RL: 16.8 | 89.29 | (Patowary et al. 2018) |
| Ramnolípidos (20 g/L) | 1 kg de suelo contaminado con petróleo crudo (35 g/kg) durante 35 días. | CM: 63.5 CM + RL: 81.9 RL: 39 5 | 28.97 < 1 | (Chao et al. 2020) |
| Lipopétidos (0.2 %) | 50 g de suelo impregnaos en hidrocarburos poliaromáticos durante 32 días. | Testigo: 35.98 LP: 45.12 | 20.62 | (Bezza y Chirwa 2017) |
| Ramnolípidos | 1 kg de suelo contaminado con petróleo crudo (50 g/kg) durante 30 días. | CM: 30.28 CM + RL: 33.85 RL: 55.22 | 38.71 45.16 | Este estudio |
RL: ramnolípidos; CM: cultivo mixto; LP: lipopétidos.
Aun cuando se han demostrado los efectos positivos de la aplicación de biotensioactivos en la biodegradación de hidrocarburos durante las últimas dos décadas (Abalos et al. 2004, Bezza et al. 2015, Mnif et al. 2015, 2017, Bezza y Chirwa 2017, Patowary et al. 2018, Torres et al. 2018, Chao et al. 2020), también se han reportado algunos efectos negativos. Se han propuesto varios factores y mecanismos para explicar los efectos inhibitorios: 1) su posible toxicidad por la capacidad de lisar células, incrementar la permeabilidad celular o solubilizar compuestos tóxicos, 2) efectos físicos y químicos que inducen interacciones célula-sustrato no deseadas, 3) disminución de la biodisponibilidad de los hidrocarburos al quedar atrapados en las micelas, y 4) el empleo del biotensioactivo como fuente de carbono preferencial (Bezza et al. 2015, Liu et al. 2018).
En las parcelas, el crecimiento de microorganismos viables y degradadores no fue proporcional al obtenido en los microcosmos debido a la diferencia en las condiciones ambientales (menos controladas) de los ensayos, del suelo, la microbiota activa y el contaminante. No todas las bacterias están adaptadas a los suelos contaminados, el tipo la fuente de nitrógeno y fósforo, el tipo y biodisponibilidad de hidrocarburos, de manera que las interacciones de sinergia y competencia entre ellas pudieran limitar el proceso de degradación (Chao et al. 2020).
Para que la biodegradación sea satisfactoria se requiere la desorción de los hidrocarburos del suelo, así como su deshidratación y asimilación por las células a través de sus membranas. La tasa de transferencia de adsorbido (insoluble) a sorbido (soluble) se considera el paso limitante en la biodegradación (Ebadi et al. 2017).
La adición de ramnolípidos mejora la biodegradación de hidrocarburos, aunque los porcentajes alcanzados no son semejantes en parcelas y microcosmos. En primer lugar, la microbiota autóctona en estos suelos es diferente y también influyen la complejidad de estructuras químicas de los contaminantes presentes, así como la imposibilidad de controlar condiciones ambientales tales como humedad, temperatura, ciclos de luz, etc., fuentes de nitrógeno y fósforo. El contenido de nitrógeno en las parcelas era menor que en los microcosmos. Los procesos de degradación natural tienen lugar en 90 o más días, la bioestimulación con ramnolípidos evidenció los incrementos de degradación a los 30 días, con valores superiores al 20 %.
La degradación de los hidrocarburos de petróleo habitualmente decrece en el orden de n-alcanos, alcanos ramificados, aromáticos de bajo peso molecular, monoaromáticos, alcanos cíclicos, aromáticos policíclicos y asfaltenos (Bezza et al. 2015). La adición de ramnolípidos en las parcelas incrementó la degradación de HTP, GA y aromáticos. En estudios previos se demostró la efectividad de los ramnolípidos para solubilizar e incrementar la biodegradación de hidrocarburos aromáticos policíclicos de desorción lenta, incluso en suelos donde previamente se habían aplicado otros métodos de biorremediación (Posada-Baquero et al. 2019). Las tasas de incremento de la degradación de HTP y aromáticos calculadas en las parcelas fueron 10 % menores a las calculadas en los microcosmos; sin embargo, la degradación de GA mejoró en 86.51 % en la parcela mientras que en los microcosmos no hubo diferencia entre los tratamientos.
Este resultado se debe a efectos previamente confirmados: incremento de la biodisponibilidad y solubilidad de las moléculas, alteración de algunas interacciones microbianas, aumento de la afinidad celular por los hidrocarburos y estimulación del crecimiento de bacterias degradadoras empleando como fuente de carbono los hidrocarburos contaminantes (Patowary et al. 2017, Liu et al. 2018).
Como el petróleo crudo es una mezcla compleja de hidrocarburos, su grado de toxicidad, carcinogenicidad y mutagenicidad está condicionado por las diferentes estructuras químicas presentes. Para la biorrecuperación de suelos contaminados con hidrocarburos, además de la degradación de éstos, el suelo debe ser apto para la vida. Los valores de toxicidad aguda obtenidos con Eisenia andrei (lombriz de tierra) califican el suelo como restaurado, ya que éste es un modelo ampliamente usado y aceptado para tales fines.
CONCLUSIONES
La investigación demuestra que la aplicación de ramnolípidos en procesos de biorremediación incrementa la biodegradación de hidrocarburos sin la necesidad de inocular microorganismos exógenos a los ecosistemas. La bioestimulación con ramnolípidos en ambientes contaminados no controlados incrementa la biodegradación en un 87 % sin provocar toxicidad al ecosistema.











 nueva página del texto (beta)
nueva página del texto (beta)


